Gd2O3-NH4HF2系制备氟化钆机制及工艺研究
北京科技大学冶金与生态工程学院,北京科技大学冶金与生态工程学院 北京100083,包头师范学院化学学院,北京100083,包头师范学院计算机科学院,内蒙古包头014030
摘 要:
以氧化钆和氟化氢铵为原料, 通过X射线衍射、化学分析和实际观察, 确定了反应过程中的产物, 研究了该体系在不同条件下的反应规律, 制定了新的GdF3制备工艺。常压下, 粉状Gd2O3与NH4HF2在100℃开始反应, 生成GdNH4F4, NH4F, NH3和H2O。224℃时GdNH4F4分解为GdF3和NH4F, NH4F在156-430℃间挥发和分解。反应过程包括合成、分解和脱铵3个反应环节。真空可以降低每一步反应的起、止温度, 特别有利于脱铵反应进行。用氟化氢铵制备氟化钆应采用“常压低温合成-真空中温分解-真空高温脱铵”工艺:即压力为101 kPa, 温度为185℃合成GdNH4F4;压力小于10.1 kPa, 温度为210℃分解GdNH4F4;压力小于10.1 kPa, 温度为385℃脱除NH4F。
关键词:
中图分类号: TB39
收稿日期:2006-05-28
Craft of Preparing Gadolinium Fluoride in Gd2O3-NH4HF2
Abstract:
The gadolinium oxide and the ammonium hy-drogen fluoride were used as the raw materials.Through X-ray and chemical analysis and observation results, the products were determined, the reaction regulation of that system under the different condition was studied, and the preparation craft of new GdF3was determined.Underp/ pθ= 1, powdery Gd2O3and NH4HF2began to react at 100℃, and GdNH4F4, NH4F, NH3and H2O were formed.Then GdNH4F4was decomposed into GdF3andNH4F at 224℃.NH4F was volatilized and decomposed at 156430℃.The reaction process included synthe-sizing, decomposing and taking off the ammonium three reaction segment.The vacuum may reduce the initial temperature and the final temperature for each step reac-tions.It is especially advantageous for reaction of taking off NH4F.Under 101 kPa, at 185℃, GdNH4F4was formed;at 10.1 kPa, at 210℃, GdNH4F4decom-posed;under 10.1 kPa, at 385℃, NH4F was released.
Keyword:
ammonium hydrogen fluoride;gadolinium fluoride;mechanism;craft;
Received: 2006-05-28
稀土氟化物是重要的化工冶金原料。 可作为生产稀土金属的基础原料
稀土氟化物研究可追溯到20世纪50~60年代
稀土氟化物的制备方法按照氟化剂的种类分为氢氟酸沉淀-真空脱水法 (俗称“湿法氟化”) 、 氟化氢气体氟化法 (俗称“干法氟化”) 和氟化氢铵氟化法3种。 前两种方法的理论和工艺相对成熟, 人们的认识基本一致; 对于氟化氢铵氟化法, 特别是有关RE2O3-NH4HF2系合成稀土氟化物反应规律研究, 尚存在研究方面的不足和认识上的分歧, 颜豪威
本文针对上述问题, 以氧化钆 (Gd2O3) 和氟化氢铵 (NH4HF2) 为原料, 通过X射线衍射化学分析和实际观察, 确定反应过程中的产物; 在常压和真空状态下, 通过初步工艺条件试验对反应过程进行验证, 并考查该体系中各反应发生的行为, 在此基础上, 提出新的REF3制备工艺。
1 实 验
1.1 原 料
氧化钆 (Gd2O3) : 99.99%, 粉末; 氟化氢铵 (NH4HF2) : 分析纯, 粉末。
1.2 仪器与装置
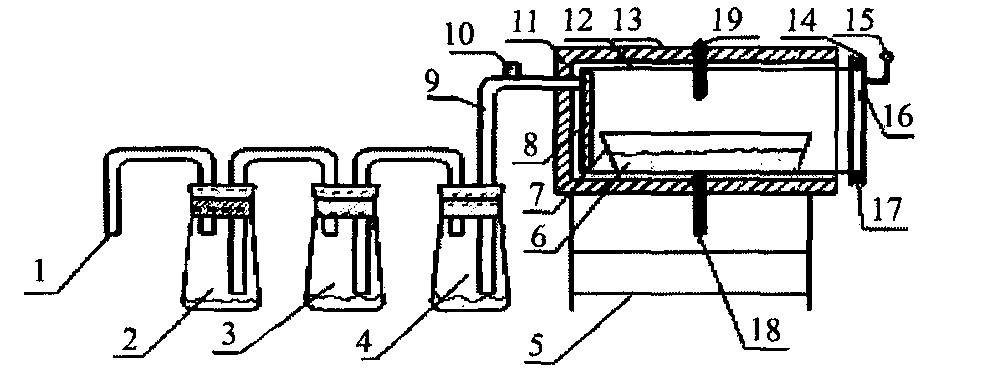
实验仪器为日本理学D/max-IIIA型X射线衍射仪和ACS-09型30 kg/1~2 g电子秤。 试验装置为图1所示的氟化炉, 可分别在常压和真空下进行高温化学反应研究。
1.3 方 法
将氧化钆 (Gd2O3) 和氟化氢铵 (NH4HF2) 按摩尔比1∶6的混合物500 g混合均匀, 置于图1所示的合金料盘中, 密封炉体。
图1 实验装置示意图
Fig.1 Schematic diagram of experimental equipment
1-Pump interface; 2-Ammonia absorbs bottle; 3-Steam absorbs bottle; 4-Condenser; 5-Support; 6-Raw materials; 7-Alloy material plate; 8-Condensation board; 9-Blast pipe; 10-Pressure valve; 11-Material kept warm; 12-Alloy hearth; 13-Health; 14-Rust steel flange; 15-Vacuum manometer; 16-Viewing panel; 17-Sealed circle; 18-Examine warm electric thermocouple; 19-Control temperature electric thermocouple
研究常压反应规律时, 将压力调节阀10打开, 与大气连通, 保持炉内压力为常压, 以5 ℃·min-1的速度升温, 通过观察窗16观察炉内变化, 通过压力调节阀考察炉内是否有气体溢出。 当炉内物料发生变化时, 记录开始变化的温度及现象, 并保温1 h后, 迅速取出部分样品, 待分析; 然后以同样的速度升温, 随时观察、 记录、 取样, 直至反应无明显的变化为止。
研究真空下反应规律时, 除了利用机械泵和压力调节阀10分别保持炉内压力为10.1 kPa (p/pθ=0.1) 和1.01 kPa (p/pθ=0.01) 外, 其余方法与研究常压下反应规律的方法类似。
用日本理学D/max-IIIA型X射线衍射仪对样品进行结构分析, 用化学分析法对样品进行组成分析, 用ACS-09型30 kg/1~2 g电子秤称量物料, 确定物料平衡。
2 结果与讨论
2.1 Gd2O3-NH4HF2系制备氟化钆过程产物的物相确定
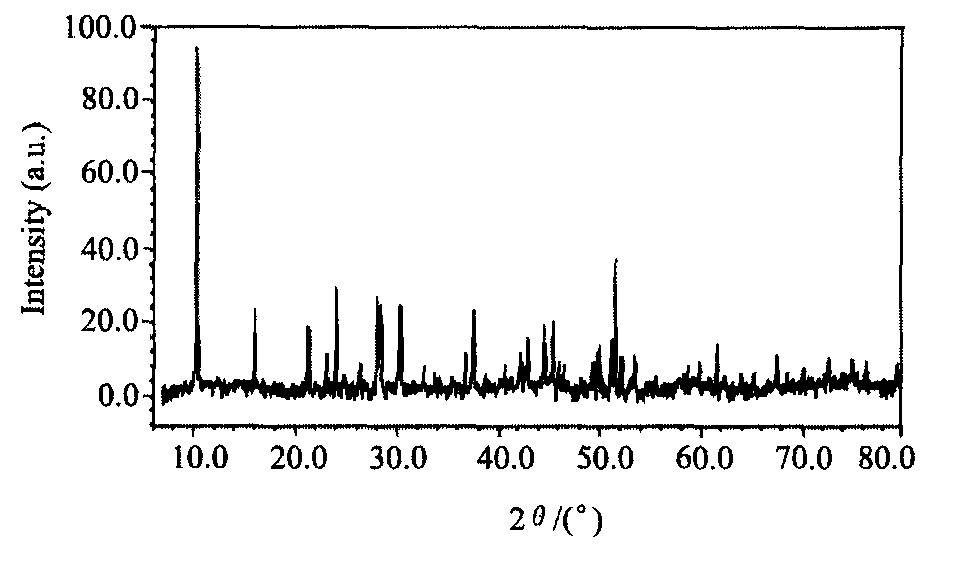
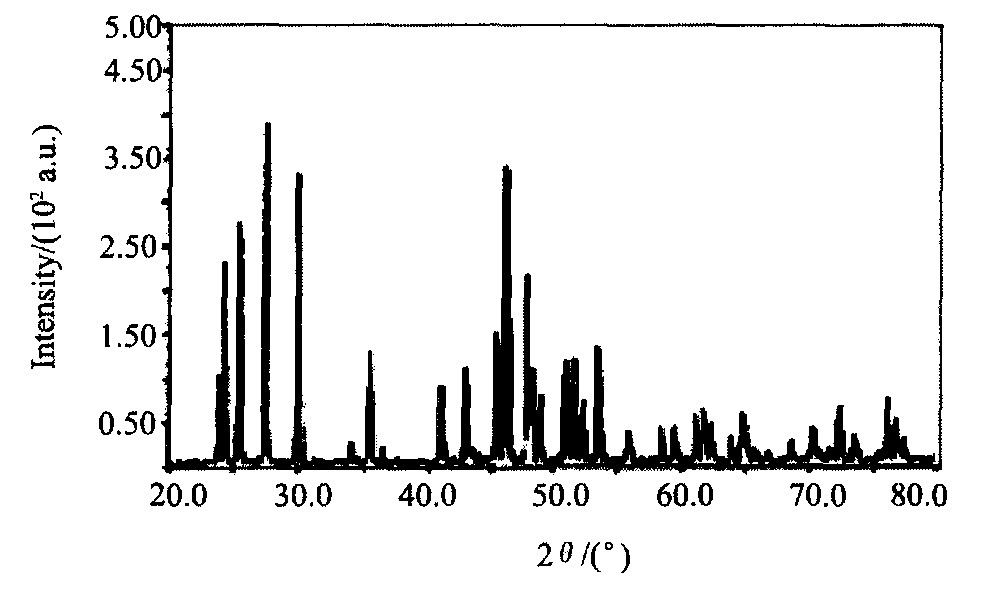
图2和3分别为GdNH4F4, GdF3的XRD图谱。 表1列出了不同工艺条件下Gd2O3-NH4HF2在反应过程中发生的现象及产物的相组成。
反应过程的产物主要通过XRD图谱、 化学分析和实际观察确定。 由图2, 3和表1可知, 在反应过程的不同阶段, 有不同产物, 反应前期有氨气放出, 反应产物为NH3, GdNH4F4, NH4F和H2O, 如压力为p/pθ=1, 温度为100~185 ℃阶段。 经过一相对平稳的温度段 (如p/pθ=1, 185~224 ℃) 后, GdNH4F4开始分解, 在p/pθ=1, 分解温度为224 ℃时, 此时过程的产物为GdF3, NH4F和部分未分解完全的GdNH4F4, 直至430 ℃整个反应全部结束。
图2 GdNH4F4的XRD图谱
Fig.2 XRD pattern of GdNH4F4
图3 GdF3的XRD图谱
Fig.3 XRD pattern of GdF3
2.2 Gd2O3-NH4HF2系制备氟化钆过程的化学反应
根据实验过程发生的现象和反应体系内存在的各物质的物理化学性质, 结合2.1确定的产物可知, NH4HF2在100 ℃时首先吸热熔化, 继而与Gd2O3进行放热化学反应, 反应后期, 在156~224 ℃之间NH4F吸热、 挥发、 分解, 离开体系在冷端冷凝, 这一过程包括下述3个反应, 其中主反应 (2) 称为合成反应。
NH4HF2 (s) =NH4HF2 (l) (1)
5NH4HF2 (l) +Gd2O3 (s) =2GdNH4F4 (s) +NH3 (g) +2NH4F (s) +3H2O (g) (2)
表1 Gd2O3-NH4HF系反应过程发生的现象及产物相组成
Table 1 Reaction phenomenon and phase composition
| Pressure p/pθ |
Time/ min |
Temperature/℃ | Phenomena | Product composition |
1 |
60 | 100 | NH3 | GdNH4F4+NH4F |
| 60 | 156 | NH3 white precipitate | GdNH4F4+NH4F | |
| 60 | 185 | No gas, white precipitate | GdNH4F4+NH4F | |
| 60 | 224 | White precipitate | GdNH4F4+GdF3+NH4F | |
| 60 | 430 | - | GdF3 | |
0.1 |
60 | 95 | NH3 | GdNH4F4+NH4F |
| 60 | 150 | NH3, white precipitate | GdNH4F4+NH4F | |
| 60 | 180 | No gas, white precipitate | GdNH4F4+NH4F | |
| 60 | 210 | White precipitate | GdNH4F4+GdF3+NH4F | |
| 60 | 385 | - | GdF3 | |
0.01 |
60 | 92 | NH3 | GdNH4F4+NH4F |
| 60 | 146 | NH3, white precipitate | GdNH4F4+NH4F | |
| 60 | 176 | No gas, white precipitate | GdNH4F4+NH4F | |
| 60 | 190 | White precipitate | GdNH4F4+GdF3+NH4F | |
| 60 | 360 | - | GdF3 |
NH4F (s) =NH4F (g) (3)
总反应为:
5NH4HF2 (l) +Gd2O3 (s) =2GdNH4F4 (s) +NH3 (g) +2NH4F (g) +3H2O (g) (4)
这一反应的理论失重率和吸放热过程与图2的TG, DTA的实验结果基本吻合。
随着温度的升高, 在224~430 ℃之间, 反应过程进入复合稀土氟化物分解反应和脱铵反应阶段, 产物GdNH4F4开始分解为GdF3和NH4F, 复合稀土氟化物分解反应按下式进行。
GdNH4F4 (s) =GdF3 (s) +NH4F (l) (5)
由于这一步的反应温度高, 脱铵分解产物NH4F在高温时先分解为NH3, HF, 又在低温部分的冷凝板上结合为NH4F, 反应按 (6) 式进行。
NH4F (l) =HF (g) +NH3 (g) =NH4F (s) (6)
因此, Gd2O3-NH4HF2系制备氟化钆过程的反应机理可以概括为: 粉状Gd2O3和NH4HF2混合物, 低温时NH4HF2首先熔化, 然后与Gd2O3发生液固相反应, 生成复合稀土氟化物GdNH4F4, NH4F, NH3, H2O, 随着温度的升高, 后期发生GdNH4F4分解反应, 生成GdF3和NH4F, 从反应开始至结束, 始终伴随有NH4F的挥发、 分解和冷凝这样一个脱铵反应过程。
2.3 Gd2O3-NH4HF2系制备氟化钆工艺参数的初步确定
2.3.1 压力、 温度的确定 图4为根据表1数据作出的不同压力状态下氟化过程的温度-时间曲线。 可以看出, 在同一压力下, 过程发生的反应随温度而改变, 如体系压力P=101 kPa时, 在A段首先发生合成反应, 温度达到B段时合成反应和脱铵反应同时进行, 在C段合成反应完成, 脱铵反应继续, 温度达到D段时, 发生分解反应, 同时伴有脱铵反应, 当温度达到E段并保持1 h后全部反应结束。 体系压力不同, 过程反应的变化趋势不变, 但每一阶段反应的起止温度不同。 压力降低, 反应的起止温度也随着降低, 也就是说, 提高系统的真空度, 可以降低过程反应的温度, 有利于反应在低温下进行。 表2列出了各阶段反应温度随压力变化的情况。 温度不同, 发生的反应不同, 过程产生的现象和产物也不同; 温度由低温到高温时, 过程反应按合成反应→脱铵反应→分解反应→脱铵反应的顺序进行。
综合考虑节能、 脱铵效果, 应采用“常压低温合成-真空中温分解-真空高温脱铵”工艺: 即压力为101 kPa, 温度为185 ℃合成GdNH4F4; 压力小于10.1 kPa, 温度为210 ℃分解GdNH4F4; 压力小于10.1 kPa, 温度为385 ℃脱除NH4F。
图4 不同压力下过程反应温度和时间的关系
Fig.4 Relation of reaction temperature and time under different pressures
表2 不同压力下各阶段反应的起止温度
Table 2 Reaction temperature under different pressures
Pressure |
Synthesizing temperature/℃ |
Deamination temperature/℃ |
Decomposition temperature/℃ |
|||
| Start | Stop | Start | Stop | Start | Stop | |
| p/pθ=1 | 100 | 185 | 156 | 430 | 224 | 430 |
p/pθ=0.1 |
95 | 180 | 150 | 385 | 210 | 385 |
p/pθ=0.01 |
92 | 176 | 146 | 360 | 190 | 360 |
2.3.2 原料配比的确定 实验研究了常压下配比 (Gd2O3与NH4HF2的摩尔比) 对反应的影响, 即当q/pθ=1时, 按照图2所示的曲线升温, 不同配比对氟化钆样品纯度的影响结果见表3。
从表中可知, 配比影响氟化钆样品的组成, 配比R≤1∶5时, 样品中含有Gd2O3, 氟化过程不完全; 配比R≥1∶6时, 氟化完全, 样品纯度高。 对比反应方程式 (4) 可知, 适当过量NH4HF2 (如R=1∶6) 有利于获得较纯的氟化钆。
表3 p/pθ=1时, 不同配比下氟化钆样品的组成
Table 3 Composition of fluorine gadolinium sample at p/pθ=1
| Ratio R | 1∶3 | 1∶4 | 1∶5 | 1∶6 | 1∶7 |
Composition |
Gd2O3 (much) +GdF3 |
Gd2O3 (more) +GdF3 |
Gd2O3 (few) +GdF3 |
GdF3 | GdF3 |
3 结 论
1. 粉状Gd2O3和NH4HF2在常压下反应, 反应过程为: 粉状Gd2O3和NH4HF2混合物, 低温时NH4HF2首先熔化, 然后与Gd2O3发生液固相反应, 生成复合稀土氟化物GdNH4F4和NH4F, NH3, H2O, 随着温度的升高, 后期发生GdNH4F4分解反应, 生成GdF3和NH4F, 从反应开始至结束, 始终伴随有NH4F的挥发、 分解和冷凝这样一个脱铵反应过程。
2. 真空可以降低每一个反应的起、 止温度, 有利于脱铵反应进行。
3. 用氟化氢铵制备氟化钆应采用“常压低温合成—真空中温分解—真空高温脱铵”工艺: 即压力为101 kPa, 温度为185 ℃合成GdNH4F4; 压力小于10.1 kPa, 温度为210 ℃分解GdNH4F4; 压力小于10.1 kPa, 温度为385 ℃脱除NH4F。
4. Gd2O3与NH4HF2的摩尔比R=1∶6可获得较纯的氟化钆。
参考文献
[1] Spedding F H, et al.Beaudry Research and Development Report Is-1900[M].Ames Lab., 1968.
[2] 徐光宪主编.稀土 (中册) [M].北京:冶金工业出版社, 1995.26.
[3] 金卓仁.稀土氟化物在复合自润滑轴承中作用的研究[J].稀土, 1996, 17 (5) :57.
[4] 王亚军, 刘前, 索全伶, 等.稀土氟化物的沉淀方法及组成研究[J].稀土, 2000, 21 (1) :14.
[6] 张茂峰, 孟建新, 刘应亮, 满石清.LaF3∶Eu3+纳米粒子的水热法制备及发光性质研究[J].中国稀土学报, 2005, 23 (5) :564.
[9] 刘文生, 云月厚, 李国栋.干法氟化制备高纯金属镝的研究[J].稀有金属, 2003, 27 (1) :154.
[10] 颜豪威.NH4HF2氟化制备稀土氟化物的化学原理及工艺探讨[J].江西冶金, 1995, 15 (6) :31.
[11] 由芳田, 王颖霞, 林建华.NH4F-LnF体系的合成及荧光性质[J].无机化学学报, 2002, 18 (1) :41.
[12] 童兆达.碳酸稀土转型制备氟化稀土[J].稀土, 1987, (1) :62.
[13] Spedding F H, Daane A H.The Rera Earths[M].New York, 1961.83.
[1] Spedding F H, et al.Beaudry Research and Development Report Is-1900[M].Ames Lab., 1968.
[2] 徐光宪主编.稀土 (中册) [M].北京:冶金工业出版社, 1995.26.
[3] 金卓仁.稀土氟化物在复合自润滑轴承中作用的研究[J].稀土, 1996, 17 (5) :57.
[4] 王亚军, 刘前, 索全伶, 等.稀土氟化物的沉淀方法及组成研究[J].稀土, 2000, 21 (1) :14.
[6] 张茂峰, 孟建新, 刘应亮, 满石清.LaF3∶Eu3+纳米粒子的水热法制备及发光性质研究[J].中国稀土学报, 2005, 23 (5) :564.
[9] 刘文生, 云月厚, 李国栋.干法氟化制备高纯金属镝的研究[J].稀有金属, 2003, 27 (1) :154.
[10] 颜豪威.NH4HF2氟化制备稀土氟化物的化学原理及工艺探讨[J].江西冶金, 1995, 15 (6) :31.
[11] 由芳田, 王颖霞, 林建华.NH4F-LnF体系的合成及荧光性质[J].无机化学学报, 2002, 18 (1) :41.
[12] 童兆达.碳酸稀土转型制备氟化稀土[J].稀土, 1987, (1) :62.
[13] Spedding F H, Daane A H.The Rera Earths[M].New York, 1961.83.