氧化亚铁硫杆菌中磁小体形成相关基因mpsA在不同铁源刺激下的差异表达
刘新星,刘文斌,闫 颖,武海艳,邱冠周
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
摘 要:
摘 要:为研究氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)在胞内形成的电子致密的磁性颗粒的相关基因,对氧化亚铁硫杆菌标准菌株ATCC23270的全基因组的生物信息学进行分析,在ATCC23270的全基因组上查找与趋磁细菌中mpsA基因的同源基因ORF1622,并对其进行保守结构域、氨基酸序列比对以及蛋白质同源性分析。利用反转录PCR技术从转录水平研究mpsA基因在硫培养条件下分别用20 mmol/L FeCl3和FeSO4·7H2O刺激时的差异表达以验证它们在磁小体形成过程中的作用。研究结果表明:ORF1622编码的蛋白含有PRK05724结构域,与mpsA序列相同度为48%,与acetyl-CoA carboxylase carboxyltransferase subunit alpha同源;氧化亚铁硫杆菌中的mpsA基因在转录层面的表达与亚铁有直接关系,并且氧化亚铁硫杆菌仅在亚铁培养下生成磁小体,因此,它与氧化亚铁硫杆菌中磁小体的形成相关。
关键词:
氧化亚铁硫杆菌;mpsA基因;生物信息学分析;反转录PCR;
中图分类号:Q786 文献标志码:A 文章编号:1672-7207(2009)06-1471-05
Real-time PCR analysis of different Fe ion shock responses of mpsA gene in Acidithiobacillus ferrooxidans ATCC 23270
LIU Xin-xing, LIU Wen-bin, YAN Ying, WU Hai-yan, QIU Guan-zhou
(School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: The whole genome of the type strain Acidithiobacillus ferrooxidans ATCC 23270 and the conserved domain and amino acid sequences as well as the protein identity of the target gene were analyzed. To obtain further knowledge of the magnetosomes formation mechanisms of Acidithiobacillus ferrooxidans in response to different kinds of Fe ions, temporal gene expression profiles were examined in cells subjected to 20 mmol/L FeCl3 and FeSO4·7H2O shock by using reserved transcript PCR. The results indicate that ORF 1622 of the ATCC 23270 is homologous with mpsA gene in magnetotactic bacteria and the expressions of ORF 1622 is related to Fe2+. According to the fact that the Acidithiobacillus ferrooxidans is able to synthesize intracellular magnetosomes when it grows on FeSO4, it can be supposed that the mpsA gene is related with the magnetosome formation in Acidithiobacillus ferrooxidans.
Key words: Acidithiobacillus ferrooxidans; mpsA gene; bioinformatics analysis; RT-PCR
氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)由Temple等[1]在20世纪50年代初发现并命名的。它是生物冶金中的重要细菌之一。它可利用黄铁矿等矿物中的硫和铁,从而使矿物分解,释放出包裹在其中的贵金属,因此,广泛用于浸出各种金属硫化矿。刘新星等[2]在氧化亚铁硫杆菌中发现了磁性颗粒。磁小体微细,化学纯度高,结晶完美,大小均匀,且来自活体细胞,具有良好的生物相容性,所以,它是一种理想的生物纳米材料[3-6]。目前,Grunberg等[7-13]从蛋白质和基因角度研究了磁小体的形成机理。Matsunaga等[14]采用SDS-PAGE方法在Magnetospirillum sp. AMB-1分离得到mpsA基因编码的蛋白。该基因编码为1个长317氨基酸的不含N末端细胞传输信号序列的蛋白质,同源分析表明mpsA蛋白与大肠杆菌乙酰-CoA羧化酶的α亚基具有52%的同源性,并且具有CoA的结合域。尽管没有直接证据表明磁小体膜与细胞质膜相连,但由于磁小体膜与细胞质膜组成大致相同,而据Pfanner等[15]的报道,真核生物膜上ADP-核糖基化作用因子的酰基化引发膜内陷,并且脂酰-CoA能够刺激细胞外高尔基泡出芽形成小囊泡,因此,Matsunaga等[14]推测MpsA利用酰基CoA作为羧基受体从而转移酰基给受体分子,通过酰基化引发细胞质内陷形成磁小体膜包裹细胞内的Fe3O4颗粒。
由于对氧化亚铁硫杆菌中磁小体形成相关基因的研究尚少,因此,本文作者通过生物信息学方法,在氧化亚铁硫杆菌ATCC23270菌株中寻找得到与AMB-1菌株中mpsA基因的同源基因,并利用反转录PCR方法研究该基因在硫单质培养条件下用Fe2+和Fe3+刺激的差异表达,探索氧化亚铁硫杆菌形成磁小体相关基因,以便为研究氧化亚铁硫杆菌中磁小体形成的相关机理打下基础。
1 实验材料与方法
1.1 材 料
1.1.1 菌种与培养基
A.ferrooxidans ATCC 23270由美国菌种保藏中心(American Type Culture Collection,ATCC)生产。
采用美国模式菌种保藏中心ATCC medium 2039培养基配方。
能源是质量浓度为10 g/L的硫粉,铁源分别为FeSO4和FeCl3。所有试剂均为分析纯。
1.1.2 其他试剂
RNA提取试剂为Trizol(Invitrogen),RNA纯化试剂盒为SV Total RNA Isolation System(Promega);RNA反转录试剂为SuperScriptTMⅡ反转录酶(Invitrogen)和随机引物(Invitrogen)。
1.2 实验方法
1.2.1 氧化亚铁硫杆菌中mpsA基因的生物信息学 分析
A.ferrooxidans ATCC 23270全基因组序列及其部分注释从The institute for genome research(tigr)网获得,采用tigr网基因组分析工具BLAST寻找A.ferrooxidans ATCC 23270上与趋磁细菌中mpsA基因的同源基因。采用Gene Runner软件分析获得目标基因的开放阅读框(ORF),进行目标蛋白保守结构域分析。目标蛋白与趋磁细菌中同源蛋白氨基酸序列比对结果通过Gene Doc软件获得。在National Center for Biotechnology Information(NCBI)进行两序列的同源性分析。
1.2.2 氧化亚铁硫杆菌中mpsA基因的引物设计
根据BlastN比对得到同源基因序列,利用Primer 5.0软件设计基因特异引物mpsA1 5′-GGCTATTAT- CGGCGGTCTGGC-3′和mpsA2 5′-GCTCCGGGCG- TATCAATGAAC-3′。两引物间重叠区为201bp。
1.2.3 ATCC23270培养条件及生长曲线测定
取对数期ATCC23270菌种接于2 L培养基中,调至pH=2.0,以1%(质量分数)硫单质为能源,在转速为180 r/min的摇床中培养,温度为30 ℃。用血球计数板在光学显微镜下直接观察计数菌液中细菌浓度,如未有特别说明,所有实验均重复3次。
1.2.4 不同铁源处理后RNA的提取纯化及反转录
当细菌培养至对数期后,将培养好的细菌等量分成3组,其中:第1和第2组分别加入FeCl3,FeSO4·7H2O(终浓度为20 mmol/L)在培养条件下进行刺激;第3组以无铁刺激硫培养细菌作为空白对照,刺激1 h后,每组取300 mL培养液(温度为4 ℃)过滤除去硫粉后,立即冷冻、离心,收集菌体,剩余培养液继续培养至稳定期收集菌体,以备透射电子显微镜观察磁小体颗粒形成情况所用。采用Trizol一步法提取总RNA,用RNA纯化试剂盒(Promega)纯化粗RNA,用NanoDrop微量分光光度计(NanoDrop Technologies)检测RNA浓度和纯度。以总RNA中mRNA为模板,反转录合成cDNA,用NanoDrop微量分光光度计测定其浓度,将3个cDNA样品浓度均调至200 mg/L,于-20 ℃冷藏备用。反转录采用Invitrogen公司 SuperScriptTMⅡ反转录酶和随机引物,具体反应条件参见试剂盒操作手册。
1.2.5 反转录PCR反应检测硫培养时不同铁源刺激下的差异表达
分别以3组样品的cDNA为模板,采用本文设计引物对扩增基因片段。PCR程序为:于94 ℃解链 4 min;于94 ℃解链20 s,于60 ℃退火20 s,于72 ℃延伸30 s,共30个循环;于72 ℃解链8 min。采用纯化后RNA作为模板为阴性对照。PCR反应后,用1%琼脂糖凝胶电泳检验不同铁源胁迫下各基因的表达情况。
1.2.6 不同培养条件下磁小体形成情况
用异戊醛固定收集后的菌体,并进行超薄切片(70 nm),将切片置于透射电镜下(JEM1230,电压80 kV),观察比较不同铁源刺激后和缺铁条件下单质硫培养时菌体内磁小体颗粒数量。
2 结果与分析
2.1 ATCC23270与AMB-1mpsA基因编码蛋白比对结果
用AMB-1菌株的mpsA基因与ATCC23270的全基因组进行比对得到同源的核酸序列,为tigr网站ATCC23270的全基因组上编号为第1622号的基因。该基因全长951bp,编码1个长316氨基酸的蛋白质。对该基因编码的蛋白质进行保守结构与分析,结果如图1所示。用此蛋白与AMB-1 mpsA基因编码的蛋白质进行同源性比较,结果显示:同源性为48%(图2)与acetyl-CoA carboxylase carboxyltransferase subunit alpha同源。
2.2 ATCC23270硫单质培养生长曲线的测定
![]()
图1 与mpsA同源的ORF1622保守结构域分析
Fig.1 Conserved domain analysis of ORF1622
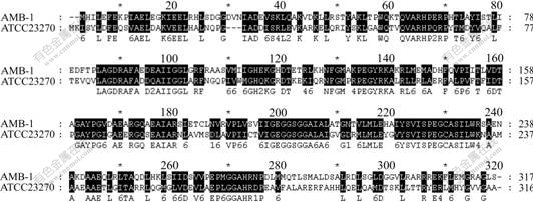
图2 ATCC23270中ORF1622编码蛋白与AMB-1 mpsA蛋白氨基酸序列比对结果
Fig.2 Amino acid sequences alignment between ORF1622 and mpsA in ATCC23270
Acidithiobacillus ferrooxidans ATCC23270硫单质
培养生长曲线如图3所示。图3表明:ATCC23270在以硫单质为能源时对数期较长。在接种后第8 d提取总RNA,以研究mpsA基因在不同铁源刺激下的差异表达。
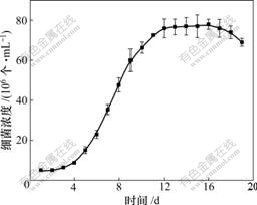
图3 Acidithiobacillus ferrooxidans ATCC23270硫单质培养生长曲线
Fig.3 Growth curve of Acidithiobacillus ferrooxidans ATCC 23270
2.3 总RNA质量
细菌总RNA电泳分析结果如图4所示。23S rRNA与16S rRNA条带完整、清晰,表明总RNA提取纯化过程中无明显的RNase作用导致的降解,经NanoDrop微量分光光度计检测,在波长为260 nm和280 nm处的消光系数OD260和OD280比值为1.90~2.00,样品的纯度较高。总RNA的纯度与完整性均良好,mRNA无降解。
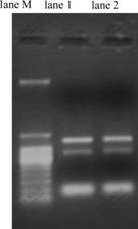
lane M为marker,lane 1为Fe2+刺激1 h总RNA,lane 2为Fe3+刺激1 h总RNA
图4 总RNA电泳图
Fig.4 Gel analysis of total RNA
2.4 不同铁源刺激下氧化亚铁硫杆菌mpsA基因的差异表达情况
反转录PCR产物的琼脂糖电泳图谱如图5所示。从图5可知:当ATCC23270在以硫单质为能源时,mpsA基因在不同铁源刺激下具有表达差异;mpsA基因在Fe2+刺激下于cDNA上有表达,而Fe3+刺激以及不加铁刺激时均无表达。PCR产物约为200bp,与引物设计的201bp重叠区长度一致,所得PCR产物为目标产物。这说明氧化亚铁硫杆菌中mpsA基因的表达是与Fe2+相关的,与硫单质以及Fe3+无关。
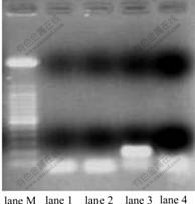
lane1为无铁刺激硫培养,lane 2为Fe3+刺激,lane 3为Fe2+刺激,lane 4为阴性对照,lane M为100bp marker,目标片段长度为200bp
图5 mpsA基因RT-PCR产物电泳图谱
Fig.5 RT-PCR analysis of different Fe ion shock response of mpsA gene
2.5 不同培养条件下磁小体生成情况
透射电子显微镜结果如图6所示。从图6可知:Acidithiobacillus ferrooxidans ATCC 23270 在Fe2+刺激硫培养时能生成电子致密的磁性颗粒(图6(c)),而在无铁刺激硫培养(图6(a))和Fe3+刺激硫培养时(图6(b)) 均没有电子致密颗粒形成。
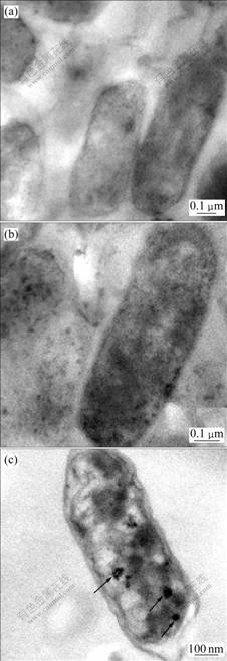
(a) 无铁刺激硫;(b) Fe3+刺激硫;(c) Fe2+刺激硫;
箭头所示黑色电子致密颗粒为磁小体
图6 不同铁源刺激硫培养条件下Acidithiobacillus ferrooxidans ATCC 23270超薄切片透射电镜照片
Fig.6 Transmission electron micrograph images of thin-sectioned Acidithiobacillus ferrooxidans ATCC 23270 cells under different Fe ion shocks
3 结 论
a. 在氧化亚铁流杆菌ATCC23270的全基因组上找到了趋磁细菌Magnetospirillum sp.AMB-1菌株中磁小体合成基因mpsA的同源基因,并将两基因编码的蛋白进行比对,相似性高达48%。
b. ATCC23270菌株中mpsA基因在硫单质培养条件下,在Fe2+刺激下有表达,而Fe3+刺激以及不加铁刺激时均无表达。这说明mpsA基因与氧化亚铁硫杆菌中亚铁的代谢相关,这与ATCC23270中磁小体的形成与亚铁相关而与硫单质及三价铁无关的现象相 一致。
c. 由于mpsA基因在趋磁细菌中为磁小体合成的重要基因,该基因在氧化亚铁硫杆菌的磁小体形成过程中也发挥了重大作用,其可能与磁小体膜内陷相关,具体的作用方式及调控机理将有待于进一步研究。
d. 利用生物信息学方法结合RT-PCR技术,能够在氧化亚铁硫杆菌中找到更多的可能与磁小体形成相关的基因,这将为研究氧化亚铁硫杆菌中磁小体的形成提供一种有效手段,也将为探索氧化亚铁硫杆菌中磁小体形成机理以及构建相关基因蛋白的调控网络打下基础。
参考文献:
[1] Colmer A R, Hinkle. The role of microorganisms in acid mining drainage1a preliminary report[J]. Science, 1947, 106: 253-256.
[2] 刘新星, 刘文斌, 闫 颖, 等. 固体平板磁泳分离细菌新方法的研究[J]. 中国生物工程杂志, 2008, 28(3): 79-83.
LIU Xin-xing, LIU Wen-bin, YAN Ying, et al. Isolation of acidithiobacillus ferrooxidans by using solid-plate magnetophoresis[J]. China Biotechnology, 2008, 28(3): 79-83.
[3] Matsunaga T, Nakayama H, Okochi M, et al. Fluorescent detection of cyanobacterial DNA using bacterial magnetic particles on a MAG-microarray[J]. Biotechnology and Bioengineering, 2001, 73(5): 400-405.
[4] Yoza B, Matsumoto M, Matsunaga T. DNA extraction using modified bacterial magnetic particles in the presence of amino silane compound[J]. Journal of Biotechnology, 2002, 94(3): 217-224.
[5] Herborn C U, Papanikolaou N, Reszka R. Magnetosomes as biological model for iron binding: Relaxivity determination with MRI[J]. Rofo-Fortschritte Auf Dem Gebiet Der Rontgenstrahlen Und Der Bildgebenden Verfahren, 2003, 175(6): 830-834.
[6] Schuler D, Frankel R B. Bacterial magnetosomes: microbiology, biomineralization and biotechnological applications[J]. Applied Microbiology and Biotechnology, 1999, 52(4): 464-473.
[7] Grunberg K, Wawer C, Tebo B M. A large gene cluster encoding several magnetosome proteins is conserved in different species of magnetotactic bacteria[J]. Applied and Environmental Microbiology, 2001, 67(10): 4573-4582.
[8] Matsunaga T, Okamura Y. Genes and proteins involved in bacterial magnetic particle formation[J]. Trends in Microbiology, 2003, 11(11): 536-541.
[9] Grunberg K, Muller, E C, Otto A. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospitillum gryphiswaldense[J]. Applied and Environmental Microbiology, 2004, 70(2): 1040-1050.
[10] Heyen U, Schuler D. Growth and magnetosome formation by microaerophilic magnetospirillum strains in an oxygen-controlled fermentor[J]. Applied Microbiology and Biotechnology, 2003, 61(5/6): 536-544.
[11] Schuler D, Baeuerlein E. Iron transport and magnetite crystal formation of the magnetic bacterium magnetospirillum gryphiswaldense[J]. Journal De Physique Iv, 1997, 7(C1): 647-650.
[12] Matsunaga T, Sakaguchi T, Molecular mechanism of magnet formation in bacteria[J]. Journal of Bioscience and Bioengineering, 2000, 90(1): 1-13.
[13] Ullrich S, Kube M, Schubbe S. A hypervariable 130-kilobase genomic region of Magnetospirillum gryphiswaldense comprises a magnetosome island which undergoes frequent rearrangements during stationary growth[J]. Journal of Bacteriology, 2005, 187(21): 7176-7184.
[14] Matsunaga T, Noriyuki T, Okamura Y. Cloning and characterization of a Gene, mpsA, encoding a protein associated with intracellular magnetic particles from magnetospirillum sp. strain AMB-1[J]. Biochemical and Biophysical Research Communications, 2000, 268(3): 932-937.
[15] Pfanner N, Glick B S, Arden S R. Fatty acylation promotes fusion of transport vesicles with Golgi cisternae[J]. J Cell Biol, 1990, 110(4): 955-961.
收稿日期:2008-11-23;修回日期:2009-03-20
基金项目:国家自然科学基金资助项目(50774102);国家自然科学基金创新群体基金资助项目(50321402);国家重点基础研究发展规划项目(2004CB619201);中南大学研究生教育创新工程资助项目(1343-77341)
通信作者:刘新星(1955-),女,湖南长沙人,教授,从事生物冶金和生物信息学研究;电话:0731-88876697;E-mail: x-mine@mail.csu.edu.cn


