模拟体液中羟基磷灰石-壳聚糖矿化行为的压电阻抗
许 超,何德良,曾丽萍,罗胜联
(湖南大学 化学生物传感与计量学国家重点实验室,湖南 长沙,410082)
摘 要:
摘 要:采用压电石英晶体阻抗技术(PQCI)研究复合材料羟基磷灰石-壳聚糖(HA-CS)在模拟体液中的矿化行为。研究结果表明:HA-CS在模拟体液中的矿化过程导致石英晶体传感器频率显著降低,当复合材料中HA与CS的质量比为6?4时,矿化能力最强;PQCI实时在线监测所得的频率、动态电阻、动态电感、动态电容和静态电容等参数的变化可用于评价矿化过程中HA-CS复合材料的微观变化;根据矿化过程中频率与动态电阻的变化可将HA-CS在模拟体液中的矿化过程分成3个阶段,并获得各阶段的动力学方程。此研究方法为骨组织工程材料的制备提供了一种新的实时监测技术。⊙
关键词:
中图分类号:TQ174.1 文献标识码:A 文章编号:1672-7207(2009)02-0334-06
Biomineralization of hydroxyapatite-chitosan composite in a simulated body fluid using piezoelectric quartz crystal impedance
XU Chao, HE De-liang, ZENG Li-ping, LUO Sheng-lian
(State Key Laboratory of Chemo/Biosensing and Chemometrics, Hunan University, Changsha 410082, China)
Abstract: The biomineralization process of hydroxyapatite-chitosan (HA-CS) in a simulated body fluid was studied using piezoelectric quartz crystal impedance (PQCI). The results show that the frequency decreases obviously during the biomineralization process of hydroxyapatite-chitosan composite and the optimal mass ratio of HA to CS is 6?4. Several parameters (frequency Δf, resistance ΔRm, inductance ΔLm, static capacity ΔCm, dynamic capacity ΔCs) are simultaneously obtained from the PQCI on-line measuring and applied to investigating the change of HA-CS during the biomineralization. It is shown the mineralization process of HA-CS can be divided into three steps according to the slope of Δf vs. ΔRm. The correlative kinetic equations and parameters are obtained from the frequency change. The proposed method can be used in mineralization studies of materials for bone tissue engineering for its advantages in providing real-time multidimensional information.
Key words: hydroxyapatite; chitosan; piezoelectric quartz crystal impedance; simulated body fluid; biomineralization
羟基磷灰石(HA)是自然骨骼的主要无机矿物成分,已广泛应用于生物医学材料领域[1]。但由于纯HA脆性大,可塑性差[2-3],许多学者把HA与其他有机物材料复合使用,使其在骨修复方面得到更好的应用。复合材料羟基磷灰石—壳聚糖(HA-CS)即是一种具有良好生物相容性、生物降解性、生物活性和细胞亲和性的新型骨组织工程支架材料和骨修复材料[4-5]。
目前,关于骨生物材料矿化的研究很多,如烧结的羟基磷灰石,β-TCP,以及含有结晶磷酸盐和钙硅石的生物陶瓷A-W,均可在模拟体液中矿化,植入生物体内可与宿主骨相结合,成为了重要的临床上骨替代的材料[6]。实验研究表明,骨生物材料在体外模拟环境中的矿化性能,即在模拟体液中材料表面形成类骨磷灰石的能力是评价此材料生物活性的重要依据,且可定量考察不同材料活性。用于骨材料矿化研究方法有:TEM-EDX[7],X光电子能谱(XPS)[8],扫描电镜(SEM)[9],X射线衍射(XRD),FT-IR法[10],质量测量方法[11]等,但是这些方法只能对矿化过程进行静态的研究,难以得到矿化过程的动态数据。压电石英晶体阻抗技术(Piezoelectric quartz crystal impedance,PQCI)在分析化学中应用越来越广泛[12]。此技术基于BVD(Butterworth-van Dyke)等效电路进行分析,此电路由并联的静态臂和动态臂组成,其中,动态臂包括多个参数:动态电阻Rm、动态电感Lm 以及动态电容Cm;静态臂只有1个:静态电容Cs。PQCI不但可测出响应频率,同时可获得其他一系列参数,如动态电阻、动态电容、动态电感等的变化。在此,本文作者采用压电阻抗对HA-CS复合材料的矿化进行实时在线监测,获得矿化过程中频率、动态电阻、动态电容、动态电感、静态电容等参数的变化,并据此对HA-CS的矿化过程进行动力学分析。
1 试验方法
1.1 实验材料
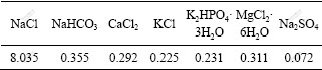
壳聚糖(分子量100 000)购于Sigma公司,脱酰度为97%,本实验所需其他化学药品皆为分析纯,均购于上海化学试剂有限公司。所有溶液皆采用二次蒸馏水配制。纳米羟基磷灰石晶体在常温常压下制备[13]。模拟体液的成分如表1所示。按顺序称取各药品,配制1 L模拟体液(SBF)[6],然后,用三羟甲基氨基甲烷和盐酸的缓冲液调节其pH值为7.40±0.05。
表1 配制的模拟体液的成分
Table 1 Composition of prepared SBF ρ/(g?L-1)
1.2 压电晶体表面修饰
用乙酸溶液制备1% 壳聚糖溶液,然后,按一定质量比(7?3,6?4,5?5)配制HA-CS的复合溶液,经超声溶解分散后冷藏于冰箱中备用。压电石英晶体上的金电极经新制的Piranha溶液[V(H2SO4浓)?V(H2O2 30%)= 7?3]清洗后,置于浓度为0.1 mol/L的β-巯基乙酸中浸泡12 h避光自组装一层膜,在去离子水中清洗20 min,洗去吸附不强的β-巯基乙酸。用微量注射器吸取40 μL的 HA-CS复合溶液均匀覆盖在电极上,沉积2 h,然后用去离子水清洗电极,干燥,待用。
1.3 仪器装置
压电阻抗试验研究装置如图1所示。由Visual Basic (VB) 5.0编程控制HP4395A网络/频谱测量仪测定石英晶体谐振的电导(G)和电纳(B),该程序亦可实时拟合导纳数据获得BVD等效电路参数,实验中每30 s 获取一组BVD 等效电路参数(动态电阻Rm, 动态电感Lm, 动态电容Cm, 静态电容Cs)作为评估参数。电极置于装有10 mL模拟体液的烧杯中,单面触液,搅拌,循环水浴恒温37 ℃。复合材料矿化后表面形貌采用扫描电子显微镜(JSM-6700F)进行表征。矿化产物分析采用傅里叶变换红外光谱仪(Perkin elmer Spectrum One)进行。
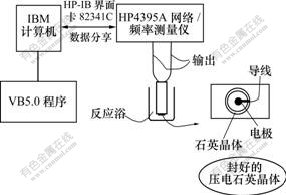
图1 压电石英晶体声波传感阻抗分析系统示意图
Fig. 1 Schematic representation of PQCI
2 结果与讨论
2.1 不同配比时HA-CS复合材料的频率响应
PQCI能灵敏检测HA-CS复合材料在模拟体液中矿化过程的频率响应。图2所示为不同质量比的复合材料修饰电极在模拟体液中的频率响应图。从图2可见,3条曲线基本的变化趋势都相似,随时间的增加,频率开始缓慢降低,然后,下降速度增加,最后趋于缓和,且频率下降幅度都较大。当HA与CS质量比为7?3时,在约1 800 min时,频率达到一个平台,下降约2.2 kHz;当HA与CS质量比为6?4和5?5时,频率约2 000 min后分别下降约5.1 kHz和5 kHz。频率的变化基本上可以反映压电石英晶片(PQC)表面质量负载的变化量。从图2可以看出,当HA-CS质量比为6?4时,频率下降幅度最大,且较光滑,矿化效果最好,也就是说,HA与CS的质量比为6?4是HA-CS复合材料最佳的配比。这是因为:一方面,壳聚糖在模拟体液中的矿化量很小[11, 14],但羟基磷灰石与壳聚糖复合后,羟基磷灰石为类骨磷酸钙盐的生成提供晶核,改善了矿化性能,且复合材料中羟基磷灰石越多,矿化效果越好;另一方面,材料的孔隙越多,矿化越易进行,而HA-CS质量比为6?4的HA-CS复合材料孔隙率比HA-CS质量比为7?3时的大。因此,随后的试验研究均采用这个配比。
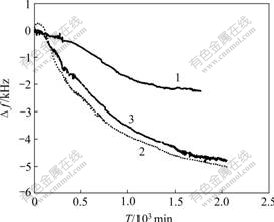
m(HA)?m(CS): 1—7?3; 2—6?4; 3—5?5
图2 不同组分复合材料矿化过程频率响应图
Fig. 2 Time course of Δf responses during biomineralization with different mass ratios of HA to CS
2.2 HA-CS复合材料矿化过程PQCI监测
图3所示为各参数Δf,?Rm,?Lm,?Cm和?Cs响应图。在溶液中,PQCI的响应频率(?f)是一个综合响应,主要受电极表面质量负载,黏弹性和粗糙度等因素的影响。动态电阻(Rm)等效为晶体振荡时,摩擦等引起的机械能耗,动态电阻的变化(?Rm)即反映了溶液的密度、黏度,PQC表面膜层黏弹性以及粗糙程度的变化。而此实验中SBF的密度与粘度基本不变,因此,电阻的变化可归结为PQC表面黏弹性以及粗糙度的变化。

(a) ?f的响应; (b) ?Rm的响应; (c) ?Lm的响应; (d) ?Cm的响应; (e) ?Cs的响应
图3 HA-CS在模拟体液中各参数随时间变化的响应图
Fig. 3 Time course of simultaneous responses of various parameters during HA-CS biomineralization in SBF
对于8 MHz的晶振,当?f/?Rm大于10 Hz/W,就可不考虑溶液的密度与膜层黏弹性等因素,理解为纯质量响应。图4所示为?f —?Rm关系图。从图4可以看出,整个矿化过程可以分为以下3个阶段。
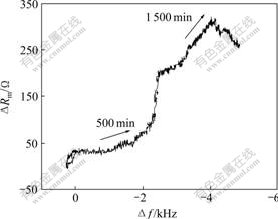
图4 HA-CS在模拟体液中矿化的参数?f—?Rm响应图
Fig. 4 ?f vs. ?Rm for HA-CS biomineralization in SBF
a. 开始阶段,?f —?Rm响应图斜率很小,在此阶段?f/?Rm值约为40 Hz/W,可以忽略密度与黏弹性等的影响,因此,?f主要是电极表面质量变化引起的。此阶段可以理解为,刚开始,HA-CS复合材料修饰好的电极浸入略带碱性(pH=7.4)的SBF中时,溶液中的
OH-富集到复合材料表面,使表面带负电荷,然后吸附SBF中的Ca2+,形成了一个富含Ca2+的表面,表面的Ca2+进一步束缚溶液中的PO43-,从而构成有利于类骨磷酸钙盐晶核形成[15]。因此,这可以作为第1个阶段,称之为晶核的形成。
b. 在接近500 min时?f—?Rm斜率发生显著变化。此阶段频率变化平缓,而电阻呈直线上升趋势,说明此过程不再是单纯的质量变化,而是电极表面质量与膜层的黏弹性及粗糙度变化的共同作用,且此时黏弹性及粗糙性作用大于质量作用。而500 min后频率变化比较快,电阻变化较慢,斜率变小,此阶段可认为质量响应占主导作用的综合响应。可理解为新沉积在电极表面的磷酸钙盐结构发生了变化。晶核形成后,随着周围环境中其他相关的离子,如OH-,CO32-等的掺杂,磷酸钙盐经过一系列组成、结构上的调整及转化,最终矿化成为类骨磷酸钙盐。磷酸钙盐的结构变化引起了PQC表面黏弹性以及粗糙度的变化,磷酸钙盐的最终形成引起了质量的增加。此阶段可认为是第2阶段,称之为晶核的生长。
c. 到1 500 min时,频率继续降低,但是,电阻不仅未增加,反而减小,即图中?f —?Rm的斜率从负值变为了正值,此阶段质量响应占主要作用。可理解为PQC表面以生成的类骨磷酸钙盐为新晶核,结合模拟体液中的离子,继续生成磷酸钙盐,所以,质量增加,频率减少。复合材料HA-CS是一种多孔的材料。然而,在PQC表面新沉积的磷酸钙盐不但使PQC质量继续增加,而且不断沉积的新物质使PQC表面更加致密光滑,晶振剪切的阻力减小,导致电阻减小。此阶段可认为是第3阶段,可称为新物质的继续生成 阶段。
在整个矿化过程中,动态电感?Lm和动态电容?Cm的变化不明显。静态电容Cs反映的是界面双电层电容。静态电容变化(?Cs)是由于电极界面电容以及膜层结构的变化引起的。在图4中,?Cs刚开始呈下降趋势,这是由于HA-CS复合材料在模拟体液中不断矿化生成一层新物质,使得膜层更厚更致密。在后一阶段,虽然膜层继续增厚,但是,膜层结构的重组使介电常数发生了变化,各因素共同作用使得电容?Cs变化较小。
2.3 扫描电镜表征材料矿化不同阶段的形貌
图5所示为复合材料在模拟体液中矿化不同时间的SEM照片。从材料矿化前的照片(图5(a))可以看出,此复合材料HA-CS是一种多孔状的结构。在模拟体液中矿化500 min后(图5(b)),有一些白色的物质零星的点缀在复合材料表面,这就是晶核的形成。矿化 1 500 min后可见表面覆盖物明显增加(图5(c)),可认为是磷酸钙盐的形成。而矿化2 000 min后(图5(d)),表面几乎完全被一层覆盖物覆盖,并且使得表面更加得光滑平整,可认为生成的磷酸钙盐不断增长。此与上述推出的复合材料在模拟体液中矿化过程分为3个阶段相符合。

(a) 矿化前; (b) 矿化500 min; (c) 矿化1 500 min; (d) 矿化2 000 min
图5 复合材料HA-CS在模拟体液中矿化不同时间的扫描电镜照片
Fig.5 SEM images of HA-CS after soaking in SBF for various time
2.4 红外光谱分析
HA-CS在模拟体液中浸泡不同时间后的红外图谱如图6所示。从图6可见,未在模拟体液中浸泡的HA-CS复合材料在1 602 cm-1和1 484 cm-1处有2个弱峰,即复合材料中壳聚糖酰胺Ⅰ谱带和—NH2吸收峰。在模拟体液中浸泡后,2峰消失,说明此复合材料表面被一层新的物质覆盖。同时,在630 cm-1和525 cm-1处的2个较弱的吸收双峰开始尖锐化,这是结晶态PO43-官能团中P—O的特征弯曲振动峰所致。浸泡2 d后,这对吸收峰强度增加,峰形轮廓更清晰,更尖锐,说明经SBF 浸泡后电极表面生成了结晶态的PO43-增加。与此同时,浸泡1 d后,在1 495 cm-1处出现了微弱的吸收峰,该峰为碳酸根CO32-中C—O 的特征振动,2 d后CO32-的振动峰变得明显,从而可以证明浸泡后电极表面生成了较多的碳酸羟基磷灰石。
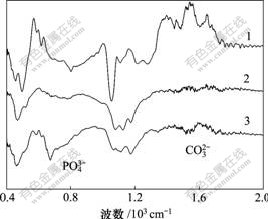
1—0; 2—1 d; 3—2 d
图6 HA-CS在模拟体液中浸泡不同时间的红外谱图
Fig. 6 FTIR spectrum of HA-CS incubated in SBF
2.5 动力学分析
有关矿化过程的动力学研究对材料矿化条件的选择与控制有重大意义。其一,可据此来考察不同材料的活性;其二,因为动力学方程可反映出各过程进行的速度,因此,对模拟体液中制备类骨磷酸钙盐有一定的指导作用。如前所述,复合材料HA-CS在模拟体液中的矿化过程可以分为3个阶段。
第1个阶段可认为纯质量响应过程,石英晶体谐振频率与晶体电极表面质量负载变化之间的关系可满足Sauerbrey方程:

Df = (0.287±0.001)Dm。 (2)
也就是说,频率降低1 Hz,对应电极表面质量增加 3.47 ng。
利用第1阶段的频率随时间变化的实时监测数据,经回归分析,可得:
Df = -4 132.22+5 191 exp(-t/412.05)
(当0<t<500 min时)。 (3)
将式(2)代入式(3)可得:
Dm = -1 4347.2+1 8024.3exp(-t/412.05)
(当0<t<500 min时)。 (4)
此矿化过程中各时间段增加的质量就可以通过方程(4)得到。
第2阶段是质量变化与膜层黏弹性、粗糙度等的共同作用的综合响应过程。对此阶段的频率响应数据进行回归分析可得到第2阶段的动力学方程为:
Df = -5 123.67 + 5 852 exp(-t/646.04)
(当500<t<1 500 min时)。 (5)
第3个阶段是质量占主导作用的综合响应过程,得到相应的动力学方程为:
Df = -5 721.22 + 3 587 exp(-t/1 277.27)
(当1 500<t<2 050 min时)。 (6)
通过动力学分析,可以简便地获取骨组织功能材料矿化的速度,为今后骨生物材料的选择提供新的方法。运用本文的方法也可确定影响矿化效果的最佳参数,如温度,模拟体液浓度等。
3 结 论
a. 采用压电石英晶体研究HA-CS复合材料在模拟体液中的矿化行为。不同质量比的HA-CS复合材料在模拟体液中矿化过程中的频率下降幅度有一定的差异,即矿化的效果不一样。当HA与CS质量比为6?4时,矿化效果最佳,生物活性最强。
b. PQCI实时在线监测所得的频率(Df)、动态电阻(Rm)、动态电感(Lm)、动态电容(Cm)和静态电容(Cs)等参数的变化可用于评价矿化过程中HA-CS复合材料的微观变化。根据矿化过程中频率与动态电阻的变化可将HA-CS在模拟体液中的矿化过程分成3个阶段:第1个阶段,以质量响应为主,晶核形成;第2阶段,质量与黏弹性共同作用,晶核生长;第3个阶段,以质量为主的综合作用,新物质继续生长。经过线性回归获得的各阶段的动力学方程可以考察其矿化过程的速度。
c. 采用扫描电镜表征复合材料在模拟体液中矿化的3个过程。红外光谱检测证实HA-CS复合材料在模拟体液中矿化生成的新物质为碳酸羟基磷灰石。
参考文献:
[1] Hench L L. Biomaterials: A forecast for the future[J]. Biomaterials, 1998, 19(16): 1419-1423.
[2] Itoh S, Kikuchi M, Takakuda K, et al. The biocompatibility and osteoconductive activity of a novel hydroxyapatite/collagen composite biomaterial, and its function as a carrier of rhBMP-2[J]. Biomed Mater Res, 2001, 54(3): 445-453.
[3] 张 斌, 周科朝, 黄苏萍, 等. HAP/HDPE/UHMWPE复合材料的制备和表征[J]. 中南大学学报: 自然科学版, 2008, 39(1): 23-28.
ZHANG Bin, ZHOU Ke-chao, HUANG Su-ping, et al. Preparations and characterizations of HAP/HDPE/UHMWPE composites[J]. Journal of Central South University: Science and Technology, 2008, 39(1): 23-28.
[4] KONG Li-jun, GAO Yuan, CAO Wen-ling, et al. Preparation and characterization of nano-hydroxyapatite/chitosan composite scaffolds [J]. Biomed Mater Res A, 2005, 75(2): 275-282.
[5] 李保强, 胡巧玲, 钱秀珍, 等. 原位沉析法制备可吸收壳聚 糖/羟基磷灰石棒材[J]. 高分子学报, 2002(6): 828-833.
LI Bao-qiang, HU Qiao-ling, QIAN Xiu-zhen, et al. Bioabsorbable chitosan/hydroxyapatite composite rod prepared by in-situ precipitation for internal fixation of bone fracture[J]. Acta Polymerica Sinica, 2002(6): 828-833.
[6] Kokubo T, Takadama H. How useful is SBF in predicting in vivo bone bioactivity?[J]. Biomaterials, 2006, 27(15): 2907-2915.
[7] Kim H M, Himeno T, Kokubo T, et al. Process and kinetics of bonelike apatite formation on sintered hydroxyapatite in a simulated body fluid[J]. Biomaterials, 2005, 26(21): 4366-4373.
[8] Gu Y W, Khor K A, Cheang P. Bone-like apatite layer formation on hydroxyapatite prepared by spark plasma sintering (SPS)[J]. Biomaterials, 2004, 25(18): 4127-4134.
[9] Bigi A, Panzavolta S, Rubini K. Setting mechanism of biomimetic bone cement[J]. Chem Mater, 2004, 16(19): 3740-3745.
[10] Laird D F, Mucalo M R, Yokogawa Y. Growth of calcium hydroxyapatite (Ca-HAp) on cholesterol and cholestanol crystals from a simulated body fluid: A possible insight into the pathological calcifications associated with atherosclerosis[J]. Colloid Interface Sci, 2006, 295(2): 348-363.
[11] KONG Li-jun, GAO Yuan, LU Guang-yuan. A study on the bioactivity of chitosan/nano-hydroxyapatite composite scaffolds for bone tissue engineering[J]. Eur Polym J, 2006, 42(12): 3171-3179.
[12] Cooper M A, Singleton V T. A survey of the 2001 to 2005 quartz crystal microbalance biosensor literature: applications of acoustic physics to the analysis of biomolecular interactions[J]. Mol Recognit, 2007, 20(3): 154-184.
[13] 王庆良, 葛世荣, 朱 华, 等. 常温常压下纳米羟基磷灰石晶体的合成及结构研究[J]. 中国矿业大学学报, 2004, 33(5): 533-536.
WANG Qing-liang, GE Shi-rong, ZHU Hua, et al. Study on the synthesis and structure of nanosized hydroxyapatite crystals at normal temperature and atmospheric pressure[J]. China University of Mining & Technology, 2004, 33(5): 533-536.
[14] Nakamatsu J, Torres F G, Omar P. Processing and characterization of porous structures from chitosan and starch for tissue engineering scaffolds[J]. Biomacromolecules, 2006, 7(12): 3345-3355.
[15] 郑裕东, 王迎军, 杨 槐, 等. 生物活性复合材料在生物矿化过程中的微观形貌与离子浓度变化[J]. 高等学校化学学报, 2005, 12(11): 2140-2144.
ZHENG Yu-dong, WANG Ying-jun, YANG Huai, et al. Changes of micromorphology and ion concentrations for bioactive composite materials during the process of biomineralization under physiological condition[J]. Chemical Journal of Chinese Universities, 2005, 12(11): 2140-2144.
收稿日期:2008-04-03;修回日期:2008-06-20
基金项目:“973”计划资助项目(2005CB623901)
通信作者:何德良(1969-),男,湖南益阳人,教授,从事生物电化学研究;电话:0731-8822286;E-mail: delianghe@163.com
[1] Hench L L. Biomaterials: A forecast for the future[J]. Biomaterials, 1998, 19(16): 1419-1423.
" target="blank">[15] 郑裕东, 王迎军, 杨 槐, 等. 生物活性复合材料在生物矿化过程中的微观形貌与离子浓度变化[J]. 高等学校化学学报, 2005, 12(11): 2140-2144.ZHENG Yu-dong, WANG Ying-jun, YANG Huai, et al. Changes of micromorphology and ion concentrations for bioactive composite materials during the process of biomineralization under physiological condition[J]. Chemical Journal of Chinese Universities, 2005, 12(11): 2140-2144.


