中国有色金属学报 2004,(03),460-464 DOI:10.19476/j.ysxb.1004.0609.2004.03.023
Al-Ti基体上纳米网状钙磷陶瓷/多孔Al2O3生物复合涂层的原位生长
湖南大学机械与汽车工程学院,湖南大学化学化工学院,湖南大学化学化工学院 长沙410082 ,长沙410082 ,长沙410082
摘 要:
先采用PVD法在医用钛金属表面沉积一层Al膜,得到Al Ti基体材料;而后采用阳极氧化与水热合成复合制备技术在Al Ti基体上成功构造了由纳米网状磷酸盐组成的钙磷生物陶瓷/Al2O3多孔复合生物涂层。利用扫描电镜(SEM)、透射电镜(TEM)、电子能谱(EDAX)、X射线衍射(XRD)表征了阳极氧化前后铝膜和钙磷生物陶瓷涂层的微观形貌、元素构成以及晶相成分。结果表明:在阳极氧化过程中,钙、磷元素嵌入阳极氧化铝(AAO)膜,并经水热处理反应原位生成钙磷陶瓷;钙磷陶瓷晶体从Al2O3孔洞长出并覆盖于多孔氧化膜的表面;最终获得的钙磷生物陶瓷/多孔Al2O3复合涂层具有纳米网状、多孔的结构特征。分析探讨了钙磷生物陶瓷/多孔Al2O3复合涂层的原位生长过程,浓度梯度与电位差分别是Ca、P元素进入AAO膜的主要推动力。
关键词:
中图分类号: TB383
作者简介:何莉萍(1968),女,教授,博士.;陈宗璋,教授;电话:07318823863;E mail:elisahe68@yahoo.com;
收稿日期:2003-06-24
基金:香港DAG基金资助项目(7100222);
In-situ growth of nanometric network calcium phosphate/porous Al2O3 biocomposite coating on Al-Ti substrate
Abstract:
Pure Al thin film was PVD-deposited on medical titanium to form Al-Ti substrate. Al-Ti substrate was then applied to the hybrid technique of anodization and hydrothermal treatment, which finally led to the successful fabrication of nanometric network calcium phosphate/porous Al2O3 biocomposite coating on Al-Ti substrate. Scanning electron microscopy(SEM), transmission electron microscopy(TEM), energy-dispersive X-ray analysis(EDAX) and X-ray diffraction(XRD) were employed to study the microstructures and compositions of Al thin film and calcium phosphate/porous Al2O3 biocomposite coating. The results indicate that the Ca and P ions are incorporated into the anodized alumium oxide(AAO) during the anodization process, and the incorporated Ca and P are reacted to be calcium phosphate after hydrothermal treatment. The calcium phosphate grows from the holes of AAO and covers the surface of AAO layer. In addition, the mechanism for the in-situ growth process of calcium phosphate/porous Al2O3 biocomposite coating was discussed. The concentration gradient and potential difference contribute to the incorporation of Ca and P into AAO film, respectively.
Keyword:
calcium phosphate; Ti substrate; anodization; PVD; hydrothermal treatment; biocomposite;
Received: 2003-06-24
钛及其合金(如Ti6Al4V)具有质轻、 耐挤压、 抗弯曲等优良的力学性能, 是目前较多应用于人体硬组织取代与修复领域的一类医用材料; 但因属于惰性生体材料, 在植入人体后有致毒(引起炎症、 刺激、 过敏等)和导致突变的危险
基于阳极氧化生成Al2O3优异的耐磨、 抗蚀性能以及具有多孔的结构特征
1实验
1.1样品制备
在商业纯钛片(d 18 mm×(0.5~0.8)mm, 纯度高于99.99%)上物理气相沉积(PVD)铝膜(铝靶纯度高于99.99%, 英国Goodfellow公司生产)。 将所制得Al-Ti材料作为阳极, 以大面积铝板作为阴极, 含钙、 磷盐为主要成分的电解质提供钙、 磷元素, 直流电压恒压阳极氧化, 以去离子水洗涤、 吹干, 获得含钙、 磷元素的多孔Al2O3/Al-Ti复合材料。 随后将其置于高压反应釜中进行水热处理, 工艺条件为: 212 ℃, 2.0 MPa, 8 h, 介质为磷酸的去离子水溶液(1∶800)。 将水热处理后的样品用去离子水反复淋洗, 吹干。
1.2测试与表征
利用扫描电镜及能谱仪(SEM+EDAX, JEOL/JSM-5600)观察PVD沉积铝膜形貌、 阳极氧化后以及水热处理后样品的表面形貌、 结晶形态和表面元素构成; 用透射电镜(TEM, Philips CM20)分析水热处理后多孔复合膜的结构特征; 用X射线衍射仪(XRD, Siemens D500)测试复合涂层体系的物相组成。
2结果与讨论
2.1多孔Al2O3/Al-Ti基底的形貌与成分分析
采用PVD法在钛基底上沉积的铝膜形貌如图1所示。 从图可知, 由于铝的局部团聚, 使铝膜呈现一定的粗糙度。 非平滑纯铝膜的形成是后续阳极氧化的基础, 也为水热处理原位生长钙磷生物陶瓷涂层提供了更多的嵌入生长点。
图1 PVD法沉积铝膜的表面形貌
Fig.1 Micrograph of Al thin film deposited on Ti by PVD
上述Al-Ti基底经阳极氧化处理后, 成功转变为多孔Al2O3/Al-Ti体系, 图2所示为其SEM微观形貌。 众所周知, 铝的常规阳极氧化(通常以硫酸、 草酸、 磷酸或它们的混合物作为电解介质)通常形成具有密布、 六棱柱状结构孔洞的多孔Al2O3层。 但从图2可知, 本实验所得多孔Al2O3层的针孔孔径在10~30 nm之间, 分布较为疏散, 而且粗糙表面(铝的团聚)并未随着电解的进行而变得平滑。 由于阳极氧化条件(如电压、 温度、 时间等)与常规阳极氧化相近似, 故可推断正是特殊的电解质造成了该阳极氧化Al2O3的形貌特征。
图2 阳极氧化铝的表面形貌
Fig.2 SEM microstructure of porous Al2O3
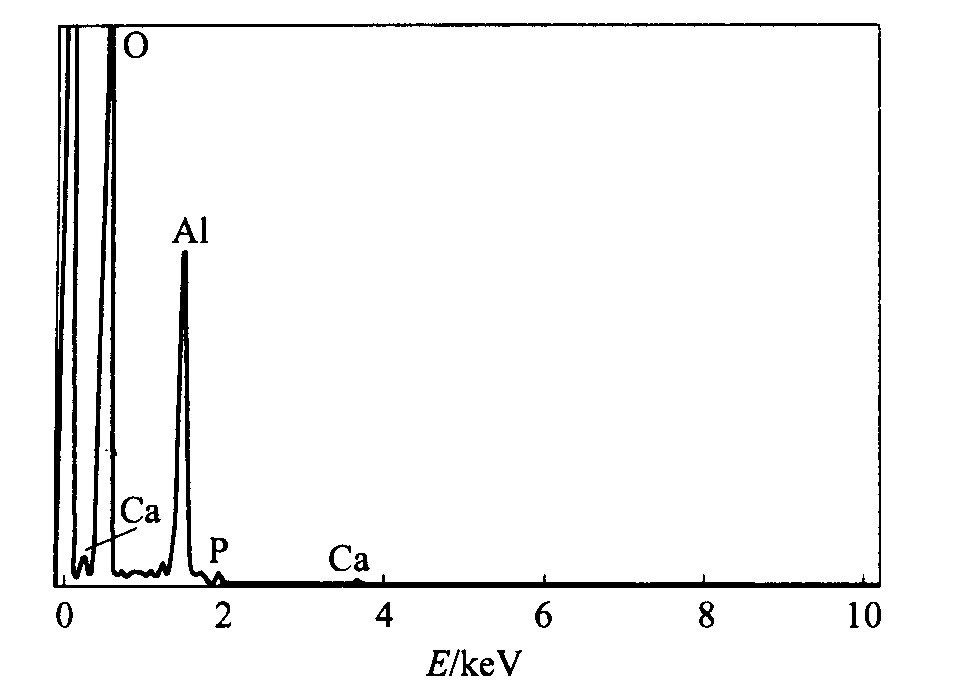
电子能谱分析(图3)表明此多孔Al2O3膜中含有Ca、 P元素。 因为已用去离子水反复清洗经阳极氧化的样品, 所以Ca、 P元素是存在于多孔膜中而非吸附于其表面, 能谱图中未检测到其它元素也证明了这一点。
图3 阳极氧化铝EDAX成分分析结果
Fig.3 Elements analyses of anodized aluminum oxide by EDAX
2.2钙磷生物陶瓷涂层的形貌、 物相分析
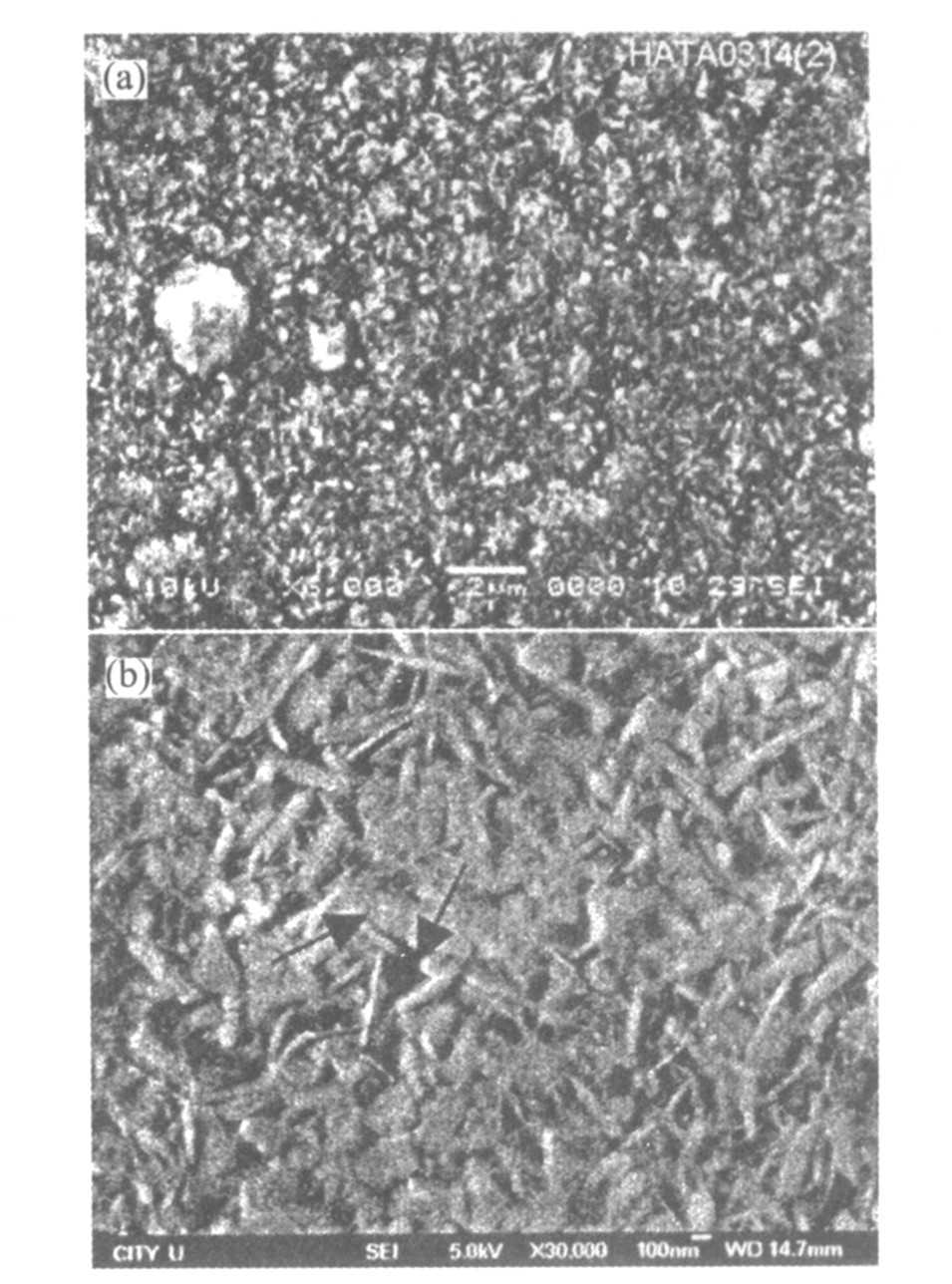
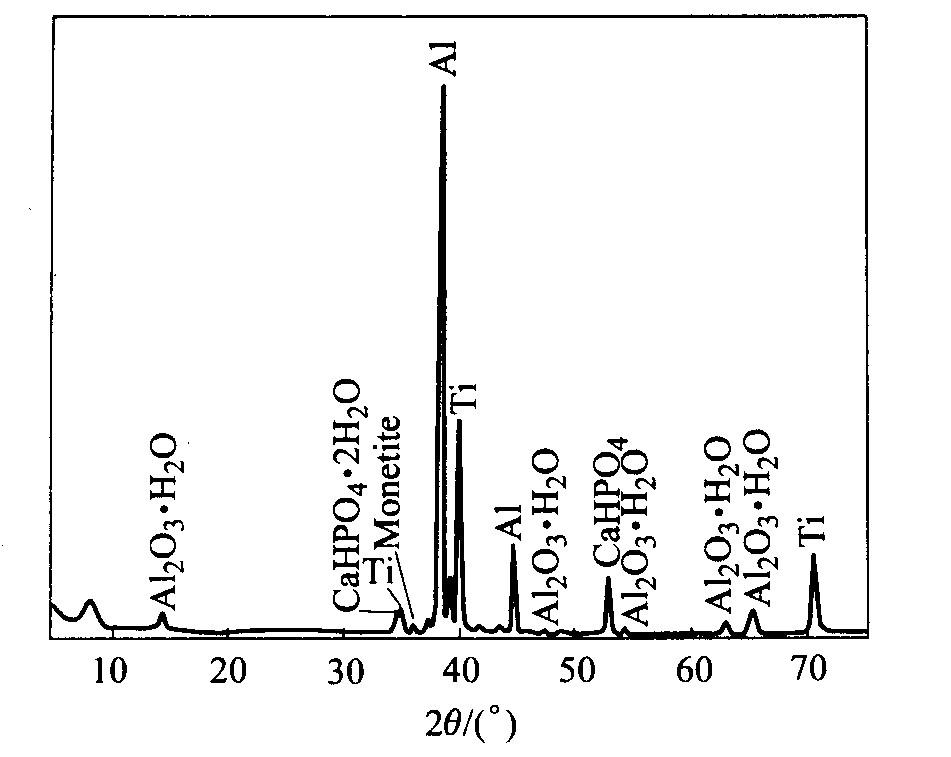
经过水热处理后, 在含钙、 磷元素的多孔Al2O3/Al-Ti基体上成功构造了纳米网状钙磷生物陶瓷涂层, 其微观形貌如图4所示。 从图中可知, 所得涂层由直径为7~30 nm、 长度为200~650 nm并相互交连成网状的针状晶体构成。 该钙磷涂层的形状和结构在一定程度上模拟人体骨骼结构特征, 即人体密质骨中羟基磷灰石沿胶原体生长, 并且胶原体呈纤维网状结构, 羟基磷灰石也为纳米级纤维网状晶体。 在进行硬组织植入修复或替换时, 这种仿生涂层结构将有利于新生骨的生长嵌入, 形成牢固的“骨整合”, 从而提高新骨与植入体系间的结合强度, 延长植入材料的有效使用寿命。 图5所示为钙磷陶瓷-Al2O3/Al -Ti多孔体系的TEM形貌。 从图中可清晰地观察到多孔Al2O3层的管状结构, 且在纤维管状结构中有钙磷盐相(图中多孔层较为明亮的部分)以纳米线形式存在。 X射线衍射分析结果表明(如图6所示), 复合涂层由水合Al2O3、 水合CaHPO4与CaHPO4构成; 此外, 还可观察到Al2O3的非晶峰(图6中左侧的矮宽峰)。 可见生物陶瓷涂层是磷酸钙盐的混合物相。 但从图4与图6所显示的结果来看, 复合涂层的表面绝大部分为三斜磷酸钙。 文献[12]表明, 前述几类酸性磷酸钙能在体内生理环境中转换为羟基磷灰石, 因此, 该复合磷酸钙盐涂层将具有优异的生物活性与生物相容性。 而且所得材料的原位生长效应、 多孔效应以及仿生结构特征将有可能提高陶瓷涂层与基体之间的结合强度等力学性能。
图4 钙磷生物陶瓷涂层的表面形貌
Fig.4 Micrographs of calcium phosphate bioceramic coatings (a)—Lower magnification; (b)—Higher magnification
图5 含钙磷陶瓷(白色线状物) 多孔Al2O3层的TEM形貌
Fig.5 TEM microstructure of porous Al2O3 containing calcium phosphate bioceramic(white nanowires)
图6 钙磷生物陶瓷复合涂层的XRD谱
Fig.6 XRD pattern of calcium phosphate bioceramic coating
2.3钙磷生物陶瓷/Al2O3复合涂层的原位生长过程分析
2.3.1 影响钙磷元素进入Al2O3层的主要因素
文献[13]表明, 在进行电解处理时, 强电场中的带电粒子(如离子、 荷电胶粒等)将按电场的作用力作相应运动, 即负电粒子向高电位处迁移, 而荷正电的粒子则朝低电位方向运动; 当电场强度不高时, 荷电粒子则受浓度梯度等其它势场的影响更大, 甚至出现逆电场方向的迁移运动。
本研究中, 在阳极氧化的初始阶段, Al-Ti基体的铝膜表面将迅速形成致密的Al2O3层。 在导电能力低的Al2O3层完全形成之前, 电解质溶液电压降占整个槽压的较大部分, 加之极间距较小(<5 cm), 所以电解质中的带电离子或带电基团将在强电场中发生定向移动, 如Ca2+向阴极迁移, 而含磷的负电基团则会在阳极基片附近富集, 后者进入阳极表面双电层并在发生某些相应的化学与电化学反应后, 磷元素以杂质的形式嵌入Al2O3晶格形成缺陷。 此阶段仅有极少量的钙元素混入Al2O3层。
当形成致密Al2O3层后, 阳极氧化进入多孔Al2O3层的生长阶段, 电解体系的电阻变得很大, 电流密度随之降低, 阳极附近双电层内的化学与电化学反应趋于平缓。 一方面, 含磷的负电基团继续在阳极表面富集、 反应并进入Al2O3多孔层, 但数量较致密Al2O3层形成阶段要少; 另一方面, 由于电解质中的电场强度非常低(此时电解液的阻值相对于近乎绝缘的Al2O3层阻值可忽略不计), 故浓度梯度将成为高浓度离子(如实验体系中的Ca2+)运动的主要推动力。 因此, 该阶段将有大量的Ca2+在浓度差的作用下进入阳极双电层, 且进入不断生长变厚的多孔Al2O3层中。
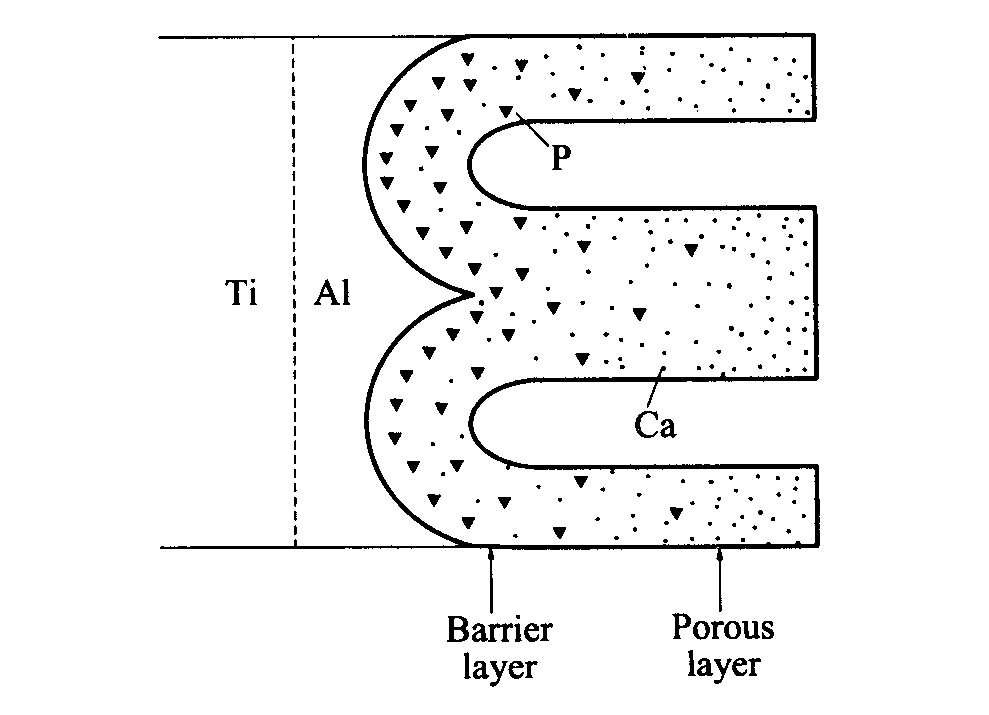
最终在电势差、 浓度差以及相关双电层反应的共同作用下, 钙、 磷元素进入Al2O3/Al-Ti体系中且呈梯度分布(如图7所示): 从致密Al2O3层到多孔Al2O3层, 磷含量降低, 钙含量增加。 由于致密Al2O3层形成过程很短, 阳极氧化的绝大部分时间为多孔Al2O3层的生长, 所以氧化铝中钙含量应比磷含量高。 该分析结果很好地与能谱(EDAX)元素分析结果(见表1)相吻合。
图7 Al2O3中钙、 磷元素分布示意图
Fig.7 Schematic diagram of Ca and P distribution in anodic aluminum oxide
表1 Al2O3膜层中各元素的含量
Table 1 Ingredient of anodized aluminumoxide(mole fraction, %)
O |
Al | Ca | P |
65.74 |
30.39 | 3.43 | 0.44 |
2.3.2 涂层的水热生长分析
经阳极氧化的样品在212 ℃, 2.0 MPa的高温高压蒸汽中进行处理, 主要有以下3方面的变化。
1) Al2O3层中的钙、 磷元素由于热运动, 向多孔Al2O3层富集并伴随有与氧等其它元素或基团间的反应, 生成少量磷酸钙盐晶种。
2) 随着水热处理时间的延长, 磷酸钙盐从AAO膜孔中沿管壁向外生长, 最终覆盖在AAO膜表面, 形成生物活性优异的纳米生物陶瓷涂层。
3) 高温状态使水热处理料液中H3PO4的第二、 三级离解变得容易, 可为富余的钙离子提供充足的磷源(HPO
由于阳极氧化铝具有薄致密层与厚多孔层的独特结构, 使其所含的钙、 磷元素在高温高压条件下可完全参与磷酸盐的成核生长反应, 避免致密Al2O3层中残留钙、 磷杂质元素而导致的氧化铝层与基底间结合强度下降。 因此, 采用先阳极氧化再水热处理的复合制备技术, 可完全将含钙、 磷元素的阳极化多孔Al2O3充分转变为钙磷陶瓷/多孔Al2O3复合涂层, 即使复合涂层原位生长于Al-Ti基体上。
3结论
在钛片上PVD法预沉积纯铝膜, 通过阳极氧化与水热处理复合制备技术在Al-Ti基体上成功制得了纳米网状磷酸钙盐/多孔Al2O3生物复合涂层材料。 在阳极氧化阶段, 钙、 磷元素分别在电位差和浓度差的作用下进入阳极氧化铝层并呈梯度分布; 经水热处理,于Al-Ti基体上原位形成具有纳米尺寸的网状钙磷生物陶瓷/多孔Al2O3复合涂层。
参考文献