DOI: 10.11817/j.issn.1672-7207.2016.09.050
油藏内源乳化功能微生物对剩余油的微观驱替机理
朱维耀1,田英爱1,汪卫东2,宋智勇1,韩宏彦1,宋永亭2,李彩风2
(1. 北京科技大学 土木与环境工程学院,北京,100083;
2. 中国石化胜利油田分公司 采油工艺研究院,山东 东营,257000)
摘 要:
(Geobacillus stearothermophilus SL-1)为对象,利用微观渗流物理模型模拟油藏条件(65 ℃,10 MPa),研究该菌株对剩余油的驱替作用和机理。通过对比其与菌群的综合作用,揭示乳化功能菌对整体驱油效果的贡献;通过对比外源发酵与内源激活2种方式对剩余油驱替效果的差异,揭示生命活动的独特驱油机理。研究结果表明:该微生物及其代谢产物能够有效乳化分散剩余油,促进其剥离与渗流;该产物促使原油分散形成的油水乳液黏度较原油的原始黏度提高2~70倍,有助于改善深部孔隙的油水流度比、增大波及体积;并能够改变孔隙壁面的润湿性,提高膜状剩余油的驱替效果;模型内激活的微生物依靠特有的界面趋向性和原位代谢,比外源发酵方式多采出21%的盲端剩余油,包括化学驱无法波及的深层盲端。依靠上述机理提高微观模型总采收率达11.2%~13.5%。
关键词:
中图分类号:TE357.9 文献标志码:A 文章编号:1672-7207(2016)09-3280-09
Mechanisms of oil displacement by indigenous microorganism producing bio-emulsifier using microscopic modeling
ZHU Weiyao1, TIAN Ying’ai1, WANG Weiding2, SONG Zhiyong1, HAN Hongyan1,
SONG Yongting2, LI Caifeng2
(1. School of Civil and Environmental Engineering, University of Science & Technology Beijing, Beijing 100083, China;
2. Oil Production Technology Research Institute, Shengli Oilfield Company of SINOPEC, Dongying 257000, China)
Abstract: A strain producing emulsifier, Geobacillus stearothermophilus SL-1, was isolated from community of oil reservoir and chosen as target species. A microscopic seepage model was used to simulate reservoir environment and to determine the displacement effect and mechanism of on residual oil by the strain. The oil displacement mechanisms between G. stearothermophilus SL-1 and indigenous microbial community was contrasted; meanwhile, the different of displacement phenomena and mechanism between activating microbial in model and flooding with fermentation broth was studied intensively for illustrating the unique property of microbial flooding. The results show that the product of this strain can efficiently emulsify the residual oil to improve flow capacity. The viscosity of emulsion increased by 7-20 times than the crude oil, therefore, the enhancement of mobility ratio can shift the flow into the edges where flooding could not reach. Moreover, the wettability of surface of solid is altered, and the oil displacement in membranes and blind ends are improved. Particularly, the oil recovery in blind end is improved by 21%, due to the unique characteristics of cells activated in the model, such as chemotaxis and in-situ metabolism, which is absent in chemical displacement. In general, the oil recovery in the whole model increases by 11.2%-13.5%.
Key words: physical simulation; microscopic model; bioemulsifier; oil recovery
内源微生物驱油技术是依靠人工激活油藏中的微生物群落,依靠微生物的生命活动及代谢产物提高原油采收率的绿色开发技术,经多年研究已在部分现场显示出与化学驱相近的良好驱油效果及更优的经济性[1]。但因内源菌群依托多种功能微生物及代谢产物(如生物表面活性剂、生物气、生物聚合物、有机酸等)共同作用于原油和油藏孔隙来影响渗流以致残余油饱和度[2-5],多种机理掺混使得各自的贡献程度及相互影响尚不清晰,导致现场工艺优化缺乏明确方向,严重延缓了微生物技术的新区块筛选和实施进度。而物理模拟实验是驱油技术获取清晰机理与准确参数不可或缺的研究手段。其中,微观渗流模拟能够为机理描述提供直观现象及半定量数据支撑,是重要和必要的物理模拟方法。目前,多数微观研究仅针对常压、不同的油藏温度开展微生物渗流实验[6-8],忽视了环境压力对微生物代谢速率和生物气的重要影响。因微观模型材质不耐高压,已有报道仅在模型外培养微生物时保持压力,模型驱替阶段仍降至常压[9],无法为内源微生物在孔隙中的原位代谢研究提供高压模拟条件。针对这一问题,朱维耀等[10-11]建立了具备高温高压模拟能力(压力≤25 MPa,温度≤150 ℃)的微观可视渗流模拟系统,发现内源混合菌群在油藏(65 ℃,10 MPa)条件下对剩余油起到了降解、溶解气降黏、乳化分散、降低界面张力、改变润湿性等多种作用[10]。针对这一由多机理混合的复杂系统,亟需准确辨识不同条件下的主导驱油机理,即明确不同驱油功能对整体效果的贡献程度。为实现该综合目标,首先应以清晰认识各功能菌的独立驱油机理为基础。作为其中的重要环节之一,本文作者针对油藏优势菌群中普遍存在的产乳化剂功能菌(嗜热脂肪地芽孢杆菌SL-1作为模式研究对象)开展微观模拟研究,并与前期针对整体菌群作用的研究结果进行对比,揭示产乳化剂功能菌在整体群落作用效果中的贡献方式;另外,通过对比外源发酵与内源激活效果的微观差异,研究微生物在孔隙中的生长繁殖等生命活动对剩余油动用所发挥的作用及机理。
1 实验材料与方法
1.1 实验材料
实验所用原油来自胜利油田沾3区块,65 ℃黏度为59.4 mPa·s。微观模型驱替水为模拟地层水,NaCl质量浓度为3.2 g/L,CaCl2质量浓度为0.2 g/L,MgCl2质量浓度为0.1 g/L,pH为7.0;
本研究的研究对象菌株SL-1分离自油田产出液,产生物乳化剂,经鉴定为嗜热脂肪地芽孢杆菌Geobacillus stearothermophilus,以石油烃为唯一碳源生长,最适生长温度为65~70 ℃[12],是中高温油藏最常见、且与驱油效果高度相关的内源优势菌种之一[3, 13-14]。
模型驱替用微生物注剂包括:1) 发酵液:微生物接种于无菌激活剂中(接种量(体积分数)为8%),在 65 ℃,以转速120 r/min震荡培养2周(时长与模型静态培养一致);2) 菌体:经培养的发酵液以3 000 r/min离心10 min,弃上清液,菌体重新悬浮于等体积无菌水中,即得到该菌体悬液;3) 激活剂:包括葡萄糖3.0 g/L、酵母粉3.0 g/L、蛋白胨3.0 g/L、NaCl 5.0g/L、K2HPO4 2.7 g/L,pH 7.2。
1.2 实验仪器
实验仪器为NDJ-1B旋转黏度计、显微镜、BZY-1全自动表面张力仪、恒温水浴震荡培养箱、微观仿真可视模型(图1)、高温高压微观驱替系统[10](包括微量泵、模型夹持器、容器罐、加压系统、图像采集系统、温控系统等)。
为便于定位观察、明确驱替过程的波及情况,根据距离主流通道的距离将模型进行理论分区。
1.3 微生物培养
SL-1菌接种于无菌激活剂(接种量(体积分数)为8%),在65 ℃以120 r/min震荡培养,每24 h测定细菌数[13]和发酵液的表面张力。
1.4 原油乳化实验及黏度测定
原油与微生物发酵液按照不同油水体积比混合,在65 ℃以150 r/min震荡5 min,静置10 min后观察、

图1 微观可视模型及其水驱流场理论分区示意图
Fig. 1 Photograph of microscopic model and theoretical partition of flow field
拍照记录,并测定乳液脱水率和黏度。
1.5 微观驱替实验
模型恒温65 ℃、恒压10 MPa,注入速度0.08 mL/min,观察并记录实验过程。实验步骤包括:
1) 微观模型抽真空、饱和水。
2) 模型饱和油。
3) 一次水驱1.3Vp,Vp为孔隙体积。
4) 分组注入上述微生物注剂0.8Vp。第1组(发酵液直接驱替组):注入发酵液,之后直接进行第5)步;第2组(模型内培养组):注入菌体与激活剂,保持温度压力静态放置2周,同期观察剩余油变化,之后进行第5)步;第3组(空白对照组):省略步骤4),直接进行第5)步。
5) 二次水驱1.6 Vp。
6) 分析实验图片及数据。
观察剩余油变化,分析拍摄图片中孔隙剩余油的像素灰度,得到原油像素占孔隙像素的比值,即视野孔隙中含油饱和度。某一时刻的饱和度为同期的20个视野的平均值。
2 结果与讨论
2.1 产生物乳化剂功能菌的生长、乳化特性
经过对胜利油田多个区块及我国多个油田的内源微生物检测、调研发现,地芽孢杆菌属(Geobacillus)是中高温油藏最为常见、且与驱油效果高度相关的内源优势菌种之一[3, 14-15]。胜利油田从高温油藏产出液中分离得到产生物乳化剂菌株SL-1,经核酸鉴定为Geobacillus stearothermophilus[12],其最适生长温度(65~70 ℃)和耐高矿化度(8% NaCl)等特征均符合油藏的自然属性。尤其能以原油为唯一碳源生长、合成乳化剂,乳化效果显著且稳定,可提高填砂岩心采收率8.3%。鉴于该菌株来自实际油藏、且其种属分布广泛,本文将其作为乳化功能的模式菌株开展研究。
实验发现:该菌经培养可将发酵液的表面张力降至36.6 mN/m(图2),明显高于内源混合菌群发酵液的最低表面张力(23.2 mN/m)[10],说明该菌代谢产物(生物乳化剂)的表面活性相对糖脂、脂肽等生物表面活性剂较低。但其乳化性能突出,产生的乳化剂能够迅速将原油分散,形成水包油型乳液(图3),油滴直径约10 μm[12]。乳液黏度较高,可达原油初始黏度的2~70倍(表1),有助于在驱油过程中增大高渗通道的渗流阻力、扩大整体的波及体积,对渗流有显著影响,并已在本研究的微观实验中得到证实。值得注意的是,油水体积比为1.5:1时油水乳液黏度增幅出现最大值,因此,该作用更易出现在含油饱和度较高(50%~70%)的区域,或是通过水驱于沿途孔隙不断富集原油,进而在油藏深部发挥作用。而对于含油饱和度极低的注水井周围,则不会因此增大渗流阻力,即不会造成注水压力提高等不良影响。
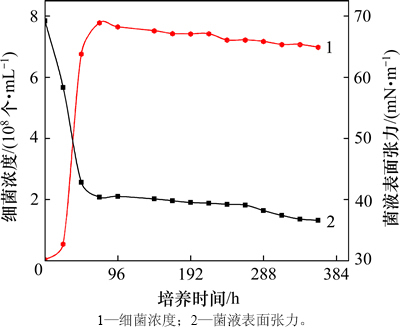
图2 培养过程中微生物浓度和发酵液表面张力
Fig. 2 Concentration of microorganisms and fermentation surface tension during cultivation
表1 不同油水体积比时乳液黏度及脱水率
Table 1 Emulsion viscosity and dewatering rate with different volume ratios of oil to water


图3 不同油水比乳液状态变化
Fig. 3 Emulsion state at different volume ratios of oil to water
2.2 产乳化剂功能菌的驱油效果
经一次水驱后剩余原油40%左右,无论发酵液直接驱替还是模型内培养后驱替,总体驱油效果相似。其表现为,主流通道内剩余油进一步降低,过渡区甚至模型边界剩余油饱和度也显著降低(图4),与单纯的水驱实验(总采收率64.0%)相比,采收率分别提高13.5%和11.2%。发酵液直接驱替组不同形态剩余油的变化如表2所示。从表2可见:对膜状剩余油的采收率最高(54.3%),簇状、柱状和盲端也达到40%左右,最低的孤岛状剩余油采出仅13.7%。
前期研究内源混合菌驱油机理的成果[10]主要包括对原油的降解作用、生物气降黏作用,生物表面活性剂的剥离、乳化作用等。SL-1菌未体现出显著的产气降黏功能,而以乳化分散、改变润湿性等功能为主。图5表明,SL-1发酵液注入的同时就体现出较高的驱油效果,相比一次水驱剩余油采收率减少10.2%;但模型内培养组的菌体与激活剂刚注入时驱替效果相对较低,经孔隙内培养2周后水驱,采收率进一步提高9.4%,总体接近发酵液直接驱替效果,说明模型内的菌体要在激活后配合代谢产物才能充分发挥驱油作用。
从提高采收率看,模型内培养组的总体驱油效果比发酵液直接驱替组的总体驱油效果略低(图5)。摇床震荡使发酵液具有充足的溶氧和较高的传质效率,促进了微生物代谢;而模型孔道内的静置培养限制了微生物的活动范围、营养物传递和代谢速率,最终表现出稍低的驱替效率。
2.3 产乳化剂功能菌驱油机理分析
2.3.1 产乳化剂功能菌乳化分散剩余油
SL-1菌及其代谢产生的乳化剂使原油更易从大块剩余油上逐步剥离分散成较小的油滴、便于通过喉道,增强整体剩余油的运移能力[16-18]。由表2可见:相比一次水驱,注入发酵液后孤岛状原油体积分数由3.4%增至5.8% (增幅68%),正是由于发酵液的乳化分散作用使其他类型的剩余油变成易被驱替的油滴分散在孔道中。在静态图像分析时被归入孤岛状剩余油,实际上是已被释放的流动状态。另外,孔道内含油量较多时,油滴在流动过程中会与其他剩余油相互碰撞聚并成油带,逐步形成更大的连续油相,进而减小油相的流动阻力(图6)。
表2 发酵液直接驱替组不同形态剩余油的变化
Table 2 Changes in different forms of residual oil under broth flooding
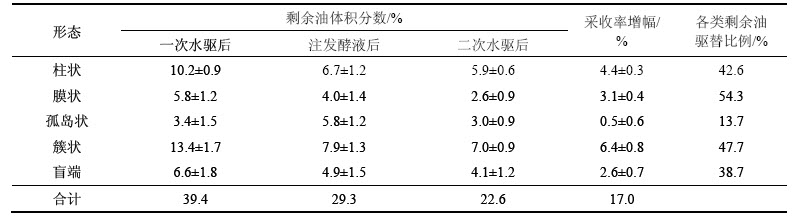

图4 注菌前后模型边界剩余油变化情况
Fig. 4 Changes of residual oil in model boundary before and after microbes injection
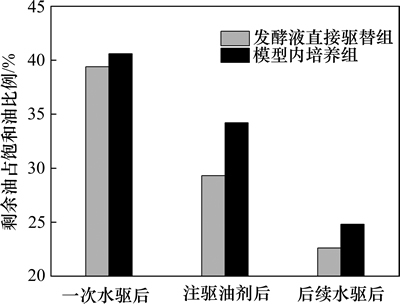
图5 不同驱油方式下总剩余油变化分析
Fig. 5 Changes of total residual oil by different flooding processes
2.3.2 产乳化剂功能菌改变孔隙壁面润湿性
孔道润湿性改变如图7所示。由图7可见:随着模型内培养组的原位静置培养时间延长,膜状剩余油因壁面润湿性改变逐渐收缩直至形成球形,减小了与孔隙壁面的附着力而更易被驱动。同时,盲端中的剩余油与壁面的接触角也显著增大,体现了生物细胞及其代谢产物具有沿界面聚集和渗透的能力。配合其引起的界面张力梯度对流(Marangoni对流)[19],在没有水驱动力的静止培养阶段,部分剩余油即可自发地从圆形盲端内剥离并推出,以游离的油珠形式分布在孔道内,成为易被驱替的形式。
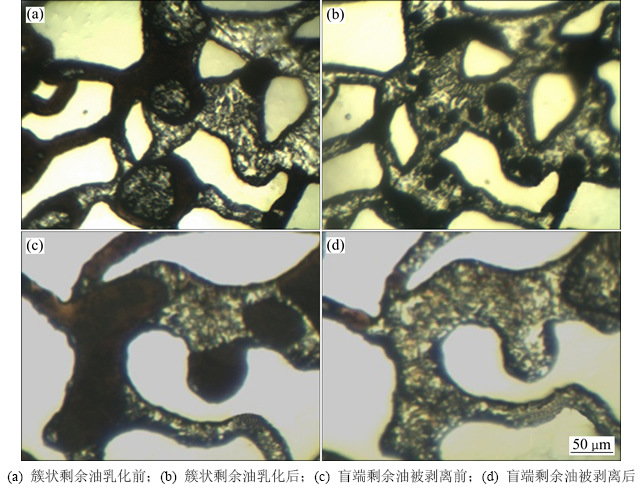
图6 产乳化剂功能菌对剩余油的作用
Fig. 6 Effects of emulsifier producing microbial on residual oil
2.3.3 产乳化剂功能菌扩大水驱波及体积
随着菌液注入,模型主流通道附近出现较多O/W型的乳状液[20-21],由于模型孔喉半径差异大,分散液珠经过细小喉道时必须消耗能量改变形状,剩余油转向流至其他喉道,进而扩大发酵液和水驱的波及范围。反复实验均观察到发酵液进入一次水驱完全未波及的模型边缘,并在边缘部分观察到与主流通道一致的原油乳化、剥离现象(图8)。这一现象验证了该菌产生的乳化剂使油水乳液黏度显著增大的特征,因而改善了油水流度比和整体波及效率。
2.3.4 产乳化剂功能菌生命活动对剩余油的作用
多次重复实验表明,微生物在模型内培养需要3~5 d的适应期,剩余油变化一般出现在菌体和激活剂注入后第5天,14 d后孔道内剩余油一般不再有显著变化,因而静置实验观察时间均定为14 d。根据模型静置培养期间观察(图9,没有外加水驱动力),在微生物活动和代谢产物的作用下,剩余油的内聚力降低,较细喉道内的原油被割裂并乳化[20],膜状和簇状剩余油表面产生较多乳化油滴;同时,因固体表面润湿性的改变,膜状剩余油发生不同程度的收缩现象,盲端内的原油也被剥离。体现了微生物生命活动的特点:自发生长、作用效果随时间积累。

图7 孔道润湿性改变
Fig. 7 Changes of wettability in pores
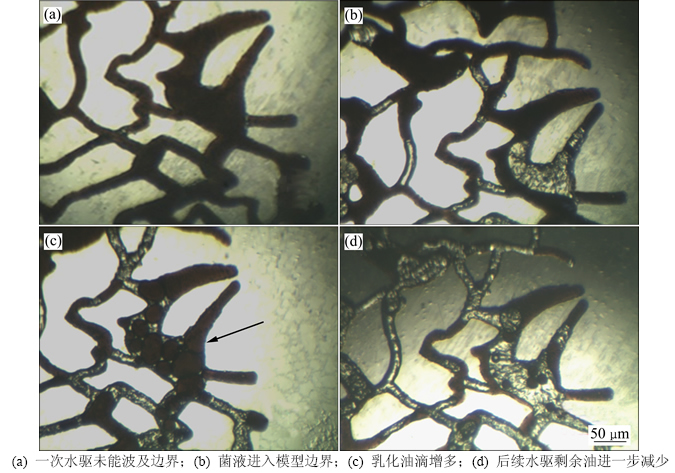
图8 水驱未波及的孔道(模型右上边界)内原油采出情况
Fig. 8 Oil recovery in unswept pores (upper right border of models)
从不同类型剩余油的驱替情况来看(表3),模型内培养组对盲端剩余油的采收率显著高于发酵液直接驱替组(提高21%)。从动态图像来看,发酵液直接驱替的作用机理类似于化学剂作用,仅对长径比为1:2~ 1:0.8范围内的圆形、梯形盲端剩余油有明显驱替效果;而菌体经激活培养数日之后,则能够对长径比3:1以上的深层、甚至口袋型(内腔大而出口窄)盲端有显著的驱替效果(图10)。该现象体现了微生物生命活动的第2个突出特点:对难波及剩余油的活化作用,即微生物在培养期间依靠特有的界面趋向性[22]和原油降解作用,令菌体细胞主动沿界面向深部运移,使得代谢产物在盲端深部油/水/固体界面形成局部高浓度,依靠原油分散和壁面润湿性改变将深部剩余油逐步瓦解、排挤到水流通道中,这是各类化学剂所不具备的盲端深部剩余油驱替能力。
表3 不同注入方式下不同形状剩余油变化
Table 3 Changes of different forms of residual oil under different flooding ways %
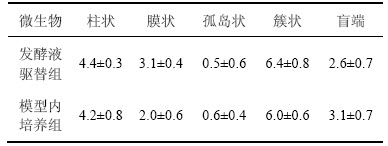
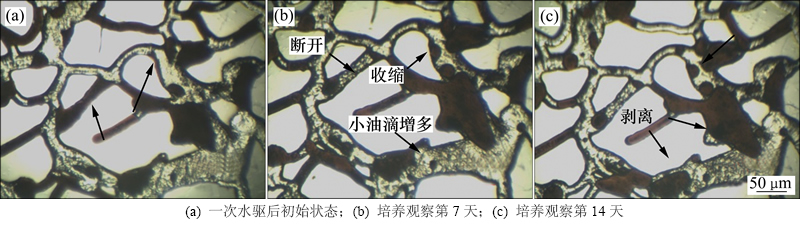
图9 培养期间剥离盲端油及原油断裂过程
Fig. 9 Residual oil in blind end and break process during cultivation in model
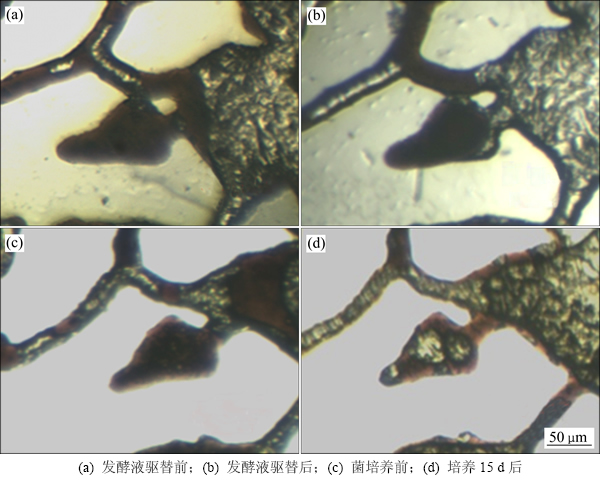
图10 2种驱油方式下难动用盲端的剩余油变化对比
Fig. 10 Comparison of residual oil in deep blind end by two flooding ways
3 结论
1) 嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus SL-1),作为油藏内源菌群中乳化功能优势菌种的代表,对微观模型中膜状、柱状、簇状以及盲端剩余油的驱替可达38%~54%,各类剩余油的采收率总体提高11.2%~13.5%。
2) 模型内激活的微生物依靠特有生命活动(界面趋向性及原位代谢等),较发酵液直接驱替组多驱出21%的盲端剩余油,并且采出了一般化学驱技术无法波及的深层盲端剩余油。
3) 作为油藏菌群的主要功能菌之一,产乳化剂菌对采收率的贡献主要体现在乳化分散、改变流度比(增大油水乳液黏度)和改变孔隙表面润湿性,因此具备同时提高洗油效率和波及体积的能力。而油藏菌群涵盖的产生物气降黏和产生物表面活剂降低界面张力则并非该单一菌种的主要机理。
参考文献:
[1] 曹功泽, 巴燕, 刘涛, 等. 沾3区块内源微生物驱油现场试验[J]. 特种油气藏, 2014, 21(1): 145-147.
CAO Gongze, BA Yan, LIU Tao, et al. Field pilot test of indigenous microbial flooding in Block Zhan-3[J]. Special Oil and Gas Reserviors, 2014, 21(1): 145-147.
[2] 计秉玉. 国内外油田提高采收率技术进展与展望[J]. 石油与天然气地质, 2012, 33(1): 111-117.
JI Bingyu. Progress and prospects of enhanced oil recovery technologies at home and abroad[J]. Oil And Gas Geology, 2012, 33(1): 111-117.
[3] 夏文杰, 董汉平, 俞理. 嗜热耐盐烃降解菌Geobacillus sp.WJ-2降解原油性能研究[J]. 中南大学学报(自然科学版), 2012, 43(1): 8-16.
XIA Wenjie, DONG Hanping, YU Li. Oil-degrading characterization of thermophilic and halotolerant strain Geobacillus sp. WJ-2[J]. Journal of Central South University (Science and Technology), 2012, 43(1): 8-16.
[4] GUDINA E J, PEREIRA J, COSTA R, et al. Biosurfactant- producing and oil-degrading Bacillussubtilis strains enhance oil recovery in laboratory sand-pack columns[J]. Journal of Hazardous Materials, 2013, 261(15): 106-113.
[5] 伍晓林, 陈坚, 伦世仪. 生物表面活性剂在提高原油采收率方面的应用[J]. 生物学杂志, 2000, 17(6): 25-28.
WU Xiaolin, CHEN Jian, LUN Shiyi. Application of biosurfactants to enhanced oil recovery[J]. Journal of Biology, 2000, 17(6): 25-28.
[6] 伍晓林, 石梅, 侯兆伟, 等. 以烃为碳源的微生物驱油微观机理探索研究[J]. 大庆石油地质与开发, 2003, 22(4): 56-60.
WU Xiaolin, SHI Mei, HOU Zhaowei, et al. Exploration and research of carbon source microbial flooding mechanism[J]. Petroleum Geology and Oilfield Development in Daqing, 2003, 22(4): 56-60.
[7] 马继业, 郭省学, 雷光伦, 等. 高温高压条件下微生物驱油微观机理研究[J]. 油田化学, 2001, 25(4): 369-373.
MA Jiye, GUO Shengxue, LEI Guanglun, et al. The microscopic mechanism of microbial flooding under high temperature and pressure conditions[J]. Oilfield Chemistry, 2001, 25(4): 369-373.
[8] 冯庆贤, 邰庐山, 腾克孟, 等. 应用微观透明模型研究微生物驱油机理[J]. 油田化学, 2001, 18(3): 260-263.
FENG Qingxian, TAI Lushan, TENG Kepeng, et al. The mechanism of microbial enhanced oil recovery by microscopic transparent model[J]. Oilfield Chemistry, 2001, 18(3): 260-263.
[9] 雷光伦, 马继业, 汪卫东, 等. 微生物提高采收率微观机制[J]. 中国石油大学学报(自然科学版), 2009, 33(3): 108-113.
LEI Guanglun, MA Jiye, WANG Weidong, et al. Micromechanism of microbial enhanced oil recovery[J]. Journal of China University of Petroleum (Edition of Natural Science), 2009, 33(3): 108-113.
[10] 朱维耀, 夏小雪, 郭省学, 等. 高温高压条件下油藏内源微生物微观驱油机理[J]. 石油学报, 2014, 35(3): 528-535.
ZHU Weiyao, XIA Xiaoxue, GUO Shengxue, et al. Indigenous microorganisms microscopic oil displacement mechanism under high temperature and high pressure conditions[J]. Acta Petrolei Sinica, 2014, 35(3): 528-535.
[11] 夏小雪, 朱维耀, 李娟, 等. 油藏内源微生物生长代谢及驱油特性研究[J]. 石油天然气学报, 2014, 36(1): 122-126.
XIA Xiaoxue, ZHU Weiyao, LI Juan, et al. Research of indigenous microorganisms metabolism and microscopic oil displacement[J]. Journal of Oil and Gas Technology, 2014, 36(1): 122-126.
[12] 宋智勇, 郭辽原, 高光军, 等. 内源微生物驱油物模实验及其群落演变研究[J]. 石油钻采工艺, 2010, 32(1): 89-93.
SONG Zhiyong, GUO Liaoyuan, GAO Guangjun, et al. Succession of microbial community in physical simulation of indigenous microorganism flooding[J]. Oil Drilling and Production Technology, 2010, 32(1): 89-93.
[13] 李娟. 油藏环境本源微生物与石油烃作用机理及群落结构变化分析[D]. 北京: 北京科技大学土木与环境工程学院, 2012: 12-40.
LI Juan. Study on indigenous microbe action mechanism of petroleum hydrocarbon in the reservoir conditions and analysis of community structure[D]. Beijing: Universities of Science and Technology Beijing. School of Civil and Environmental Engineering, 2012: 12-40.
[14] 宋智勇, 郝滨, 赵凤敏, 等. 胜利油田水驱油藏内源微生物群落结构及分布规律[J]. 西安石油大学学报(自然科学版), 2013, 28(4): 44-49.
SONG Zhiyong, HAO Bing, ZHAO Fengmin, et al. Study on the elastic production mechanism in fraetured-vuggy carbonate reservoir of single fracture and single cave with bottom water[J]. Journal of Xi’an Shiyou University(Natural Science Edition), 2013, 28(4): 44-49.
[15] 李彩风, 吴晓玲, 刘涛, 等. 高温产生物乳化剂菌株SL-1的性能评价及物模驱油研究[J]. 安徽大学学报(自然科学版), 2014, 38(1): 90-95.
LI Caifeng, WU Xiaoling, LIU Tao, et al. Study on the property evaluation and physical simulation oil displacement of a thermophilic bioemulsifier-producing bacteria SL-1[J]. Journal of Anhui University (Natural Science Edition), 2014, 38(1): 90-95.
[16] BENKA M O, EKUNDAYO J A. Applicability of evaluating the ability of microbes isolated from an oil spill site to degrade oil[J]. Environmental Monitoring and Assessment, 1997, 45(3): 259-272.
[17] 吴维高, 吕迪. 生物表面活性剂驱油性能研究[J]. 油气藏评价与开发, 2012, 2(1): 50-54.
WU Weigao, L Di. Research on biosurfactant in oil exploitation[J]. Reservoir Evaluation and Development, 2012, 2(1): 50-54.
Di. Research on biosurfactant in oil exploitation[J]. Reservoir Evaluation and Development, 2012, 2(1): 50-54.
[18] 冯庆贤, 陈智宇. 耐高温采油微生物的研究与应用[J]. 石油勘探与开发, 2000, 27(3): 50-52.
FENG Qingxian, CHEN Zhiyu. Research and application of Microbial enhanced oil recovery under high-temperature[J]. Petroleum Exploration and Development, 2000, 27(3): 50-52.
[19] 王大威, 刘永健, 杨振宇, 等. 脂肽生物表面活性剂在微生物采油中的应用[J]. 石油学报, 2008, 29(1): 111-115.
WANG Dawei, LIU Yongjian, YANG Zhenyu, er al. Application of surfacting in microbial enhanced oil recovery[J]. Acta Petrolei Sinica, 2008, 29(1): 111-115.
[20] LIU J F, MA L J, MU B Z, et al. The field pilot of microbial enhanced oil recovery in a high temperature petroleum reservoir[J]. Journal of Petroleum Science and Engineering, 2005, 48(3): 265-271.
[21] 包木太, 袁书文, 宋智勇, 等. 不同碳源激活剂对胜利油田中一区油藏内源菌激活效果评价[J]. 化工学报, 2011, 62(3): 786-791.
BAO Mutai, YUAN Shuwen, SONG Zhiyong, et al. Evaluation on effects of different carbon source on activating indigenous bacteria in Zhongyi block of Shengli Oilfield[J]. CIESC Journal, 2011, 62(3): 786-791.
[22] GUANG H Z, LIU M T, MU B Z. Modeling of microorganisms transport in a cylindrical pore[J]. Journal of Industrial Microbiology Biotechnology. 2008, 35(6): 495-500.
(编辑 赵俊)
收稿日期:2015-04-09;修回日期:2015-08-26
基金项目(Foundation item):国家自然科学基金资助项目(11372033);中央高校基本科研业务费专项资金资助项目(FRF-MP-12-006A,FRF-TP-14-037A1) Project(11372033) supported by the National Natural Science Foundation of China; Projects(FRF-MP-12-006A, FRF-TP-14-037A1) supported by the Fundamental Research Funds for the Central Universities)
通信作者:宋智勇,博士,副教授,从事微生物提高采收率领域研究;E-mail: songzhy232@163.com
摘要:以产乳化剂菌株(Geobacillus stearothermophilus SL-1)为对象,利用微观渗流物理模型模拟油藏条件(65 ℃,10 MPa),研究该菌株对剩余油的驱替作用和机理。通过对比其与菌群的综合作用,揭示乳化功能菌对整体驱油效果的贡献;通过对比外源发酵与内源激活2种方式对剩余油驱替效果的差异,揭示生命活动的独特驱油机理。研究结果表明:该微生物及其代谢产物能够有效乳化分散剩余油,促进其剥离与渗流;该产物促使原油分散形成的油水乳液黏度较原油的原始黏度提高2~70倍,有助于改善深部孔隙的油水流度比、增大波及体积;并能够改变孔隙壁面的润湿性,提高膜状剩余油的驱替效果;模型内激活的微生物依靠特有的界面趋向性和原位代谢,比外源发酵方式多采出21%的盲端剩余油,包括化学驱无法波及的深层盲端。依靠上述机理提高微观模型总采收率达11.2%~13.5%。
[1] 曹功泽, 巴燕, 刘涛, 等. 沾3区块内源微生物驱油现场试验[J]. 特种油气藏, 2014, 21(1): 145-147.
[2] 计秉玉. 国内外油田提高采收率技术进展与展望[J]. 石油与天然气地质, 2012, 33(1): 111-117.
[3] 夏文杰, 董汉平, 俞理. 嗜热耐盐烃降解菌Geobacillus sp.WJ-2降解原油性能研究[J]. 中南大学学报(自然科学版), 2012, 43(1): 8-16.
[5] 伍晓林, 陈坚, 伦世仪. 生物表面活性剂在提高原油采收率方面的应用[J]. 生物学杂志, 2000, 17(6): 25-28.
[6] 伍晓林, 石梅, 侯兆伟, 等. 以烃为碳源的微生物驱油微观机理探索研究[J]. 大庆石油地质与开发, 2003, 22(4): 56-60.
[7] 马继业, 郭省学, 雷光伦, 等. 高温高压条件下微生物驱油微观机理研究[J]. 油田化学, 2001, 25(4): 369-373.
[8] 冯庆贤, 邰庐山, 腾克孟, 等. 应用微观透明模型研究微生物驱油机理[J]. 油田化学, 2001, 18(3): 260-263.
[9] 雷光伦, 马继业, 汪卫东, 等. 微生物提高采收率微观机制[J]. 中国石油大学学报(自然科学版), 2009, 33(3): 108-113.
[10] 朱维耀, 夏小雪, 郭省学, 等. 高温高压条件下油藏内源微生物微观驱油机理[J]. 石油学报, 2014, 35(3): 528-535.
[11] 夏小雪, 朱维耀, 李娟, 等. 油藏内源微生物生长代谢及驱油特性研究[J]. 石油天然气学报, 2014, 36(1): 122-126.
[12] 宋智勇, 郭辽原, 高光军, 等. 内源微生物驱油物模实验及其群落演变研究[J]. 石油钻采工艺, 2010, 32(1): 89-93.
[13] 李娟. 油藏环境本源微生物与石油烃作用机理及群落结构变化分析[D]. 北京: 北京科技大学土木与环境工程学院, 2012: 12-40.
[14] 宋智勇, 郝滨, 赵凤敏, 等. 胜利油田水驱油藏内源微生物群落结构及分布规律[J]. 西安石油大学学报(自然科学版), 2013, 28(4): 44-49.
[15] 李彩风, 吴晓玲, 刘涛, 等. 高温产生物乳化剂菌株SL-1的性能评价及物模驱油研究[J]. 安徽大学学报(自然科学版), 2014, 38(1): 90-95.
[17] 吴维高, 吕迪. 生物表面活性剂驱油性能研究[J]. 油气藏评价与开发, 2012, 2(1): 50-54.
[18] 冯庆贤, 陈智宇. 耐高温采油微生物的研究与应用[J]. 石油勘探与开发, 2000, 27(3): 50-52.
[19] 王大威, 刘永健, 杨振宇, 等. 脂肽生物表面活性剂在微生物采油中的应用[J]. 石油学报, 2008, 29(1): 111-115.
[21] 包木太, 袁书文, 宋智勇, 等. 不同碳源激活剂对胜利油田中一区油藏内源菌激活效果评价[J]. 化工学报, 2011, 62(3): 786-791.


