FHA粉末的制备及相结构和热稳定性
周宏明1, 2,曾麟1,易丹青1,郭雁军1,贾晓慧1,刘珊1,何俊杰1
(1. 中南大学 材料科学与工程学院,湖南 长沙,410083;
2. 中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
摘要:采用沉淀-煅烧法制备F掺杂的FHA(Ca10(PO4)6(OH)2-2xF2x,0≤x≤1)粉末。通过X线衍射(XRD)、热重分析(TG)研究反应物浓度、F掺杂量和煅烧温度等制备工艺参数对粉末的物相组成、晶格点阵参数、晶胞体积和密度以及高温热稳定性的影响。研究结果表明:当反应物F-的浓度为0.5 mol/L时,产物为纯FHA;当F-浓度增大至1.0 mol/L时,煅烧后产物中有明显的CaF2相;当热处理温度为70~1 250 ℃时,随温度升高,F0.75HA晶胞体积呈线性增加,密度线性减小;随F含量增加,FHA晶体中a轴点阵参数呈非线性减小;F掺杂能够提高FHA的高温热稳定性,当x≥0.5时,FHA粉末在1 250 ℃时不分解。
关键词:
中图分类号:TQ174 文献标志码:A 文章编号:1672-7207(2011)05-1254-07
Phase structure and thermal stability of prepared FHA powders
ZHOU Hong-ming1, 2, ZENG Lin1, YI Dan-qing1, GUO Yan-jun1, JIA Xiao-hui1, LIU Shan1, HE Jun-jie1
(1. School of Materials Science and Engineering, Central South University, Changsha 410083, China;
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: FHA(Ca10(PO4)6(OH)2-2xF2x, 0<x<1) powders were synthesized by wet precipitation-calcination method. XRD and TG were used to investigate influences of reactant concentration, F doping content and calcination temperature on the phase composition, structure, lattice parameters, unit cell volume, density and thermal stability at high temperature. The results show that CaF2 phase is detected when reactant concentration of F- increases from 0.5 mol/L to 1.0 mol/L, unit cell volume of F0.75HA increases linearly and density decreases linearly with the increase of the heat treatment temperature from 70 ℃ to 1 250 ℃, doping F leads to the nonlinear decrease of a axis lattice parameters, and can improve the phase stability of FHA at high temperature, when x≥0.5, FHA powders doesn’t decompose at 1 250 ℃.
Key words: FHA; doping powders; reactant concentration; lattice parameters; phase stability
羟基磷灰石(Ca10(PO4)6OH)2,简称HA)是人体骨骼、牙齿等硬组织的主要矿物成分,因其在临床应用领域包括人体硬组织修复工程中的重要性,近年来一直是生物材料科学领域的研究热点[1-4]。无论是在自然的HA还是合成的HA中,都存在![]() ,F-和Cl-被HA中羟基离子取代[5-6]。牙齿中含有95%~97%的HA,其中含氟量(质量分数)为0.04%~0.07%[7]。体液中一定的含氟量有助于骨骼和牙齿的正常生长,F-的注入有利于骨质疏松症的治疗[8]。由F-部分取代羟基磷灰石中的OH-形成的氟取代的磷灰石,简称FHA (Ca10(PO4)6(OH)2-2xF2x,0≤x≤1),在骨以及牙齿等植入体中具有广阔的应用前景。在弱酸性环境中(pH=5~7),FHA具有比HA更低的溶解度,有更长的存留时间。合成的HA热稳定性不强,当烧结温度高于900 ℃时会分解成其他相[9]如磷酸钙(Ca3(PO4)2,即TCP)。而FHA的热稳定性比HA的强,氟磷灰石(Ca5(PO4)3F)直到1 400 ℃仍然不分解[10]。研究表明:高F-含量的FHA无细胞毒性[11],因此,FHA有潜力成为优良的人体硬组织替代材料。FHA在骨组织替代材料领域具有广阔的应用前景[12]。目前,已经有多种制备FHA的方法,如固态反应法、沉淀法、溶胶-凝胶法,水热法等等[1, 13-15]。在对FHA的研究方面,Chen等[9]研究了不同F含量的FHA热稳定性以及抗腐蚀能力;Kothapalli等[16]研究了反应物浓度和温度对HA的烧结以及力学性能的影响;Gross等[17-18]研究了FHA的烧结性能、力学性能以及细胞毒性。但是,目前有关反应物浓度、F-含量和煅烧温度对FHA相组成、相结构和热稳定性影响的研究较少。在此,本文作者采用沉淀-煅烧法制备不同氟含量的含氟羟基磷灰石(FHA)生物陶瓷,研究反应物浓度对产物相组成、煅烧温度、F-含量对FHA相结构、晶胞参数和密度的影响,以便为FHA粉末的沉淀-煅烧制备工艺参数的优化提供理论依据。
,F-和Cl-被HA中羟基离子取代[5-6]。牙齿中含有95%~97%的HA,其中含氟量(质量分数)为0.04%~0.07%[7]。体液中一定的含氟量有助于骨骼和牙齿的正常生长,F-的注入有利于骨质疏松症的治疗[8]。由F-部分取代羟基磷灰石中的OH-形成的氟取代的磷灰石,简称FHA (Ca10(PO4)6(OH)2-2xF2x,0≤x≤1),在骨以及牙齿等植入体中具有广阔的应用前景。在弱酸性环境中(pH=5~7),FHA具有比HA更低的溶解度,有更长的存留时间。合成的HA热稳定性不强,当烧结温度高于900 ℃时会分解成其他相[9]如磷酸钙(Ca3(PO4)2,即TCP)。而FHA的热稳定性比HA的强,氟磷灰石(Ca5(PO4)3F)直到1 400 ℃仍然不分解[10]。研究表明:高F-含量的FHA无细胞毒性[11],因此,FHA有潜力成为优良的人体硬组织替代材料。FHA在骨组织替代材料领域具有广阔的应用前景[12]。目前,已经有多种制备FHA的方法,如固态反应法、沉淀法、溶胶-凝胶法,水热法等等[1, 13-15]。在对FHA的研究方面,Chen等[9]研究了不同F含量的FHA热稳定性以及抗腐蚀能力;Kothapalli等[16]研究了反应物浓度和温度对HA的烧结以及力学性能的影响;Gross等[17-18]研究了FHA的烧结性能、力学性能以及细胞毒性。但是,目前有关反应物浓度、F-含量和煅烧温度对FHA相组成、相结构和热稳定性影响的研究较少。在此,本文作者采用沉淀-煅烧法制备不同氟含量的含氟羟基磷灰石(FHA)生物陶瓷,研究反应物浓度对产物相组成、煅烧温度、F-含量对FHA相结构、晶胞参数和密度的影响,以便为FHA粉末的沉淀-煅烧制备工艺参数的优化提供理论依据。
1 实验
1.1 FHA粉末的制备
采用沉淀法[19-20]制备FHA粉末。FHA为Ca10(PO4)6[(OH)1-xFx]2(x取0,0.25,0.50,0.75,1.00时,相应的FHA粉末分别用HA,F0.25HA,F0.5HA,F0.75HA和FA表示),采用的原料为Ca(NO3)2·4H2O,(NH4)2HPO4,NH4F和氨水。方法是:用(NH4)2HPO4和NH4F的混合溶液滴加到Ca(NO3)2·4H2O溶液中,同时剧烈搅拌,混合液的pH保持在10~11之间,得到胶状沉淀。化学反应方程式为:
10Ca(NO3)2·4H2O+6(NH4)2HPO4+(8-8x)NH4OH+8xNH4F→Ca10(PO4)6[(OH)1-xFx]2+20NH4NO3+6xHF+(46-6x)H2O
用去离子水将沉淀反复洗涤至pH呈中性,然后,经过滤、干燥,在不同温度下煅烧得到FHA粉末,对其结构与性能进行分析。
1.2 样品的表征
(1) 采用Dmax-2500VB X线衍射仪(XRD)分析粉末的物相结构。分析条件如下:Cu Kα辐射,工作电压为40 kV,工作电流为250 mA,扫描范围为20°~60°,扫描速度为8 (°)/min。
(2) 采用TREOR程序的最小平方法从XRD图谱中计算FHA晶胞参数,即:a和c轴的长度,晶胞体积和密度。
(3) 采用热分析仪NETZSCH STA 449 C分析粉末的热稳定性;采用氧化铝坩埚和空气气氛,升温速率为10 ℃/min,温度范围为从室温至1 400 ℃。
2 结果和讨论
2.1 反应物浓度对FHA粉末相组成的影响
研究反应物浓度对FHA粉末相组成的影响,x取0.5,记为F0.5HA。将干燥后的F0.5HA粉末于900 ℃煅烧,得到的XRD图如图1所示。
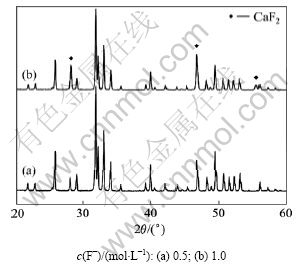
图1 不同反应物浓度制备的F0.5HA的XRD图谱
Fig.1 XRD patterns of F0.5HA prepared at different reactant concentrations
从图1可以看出:当反应物浓度为0.5 mol/L时,粉末产物的衍射峰为纯FHA相;当反应物浓度上升到1.0 mol/L时,其产物在28.14°和46.86°处的XRD峰明显增强,并且在55.70°处有1个明显的非FHA衍射峰,这3个衍射峰分别属于CaF2的(111),(220)和(311)晶面。因此,可以断定反应物浓度上升导致煅烧的产物中产生第二相CaF2。
Eslami等[18, 21-22]在研究对HA进行F掺杂生成FA的过程中,在高F-浓度下,进行多步反应,在转变过程中有CaF2生成。研究表明[16]:在采用沉淀法生成HA的过程中,反应物浓度升高导致沉淀产物中粒子体积增大和数目减小。在本实验中,反应物浓度提高可能导致沉淀在生成过程中颗粒发生团聚,导致部分区域反应没有进行完全,从而生成CaF2。因此,在本实验中,反应溶液F-浓度以不超过0.5 mol/L为宜。以下制备FHA的反应物F-浓度为0.5 mol/L。
2.2 热处理温度对FHA相结构的影响
F0.75HA粉末在不同温度下热处理的XRD图谱如图2所示。
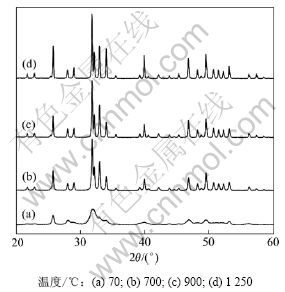
图2 F0.75HA粉末在不同温度下处理的XRD图谱
Fig.2 XRD patterns of F0.75HA powders calcinated at different temperatures
从图2可以看出:当热处理温度在70~1 250 ℃变化时,所得产物皆为单一的磷灰石相,没有TCP相生成;在70 ℃干燥后,得到FHA相,衍射峰明显宽化,结晶度较低;随着热处理温度的升高,衍射峰变得尖锐,结晶程度提高;同时,随着热处理温度的升高,衍射峰整体向小角度平移。
煅烧温度和FHA晶胞体积以及粉末密度的关系如图3和图4所示。从图3可以看出:晶胞体积随着热处理温度的升高呈线性增大,拟合系数R为0.999 6;当温度从70 ℃升高到1 250 ℃时,晶胞体积增加 0.97×10-30 m3。从图4可见:随着温度的升高,粉末密度呈直线减小,R为0.999 6。这是晶胞体积增大导致的必然结果。
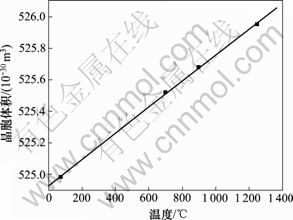
图3 F0.75HA晶胞体积和煅烧温度的变化关系
Fig.3 Relationship between cell volume and calcination temperature of F0.75HA
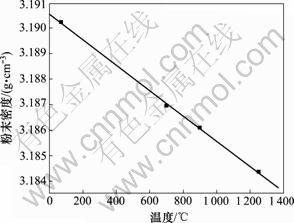
图4 F0.75HA粉末密度和煅烧温度的变化关系
Fig.4 Relationship between powder density and calcination temperature of F0.75HA
以上分析结果表明:热处理温度对FHA晶体的结晶度以及晶胞体积有十分重要的影响;在低温下,FHA没有足够的能量形成完全结晶,当热处理温度上升到700 ℃时,高温下FHA形成了相对取向一致的晶体结构,因此,衍射峰更加尖锐;同时,热处理温度上升必然会导致晶胞体积膨胀,且点阵参数增大导致衍射峰整体向小角度平移。晶胞体积和热处理温度几乎呈线性相关,说明晶胞参数对热处理温度十分敏感。
2.3 F含量对FHA相结构的影响
Ca10(PO4)6[(OH)1-xFx]2在700 ℃处理所得的XRD图如图5所示。从图5可以看出:经过700 ℃热处理后,无论x如何变化,都能够得到单一的FHA相;而且FHA的衍射峰明显比HA的尖锐,说明F的加入提高了FHA的结晶度。

图5 于700 ℃煅烧处理的FHA粉末XRD图谱
Fig.5 XRD patterns of FHA powders calcinated at 700 ℃
FHA中F含量对c轴点阵参数几乎没有影响。F含量对a轴点阵参数的影响如图6所示。
(200)和(300)晶面的衍射峰2θ角的变化反映a轴点阵参数的变化规律,衍射峰向大角度方向平移说明相对应的晶轴点阵参数减小。从图6可以看出:随着F含量的增加,(200)和(300)晶面的衍射峰都向大角度方向平移,说明a轴的点阵参数减小;同时,(200)和(300)晶面都有类似的变化规律,即当x为0~0.25时,加入少量的F就使a轴对应的衍射峰朝着大角度方向有很大的偏移量,a轴的点阵参数有很大的减小量;当x为0.25~0.75时,衍射峰朝着大角度方向只有较小的偏移量,a轴点阵参数减小缓慢;当x为0.75~1.00时,即当F逐渐取代晶格中的OH基团时,衍射峰朝着大角度方向再次出现较大的平移,对应于点阵参数发生较大变化;当x为0~1.00时,a轴点阵参数的长度减小0.048×10-10 m;当x分别为0~0.25,0.25~0.75和0.75~1.00时,a轴点阵参数的长度分别减小 0.019×10-10,0.012×10-10和0.017×10-10 m。
以上分析说明:随着FHA中F含量的增加,FHA的点阵参数减小。然而,F对HA掺杂并没有导致其点阵参数呈线性减小。其变化规律为:当晶体中只存在OH-和F-中的1种基团且OH-和F-中的一种对另外一种进行掺杂时,a轴的点阵参数变化程度较大;而晶体中始终存在OH-和F- 2种基团时,掺杂对a轴点阵参数的影响较小。其原因可能是OH-和F-具有不同的离子吸附能力,F-具有很强的电负性,当F-出现在
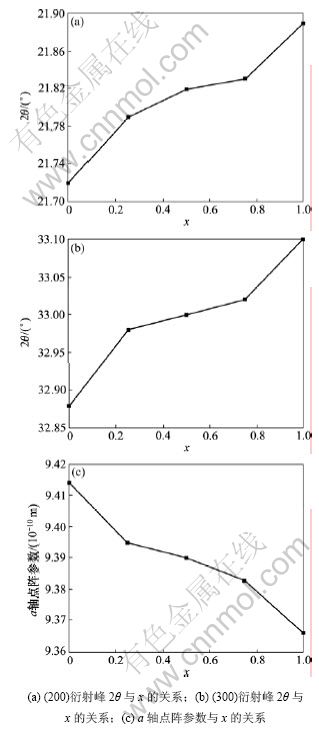
图6 于700 ℃煅烧的FHA中(200), (300)衍射峰2θ以及a轴点阵参数
Fig.6 2θ of (200), (300) diffraction peak and lattice parameters of FHA powders calcinated at 700 ℃
原HA晶体中OH-的位置时,由于F-对晶体中的阳离子有强烈的吸附作用,导致OH-和Ca2+被紧密地束缚在F-周围;随着F含量的进一步增大,由于各种阳离子基团被束缚在F-周围,因此,并没有带来结构上的剧变;直至晶体中的OH-完全被F-取代时,晶胞体积便出现较大的收缩。Eslami等[18]的研究结果同样表明:随着F含量的增加,FHA晶胞中a轴点阵参数呈非线性减小。
FHA中F含量对晶胞体积和密度的影响分别如图7和图8所示。从图7和图8可以看出,F含量增加导致晶胞体积减小和密度增加。这是因为F-与OH-相比,具有更强的电负性和更小的离子半径,因此,F-掺杂HA能够减小其晶胞体积,增加致密度。
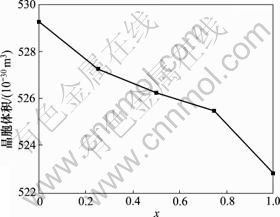
图7 700 ℃煅烧的FHA晶胞体积
Fig.7 Cell volume of FHA calcinated at 700 ℃

图8 700 ℃煅烧的FHA密度
Fig.8 Powder density of FHA calcinated at 700 ℃
结合以上分析可知:FHA中F含量增加导致晶体中a轴点阵参数减小,从而导致晶胞体积减小以及粉末密度增大;当晶体中OH-和F-中的一种被另外一种完全取代时,OH-和F-电负性的差异以及离子半径的不同导致a轴点阵参数、晶胞体积和密度发生较大 变化。
2.4 FHA粉末的高温热稳定性分析
HA在高温下会生成Ca3(PO4)2(TCP相),TCP相在人体体液中溶解速度很快,不利于HA植入人体后的稳定。一般认为[14],HA的分解可以分解成2个 部分:
(1) 在800 ℃,
Ca10(PO4)6(OH)2 →Ca10(PO4)6(OH)2-2xOx+xH2O
(2) 在1 220 ℃,
Ca10(PO4)6(OH)2-2xOx → 3Ca3(PO4)2+CaO+(1-x)H2O
研究结果表明:FHA的热稳定性比HA的强[9, 18]。但是,对于在高温下(1 200~1 400 ℃),F-对HA晶格中OH-的取代率为多大时就能够保持单一的FHA相,还鲜有报道。为此,本实验拟通过1 250 ℃煅烧后的不同F掺杂量的XRD谱,并结合热重分析曲线,分析高温下(1 250 ℃)FHA保持稳定时F含量的取值范围。FHA粉末在1 250 ℃煅烧2 h后的XRD谱如图9所示。
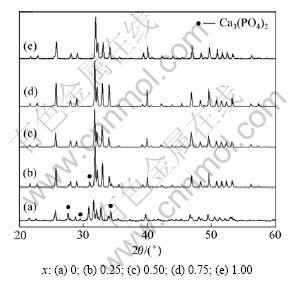
图9 FHA粉末在1 250 ℃处理后的XRD图谱
Fig.9 XRD patterns of FHA powders calcinated at 1 250 ℃
从图9可以得出:当HA晶格中不掺入F-时, 粉末在1 250 ℃处理后直至冷却到室温,HA中有杂相β-TCP相产生 。
当x=0.25时,FHA的衍射峰与HA的衍射峰相 比,β-TCP相衍射峰明显减弱,FHA的衍射峰明显增 强;当x≥0.5时,于1 250 ℃煅烧处理可得到单一的FHA相。
FHA和HA分解的第1步是部分羟基丢失,必然导致其质量减小[9]。从预先经过1 250 ℃煅烧后的F0.75HA的热重曲线见图10。从图10可以看出:从室温到1 400 ℃没有发现明显的质量损失,说明F0.75HA能够在温度不超过1 400 ℃时保持热稳定性,没有TCP相产生。
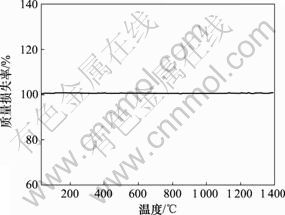
图10 于1 250 ℃煅烧后的F0.75HA粉末在空气气氛下的TG曲线
Fig.10 TG curve of F0.75HA powders calcinated at 1 250 ℃ in air
根据以上实验结果可以得出:F对HA的掺杂提高了其高温热稳定性;当x≥0.5时,FHA经过1 250 ℃煅烧后不分解,F0.75HA在1 400 ℃以下能够保持单一的FHA相;当晶体中的OH-被F-部分取代时,由于F-的电负性比OH-的强,F-与基体中的阳离子(Ca2+)形成更加稳定的化学结合,而且F-比O2-具有和H+更强的亲和力,OH-中H+被束缚在F-周围,形成取向相对一致的磷灰石结构,提高了HA基体的热稳定性;当F-取代HA中50%的OH-时,晶体形成相对稳定的有序结构[9],在1 250 ℃时FHA具有很强的热稳定性。
3 结论
(1) 采用沉淀法制备了FHA粉末,反应物浓度为0.5 mol/L,产物为纯FHA;当反应物浓度增大至 1.0 mol/L时,产物中有第二相CaF2。
(2) 当热处理温度不超过1 250 ℃时,温度升高,FHA的结晶度增大,晶胞体积呈线性减小,密度呈线性增加。
(3) 于700 ℃进行热处理,随着F掺杂量的增加,当晶体中OH-和F-中的一种被另外一种完全取代时,OH-和F-电负性的差异以及离子半径不同导致a轴点阵参数、晶胞体积和密度发生较大变化。
(4) F掺杂制备的FHA的高温相稳定性比HA的强;当x≥0.5时,FHA在1 250 ℃没有TCP相产生,具有很强的热稳定性;当x=0.75时,FHA在1 400 ℃下不分解。
参考文献:
[17] Gross K A, Rodriguez-Lorenzo L M. Sintered hydroxyfluorapatites. Part Ⅰ: Sintering ability of precipitated solid solution powders[J]. Biomaterials, 2004, 25(7/8): 1375-1384.
收稿日期:2010-06-10;修回日期:2010-08-28
基金项目:湖南省国际合作重点项目(2008WK2005);中国博士后基金特别资助项目(200801350);教育部博士点新教师基金资助项目(200805331062);中国博士后基金资助项目(20060400261)
通信作者:易丹青(1953-),男,湖南湘乡人,博士,教授,从事高温结构材料、生物及高温抗氧化涂层研究;电话:0731-88836320;E-mail: yioffice@csu.edu.cn


