流化床燃烧黄磷尾气过程中Ca(OH)2的固磷作用
王磊,王重华,宁平,蒋明,覃扬颂
(昆明理工大学 环境科学与工程学院,云南 昆明,650500)
摘 要:
燃烧黄磷尾气,在燃烧过程中加入氢氧化钙,对黄磷尾气燃烧产生的五氧化二磷进行去除。改变空燃比考察反应温度对去除率的影响,对吸收剂进行XRD,SEM,EDS物相表征和微区元素分析,采用FactSage6.2热力学软件对生成的固体产物进行预测。研究结果表明:流化床预混燃烧黄磷尾气,最高温度1 060 ℃,在空燃比1.7~4.2的范围内炉内温度能稳定在870 ℃以上。吸收剂可同五氧化二磷反应,吸收率随温度升高而增加,1 060 ℃时吸收率为86%,920 ℃时吸收率为50%,870 ℃时吸收率为30%;氢氧化钙同五氧化二磷首先形成碱式磷酸钙,之后变为磷酸钙,在高温下磷酸钙转变为焦磷酸钙。固体产物的预测结果与实验结果一致。
关键词:
中图分类号:X511 文献标志码:A 文章编号:1672-7207(2013)02-0835-08
Phosphorus-fixation by hydrated lime in fluidized bed combustion of yellow phosphorus tail gas
WANG Lei, WANG Zhonghua, NING Ping, JIANG Ming, QIN Yangsong
(Faculty of Environment Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China)
Abstract: Hydrated lime was tested for removing phosphoric pentoxide during the premixed combustion of yellow phosphorus tail gas in fluidized bed. The effect of temperature on the retention of phosphoric pentoxide in hydrated lime was examined by changing air fuel ratio. XRD, SEM and EDS techniques were used to analyze and characterize fresh sorbent and sorbent after reaction. The computer software package FactSage6.2 was used to predict solid product. The results show that the highest temperature of yellow phosphorus tail gas premixed combustion in fluidized bed is 1 060 ℃. Within flow ratio of air to fuel from 1.7 to 4.2, the temperature can be stabilized above 870 ℃. The sorbent can react with phosphoric pentoxide and removal efficiencies increase with the increase of the temperature. Phosphoric pentoxide removal by hydrated lime is 86% at 1 060 ℃, 47% at 920 ℃, and 30% at 870 ℃ in fluidized bed, respectively. The sorbent reacts with phosphoric pentoxide firstly forming basic calcium phosphate, and then changing into calcium phosphate. At high temperature, calcium phosphate changes into calcium pyrophosphate. Solid product predicted results are consistent with the experimental results.
Key words: phosphorus-fixation; premixed combustion; yellow phosphorus tail gas
黄磷是国民经济的基础原材料,在国民经济中具有广泛用途。每生产1 t黄磷,副产黄磷尾气2 500~3 000 m3。尾气中含CO质量分数为87%~92%,总硫质量浓度为0.8~8.0 g/m3,总磷质量浓度为0.5~1.5 g/m3和其他一些杂质,发热值10.5~11 MJ/m3[1-2],具有很高的利用价值。中国是产磷大国,产能占世界总产能的80%。2010年黄磷产量89.9万t,向大气排放约24亿m3的黄磷尾气[3]。目前国内黄磷尾气利用率不足30%,多数企业将其燃烧后直接排放[4],不仅造成了能源浪费,对大气环境也造成了污染。目前综合利用黄磷尾气的主要途径为用作热源、作为一碳化工原料以及利用尾气发电[5-6]。将黄磷尾气用作热源烘干原料,用量有限,燃烧后气体不经处理排放,造成环境污染;用作碳一化学品合成,虽然提高了黄磷尾气的利用价值,但黄磷尾气成分复杂,净化设备投资大;利用尾气发电,在蒸汽锅炉燃烧黄磷尾气过程中,磷和硫会腐蚀炉膛内换热器和换热管壁[7-9],7~90 d之内就能导致穿孔[10],锅炉停用。在此,本文作者采用一种适用于气体燃烧的流化床,预混燃烧黄磷尾气,在燃烧过程中加入氢氧化钙对硫[11]和磷进行吸收,考察氢氧化钙的固磷作用。其目的在于探索一种既不腐蚀设备,又能降低环境污染,同时还能高效利用黄磷尾气热能的方法。
1 现场实验及分析检测
1.1 实验原料
1.1.1 尾气的来源及组成
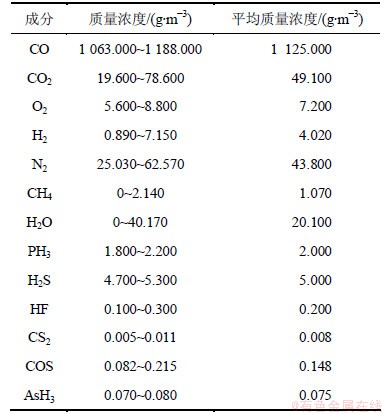
黄磷尾气来源于某黄磷厂。电炉法工艺生产的黄磷炉气,经3次水冷分离磷蒸气后,再经3次水洗所得的尾气。采样口位于净化装置入口前,采用真空泵抽取。黄磷尾气主要组成如表1所示。其中数据来源于该黄磷厂在线检测值,PH3和H2S为本实验过程中现场检测结果。
表1 黄磷尾气组成成分
Table 1 Components of yellow phosphorus tail gas
1.1.2 吸收剂的制备
选用试剂为分析纯Ca(OH)2 (成都市科龙化工试剂厂)。Ca(OH)2在室温下与水混合,成型干燥后破碎,过筛制成直径为1.0~1.2 mm的颗粒。
1.2 实验装置和过程
1.2.1 自制小型流化床装置
实验在图1所示的小型流化床反应装置中进行。其中供气系统包括一个流量为3.5 m3/h的真空泵反接输入黄磷尾气,一个流量为7.0 m3/h的真空泵反接输入空气。使用流量调节阀、转子流量计、防回火器、U型管压力计进行测量和控制。燃烧系统为自制小型流化床,由预混室、燃气喷嘴、布风板、炉膛(内径56 mm,高度600 mm)组成。其外部用硅酸铝纤维包裹保温,炉内温度的测量由2根S型铂铑热电偶分别连接测温仪完成。热电偶测温范围为0~1 300 ℃,与混合室的距离分别为70 mm和500 mm。燃烧后气体经逆流水冷冷却管和布袋除尘器处理后排放。
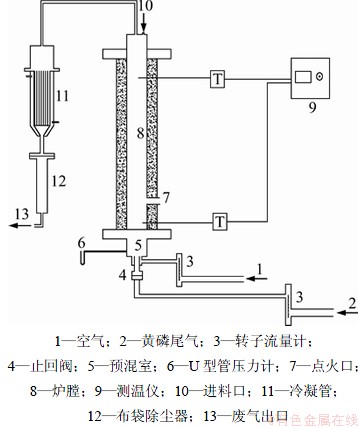
图1 流化床实验装置示意图
Fig.1 Schematic diagram of experimental setup
1.2.2 反应过程及其控制
首先在炉膛内加入100 g吸收剂,然后通入空气和黄磷尾气。二者先在预混室内混合,混合气通过布风板后,在炉膛内引燃,同吸收剂反应。整个实验过程中通过U型管压力计测出床层压降在1~2 kPa范围内。使用流量调节阀将黄磷尾气流量控制在1 m3/h左右,通过改变空气流量获得不同的空燃比(即空气流量与黄磷尾气流量之比)。在不同的空燃比下,测定燃烧温度;温度稳定5 min后记录其数值。反应完成后,关闭空气和燃气气泵,待吸收剂在炉膛内自然冷却后取出。
1.2.3 反应前后气体检测
在实验装置前,用气体检测管测量所输入的黄磷尾气中PH3和H2S的含量。每次实验前后,分别测量进气一次。所用PH3检测管量程为0.1~1.5和0.2~2.5 g/m3;H2S检测管量程为0.2~5.0和2.0~10.0 g/m3。由于PH3燃烧后产生的P2O5,300 ℃以下变为固体颗粒,极易溶于水。对气体出口磷的检测不能反应吸收剂真实的去除率。本研究中,通过测定反应后固体吸收剂中的磷含量,考察Ca(OH)2的固磷效果。
1.3 吸收剂分析检测
(1) 吸收剂中磷含量的测定采用磷钼蓝分光光度法(GB 4701.7—85),测定过程中考虑Ca离子的影响使用盐酸代替硫酸调节酸度。
(2) 吸收剂物相结构分析使用日本理学TTRIII型X线转靶衍射仪(XRD),测试靶Cu靶,管电压40 kV,管电流200 mA,扫描速率10 (°)/min,扫描范围5°~90°;日本理学D/Max-3B型X线衍射仪(XRD),测试靶Co靶,管电压20 kV,管电流20 mA,扫描速率10 (°)/min,扫描范围13°~110°。
(3) 吸收剂表面形貌分析使用飞利浦XL30ESEM-TMP型环境扫描电镜(ESEM),测试电压20 kV,微区元素分析使用伊达克斯Phoenix-OIM型X线能谱仪(EDS)。
1.4 去除效率计算
磷的去除率是以100 g吸收剂中所含磷的总质量与燃烧过程中黄磷尾气带入的磷的总质量相除得到。由于输入黄磷尾气中PH3质量浓度基本稳定在2 g/m3左右, 流量控制在1 m3/h, 尾气带入的磷的总质量取决于燃烧时间(即:输入尾气时间)。吸收剂中含磷的总质量由同一样品2次测定的平均值计算得出。吸收剂及黄磷尾气中磷含量均以P2O5的计量表示。
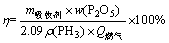 (1)
(1)
式中:η为磷去除效率;ρ(PH3)为PH3进口质量浓度;m吸收剂为吸收剂的质量;w(P2O5)为吸收剂中得磷含量,%;Q燃气为输入尾气的总量;2.09为PH3与P2O5的转换系数。
2 热力学计算
为了提高实验的针对性及验证实验结果的可靠性,在实验进行的同时采用FactSage6.2[12-13]热力学计算软件的反应模块“Reaction”,多元多相平衡模块“Equilib”, 纯物质数据库Fact53,进行了下列计算和预测:
(1) 不同空燃比下黄磷尾气的绝热燃烧温度;
(2) 在温度分别为920和1 060 ℃,压力为101.3 kPa条件下,依据吉布斯自由能最小化原理,对反应后吸收剂中的固体产物进行预测。
3 结果与讨论
3.1 空燃比对燃烧温度的影响
据1.2.2所述方法,流化床中预混燃烧黄磷尾气,不同空燃比下实测温度如图2所示。
为使实测结果与热力学计算结果之间存在可比性,热力学计算的数据输入主要考虑2个因素:
(1) 由表1可知:CO和CO2在黄磷尾气中占绝大部分,且总体积在温度为25 ℃,压力为101.3 kPa时约为1 m3, 因此,黄磷尾气简化为CO和CO2 2个组分,CO输入质量为1 125 g, CO2输入质量为49 g;
(2) 在上述温度和压力下,1 m3空气含O2 248 g和N2 932 g。以此为基准,改变空气输入量使空燃比由1.5增大至4.5,使用反应模块“Reaction” 对黄磷尾气绝热燃烧温度(△H=0)进行了计算,结果如图3所示。
从图2和图3可以看出:空燃比对燃烧温度有很大的影响,温度随空燃比的变化趋势基本一致,当空燃比为2.5左右时燃烧温度都存在一个最高点。温度最高点附近燃气和空气完全反应;其左侧空气量不足,燃气的燃烧反应不完全,燃烧温度随空气量的增加而增加;其右侧空气过量,虽然燃气燃烧充分,但部分热量用于加热过量空气,燃烧温度随空气加入量的增加而降低。由于绝热计算没有考虑热量损失,实测燃烧温度必然低于理论计算的绝热燃烧温度。
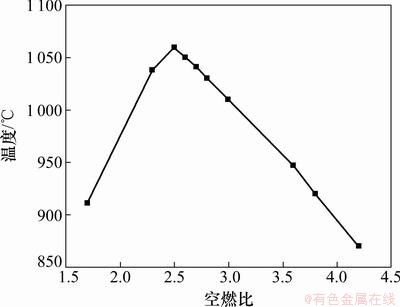
图2 不同空燃比时燃烧温度曲线
Fig.2 Premixed combustion temperature curve at different flow ratios of air to flue
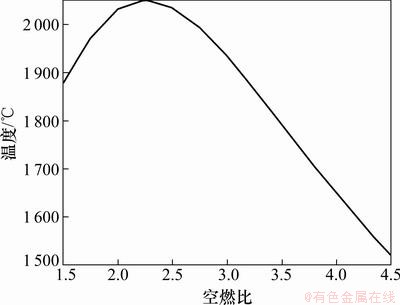
图3 不同空燃比时绝热燃烧温度曲线
Fig.3 Adiabatic combustion temperature curve at different flow ratios of air to flue
通过对出口气体的检测,只在空燃比为1.7和2.3时检测出H2S和PH3,也证实了上述推论。因此,固磷实验选择空燃比为2.5,3.8及4.2条件下进行。
3.2 燃气中磷的去除率
经燃烧反应后的吸收剂,按前面所述分析方法,测得吸收剂中的磷含量,并按式(1)计算出磷的去除率,所得结果见表2。
从表2可以看出:吸收剂对黄磷尾气燃烧后气体中的磷具有去除作用,在反应温度920 ℃时,吸收剂中的磷含量随反应时间的延长而升高,但随反应时间的延长尾气带入的总磷增加,去除效率不与时间成比列,当反应时间相同时(吸收剂B与F,和吸收剂D与E)反应温度高有利于磷的去除,本实验中所得的最佳去除条件是空燃比为2.5,反应温度1 060 ℃,反应时间60 min,反应去除率可达86.1%。
3.3 Ca(OH)2吸收磷反应产物物相分析
吸收剂在空燃比为3.8时,不同反应时间吸收剂的XRD谱图如图4所示,局部放大图如图5所示。
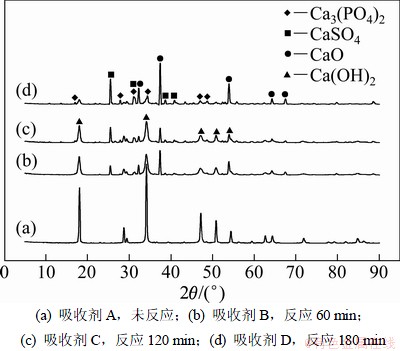
图4 空燃比为3.8时不同反应时间吸收剂的XRD谱
Fig.4 XRD patterns of fresh sorbent and different reaction time sorbent at flow ratio of air to flue of 3.8
表2 不同温度下吸收剂对P2O5的去除率
Table 2 Sorbent removal rate of P2O5 at different temperatures
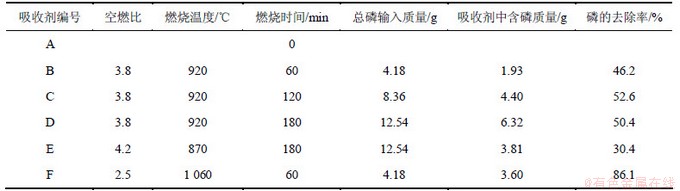

图5 空燃比为3.8时不同反应时间吸收剂的XRD局部放大图
Fig.5 Local microscope XRD patterns of different reaction time sorbent at flow ratio of air to flue of 3.8
从图4和图5可以看出:反应开始后,吸收剂颗粒部分分解为CaO,同燃烧后尾气中的磷发生反应,反应进行60 min后发现磷酸钙(Ca3(PO4)2,PDF:09-0169)。随反应的进行Ca3(PO4)2的三强峰接近等量增加,这与化学分析结果一致。从图4和图5还可见:Ca(OH)2特征峰在反应进行60 min和120 min后都较为明显,180 min后才变的微弱。Ca(OH)2颗粒随反应的进行,不断地分解为CaO,释放出H2O,形成新的孔道和表面;这可能导致了吸收剂对磷的去除率随反应时间没有明显的下降。
图6和图7所示分别为不同空燃比和不同反应时间条件下吸收剂的XRD谱及局部放大图。由表2可见:3种反应后的吸收剂磷含量接近。空燃比为4.2和3.8时反应生成Ca3(PO4)2,但对比图5(b)和图7(a)发现:吸收剂C中Ca3(PO4)2特征峰强度比吸收剂E的高,说明低温并不利于Ca3(PO4)2晶相的生成。在空燃比为2.5的XRD谱中除发现Ca3(PO4)2外,还发现了新生成物碱式磷酸钙(Ca5(PO4)3(OH),PDF:84-1998),同时CaSO4特征峰变的不明显。根据Ander等的研究发现[14]:氧含量很低时会导致CaSO4的分解,结合前面的分析可以断定空燃比为2.5时空气和燃气基本完全反应。
3.4 吸收剂表面形貌分布及微区元素分析
图8所示是当反应时间为60 min,空燃比分别为3.8和2.5时的SEM背散射电子像。图8中1,2和3点EDS微区元素分析如表3所示。
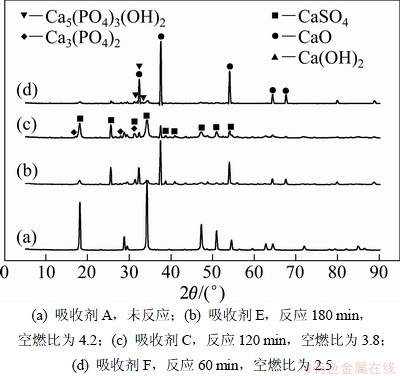
图6 不同空燃比条件下吸收剂的XRD谱
Fig.6 XRD patterns of fresh sorbent and sorbent after reaction in different flow ratios of air to flue
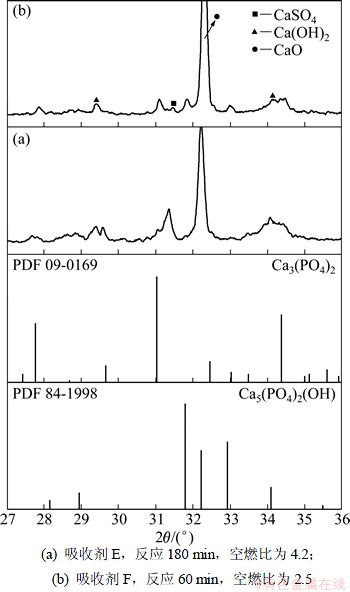
图7 不同空燃比条件下吸收剂的XRD局部放大图
Fig.7 Local microscope XRD patterns of sorbent after reaction in different flow ratios of air to flue

图8 空燃比为3.8 (920 ℃)反应60 min吸收剂和空燃比为2.5(1 060 ℃)反应60 min吸收剂背散射电子像
Fig.8 Back-scattering electron images of reaction 60 min sorbent at flow ratio of air to flue of 3.8 (920 ℃) and reaction 60 min sorbent at flow ratio of air to flue of 2.5 (1 060 ℃)
表3 吸收剂表面EDS元素分析(质量分数)
Table 3 EDS elemental analysis of sorbent surface %
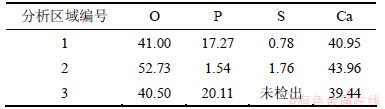
由图8可见:温度对吸收剂形貌有重要影响, 920 ℃时,晶化速率慢,结晶颗粒大(见图8(a)和(b));1 060 ℃时,晶化速率快,结晶颗粒小(见图8(c)和(d))。另外从图8(d)可以发现:在晶粒表面有细微的缝隙产生。从表3可以看出:分析区1,2和3中结晶颗粒表面和非结晶表面Ca含量基本相同,但结晶颗粒表面1和3中磷含量分别达到了17.27%和20.11%,非结晶表面2中只有1.54%,说明结晶颗粒表面更易富集磷,温度升高加快晶化速度,故温度升高有利于磷的去除。
3.5 热力学计算
为验证固相产物与热力学预测产物之间的一致性,热力学计算的数据输入主要考虑以下因素:
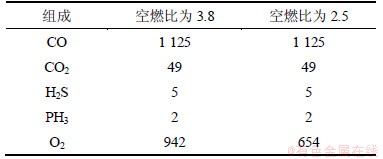
(1) 依据前面的实验及分析结果,黄磷尾气简化为CO,CO2,PH3和H2S 4个组分,黄磷尾气燃烧量为1 m3(即反应60 min),空燃比为2.5时按照各物质同氧完全反应的需氧量计算O2加入量;空燃比为3.8时,根据空燃比计算得出O2加入量。各物质加入量如表4所示。
表4 计算输入气体成分及输入质量
Table 4 Calculation of components and input values g
(2) 由于热力学计算时假设物质均匀混合,并且在温度920 ℃,和1 060 ℃时CaO同P2O5反应的吉布斯自由能低于CaO同SO2反应的吉布斯自由能;实际情况下反应主要发生在吸收剂颗粒表面。Ca(OH)2的加入量不能按实际加入量计算。Ca(OH)2的加入量根据前面的分析结果。按照式(2)~(5) 进行计算。
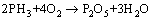 (2)
(2)
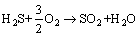 (3)
(3)
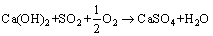 (4)
(4)
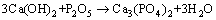 (5)
(5)
空燃比为3.8时,硫和磷同吸收剂反应生成CaSO4,Ca3(PO4)2和Ca(OH)2加入量为15.9 g;空燃比为2.5时CaSO4发生分解,磷同吸收剂反应生成物只考虑Ca3(PO4)2,Ca(OH)2加入量为5.02 g。
(3) 在压力101.3 kPa条件下,依据表2和表4,温度920 ℃时气体加入总量2 123 g(计算范围0~2 123 g,步长43),Ca(OH)2加入量15.9 g。温度1 060 ℃时气体加入总量1 835 g(计算范围0~1 835 g,步长37),Ca(OH)2加入量5.02 g。通过改变气体加入量对反应产物进行预测,结果如图9所示。
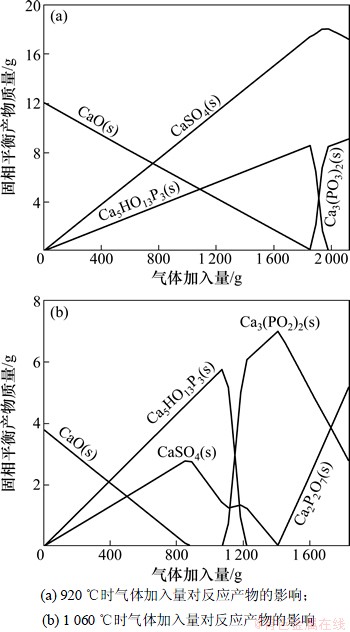
图9 不同燃烧温度热力学平衡计算图
Fig.9 Thermodynamic equilibrium calculations in different combustion temperature
从图9可以看出:不同温度下,吸收剂首先分解为CaO,同P2O5反应生成Ca5(PO4)3(OH),随着混合气加入量的增大,CaO逐渐消耗殆尽,当CaO完全反应完之后,P2O5会继续同Ca5(PO4)3(OH)反应生成Ca3(PO4)2,如下式所示。
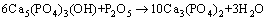 (6)
(6)
当燃气和空气完全反应时,P2O5同吸收剂反应生成物形态没有受到影响;而CaSO4却变得不稳定,易于分解。实际情况下,吸收剂尚未完全反应,但生成产物主要为Ca3(PO4)2。结合前面的分析可知:磷易富集于Ca5(PO4)3(OH)的晶粒表面,920 ℃时,晶化速率慢,晶粒表面CaO并不充足,Ca5(PO4)3(OH)会迅速转变为Ca3(PO4)2;1 060 ℃时,晶化速率快,吸收剂表面生成大量的晶体颗粒,磷在吸收剂表面的反应变的均匀,延长了Ca5(PO4)3(OH)存在时间;晶粒表面缝隙,有2个因素导致,一为H2O从晶粒中释出,二为CaSO4分解。1 060 ℃的热力学计算中发现新相Ca2P2O7,但在XRD图谱中未找到相应的特征峰。
为证明存在焦磷酸钙(Ca2P2O7),采用Co靶(Co靶波长长,背景低,晶体特征峰分离效果好)对空燃比为2.5,反应60 min颗粒样品进行XRD分析,测试结果如图10所示。
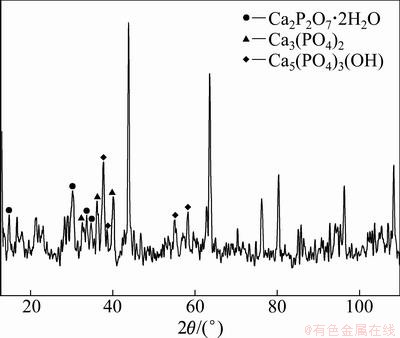
图10 1 060 ℃时反应60 min颗粒样品XRD谱
Fig.10 XRD pattern of particle sorbent after reaction at 1 060 ℃ for 60 min
从图10可以发现:反应后吸收剂颗粒表面有Ca2P2O7·2H2O(PDF:41-0448)生成;分子中的结晶水可能是样品在冷却过程中与炉内反应生成的水分子结合而成。由此证明1 060 ℃时Ca3(PO4)2还会转变为Ca2P2O7,实验结果同热力学计算相一致。
4 结论
(1) 采用流化床预混燃烧黄磷尾气,空燃比2.5时达到最高温度1 060 ℃,在空燃比1.7~4.2的范围内温度能稳定在870 ℃以上,达到了现有燃煤流化床的燃烧温度。
(2) P2O5与氢氧化钙吸收剂在870~1 060 ℃范围内均能反应,在反应过程中Ca(OH)2不断分解产生新的孔道和表面,在180 min的反应时间内吸收剂颗粒的磷去除率没有明显下降;吸收剂表面产生的结晶颗粒更易富集P2O5,温度升高有利于反应的进行。
(3) P2O5与氢氧化钙吸收剂反应先形成碱式磷酸钙,后续的P2O5富集于碱式磷酸钙晶粒表面转变为磷酸钙。在温度为1 060 ℃时,磷酸钙继续转变为焦磷酸钙。
参考文献:
[1] 陈善继. 黄磷尾气综合利用[J]. 磷肥与复合肥, 2008, 23(1): 45-48.
CHEN Shanji. Comprehensive utilization of tail gas from phosphorus furnace[J]. Phosphate and Compound Fertilizer, 2008, 23(1): 45-48.
[2] WANG Zhonghua, JIANG Ming, NING Ping, et al. Thermodynamic modeling and gaseous pollution prediction of yellow phosphorus production[J]. Ind Eng Chem Res, 2011, 50: 12194-12202.
[3] 2010—2011年中国磷矿及磷化工行业研究报告[R]. 北京: 水清木华研究中心, 2011: 7-8.
2010—2011 China phosphorite and phosphorous chemical industry report[R]. Beijing: PDAY Research, 2011: 7-8.
[4] 晏明朗. 创新和循环经济是磷化工发展必由之路. I: 黄磷尾气的综合利用与粉状磷矿的烧结技术[J]. 磷肥与复合肥, 2007, 22(3): 21-25.
YAN Minglang. Way of innovation and recycling economy for development of phosphorus chemical industry. I: Reclaiming,purification,and utilization of tail gas of yellow phosphorus[J]. Inorganic Chemicals Industry, 2007, 22(3): 21-25.
[5] 左建国. 关于黄磷尾气的利用[J]. 磷酸盐工业, 2007(2): 9-12.
ZUO Jiangguo. On the utilization of yellow phosphorus tail gas[J]. Phosphate Industry, 2007(2): 9-12.
[6] 彭元洪, 万源, 刘新坤, 等. 黄磷尾气蒸汽锅炉新技术[J]. 无机盐工业, 2010, 42(8): 39-40.
PEN Yuanhong, WAN Yuan, LIU Xinkun, et al. New steam boiler technology for utilization of yellow phosphorous tail gas[J]. Inorganic Chemicals Industry, 2010, 42(8): 39-40.
[7] 韩明杰, 刘金敬. 燃气锅炉尾部受热面低温腐蚀的原因及预防措施[J]. 冶金动力, 2007(4): 51-54.
HAN Mingjie, LIU Jinjing. Causes of low-temperature corrosion of gas-fired boiler end and preventive measure[J]. Metallurgical Power, 2007(4): 51-54.
[8] 晏明朗. 磷化工发展必走创新和循环经济之路. I: 黄磷尾气回收净化利用[J]. 无机盐工业, 2009, 41(10): 2-6.
YAN Minglang. Way of innovation and recycling economy for development of phosphorus chemical industry. I: Reclaiming, purification, and utilization of tail gas of yellow phosphorus[J]. Inorganic Chemicals Industry, 2009, 41(10): 2-6.
[9] 何浩明. 对中国磷化工业发展的思考[C]//中国国际磷化工(兴发)发展高峰论坛暨中国磷化工行业年度工作会议论文集. 北京: 化学工业出版社, 2007: 19-21.
HE Haoming. China’s phosphate industry development[C]// China International Phosphorus Chemical (Xingfa) Development Summit Forum and China’s Phosphorus Chemical Industry Annual Conference. Beijing: Chemical Industry Press, 2007: 19-21.
[10] 孙志力. 以磷炉尾气为燃料的蒸汽锅炉腐蚀原因分析[J]. 硫磷设计与粉体工程, 2011(3): 33-36.
SUN Zhili. Root cause analysis for corrosion of steam boiler fueled by off-gas from phosphorus furnace[J]. Sulphur Phosphorus and Bulk Materials Handling Related Engineering, 2011(3): 33-36.
[11] Anthony E J, Granatstein D L. Sulfation phenomena in fluidized bed combustion systems[J]. Progress in Energy and Combustion Science, 2001, 27: 215-236.
[12] Bale C W, Chartrand P, Degterov S A, et al. Factsage thermochemical software and database[J]. Calphad, 2002, 26(2): 189-228.
[13] Bale C W, Chartrand P, Degterov S A, et al. FactSage thermochemical software and databases-recent developments[J]. Calphad, 2009, 33(2): 295-311.
[14] Lyngfelt A, Langer V, Steenari B M, et al. Calcium sulphide formation in fluidized bed boilers[J]. The Canadian Journal of Chemical Engineering, 1995, 73(2): 228-233.
(编辑 杨幼平)
收稿日期:2012-02-11;修回日期:2012-06-12
基金项目:国家高技术研究发展计划(“863”计划)项目(2008AA062602);云南省自然科学基金资助项目(14051184);昆明理工大学分析测试基金资助项目(2009-061,2009-050,2010136)
通信作者:王重华(1957-),女,云南昆明人,博士后,从事大气污染研究;电话:15877925068;E-mail:zhonghuakm@googlemail.com
摘要:通过流化床预混燃烧黄磷尾气,在燃烧过程中加入氢氧化钙,对黄磷尾气燃烧产生的五氧化二磷进行去除。改变空燃比考察反应温度对去除率的影响,对吸收剂进行XRD,SEM,EDS物相表征和微区元素分析,采用FactSage6.2热力学软件对生成的固体产物进行预测。研究结果表明:流化床预混燃烧黄磷尾气,最高温度1 060 ℃,在空燃比1.7~4.2的范围内炉内温度能稳定在870 ℃以上。吸收剂可同五氧化二磷反应,吸收率随温度升高而增加,1 060 ℃时吸收率为86%,920 ℃时吸收率为50%,870 ℃时吸收率为30%;氢氧化钙同五氧化二磷首先形成碱式磷酸钙,之后变为磷酸钙,在高温下磷酸钙转变为焦磷酸钙。固体产物的预测结果与实验结果一致。
[1] 陈善继. 黄磷尾气综合利用[J]. 磷肥与复合肥, 2008, 23(1): 45-48.
[3] 2010—2011年中国磷矿及磷化工行业研究报告[R]. 北京: 水清木华研究中心, 2011: 7-8.
[4] 晏明朗. 创新和循环经济是磷化工发展必由之路. I: 黄磷尾气的综合利用与粉状磷矿的烧结技术[J]. 磷肥与复合肥, 2007, 22(3): 21-25.
[5] 左建国. 关于黄磷尾气的利用[J]. 磷酸盐工业, 2007(2): 9-12.
[6] 彭元洪, 万源, 刘新坤, 等. 黄磷尾气蒸汽锅炉新技术[J]. 无机盐工业, 2010, 42(8): 39-40.
[7] 韩明杰, 刘金敬. 燃气锅炉尾部受热面低温腐蚀的原因及预防措施[J]. 冶金动力, 2007(4): 51-54.
[8] 晏明朗. 磷化工发展必走创新和循环经济之路. I: 黄磷尾气回收净化利用[J]. 无机盐工业, 2009, 41(10): 2-6.
[9] 何浩明. 对中国磷化工业发展的思考[C]//中国国际磷化工(兴发)发展高峰论坛暨中国磷化工行业年度工作会议论文集. 北京: 化学工业出版社, 2007: 19-21.
[10] 孙志力. 以磷炉尾气为燃料的蒸汽锅炉腐蚀原因分析[J]. 硫磷设计与粉体工程, 2011(3): 33-36.


