DOI: 10.11817/j.issn.1672-7207.2015.05.053
可吸入石英粉尘中的羟自由基在磷酸盐缓冲溶液中的释放规律
王明翠1, 2,董发勤2,王彬3,贺小春2,刘立柱3,孙仕勇3,霍婷婷2
(1. 西南科技大学 生命科学与工程学院,四川 绵阳,621010;
2. 西南科技大学 固体废物处理与资源化教育部重点实验室,四川 绵阳,621010;
3. 西南科技大学 环境与资源学院,四川 绵阳,621010)
摘 要:
石英粉尘中的羟自由基(·OH)在磷酸盐缓冲溶液中的释放规律。采用对苯二甲酸-荧光分光光度法,探讨石英粒度、质量浓度、粉-液作用时间以及粉尘新鲜度对羟自由基释放的影响,并分析石英粉尘在缓冲溶液中释放羟自由基的动力学特征。研究结果表明:石英在缓冲溶液中羟自由基的产生呈剂量-效应和时间-效应关系,且颗粒尺寸效应明显,结晶态二氧化硅比非晶态二氧化硅更易产生羟自由基;新鲜石英比陈旧石英更易产生羟自由基;在较短作用时间内释放羟自由基的累积浓度呈对数增长趋势,羟自由基浓度随石英表面(·O—Si)浓度变化而变化,·OH产生的机制可能与石英表面裸露的基团和缓冲溶液发生的复杂化学反应有密切关系。
关键词:
中图分类号:P575.4 文献标志码:A 文章编号:1672-7207(2015)05-1967-06
Release of hydroxyl radicals from inhalable quartz dust in phosphate buffer solution
WANG Mingcui1, 2, DONG Faqin2, WANG Bin3, HE Xiaochun2, LIU Lizhu3, SUN Shiyong3, HUO Tingting2
(1. School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China;
2. Key Laboratory of Solid Waste Treatment and Resource Recycle of Ministry of Education,
Southwest University of Science and Technology, Mianyang 621010, China;
3. School of Environment and Resource, Southwest University of Science and Technology, Mianyang 621010, China)
Abstract: The release of hydroxyl radicals from inhalable quartz dust in phosphate buffer solution was studied by direct quantitative method. The terephthalic acid-fluorescence spectrophotometry analysis was used to track the effect of the different grain sizes, mass concentration, powder-liquid reaction times and the quartz freshness on the release of hydroxyl radicals. Moreover, the release kinetics of hydroxyl radicals in the system was also performed. The results show that the content of hydroxyl radicals generation has a dose-response and time-response relationship with the dramatic effect of particle sizes. Furthermore, the crystalline silica and fresh quartz dust generate hydroxyl radicals more easily than the amorphous one and aged quartz dust, respectively. Interestingly, the relationship between the time and the cumulative concentration hydroxyl radicals in initial stage is in accordance with logarithmic function, and the content of hydroxyl radicals is related with the levels of (·O—Si) in the surface of quartz. The mechanism for generation of the hydroxyl radicals in those inhalable quartz dust in the complex matrix can result in the complicated chemical reactions occuring in the surface of quartz particles.
Key words: hydroxyl radicals; inhalable particles; quartz; fluorescence spectroscopy; terephthalic acid
羟自由基(·OH)是一种非常活跃、进攻性极强的活性氧自由基,其对生物体危害极大,近年来成为科学工作者的研究热点[1]。许多矿物表面都能通过一定途径产生羟自由基[2],在超细加工过程中,石英通过异裂和均裂,表面出现大量裸露的基团,自由基(·SiO,·Si和·SiO2等)较丰富[3]。新破碎石英表面自由基决定尘粒表面活性,对人体粉尘性疾病的形成和细胞的损害有着重要影响。新鲜石英粉遇水能够产生羟自由基,但人体内没有清除该自由基的特征酶系[4],由此可知吸入石英粉尘会严重影响人体健康。前期研究表明,石英粉尘产生自由基对细胞体系能造成一定影响,据细胞内外活性氧和毒性指标(脂质过氧化产物MDA、超氧化物歧化酶、谷胱甘肽等)认为石英产生自由基导致细胞的氧化损伤[5-7],而对于石英粉尘在无机体系中产生羟自由基的关注较少[8]。因此,在模拟人体介质环境下,研究可吸入石英粉尘在液相中释放羟自由基具有重要意义,这将有别于石英粉尘刺激细胞产生自由基的定性研究,有助于阐明石英粉尘产生羟自由基量与其致细胞氧化损伤程度的关系。另外,由于·OH寿命短,浓度低,反应活性强[9],国内外鲜有关于石英粉尘羟自由基定量的研究,快速、灵敏和实用的羟自由基定量检测方法选择显得十分重要。为此,本文作者利用羟自由基捕获剂——对苯二甲酸,借助荧光分光光度法[10],以直接定量方式对可吸入石英粉尘在pH为中性的磷酸盐缓冲溶液中产生的羟自由基进行探讨,重点研究石英粒度、质量浓度、粉-液作用时间以及粉尘新鲜度等因素对体系中羟自由基浓度的影响,以便为深入探讨不同因素下可吸入石英粉尘羟自由基释放对细胞氧化损伤机制提供理论依据。
1 实验
1.1 主要仪器与试剂
主要仪器为:F-7000荧光分光光度计(日本HITACHI制造);HZS-H水浴振荡器(哈尔滨东联电子技术开发有限公司制造);进口石英比色皿;1/万天平(美国丹佛仪器北京有限公司制造)。
试剂为:对苯二甲酸(TA);2-羟基对苯二甲酸(HOTP);磷酸二氢钾;十二水合磷酸氢二钠;粒径为10.0 ,5.0,2.5和1.0 μm的石英粉(α-石英,纯度为99%以上);纳米二氧化硅粉体。这些试剂均为AR级。此外,还有二次石英亚沸蒸馏水。
溶液配制:对苯二甲酸应用液,浓度为1.0×10-2 mol/L;磷酸盐缓冲液,pH=7.14。
1.2 实验方法
1.2.1 标准曲线的制作
准确称取一定质量的HOTP,用缓冲液配制成浓度梯度为0.001,0.005,0.010,0.030,0.050,0.070,0.090,0.100和0.200 μmol/L HOTP工作液,将缓冲液作空白液。在最优条件下(激发波长为316 nm,发射波长为423 nm,激发、发射狭缝宽度均为10 nm)[10],依次测定工作液荧光强度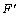 ,并测得缓冲液荧光强度
,并测得缓冲液荧光强度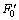 。HOTP荧光强度
。HOTP荧光强度 ,并以荧光强度
,并以荧光强度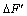 为纵坐标,HOTP标准浓度c为横坐标,绘制标准曲线。
为纵坐标,HOTP标准浓度c为横坐标,绘制标准曲线。
1.2.2 羟基自由基浓度测定
称取一定质量石英粉尘(除探讨新、旧石英粉尘自由基释放区别外,对于其他实验,使用前,均匀速手磨2 min后称质量),装入磨口锥形瓶中,依次加入缓冲溶液和对苯二甲酸,于37 ℃和180 r/min条件下水浴恒温振荡,用孔径为0.22 μm的微孔滤膜过滤,在最优条件下测滤液的荧光强度。每个样品重复3次,取平均值,并计算标准偏差。读取滤液荧光强度峰值F、未加石英粉的体系荧光强度F0,羟自由基产生的量用相对荧光强度△F=F-F0表示。其中,△F越大,表明生成的羟自由基越多。根据HOTP标准曲线,对荧光强度△F与羟自由基浓度c·OH关系曲线及体系羟自由基进行定量研究。
2 结果与讨论
羟基自由基可进攻对苯二甲酸,从而产生单一的强荧光羟基化产物HOTP,其荧光强度与·OH 浓度线性相关,实验获得HOTP的标准曲线方程为y= 2 081.3x,相关系数R2=0.999 5。羟自由基累积浓度计算公式为
c·OH = cHOTP =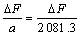 (μmol/L) (1)
(μmol/L) (1)
其中:a为标准曲线的斜率;△F为相对荧光强度。利用式(1)计算不同影响因素下石英生成羟自由基浓度。
2.1 不同粒度石英粉尘对体系羟自由基浓度的影响
可吸入石英粉尘作为大气颗粒物的重要组成成分,对人体健康有着潜在威胁,其粒径决定颗粒物在人体内的不同沉积部位。粒径越小,则越容易侵入人体细胞组织中[11]。粒径小于10.0 μm的粉尘能进入呼吸系统[12],粒径为1.0~2.5 μm的细颗粒大部分沉积于肺部深层,纳米颗粒则易与生物体细胞结合。根据不同粒径颗粒物对人体健康的影响,本组实验研究了不同粒径石英粉和纳米二氧化硅粉体以质量浓度4 g/L在缓冲溶液中作用48 h后产生羟自由基的能力,结果如图1所示(其中,“[ ]”表示浓度)。

图1 不同粒度粉尘羟自由基浓度
Fig. 1 Concentration of hydroxyl radicals in different granularities
从图1可见:缓冲溶液中·OH浓度随石英颗粒粒度的减小而增加,从0.018 μmol/L增加到0.071 μmol/L。石英粒径越小,体系产生的羟自由基量越多。石英粉在超细加工过程中,颗粒表面出现大量裸露的基团,使石英颗粒具有很强的活性。石英颗粒与水作用后,表面·SiO和·Si等基团能发生质子化反应,形成更稳定的—SiOH;同时,失去质子H的H2O随即转化为·OH。石英颗粒粒度越小,其比表面积越大,表面裸露基团也越多,进而生成的·OH越多;此外,在该体系中,纳米二氧化硅也产生羟自由基,但结晶态的二氧化硅较非晶态的二氧化硅更容易产生羟自由基。这可能是为了使纳米二氧化硅具有较好的分散性,在制备过程中已对颗粒表面进行改性,消除或减少了颗粒表面羟基数量[13]。由于纳米尺寸效应,纳米物质在水溶液中极易团聚,使得微环境极性降低,滤液极化率减小,斯托克斯位移减小,故纳米二氧化硅作用后滤液的最大发射波长有蓝移现象。
2.2 不同新鲜度石英颗粒对体系羟自由基浓度的影响
前期研究大多采用新鲜石英粉尘为模型材料,探讨石英粉尘释放羟自由基的规律,指出新鲜研磨的石英粉尘在缓冲溶液中能释放羟自由基。为探讨石英粉尘在水溶液中释放羟自由基的机理,研究了粒径为2.5 μm、质量浓度为4 g/L、不同新鲜度石英粉尘与缓冲液作用48 h后释放羟自由基的规律,实验结果如图2 所示。

图2 不同新鲜度粉尘羟自由基浓度
Fig. 2 Concentration of hydroxyl radicals in different freshness dusts
从图2可见:新鲜石英粉尘与陈旧石英(保存2月)相比在水溶液中释放羟自由基的量高约5倍。石英在研磨过程中,有更多Si—O—Si键均裂和硅载自由基产生(·Si,·SiO,·SiOO),且新鲜研磨的石英粉尘有更大的表面积,使其具有更强的活性,与水作用后,颗粒物表面的硅氧键极易水解,产生·OH,但粉尘表面活性会随着时间的延续而衰减,逐渐“老化”[3],因而,新鲜石英粉尘比陈旧石英粉尘能够释放更多的羟自由基。
2.3 不同质量浓度的石英粉尘对体系羟自由基浓度的影响
可吸入石英颗粒物能够导致人类尘肺以及其他呼吸系统疾病,其中,颗粒物浓度是重要影响因素,直接决定其在呼吸道中的沉积量[14-15]。本组实验选取粒度为2.5 μm的石英粉,设计不同的质量浓度,分别为0,0.05,0.10,0.20,0.40,0.80,1.60,4.00和8.00 g/L,与缓冲液作用48 h后,测滤液荧光强度,结果如图3所示。研究石英粉尘浓度对羟自由基浓度的影响,结果如图4所示。
从图4可见:随着粉尘质量浓度增大,体系中羟自由基的浓度明显升高;在低粉尘质量浓度体系中,羟自由基的浓度随着石英粉浓度的增加而迅速升高,当颗粒物质量浓度从0.05 g/L增大到0.80 g/L时,其羟自由基浓度从0.000 6 μmol/L增至0.020 0 μmol/L,增大了30倍;当颗粒物质量浓度为0.80~4.00 g/L时,粉尘释放羟自由基浓度呈线性递增;当颗粒物质量浓度高于4.00 g/L时,自由基的浓度较颗粒物质量浓度为0.80~4.00 g/L时的浓度的增长速率有所降低。这种现象可以解释为:在对苯二甲酸量足够且不变的情况下,当粉尘质量浓度小于0.80 g/L时,单位体积内低浓度石英粉尘表面基团与水作用反应剧烈,产生的羟自由基立即被捕获,其浓度随石英粉尘量的增加而增多;当粉尘质量浓度为0.80~4.00 g/L时,体系中石英粉尘表面基团与水作用产生的羟自由基的化学反应达到平衡,其浓度随粉尘浓度变化呈线性改变;当石英粉尘质量浓度大于4.00 g/L时,由于单位体积溶液中颗粒数量巨大,颗粒间的作用力(静电力、分子间作用力等)的相互作用影响了颗粒与溶液之间的作用行为,减缓了自由基的生成速度。
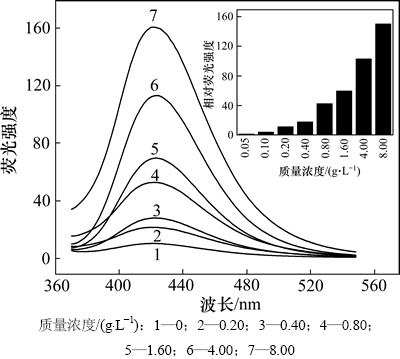
图3 不同质量浓度滤液相对荧光强度
Fig. 3 Relative fluorescence intensity of filtrate in different mass concentrations

图4 不同质量浓度羟自由基浓度
Fig. 4 Concentration of hydroxyl radicals in different mass concentrations
2.4 不同作用时间对体系羟自由基浓度的影响
颗粒物吸入人体后,会对人体特定组织形成短期和长期毒性,颗粒物化学组分、浓度及在人体内滞留时间决定其危害程度[16]。本组实验选取粒度为2.5 μm的石英粉,质量浓度为4.00 g/L,作用不同时间(0.02,2,4,6,10,12,24,48,72,96和144 h)后,测定滤液的荧光强度,研究石英粉与溶液作用时间对羟自由基浓度的影响,实验结果如图5所示。
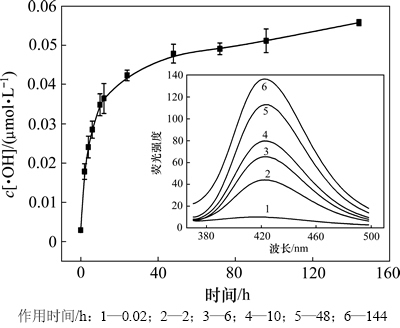
图5 不同作用时间羟自由基浓度
Fig. 5 Concentration of hydroxyl radicals in different reaction time
实验中,对第1个测量值进行校正,校正时间为0.02 h。从图5可见:石英粉尘遇水则产生羟自由基,且随着作用时间的增加,滤液的荧光强度不断升高,体系累积的羟自由基量持续增多,其中,短时间(10 h)内,羟自由基生成量快速增多;当作用时间超过48 h时,羟自由基累积量趋于稳定。这可能是由于在短时间内,石英表面裸露的活性基团数量多,单位时间内表面基团与水作用产生羟自由基多,滤液荧光强度快速增大;随着时间的延长,固定质量的石英粉尘表面基团逐渐被反应消耗,体系产生的羟自由基量越来越少,其累积浓度逐渐趋于稳定。
2.5 石英粉尘释放羟自由基动力学分析
石英粉尘在缓冲溶液中羟自由基随时间浓度的动力学规律如图5所示。通过分析发现·OH的生成量与作用时间符合对数函数关系,其动力学方程为
y=0.006 3lnt+0.020 9,R2=0.934 7 (2)
其中:y为·OH的生成量;t为时间,且t≥0.02 h。由式(2)可以看出·OH的生成量与时间呈正相关。对方程(2)求导得0.006 3/t,表明随时间的推移,·OH的产生速率逐渐降低。本研究在匀速振荡环境下进行,与其在生物体内被吞噬—释放—再吞噬的动态过程相似,体系中羟自由基可在一定时间内释放;随着石英在磷酸缓冲体系中浸泡时间的延长,·OH荧光强度逐步衰减直至消失,与前期研究利用ESR检测石英·OH结果一致[17],进而推测石英粉尘进入机体后所形成的·OH不会持续很久。由于对数函数值可以取到无限大,与自由基的生成实际上是矛盾的,所以,当浸泡时间t >> 144 h时,方程(2)对于自由生成量的模拟无效。
为验证动力学方程的有效性,通过与缓冲液作用时间分别为8 h和120 h的实验进行讨论,计算出作用8 h和120 h的羟自由基生成量,理论值分别为0.034 0 μmol/L和0.051 1 μmol/L,实际值分别为0.032 0 μmol/L和0.050 8 μmol/L,经SPSS统计分析发现,理论值与实际值没有显著性差异,故该动力学方程是正确、有效的。
石英粉尘在水溶液中产生·OH的机理主要涉及以下反应[17-18]:
·O—Si+H2O→SiOH+·OH,反应速率常数为k3 (3)
·O—Si+·OH→SiOOH,反应速率常数为k4 (4)
SiOOH+H2O→SiOH+H2O2,反应速率常数为k5 (5)
·Si+H2O2→SiOH+·OH,反应速率常数为k6 (6)
由于体系中[·O—Si]和[·Si]很低,加入大量对苯二甲酸(TA)后,反应(3)和(6)产生的·OH全部与TA反应,进一步转化为HOTP:
·OH+TA → HOTP,反应速率常数为k7 (7)
根据质量作用定律可以得到:
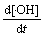 = k3[·O—Si][ H2O]-k4[·O—Si][·OH]+ k6[·Si][H2O2]-k7[·OH][TA] (8)
= k3[·O—Si][ H2O]-k4[·O—Si][·OH]+ k6[·Si][H2O2]-k7[·OH][TA] (8)
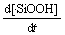 = k4[·O—Si][·OH]-k5[SiOOH][H2O] (9)
= k4[·O—Si][·OH]-k5[SiOOH][H2O] (9)
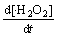 = k5[SiOOH][H2O]-k6[·Si][H2O2] (10)
= k5[SiOOH][H2O]-k6[·Si][H2O2] (10)
根据稳态法可知: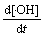 =0,
=0,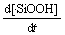 =0,
=0,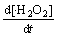 = 0。由式(8)+(9)+(10)可得:
= 0。由式(8)+(9)+(10)可得:
[·OH] =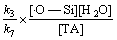 (11)
(11)
TA与·OH反应速率,即HOTP的生成速率为
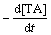 = k7[·OH][TA] (12)
= k7[·OH][TA] (12)
将式(11)代入式(12)得
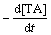 = k3[·O—Si][H2O] (13)
= k3[·O—Si][H2O] (13)
可见:HOTP的生成速率和·OH的浓度随着石英表面[·O—Si]浓度的变化而变化,与[·Si]浓度无明显关系。据反应式(7),羟自由基与对苯二甲酸以摩尔比1:1反应生成HOTP。由于随着反应的进行,[·O—Si]的浓度逐渐降低,而[H2O]可以认为是常数,表明HOTP生成速率呈降低趋势,进而反映出·OH的生成速率是逐渐降低的。该规律与图5所示结果是一致的,因而,可依方程式(13)对石英粉尘水溶液中自由基的生成速率进行估算。
石英粉尘在水溶液中产生羟自由基的机制并未完全明晰,但通过新、旧石英粉尘释放羟自由基的不同,石英粉尘释放羟自由基具有明显的剂量-效应等一系列变化规律,可以间接地说明水溶液中石英粉尘产生羟自由基的机制并不是微量元素发生的Fenton反应[19]。石英粉尘在水溶液中产生·OH的机制极可能是由于表面裸露的基团与溶液之间发生的一系列化学反应。
3 结论
1) 石英粉尘在磷酸盐缓冲溶液中释放的羟自由基浓度很低,在本实验条件下,羟自由基浓度为0.000 6~0.080 0 μmol/L。
2) 粉尘粒度、浓度、粉尘新鲜度与溶液作用时间等均可影响石英粉尘释放羟自由基能力;磷酸盐缓冲溶液中石英粉尘释放羟自由基呈剂量-效应和时间-效应关系,颗粒尺寸效应明显,且颗粒尺寸效应从大至小的颗粒粒度为1.0,2.5,5.0和10.0 μm,不同粒径可吸入石英粉尘释放羟自由基浓度均大于纳米二氧化 硅浓度。
3) 石英表面活性存在“老化”问题,新鲜石英粉尘较陈、旧石英(保存2月)在水溶液中释放羟自由基能力强5倍。
4) 石英粉尘在磷酸盐缓冲液中随时间的延长,其羟自由基浓度减少,在研究时间范围内呈对数增长关系,可采用动力学方程y=0.006 3lnt+0.020 9对短时间内石英粉尘在水溶液中释放·OH进行定量计算;·OH的浓度只与石英表面(·O—Si)的浓度有关。
参考文献:
[1] LI Xican, WANG Xiaozhen, CHEN Dongfeng, et al. Antioxidant activity and mechanism of protocatechuic acid in vitro[J]. Functional Foods in Health and Disease, 2011, 1(7): 232-244.
[2] Xu J, Sahai N, Eggleston C M, et al. Reactive oxygen species at the oxide/water interface: Formation mechanisms and implications for prebiotic chemistry and the origin of life[J]. Earth and Planetary Science Letters, 2013, 363: 156-167.
[3] 郭维新, 郭鼐. 粉尘表面活性与自由基研究进展[J]. 国外医学卫生学分册, 1996, 23(4): 208-211.
GUO Weixin, GUO Nai. Surface activity and free radical research progress of dust[J]. Foreign Medical Sciences (Section Hygiene), 1996, 23(4): 208-211.
[4] 李怡, 朱彤. 大气颗粒物致机体损伤的·OH自由基机制[J]. 生态毒理学报, 2007, 2(2): 142-149.
LI Yi, ZHU Tong. Hydroxyl Radical mechanism of toxicity induced by atmospheric particulate matter[J]. Asian Journal of Ecotoxicology, 2007, 2(2): 142-149.
[5] Jr Hamilton R F, Thakur S A, Holian A. Silica binding and toxicity in alveolar macrophages[J]. Free Radical Biology and Medicine, 2008, 44(7): 1246-1258.
[6] GONG Chunmei, TAO Gonghua, YANG Linqing, et al. The role of reactive oxygen species in silicon dioxide nanoparticle- induced cytotoxicity and DNA damage in HaCaT cells[J]. Molecular Biology Reports, 2012, 39(4): 4915-4925.
[7] van Berlo D, Wessels A, Boots A W, et al. Neutrophil-derived ROS contribute to oxidative DNA damage induction by quartz particles[J]. Free Radical Biology and Medicine, 2010, 49(11): 1685-1693.
[8] Dalal N S, Shi X, Vallyathan V. Role of free radicals in the mechanisms of hemolysis and lipid peroxidation by silica: Comparative ESR and cytotoxicity studies[J]. Journal of Toxicology and Environmental Health: Part A, Current Issues, 1990, 29(3): 307-316.
[9] XIANG Quanjun, YU Jiaguo, Wong P K. Quantitative characterization of hydroxyl radicals produced by various photocatalysts[J]. Journal of Colloid and Interface Science, 2011, 357(1): 163-167.
[10] 刘立柱, 董发勤, 孙世勇, 等. 石英粉/磷酸盐缓冲溶液体系中羟自由基荧光分光光度法定量检测研究[J]. 光谱学与光谱分析, 2014, 34(7): 1886-1889.
LIU Lizhu, DONG Faqin, SUN Shiyong, et al. Quantitative detection of hydroxyl radical generated in quartz dust/phosphate buffer solution system by fluorescence spectrophotometry[J]. Spectroscopy and Spectral Analysis, 2014, 34(7): 1886-1889.
[11] Steenhof M, Gosens I, Strak M, et al. In vitro toxicity of particulate matter (PM) collected at different sites in the Netherlands is associated with PM composition, size fraction and oxidative potential–the RAPTES project[J]. Part Fibre Toxicol, 2011, 8(1): 1-15.
[12] 邓启红, 时冰冰, 李剑东, 等. 大学教室颗粒物 PM10 化学组分特性及源解析[J]. 中南大学学报(自然科学版), 2009, 40(2): 322-328.
DENG Qihong, SHI Bingbing, LI Jiandong, et al. Chemical composition and source apportionment of particulate matter (PM10) in university classrooms[J]. Journal of Central South University (Science and Technology), 2009, 40(2): 322-328.
[13] Ma X, Lee N H, Oh H J, et al. Surface modification and characterization of highly dispersed silica nanoparticles by a cationic surfactant[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2010, 358(1): 172-176.
[14] Turner M C, Krewski D, Pope III C A, et al. Long-term ambient fine particulate matter air pollution and lung cancer in a large cohort of never-smokers[J]. American Journal of Respiratory and Critical Care Medicine, 2011, 184(12): 1374-1381.
[15] Massey D D, Kulshrestha A, Taneja A. Particulate matter concentrations and their related metal toxicity in rural residential environment of semi-arid region of India[J]. Atmospheric Environment, 2013, 67: 278-286.
[16] 刘彦飞, 邵龙义, 于倩, 等. 可吸入颗粒中金属元素对 DNA 的氧化性损伤[J]. 中南大学学报(自然科学版), 2012, 43(11): 4567-4573.
LIU Yanfei, SHAO Longyi, YU Qian, et al. Oxidative damage to DNA induce by metal elements in airborne inhalable particles[J]. Journal of Central South University (Science and Technology), 2012, 43(11): 4567-4573.
[17] Shi X, Dalai N S, Vallyathan V. ESR evidence for the hydroxyl radical formation in aqueous suspension of quartz particles and its possible significance to lipid peroxidation in silicosis[J]. Journal of Toxicology and Environmental Health, Part A: Current Issues, 1988, 25(2): 237-245.
[18] Vallyathan V, Shi X, Dalal N S, et al. Generation of free radicals from freshly fractured silica dust[J]. American Review of Respiratory Diseases, 1988, 138: 1213-1219.
[19] Fenoglio I, Prandi L, Tomatis M, et al. Free radical generation in the toxicity of inhaled mineral particles: the role of iron speciation at the surface of asbestos and silica[J]. Redox Report, 2001, 6(4): 235-241.
(编辑 陈灿华)
收稿日期:2014-06-10;修回日期:2014-08-22
基金项目(Foundation item):国家自然科学基金重点资助项目(41130746);国家自然科学基金青年科学基金资助项目(41102213) (Project(41130746) supported by the National Natural Science Foundation of China; Project(41102213) supported by the National Natural Science Foundation of Youth Science Fund)
通信作者:董发勤,教授,博士生导师,从事生态环境材料、矿物环境等研究;E-mail: fqdong@swust.edu.cn
摘要:定量研究可吸入石英粉尘中的羟自由基(·OH)在磷酸盐缓冲溶液中的释放规律。采用对苯二甲酸-荧光分光光度法,探讨石英粒度、质量浓度、粉-液作用时间以及粉尘新鲜度对羟自由基释放的影响,并分析石英粉尘在缓冲溶液中释放羟自由基的动力学特征。研究结果表明:石英在缓冲溶液中羟自由基的产生呈剂量-效应和时间-效应关系,且颗粒尺寸效应明显,结晶态二氧化硅比非晶态二氧化硅更易产生羟自由基;新鲜石英比陈旧石英更易产生羟自由基;在较短作用时间内释放羟自由基的累积浓度呈对数增长趋势,羟自由基浓度随石英表面(·O—Si)浓度变化而变化,·OH产生的机制可能与石英表面裸露的基团和缓冲溶液发生的复杂化学反应有密切关系。
(11)" target="blank">[·OH] = (11)
[3] 郭维新, 郭鼐. 粉尘表面活性与自由基研究进展[J]. 国外医学卫生学分册, 1996, 23(4): 208-211.
[4] 李怡, 朱彤. 大气颗粒物致机体损伤的·OH自由基机制[J]. 生态毒理学报, 2007, 2(2): 142-149.
[10] 刘立柱, 董发勤, 孙世勇, 等. 石英粉/磷酸盐缓冲溶液体系中羟自由基荧光分光光度法定量检测研究[J]. 光谱学与光谱分析, 2014, 34(7): 1886-1889.
[12] 邓启红, 时冰冰, 李剑东, 等. 大学教室颗粒物 PM10 化学组分特性及源解析[J]. 中南大学学报(自然科学版), 2009, 40(2): 322-328.
[16] 刘彦飞, 邵龙义, 于倩, 等. 可吸入颗粒中金属元素对 DNA 的氧化性损伤[J]. 中南大学学报(自然科学版), 2012, 43(11): 4567-4573.


