碳热还原法制备LiFePO4/C锂电池正极材料的研究
北京科技大学材料科学与工程学院
摘 要:
以Fe2O3为铁源,NH4H2PO4为磷源,Li2CO3为锂源,蔗糖为碳添加剂,应用碳热还原一步烧结法制备了LiFePO4/C复合粉体材料,系统的研究了烧结温度、烧结时间和锂铁比对样品电化学性能的影响。研究结果表明,对电化学性能影响因素最大的是烧结温度、其次是锂铁比,最后是烧结时间。当烧结温度为700℃、锂铁比为1.00、烧结时间为12 h时样品所得的电化学性能最佳,它在0.1C,0.5C和1.0C倍率下的首次放电比容量分别为130.1,118.2和105.6 mAh.g-1,经20次循环后,不同倍率下样品的容量的保持率分别为99.8%,98.9%和97.5%。
关键词:
中图分类号: TM912
作者简介:王文琴(1987-),女,江西吉安人,硕士研究生;研究方向:锂离子电池;郭志猛(E-mail:zmguo@ustb.edu.cn);
收稿日期:2011-06-17
Synthesis of LiFePO4/C Cathode Material by Carbothermal Reduction Method
Abstract:
The LiFePO4/C cathode material was synthesized by carbothermal reduction method,using Fe2O3,NH4H2PO4 and Li2CO3 as raw materials and sucrose as reduction reagent.The effects of sintering temperature,sintering time,molar ratio of Li to Fe on the electrochemical properties of LiFePO4 for lithium ion battery were studied.The results showed that the optimized synthesis process of LiFePO4 was sintering temperature of 700 ℃,molar ratio of Li to Fe of 1.00 and sintering time of 12 h.The results showed that the LiFePO4/C powders achieved a high initial discharge capacity of 130.1,118.2 and 105.6 mAh · g-1 at 0.1C,0.5C and 1.0C rate and after 20 cycles discharges,the capacity retention rate was 99.8%,98.9% and 97.5%,respectively.
Keyword:
LiFePO4;cathode material;carbothermal reduction method;sintering temperature;
Received: 2011-06-17
锂离子二次电池近年来已在各种便携式电子产品和通讯工具中得到广泛应用。 锂离子电池的性能和成本在很大程度上取决于正极材料, 因而正极材料的研制成为关键
目前, 合成LiFePO4材料的方法较多, 主要是固相合成法、 溶胶-凝胶法、 水热法、 共沉淀法、 微波法等
本实验采用Fe2O3, NH4H2PO4和Li2CO3为原料, 蔗糖为碳添加剂, 应用碳热还原一步烧结法合成了LiFePO4/C复合材料, 能适当降低成本。 在实验过程中, 设计了一组3因素3水平的L9(33)正交实验, 研究了烧结温度, 烧结时间和锂铁比对样品电化学性能的影响, 找出较为经济、 简单的磷酸铁锂正极材料的工业化制备工艺路线。
1 实 验
1.1 正交实验表的选择
以材料的首次放电比容量为考核指标, 考察合成工艺对LiFePO4/C容量的影响。 以烧结温度、 烧结时间和锂铁比作为工艺因素, 每个因素设置3个水平如表1所示。
1.2 样品的制备
按化学计量比, 以Li2CO3(电池级)、 Fe2O3(自制)和NH4H2PO4(工业原料)为反应物进行配料, 同时加入10%(以磷酸铁锂的质量计)蔗糖, 以无水乙醇作为分散剂, 在高速行星式球磨机内球磨5 h将原材料混合均匀, 然后将球磨好的物料在80 ℃真空干燥5 h, 制得前驱体。 将前驱体置于管式烧结炉中烧结, 烧结温度控制在600~800 ℃,
表1 因素水平表
Table 1 Factors and levels of orthogonal test
| Level | A Sintering temperature/℃ |
B Molar ratio of Li to Fe |
C Sintering time/h |
| 1 | 600 | 1.00 | 3 |
| 2 | 700 | 1.02 | 6 |
| 3 | 800 | 1.05 | 12 |
烧结时间选择3, 6和12 h, 烧结过程中通入氮气保护, 反应完成后随炉冷却至室温。
1.3 物性表征
采用日本Rigaku公司生产的X射线衍仪对物相进行分析, 以Cu靶为辐射源, 工作电压40 kV, 工作电流150 mA, 波长为0.15406 nm, 2θ为 10°~100°。 采用JEOL公司的JSM-5600 LV扫描电子显微镜, 在20 kV下对样品的表面形貌进行观察。 TG和DTA测试设备分别采用北京光学仪器厂的WRT-2C微机热天平和WCR-2C微机差热仪, 测试条件为: 氮气气氛下, 升温速率为10 ℃·min-1, 温度范围是0~800 ℃。 用BT-1000粉体综合特性测试仪测试样品的振实密度。 采用MATERSIZER 2000激光粒度分析仪对不同样品进行粒度分析。 用德国CS800红外碳硫检测仪分析LiFePO4样品的碳含量。
1.4 电池的组装与充放电测试
将制备的活性材料与导电碳黑、 聚偏二氟乙烯(PVDF)按照质量比为8∶1∶1称量, 在溶剂N-甲基吡咯烷酮(NMP)中混合成均匀浆料, 涂布于铝箔上。 在120 ℃的真空箱中干燥制成正极片。 以锂片为负极, Cellgard 2400聚丙烯多孔膜为隔膜, 1 mol·L-1 LiPF6/(EC/EMC/DMC, VEC∶VEMC∶VDMC=1∶1∶1)为电解液, 在充满氩气的手套箱中装配成LIR2032型扣式电池。 组装好的扣式电池在LAND CT 2001A (武汉蓝电电子设备有限公司)上测试材料的充放电性能, 截止电压为2.5~4.3 V。
2 结果与讨论
2.1 差热-热重分析
本研究以Fe2O3, Li2CO3, NH4H2PO4和蔗糖为原料, 采用碳热还原法一步合成法制备得到LiFePO4/C复合材料。 其合成的基本反应如下:
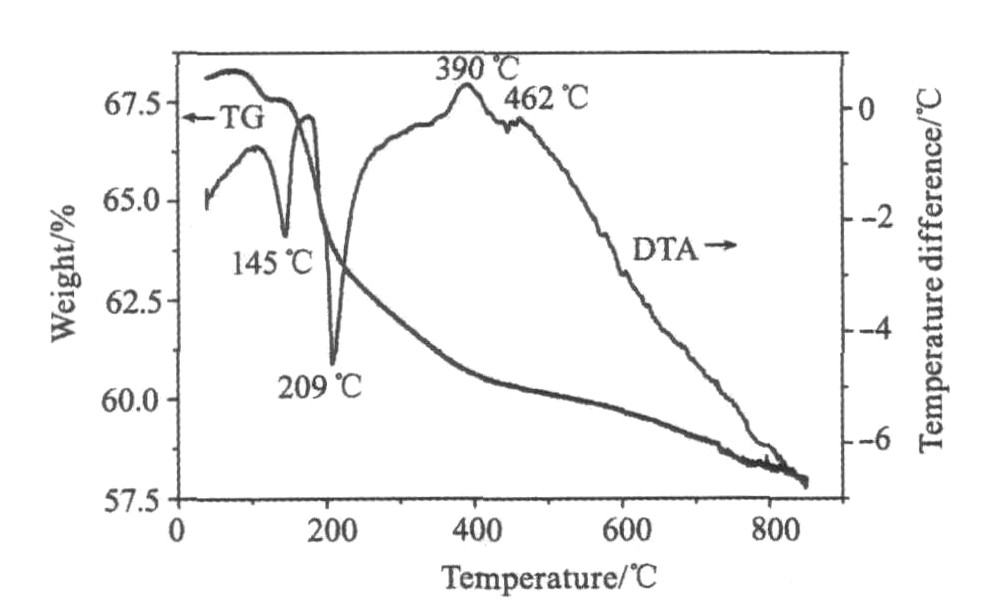
图1为含10%蔗糖的磷酸铁锂前驱体TG-DTA
图1 前驱体的TG-DTA曲线
Fig.1 TG and DTA curves for precursor
图谱: DTA曲线表明, 在145 ℃附近和209 ℃附近有吸热峰, 分别对应于水的脱出和蔗糖分解; 在390 ℃附近有一个明显的放热峰, 是样品前驱体发生热分解引起的, 挥发出CO, CO2, H2O和NH3; 在462 ℃又有一个放热峰, 样品前驱体向LiFePO4转变, 从462~800 ℃之间没有吸热峰和放热峰出现, 说明462 ℃是LiFePO4的结晶化温度。 TG曲线表明, 重量损失主要有3个阶段, 在130~209 ℃之间失重速率较快, 从209~600 ℃之间失重速率较慢, 从600~800 ℃之间失重不明显。 因此, LiFePO4的烧结温度应该在462 ℃以上以确保完全反应, 并保温一定时间有利于橄榄石结构形成。 因此, 本实验的烧结温度选择在600~800 ℃之间。
2.2 不同样品的性能分析
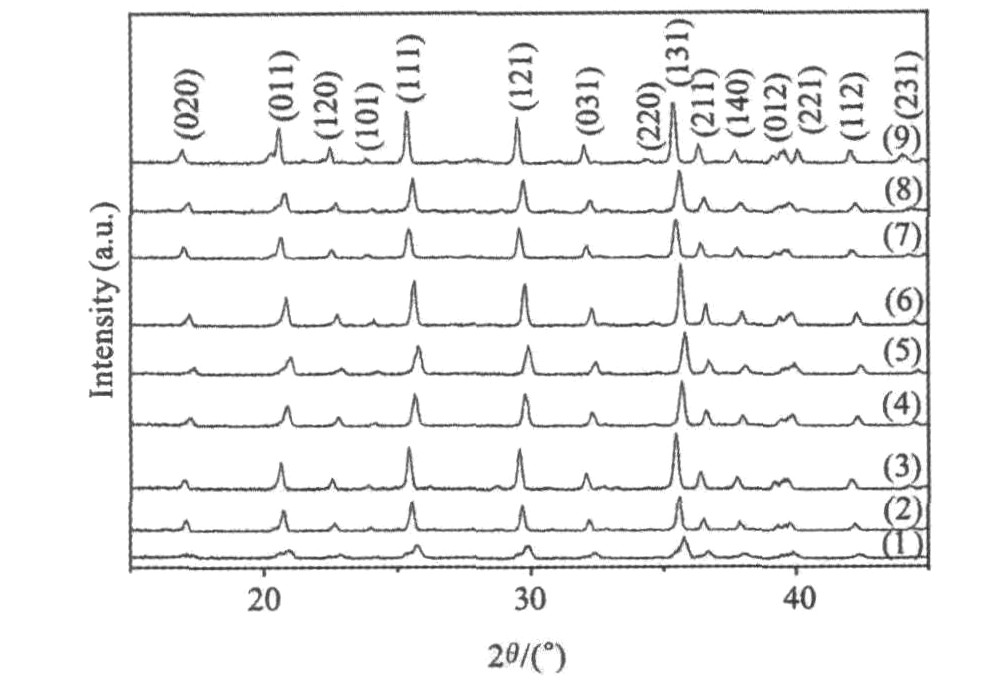
图2是不同条件下合成的LiFePO4/C的X射线衍射图谱。 从图2可以看出, 不同样品的衍射峰都符合橄榄石结构(标准JCPDS卡40-1499)LiFePO4, 无其他明显的杂相生成。 而1号样品的衍射峰较宽, 这说明在低温和短时间烧结时, 产物结晶不够完整, 因而衍射峰有所宽化。 而其他样品(特别是6号和9号)的衍射峰都比较尖锐、 结晶完整、 具有典型的单一橄榄石结构, 并且随着烧结温度的提高和时间的延长, LiFePO4的各个主峰强度增大, 各衍射峰更加尖锐, 这说明烧结温度的增加和时间的延长有利于LiFePO4的结晶化。 在图2中并没有发现碳的衍射峰, 说明蔗糖热分解成无定形碳, 对LiFePO4衍射峰没有影响。
图2 不同条件下样品的XRD图
Fig.2 XRD patterns of LiFePO4/C at different conditions
(1)Sample 1;(2)Sample 2;(3)Sample 3;(4)Sample 4;(5)Sample 5;(6)Sample 6;(7)Sample 7;(8)Sample 8;(9)Sample 9
图3是不同条件下合成的LiFePO4/C复合材料的SEM图, 从图中可以看出, 1号样品的颗粒最小, 颗粒分布比较均匀, 大部分为1~2 μm, 团聚较少, 图3(a)所示。 9号样品的颗粒团聚严重, 颗粒明显较大, 说明高温和长时间烧结将导致颗粒之间的严重团聚, 从而形成粗大的颗粒, 图3(i)所示。 其他样品的颗粒粒径都较小, 同时颗粒也比较均匀, 平均粒径为3 μm左右。
图4是不同样品在0.1C倍率下的首次放电曲线和循环图。 从图4(a)中可以看到6号样品的电化学性能最好, 它在0.1C时的首次放电容量为130.1 mAh·g-1, 这是由于在700 ℃下烧结12 h时, 样品的结晶化程度较高, 且颗粒团聚不明显, 分布均匀。 从图4(b)中可以看到9个样品经20次循环后样品的容量保持率都在99%以上, 区别不是很明显。 因此, 在后面的分析中以材料的首次放电比容量为考核指标。
表2为不同样品的电化学性能测试及极差分析结果, 实验的考核指标是D(首次放电比容量)越大越好。 表中R是本次正交实验所得出的极差, 即每个因素的不同水平的实验结果间的最大差值, 为分清影响因素的主次, 选择这个因素的最优水平提供了依据。 极差越大, 说明该因素水平对实验结果影响越大。 从表2中可以看出, 在烧结温度、 烧结时间以及锂铁比这3个因素中, 对产物的电化学性能影响最大的是烧结温度, 其次是锂铁比, 最后是烧结时间。
2.3 最优工艺条件下LiFePO4/C样品的性能
图5为样品的场发射扫描电镜图, 从图5(a)中可以看出, LiFePO4/C一次颗粒的大小为500 nm左右, 晶粒形貌较规则。 从图5(b)中可以看出, LiFePO4表面完整的包覆了一层碳膜, 碳以非晶的形式存在, 可以阻止LiFePO4的长大, 使LiFePO4颗粒细小并且分布均匀; 同时碳膜又连通于LiFePO4颗粒之间, 增加了颗粒之间的电子电导率, 有利于提高材料的高倍率充放电性能。 实验所得样品的含碳量为1.89%, 碳残余量为45%。
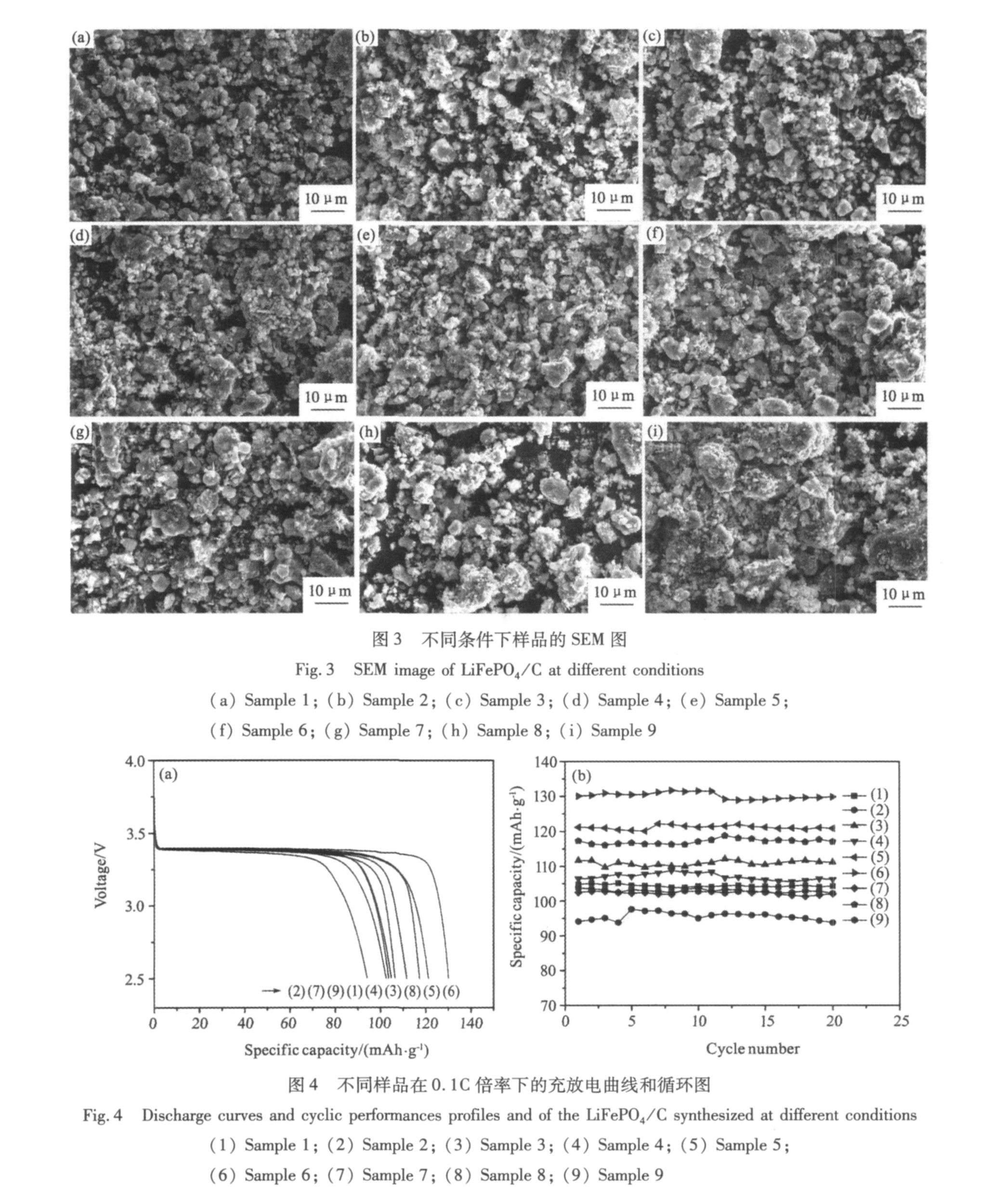
图5 LiFePO4/C样品的FE-SEM图
Fig.5 FE-SEM image of LiFePO4/C
表2 实验结果及极差分析
Table 2 Result and range analysis of the orthogonal test
| Serial number |
A (Sintering temperature/℃) |
B (Molar ratio of Li to Fe) |
C (Sintering time/h) |
D(Specific capacity/ (mAh·g-1) |
| 1 | 600 | 1 | 3 | 104.8 |
| 2 | 600 | 1.02 | 6 | 94.1 |
| 3 | 600 | 1.05 | 12 | 111.7 |
| 4 | 700 | 1.02 | 3 | 106.4 |
| 5 | 700 | 1.05 | 6 | 121.2 |
| 6 | 700 | 1 | 12 | 130.1 |
| 7 | 800 | 1.05 | 3 | 102.5 |
| 8 | 800 | 1 | 6 | 117.3 |
| 9 | 800 | 1.02 | 12 | 103.7 |
| K1,j | 303.5 | 313.7 | 352.2 | |
| K2,j | 357.7 | 317.8 | 332.6 | |
| K3,j | 323.5 | 345.5 | 335.4 | |
|
|
103.53 | 104.57 | 117.4 | |
|
|
119.23 | 105.93 | 110.87 | |
|
|
107.83 | 115.16 | 111.8 | |
| R | 15.7 | 10.59 | 6.53 |
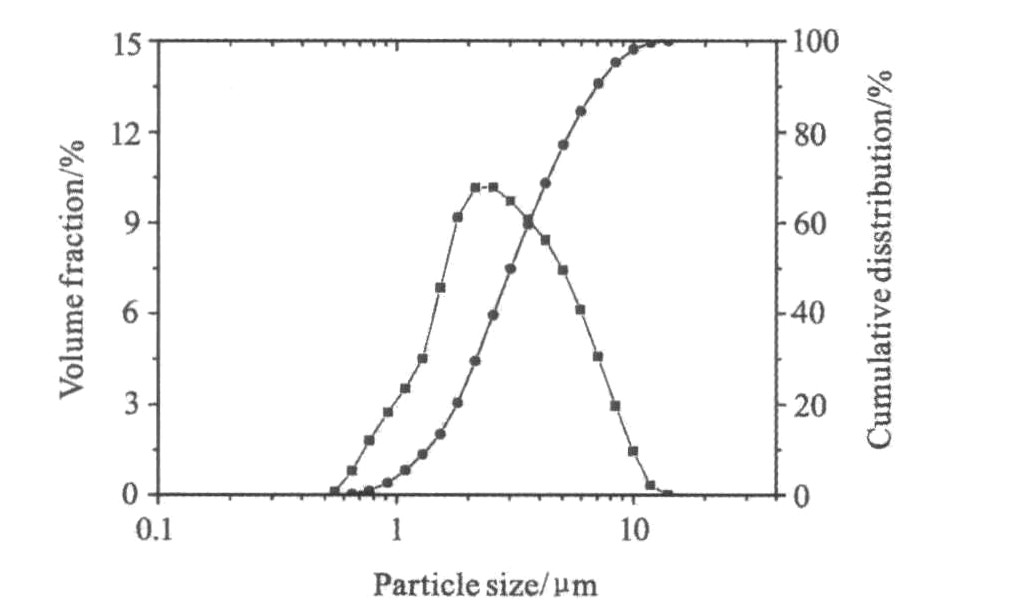
图6 LiFePO4/C样品的粒径分布图
Fig.6 Partical size distribution of LiFePO4/C
图6为LiFePO4/C样品的激光粒度分析, 其中D10=1.4 μm, D50=3.0 μm, D90=7.1 μm, 说明样品形成粒径较小且分布狭窄的颗粒。 测得振实密度结果为1.26 g·cm-3。
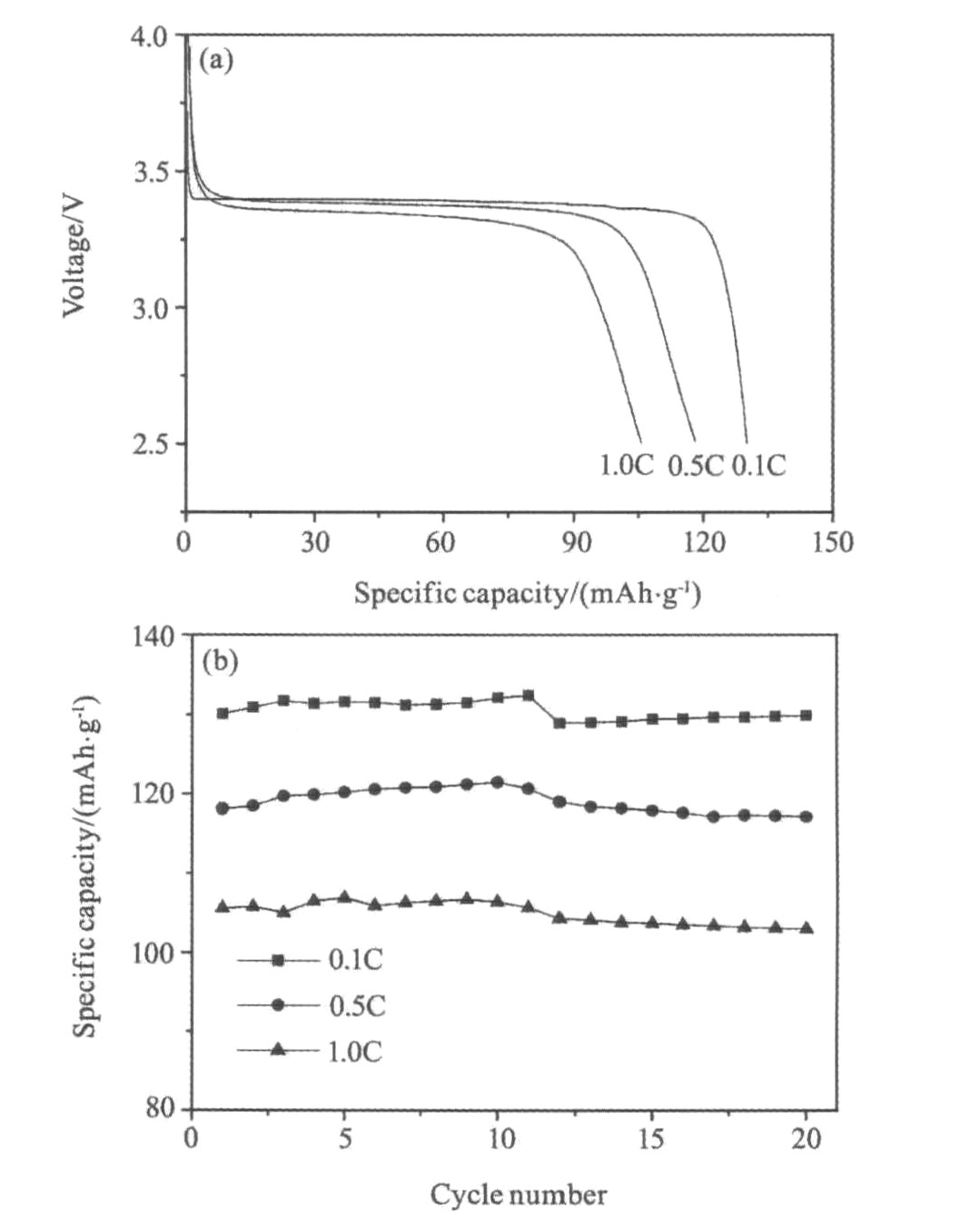
图7为样品在0.1C, 0.5C和1.0C下的首次放电曲线和循环图, 从图7(a)中可以看出, 样品在0.1C, 0.5C和1.0C倍率下的首次放电比容量分别为130.1, 118.2和105.6 mAh·g-1。 从图7(b)中可以看出, 不同倍率下的循环曲线规律相似,
图7 LiFePO4/C样品在不同倍率下的充放电曲线和循环图
Fig.7 Discharge curves and cyclic performances profiles and of the LiFePO4/C synthesized at various discharge rates
放电比容量都是在循环几次后达到最大, 分别达到132.4,121.5和106.7 mAh·g-1, 这是由于活性物质在循环过程中逐渐活化而引起的。 经20次循环后, 不同倍率下样品的容量的保持率分别为99.8%, 98.9%和97.5%。
3 结 论
1. 本实验采用廉价的Fe2O3, NH4H2PO4, Li2CO3和蔗糖为原料, 应用碳热还原一步烧结法合成LiFePO4/C复合粉体材料。 在制备LiFePO4/C复合材料的主要工艺因素中, 对材料电化学性能影响最大的因素为烧结温度, 其次为锂铁比, 最后为烧结时间。
2. 通过正交实验得到的最佳工业化制备工艺路线为烧结温度700 ℃, 烧结时间12 h, 锂铁比为1.00, 它在0.1C, 0.5C和1.0C倍率下的首次放电比容量分别为130.1, 118.2和105.6 mAh·g-1, 经20次循环后, 不同倍率下样品的容量的保持率分别为99.8%, 98.9%和97.5%。
参考文献