异化金属还原菌还原赤铁矿研究
冯雅丽1,王李娟1, 2,李浩然2,张茜1, 2,张士元1, 2,毕耜超1, 2
(1. 北京科技大学 土木与环境工程学院,北京,100083;
2. 中国科学院过程工程研究所 生化工程国家重点实验室,北京,100190)
摘 要:
氧化铁为电子受体,醋酸钠为电子供体,从厌氧活性污泥中分离得到异化金属还原菌。将赤铁矿代替氢氧化铁作为电子受体对微生物进行驯化。通过单因素实验考察好氧、厌氧条件及pH、温度对反应过程的影响,并对反应机理进行研究。研究结果表明:赤铁矿颗粒逐渐由红色变深至棕黑色并具有磁性,分析表明异化金属还原菌可将赤铁矿中的Fe(Ⅲ)还原成Fe(Ⅱ),但反应不完全。反应生成的棕黑色颗粒物质主要成分为Fe3O4与Fe2O3的混合物;厌氧条件优于好氧条件,在温度为30 ℃,振荡速度为160 r/min,接种量为10%,pH为5.0,赤铁矿加入量为1.0 g/L的条件下,20 d后,Fe(Ⅱ)的浓度可达1.87 mmol/L,赤铁矿中的部分Fe(Ⅲ)还原为Fe(Ⅱ),在矿物颗粒表面沉积并与其结合反应生成磁铁矿(Fe3O4),增强了原矿的磁性。
关键词:
中图分类号:TD921;Q939.97 文献标志码:A 文章编号:1672-7207(2013)05-1754-06
Iron reduction of hematite by dissimilatory iron-reducing bacteria
FENG Yali1, WANG Lijuan1, 2, LI Haoran2, ZHANG Qian1, 2, ZHANG Shiyuan1, 2, BI Sichao1, 2
(1. School of Civil and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China;
2. Key State Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China)
Abstract: An experimental system was developed for the study of iron reduction of hematite by dissimilatory iron-reducing bacteria (DIRB). Using ferric hydroxide as the electron acceptor and sodium acetate as the electron donor, dissimilatory iron-reducing bacteria was isolated from anaerobic activated sludge. Instead of ferric hydroxide, hematite was used as the electron acceptor for microbial acclimation. The effects of aerobic and anaerobic conditions, pH values and temperature on the iron reduction of hematite were studied by single-factor experiments, then the mechanism of reaction and the feasibility of applications were discussed. The results indicate that the color of hematite particles turn from red to nigger-brown and black gradually and the particles become magnetic. Analysis indicated that Fe(Ⅲ) in hematite can be reduced to Fe(Ⅱ) by dissimilatory iron-reducing bacteria, but the reaction is incomplete. The nigger-brown and black particles are a blend of Fe3O4 and Fe2O3, anaerobic conditions are more beneficial than aerobic conditions for iron reduction. With 160 r/min of shaking speed, 10% of appropriate inoculation, 1.0 g/L of hematite additive amount, 30 ℃ of temperature and 5.0 of pH, the concentration of Fe(Ⅱ) can be increase to 1.87 mmol/L after 20 d. Fe(Ⅱ) is combined with Fe(Ⅲ) in hematite to form magnetite (Fe3O4) which deposited on the mineral surface. The surface magnetism of hematite is enhanced in this work.
Key words: hematite; dissimilatory iron-reducing bacteria (DIRB); dissimilatory reduction; magnetization
铁氧化物是地球上分布最广的物质成分之一,而赤铁矿是公认的难选矿物。采用常规的磁选工艺难以取得好的选别效果[1]。目前能够改变矿物磁性的方法主要有物理法(如磁化焙烧)和化学法(如矿物的表面磁化)。但物理法通常需要加入不可再生的化石燃料煤[2-3],活性炭[4],或高纯气体CO和H2[5]作为还原剂,并且需要高温处理,资源消耗和能源消耗较高;化学处理则需引入其他化学药剂[6],易造成二次污染。本研究利用微生物异化还原作用,以赤铁矿为微生物的最终电子受体,将赤铁矿中的Fe(Ⅲ)还原为Fe(Ⅱ)。还原生成的Fe(Ⅱ)与赤铁矿中的Fe(Ⅲ)在矿物颗粒表面沉积并结合反应生成磁铁矿(Fe3O4),增强赤铁矿表面的磁性,为赤铁矿的选别提供一种环境友好的方法。
1 材料及方法
1.1 实验材料
实验所用菌种为北京市某污水处理厂的厌氧活性污泥中分离得到的混合异养菌株,污泥呈黑褐色,其pH为7.8,有机物质量分数为69.1%,菌种培养基成分[7]为KCl 0.1 g/L,NH4Cl 0.2 g/L,NaH2PO4 0.6 g/L,NaHCO3 2.5 g/L,Wolfe微量维生素混合液、微量矿物元素混合液(具体参照美国菌种库ATCC的第1768号培养溶液)各10 mL/L,电子供体醋酸钠0.82 g/L,电子受体Fe(OH)3或铁矿根据不同反应当量加入相应的量;Fe(OH)3由FeCl3和NaOH反应制取,反应式为
FeCl3+3NaOH→Fe(OH)3+3NaCl (1)
经洗涤除去残留的盐离子后自然干燥保存;实验所用赤铁矿取自河北省某铁矿,主要成分为Fe2O3,经球磨过筛后粒径为75 μm的矿粉。实验中所用药品均为分析纯。
1.2 实验方法
1.2.1 微生物实验
异化金属还原菌以金属氧化物作为其呼吸作用的最终电子受体,以形成完整的电子传递链,为细胞提供各项生理活动所需的能量[8-9]。调培养基pH为6.8~7.0,利用N2与CO2体积比为80:20的混合气除去培养基中的氧气后,分装入20 mL厌氧培养管中密封,于121 ℃湿热灭菌20 min后(Wolfe 微量维生素混合液、微量矿物元素混合液应过滤灭菌后最后加入),在无菌工作台上进行必要的转接等操作,接种活性污泥量(质量分数)为10%,以未接种为空白对照,于30 ℃静置避光厌氧培养,定时取样,用可见分光光度计测定600 nm波长处的光密度,用菌液的光密度表征菌种的生长情况,并绘制微生物生长曲线。
在上述操作的基础上,用赤铁矿替换培养基中的Fe(OH)3作为电子受体,其他操作同前。
1.2.2 赤铁矿还原实验
在250 mL锥形瓶中分别加入一定量的赤铁矿替换培养基中的Fe(OH)3作为电子受体,通入N2与CO2体积比为80:20的混合气15 min除去溶液中的氧气,密封置于恒温水浴摇床中进行100 mL摇瓶实验,振荡速度为160 r/min,接种量为10%,赤铁矿加入量为1.0 g/L,并根据实验需要控制厌氧好氧条件、pH及反应温度,定时取样分析。
1.3 分析方法
取1 mL混合均匀反应液于4 mL 0.5 mol/L盐酸溶液中浸提24 h[10],将浸提液通过0.22 μm滤膜,测定滤液中Fe(Ⅱ)和总铁(TFe)的浓度(重复3次以上取平均值)。Fe(Ⅱ)和总铁(TFe)的浓度采用邻菲啰啉分光光度法测定;pH采用pHS-25型pH计测定。
2 结果与讨论
2.1 异化金属还原菌菌种的分离
对厌氧活性污泥中的菌种进行筛选分离,醋酸钠(CH3COONa)作为电子供体,Fe(OH)3作为电子受体[11],接种活性污泥量(质量分数)为10%,Fe(OH)3被还原的反应式见式(2)。经过10 d的厌氧避光培养,菌液逐渐变得浑浊。接种3~4 d后,厌氧管中的棕红色Fe(OH)3颗粒逐渐变为黑色颗粒,7~8 d后黑色颗粒具有明显磁性。因此,认为已从厌氧活性污泥中分离筛选出异化金属还原菌。微生物生长曲线如图1所示。

图1 微生物生长曲线
Fig.1 Growth curve of dissimilatory metal reductive microbes
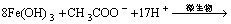
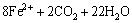 (2)
(2)
由图1可知:随着培养时间的延长,菌液的光密度逐渐增加;在培养的前3 d内,菌体处于适应调整阶段,生长比较缓慢;在3~8 d,菌种处于对数生长期,微生物量的增长速度较快,在此期间,异化金属还原菌生长旺盛,新陈代谢能力强;之后为稳定期,活菌数目达到最大,到第10 d,菌体光密度可达1.43。将悬浊液于低温高速离心机700 r/min 离心10 min,取上清液作为接种液。于培养基中连续培养3代,得到活性较强的菌种保存,作为下一步实验用。
2.2 异化金属还原菌利用赤铁矿作为电子受体的耐矿性驯化
异化金属还原菌具有强大的代谢能力,可利用其他1种或多种电子受体,并对外界环境表现出不寻常的适应和耐受能力[12]。将富集得到的菌液以接种量10%、赤铁矿为电子受体对异化金属还原菌进行驯化,随着反应的进行,颗粒的颜色由红色逐渐变深至棕黑色并具有磁性,矿物中的Fe(Ⅲ)被还原成Fe(Ⅱ),反应式为
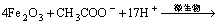
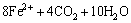 (3)
(3)
将赤铁矿还原前的红色颗粒与还原产生的棕黑色颗粒分别洗涤、过滤、干燥后,进行SEM分析对比,如图2所示。

图2 赤铁矿还原前后颗粒表面电镜图
Fig.2 SEM graphs of surface of particle of hematite before and after reduction
由图2可知:赤铁矿还原后矿物表面生成并吸附了许多颗粒状物质,对其进行XPS能谱分析,发现这些颗粒状物质的主要成分为Fe3O4,可见异化金属还原菌可将赤铁矿中的Fe(Ⅲ)还原为Fe(Ⅱ),在赤铁矿颗粒表面沉积并与其结合反应生成磁铁矿(Fe3O4)。将赤铁矿对异化金属还原菌驯化后的悬浊液于低温高速离心机700 r/min 离心10 min,取上清液作为接种液保存,为下一步实验备用。
2.3 通气对异化金属还原菌还原赤铁矿的影响
在反应温度为30 ℃,pH为7.0,厌氧和好氧的条件下,异化金属还原菌还原赤铁矿的影响用Fe(Ⅱ)浓度随时间的变化情况描述,如图3所示。

图3 厌氧和好氧条件下Fe(Ⅱ)浓度的变化
Fig.3 Concentration of Fe(Ⅱ) under anaerobic and aerobic conditions
由图3可知:经过20 d的异化还原过程,厌氧条件下的赤铁矿中Fe(Ⅱ)浓度远高于有氧条件下的浓度,可见厌氧条件更有利于异化金属还原菌对Fe(Ⅲ)的还原。在无氧条件下,赤铁矿中的Fe2O3是微生物代谢呼吸链的最终电子受体,接入菌种后,有机物的聚集促使Fe(Ⅲ)还原,在微生物呼吸过程中,还原生成Fe(Ⅱ)。由于O2在此过程中也可作为电子受体,会与Fe(Ⅲ)争夺电子产生竞争,不利于Fe(Ⅲ)的还原,所以有氧条件下反而使Fe(Ⅲ)的还原速率降低,从而显现出Fe(Ⅱ)浓度较低。
2.4 pH值对异化金属还原菌还原赤铁矿的影响
在厌氧条件下,反应温度为30 ℃,用盐酸溶液和氢氧化钠溶液调节培养基pH分别为 3.0,5.0,7.0和9.0,赤铁矿中Fe(Ⅱ)浓度随时间的变化如图4所示。
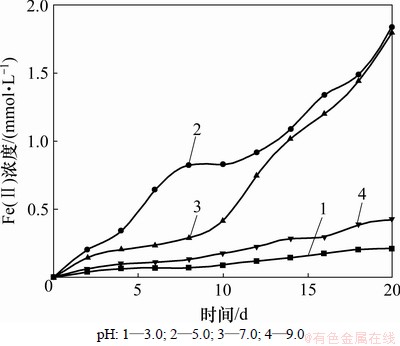
图4 不同pH下Fe(Ⅱ)浓度的变化
Fig.4 Concentration of Fe(Ⅱ) at different pH
由图4可知:在反应过程中,pH控制在5.0和7.0时,赤铁矿中Fe(Ⅱ)浓度较高,且pH为5.0时Fe(Ⅱ)浓度为1.83 mmol/L,略高于pH为7.0时的1.8 mmol/L;而pH为3.0和9.0时,Fe(Ⅱ)浓度较低。可见,当达到异化金属还原菌生长的酸性环境时,菌体活性增加,由生长停滞期可迅速达到对数生长期,并且酸性环境有利于赤铁矿中Fe(Ⅲ)的溶出,增加了微生物与Fe(Ⅲ)的接触,增大了Fe(Ⅲ)的还原量,从而使Fe(Ⅱ)浓度增加;当pH低于一定值时,虽然同样能够溶解赤铁矿中的Fe2O3,加速Fe(Ⅲ)的浸出,但菌体活性降低不利于Fe(Ⅲ)的还原,这与文献[13]报道一致;碱性条件下不仅不利于菌体的生长,而且不利于赤铁矿中Fe(Ⅲ)的浸出,从而抑制了反应的进行。可见实验过程中pH控制在5.0最佳。
2.5 温度对异化金属还原菌还原赤铁矿的影响
在厌氧条件下,pH为5.0,反应温度分别控制在25,30,35和40 ℃,赤铁矿中Fe(Ⅱ)浓度随时间的变化情况如图5所示。
由图5可知:该微生物在反应温度为25~40 ℃的范围内均可以有效地还原赤铁矿中的Fe(Ⅲ),在温度为30 ℃和35 ℃时Fe(Ⅱ)浓度较高,且30 ℃时最高,Fe(Ⅱ)浓度可达1.87 mmol/L。随着培养温度的升高,微生物生长的适应期缩短,生长加速,厌氧时分解有机物的速度也加快,可以在较短时间内达到其生长的稳定期。因菌种分离自厌氧活性污泥,且中温厌氧消化的反应温度范围为30 ℃到38 ℃,所以,菌种在此温度范围内活性最高,还原能力最强,反应速率最快,过高或过低的温度,都会使菌体的活性下降,从而导致Fe(Ⅲ)的还原速率降低。因此,最佳反应温度取30 ℃。
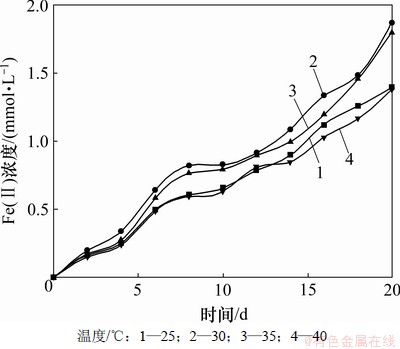
图5 不同温度下Fe(Ⅱ)浓度的变化
Fig.5 Concentration of Fe(Ⅱ) under different temperatures
2.6 反应机理初探
异化金属还原菌还原赤铁矿的过程中,可溶的Fe(Ⅱ)浓度随时间的变化情况如图6所示。
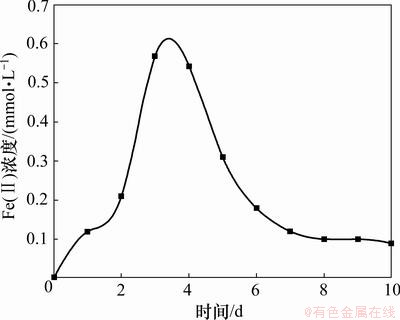
图6 Fe(Ⅱ)浓度的变化
Fig.6 Concentration of Fe(Ⅱ)
由图6可知:反应初期,即前3 d培养基中Fe(Ⅱ)浓度随时间的增长而呈上升趋势,表明异化金属还原菌已经开始将Fe(Ⅲ)还原为Fe(Ⅱ),而Fe(Ⅱ)浓度在3~4 d时达到峰值又逐渐下降。这是因为溶液中Fe(Ⅱ)开始在赤铁矿颗粒表面沉积并与其结合,反应生成不能继续被还原的磁铁矿,反应式为
 →
→ (4)
(4)
随着反应的进行,越来越多的磁铁矿包围在赤铁矿颗粒表面,阻止了细菌接触并还原赤铁矿,微生物可接触的反应面积逐渐减小,速率逐渐下降,而且赤铁矿反应不完全,到细菌生长周期后期,赤铁矿颗粒表面几乎完全被磁铁矿包围(见图2(b))。这就是异化还原菌还原赤铁矿反应不完全的原因,也是反应速率慢的主要原因,这个结论与文献[14]中报道一致。反应生成的棕黑色颗粒的主要成分为Fe3O4与Fe2O3的混合物。
反应中起主导作用的是吸附生长在矿物颗粒表面的微生物,这些细胞通过自身分泌的多糖类高分子物质互相连接,形成致密的生物膜[15],从而加速反应的进行。实验中可观察到大多数细菌吸附在赤铁矿的表面并与其紧密接触,此为微生物酶侵蚀出赤铁矿中Fe(Ⅲ),并将Fe(Ⅲ)还原为Fe(Ⅱ)的前提条件。实验结果表明:在未接菌种的状态下,即使有机物醋酸钠和赤铁矿同时存在,赤铁矿还是不能被还原;而在有菌种时,微生物对赤铁矿矿物表面的侵蚀作用是很明显的,在反应过程中,菌种边吸附在矿物表面上生长、繁殖,边对矿物进行侵蚀,使其溶解产生Fe(Ⅲ),为下一步的氧化还原反应提供条件。因此,异化金属还原菌还原赤铁矿的过程可以分为一次过程和二次过程:前者为微生物生长并吸附在矿物表面,导致矿物表面发生氧化还原反应并溶解出Fe(Ⅲ)的过程,后者则主要是在溶液本体中微生物将Fe(Ⅲ)还原为Fe(Ⅱ)的过程。这与Bonneville等[16]的研究一致。
赤铁矿中Fe2O3的生物还原是厌氧条件下异化金属还原菌呼吸作用的一种形式,通过一系列反应完成能量的转化,即二磷酸腺苷(ADP)向三磷酸腺苷(ATP)的转化。厌氧和好氧对比实验结果表明:在好氧条件下,微生物对Fe(Ⅲ)的还原效果较差,进一步证实Fe(Ⅲ)作为电子受体参与了微生物的氧化还原反应。体系中的溶解氧从2方面影响Fe(Ⅲ)的还原效果,反应初期体系中Fe(Ⅲ)与溶解氧并存,二者竞争有机物分解产生的还原力,反应后期Fe(Ⅲ)部分被还原并以Fe(Ⅱ)状态存在,溶解氧会将已还原生成的Fe(Ⅱ)氧化。
微生物还原过程使赤铁矿的结构发生变化,从反应初期很细的粉末状逐渐形成较大的固体颗粒状物质,矿物表面的比表面积减小,提高了表面电子交换的能力[17],同时加速了反应的进行。生成的颗粒状物质与之前的粉末状相比更容易利用磁选机进行分离,降低了磁选的难度。
3 结论
(1) 利用实验室自制的Fe(OH)3从厌氧活性污泥中分离出异化金属还原菌,棕红色Fe(OH)3颗粒慢慢被还原生成黑色Fe3O4颗粒。再以赤铁矿颗粒代替Fe(OH)3作为电子受体,对分离出的菌种进行驯化,随着反应的进行,颗粒的颜色由红色逐渐变深至棕黑色并具有磁性,矿物中的Fe(Ⅲ)被还原成Fe(Ⅱ),表明异化金属还原菌已可有效地还原赤铁矿中的Fe2O3,但反应不完全。
(2) 在异化金属还原菌还原赤铁矿的过程中,厌氧条件优于好氧条件,且最佳反应条件如下:温度为30 ℃,振荡速度为160 r/min,接种量为10%,pH为5.0,赤铁矿加入量为1.0 g/L。经过20 d的反应,Fe(Ⅱ)的浓度可达到1.87 mmol/L,赤铁矿中部分Fe(Ⅲ)还原为Fe(Ⅱ),在矿物颗粒表面沉积并与其结合反应生成磁铁矿(Fe3O4),增强了原矿的磁性。
参考文献:
[1] 任亚峰, 余永富. 难选红铁矿磁化焙烧技术现状及发展方向[J]. 金属矿山, 2005, 353(11): 20-23.
REN Yafeng, YU Yongfu. Present status and development orientation of magnetization roasting technology for refractory red iron ores[J]. Metal Mine, 2005, 353(11): 20-23.
[2] 张汉泉, 汪凤玲, 李浩. 鲕状赤铁矿磁化焙烧—磁选—反浮选降磷试验[J]. 武汉工程大学学报, 2011, 33(3): 29-32.
ZHANG Hanquan, WANG Fengling, LI Hao. Study on magnetic roasting—magnetic separation—inverse flotation for phosphorus reduction of oolitic hematite[J]. Journal of Wuhan Institute of Technology, 2011, 33(3): 29-32.
[3] 王成行, 童雄, 孙吉鹏. 某鲕状赤铁矿磁化焙烧—磁选试验研究[J]. 金属矿山, 2009, 395(5): 57-59.
WANG Chenghang, TONG Xiong, SUN Jipeng. Research on the magnetizing roasting and magnetic separation of an oolitic hematite ore[J]. Metal Mine, 2009, 395(5): 57-59.
[4] 李育彪, 龚文琪, 辛桢凯, 等. 鄂西某高磷鲕状赤铁矿磁化焙烧及浸出除磷试验[J]. 金属矿山, 2010, 407(5): 64-67.
LI Yubiao, GONG Wenqi, XIN Zhenkai, et al. Research on magnetic roasting and leaching dephosphorization of high-phosphorus oolitie hematite in western hubei[J]. Metal Mine, 2010, 407(5): 64-67.
[5] 李玉祥, 孙毅, 杨康, 等. 模拟流化床气基直接还原赤铁矿粉的试验研究[J]. 金属矿山, 2012, 427(1): 77-79, 135.
LI Yuxiang, SUN Yi, YANG Kang, et al. Experimental study on simulating fluidized bed gas-based direct reduction of hematite powder[J]. Metal Mine, 2012, 427(1): 77-79, 135.
[6] 伍喜庆, 段云峰, 许鹏飞, 等. 赤铁矿表面磁化研究[J]. 矿冶工程, 2011, 31(6): 39-42, 50.
WU Xiqing, DUAN Yunfeng, XU Pengyun, et al. Surface magnetization of hematite in pulp[J]. Mining and Metallurgical Engineering, 2011, 31(6): 39-42, 50.
[7] LI Haoran, FENG Yali, ZOU Xiaoyan. Study on microbial reduction of vanadium metallurgical waste water[J]. Hydrometallurgy, 2009, 99(1/2): 13-17.
[8] LI Haoran, FENG Yali, TANG Xinhua, et al. The factors affecting biofilm formation in the mediatorless microbial fuel cell[J]. Chemical and Biochemical Engineering Quarterly, 2010, 24 (3): 341-346.
[9] Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) Reduction[J]. Advances in Microbial Physiology, 2004, 49: 219-286.
[10] Schnell S, Ratering S, Jansen K H. Simultaneous determination of iron(Ⅲ), iron(Ⅱ) and manganese(Ⅱ) in environmental samples by ion chromatography[J]. Environmental Science & Technology, 1998, 32(10): 1530-1537.
[11] Finneran K T, Johnsen C V, Lovley D R. Rhodoferax ferrireducens sp. nov., a psychrotolerant, facultatively anaerobic bacterium that oxidizes acetate with the reduction of Fe(Ⅲ)[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(3): 669-673.
[12] 贺江舟, 曲东, 张莉利. Fe(Ⅲ)的微生物异化还原[J]. 微生物学通报, 2006, 33(5): 158-164.
HE Jiangzhou, QU Dong, ZHANG Lili. Dissimilatory Fe(Ⅲ) Reduction by Microorganisms[J]. Microbiology, 2006, 33(5): 158-164.
[13] 何秋香, 郭敏荣, 林玉满, 等. 异化铁还原菌去除高岭土中Fe(Ⅲ))的特性研究[J]. 非金属矿, 2009, 32(6): 3-5.
HE Qiuxiang, GUO Minrong, LIN Yuman, et al. Fe(Ⅲ)) removal characteristics of dissimilatory iron reducing bacteria from Kaolin[J]. Non-Metallic Mines, 2009, 32(6): 3-5.
[14] 冯雅丽, 李浩然, 连静, 等. 利用微生物电池研究微生物在矿物表面电子传递过程[J]. 北京科技大学学报, 2006, 28(11): 1009-1013.
FENG Yali, LI Haoran, LIAN Jing, et al. Study on the electron transport process of microbe on the mineral surface using the microbe fuel cell[J]. Journal of University of Science and Technology Beijing, 2006, 28(11): 1009-1013.
[15] 李浩然, 冯雅丽, 周良, 等. 微生物异化还原金属氧化物的机理及应用[J]. 中国矿业大学学报, 2007, 36(5): 680-683.
LI Haoran, FENG Yali, ZHOU Liang, et al. Mechanism and application of microbial dissimilatory reduction metal oxide[J]. Journal of China University of Mining & Technology, 2007, 36(5): 680-683.
[16] Bonneville S, Behrends T, van Cappellen P, et al. Reduction of Fe(Ⅲ) colloids by Shewanella putrefaciens: A kinetic model[J]. Geochimica et Cosmochimica Acta, 2006, 70(23): 5842-5854.
[17] Kostka J E, WU Jun, Nealson K H, et al. The impact of structural Fe(Ⅲ) reduction by bacteria on the surface chemistry of smectite clay minerals[J]. Geochimica et Cosmochimica Acta, 1999, 63(22): 3705-3713.
(编辑 何运斌)
收稿日期:2011-04-08;修回日期:2012-07-10
基金项目:国家自然科学基金资助项目(21176242;21176026);国家“十二五”支撑项目(2012BAB14B05,2012BAB07B05);国家高技术研究发展计划(“863”计划)项目(2012AA062401);“十二五”国家长远发展专项(DY125-15-T-08)
通信作者:李浩然(1968-),男,甘肃合水人,博士,从事矿物生化工程研究;电话:010-82627063;E-mail: hrli@home.ipe.ac.cn
摘要:以实验室自制氢氧化铁为电子受体,醋酸钠为电子供体,从厌氧活性污泥中分离得到异化金属还原菌。将赤铁矿代替氢氧化铁作为电子受体对微生物进行驯化。通过单因素实验考察好氧、厌氧条件及pH、温度对反应过程的影响,并对反应机理进行研究。研究结果表明:赤铁矿颗粒逐渐由红色变深至棕黑色并具有磁性,分析表明异化金属还原菌可将赤铁矿中的Fe(Ⅲ)还原成Fe(Ⅱ),但反应不完全。反应生成的棕黑色颗粒物质主要成分为Fe3O4与Fe2O3的混合物;厌氧条件优于好氧条件,在温度为30 ℃,振荡速度为160 r/min,接种量为10%,pH为5.0,赤铁矿加入量为1.0 g/L的条件下,20 d后,Fe(Ⅱ)的浓度可达1.87 mmol/L,赤铁矿中的部分Fe(Ⅲ)还原为Fe(Ⅱ),在矿物颗粒表面沉积并与其结合反应生成磁铁矿(Fe3O4),增强了原矿的磁性。
[1] 任亚峰, 余永富. 难选红铁矿磁化焙烧技术现状及发展方向[J]. 金属矿山, 2005, 353(11): 20-23.
[2] 张汉泉, 汪凤玲, 李浩. 鲕状赤铁矿磁化焙烧—磁选—反浮选降磷试验[J]. 武汉工程大学学报, 2011, 33(3): 29-32.
[3] 王成行, 童雄, 孙吉鹏. 某鲕状赤铁矿磁化焙烧—磁选试验研究[J]. 金属矿山, 2009, 395(5): 57-59.
[4] 李育彪, 龚文琪, 辛桢凯, 等. 鄂西某高磷鲕状赤铁矿磁化焙烧及浸出除磷试验[J]. 金属矿山, 2010, 407(5): 64-67.
[5] 李玉祥, 孙毅, 杨康, 等. 模拟流化床气基直接还原赤铁矿粉的试验研究[J]. 金属矿山, 2012, 427(1): 77-79, 135.
[6] 伍喜庆, 段云峰, 许鹏飞, 等. 赤铁矿表面磁化研究[J]. 矿冶工程, 2011, 31(6): 39-42, 50.
[12] 贺江舟, 曲东, 张莉利. Fe(Ⅲ)的微生物异化还原[J]. 微生物学通报, 2006, 33(5): 158-164.
[13] 何秋香, 郭敏荣, 林玉满, 等. 异化铁还原菌去除高岭土中Fe(Ⅲ))的特性研究[J]. 非金属矿, 2009, 32(6): 3-5.
[14] 冯雅丽, 李浩然, 连静, 等. 利用微生物电池研究微生物在矿物表面电子传递过程[J]. 北京科技大学学报, 2006, 28(11): 1009-1013.
[15] 李浩然, 冯雅丽, 周良, 等. 微生物异化还原金属氧化物的机理及应用[J]. 中国矿业大学学报, 2007, 36(5): 680-683.


