文章编号:1004-0609(2012)04-1223-06
添加剂四氟硼酸四乙基铵对石墨负极界面性能的影响
李艳红,卢 海,赵中伟,郝 新,张治安
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
采用恒流充放电、循环伏安(CV)和交流阻抗(EIS)测试方法研究四氟硼酸四乙基铵(Et4NBF4)作为锂离子电池电解液添加剂对石墨负极材料界面性质的影响,通过傅里叶变换红外光谱(FTIR)对固体电解质界面膜(SEI)的成分变化进行分析。结果表明:添加剂Et4NBF4参与了SEI膜的形成,提高了人造石墨(AG)/Li半电池充电容量和后续的循环效率,但是降低了首次充放电效率;首次放电过程中1.0~0.5 V是SEI膜形成和生长的电位区间,而0.5 V以下SEI膜进行不断的修复;添加少量Et4NBF4降低了SEI膜阻抗,提高了电解液与石墨负极的相容性。
关键词:
锂离子电池;电解液;添加剂;四氟硼酸四乙基铵;固体电解质相界面膜;
中图分类号:TM912.9 文献标志码:A
Effect of Et4NBF4 as additive on interface performance of graphite electrode
LI Yan-hong, LU Hai, ZHAO Zhong-wei, HAO Xin, ZHANG Zhi-an
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The effect of tetraethylammonium tetrafluoroborate (Et4NBF4) on the graphite interface performance of lithium ion battery in carbonate-based electrolytes was studied by constant current charge-discharge test, cyclic voltammetry (CV), electrochemical impedance spectroscopy (EIS), as well as the Fourier transform infra-red (FTIR) spectroscopy. The results indicate that the charge capacity and following cycle efficiency are improved while the initial charge-discharge efficiency is reduced by adding Et4NBF4 because Et4NBF4 participates in forming SEI film. SEI film forms in the potential range of 1.0-0.5 V during the initial discharge, and repairs below 0.5 V. The impedance of SEI film is reduced by adding Et4NBF4. Et4NBF4 additive can effectively improve the compatibility between electrolyte and graphite anode.
Key words: lithium ion battery; electrolyte; additive; tetraethylammonium tetrafluoroborate; solid electrolyte interface film
锂离子电池以其工作电压高、能量密度大、对环境污染小等优点,成为目前新能源领域的研究热点。随着移动终端电子产品混合动力电动车的高速发展,提高锂离子电池的循环性能、高低温性能及安全性能倍受人们的关注[1]。电池的这些性能与电解液组成及其与电极材料的相容性有着密切的关系,因为在锂离子电池首次充放电过程中,电极材料与电解液在固液相界面上发生反应,形成一层固体电解质界面膜(Solid electrolyte interface,SEI)。SEI膜的质量直接影响着锂离子电池的循环效率和可逆容量等性能[2-3]。目前,改善SEI膜质量的有效方法之一就是向有机电解液中添加少量的某些物质,能够在碳负极上优先还原、分解形成性能优良的SEI膜,从而改善负极的性能,这些微量物质被称为成膜添加剂(Film formation additives)[4-6]。
四氟硼酸四乙基铵(Et4NBF4)是活性炭双电层电容器常用的一种电解质盐[7],本文作者在前期研究工作中发现,Et4NBF4能够明显提高碳酸丙烯酯(PC)基电解液的首次充放电效率,通过循环伏安和红外光谱分析发现是由于Et4NBF4参与了SEI膜的形成,从而改善了SEI膜的质量,进而改善了石墨/Li半电池的电化学性能[8]。在此基础上,本文作者采用恒流充放电、循环伏安(CV)、电化学阻抗谱(EIS)、红外光谱(FTIR)等方法研究了成膜添加剂Et4NBF4对人造石墨(AG)电极在1.0 mol/L LiPF6/EC-DMC-EMC (1:1:1,质量比)电解液中界面性质的影响。
1 实验
1.1 电解液的配制
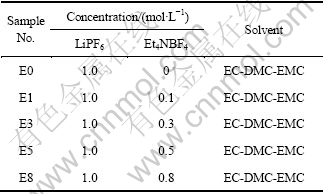
首先将碳酸乙烯酯(EC)、碳酸二甲酯(DMC)和碳酸甲乙酯(EMC)按质量比1:1:1混合成溶剂体系,然后分别溶解不同的电解质盐,配制成表1所列的5种电解液。
表1 电解液成分
Table 1 Compositions of electrolytes
1.2 电池组装及测试
实验用5组电解液如1.1节所述,采用2025型号扣式电池,正极由人造石墨试样与PVDF和导电炭黑按8:1:1的比例(干质量)混合后经热压而成,负极材料为直径为1.5 cm的薄膜锂片(上海中能锂业生产),隔膜为聚丙烯微孔膜。在充满高纯Ar的手套箱内装配好AG/Li半电池,取出后用蓝电(LAND)系列电池测试系统进行恒电流充放电测试,电池以0.1C的倍率充放电,电压范围为0. 01~2. 00 V。
循环伏安测试选用E0、E1、E3 3种电解液的AG/Li电池,在0. 01~2. 00 V 的电位范围内进行扫描,第一圈采用1 mV/s的速度,第二圈采用2 mV/s的速度,第三圈采用5 mV/s的速度,在本实验中,电位值均相对于Li/Li+。首次阴极极化的EIS测试选用E0、E1两种电解液,分别测试首次放电过程中不同截止电压下的EIS图,选取的电压为开路电压(OCP)、1.0、0.8、0.5、0.3、0.1和0.01 V。频率范围为10 mHz~100 kHz,微扰电压为5 mV。EIS结果用ZSimpWin进行等效电路的模拟和分析。CV和EIS测试在PAR2273电化学工作站(美国公司生产)上完成。FTIR测试同样选用E0和E1两种电解液,将在这两种电解液中循环3次的石墨/Li半电池拆开,取出石墨极片后用DMC清洗3次并烘干,刮下极片上的负极粉末,用北京第二光学仪器厂生产的WQF2410 傅里叶变换红外光谱仪测定SEI 膜的成分和含量。
2 结果与讨论
图1所示为石墨试样在5种电解液中的首次充放电曲线,表2所列为石墨试样在5种电解液中的前3次恒流充放电容量和效率值。其中,锂离子嵌入石墨层视为放电过程,而锂离子从石墨层中脱出视为充电过程。
从图1和表2可以看出,随着添加Et4NBF4浓度增加电池的首次充电容量增大,当Et4NBF4浓度为0.5 mo/L时达到最大值,为308 mA·h/g,首次充放电效率随着Et4NBF4浓度的增加先减小后增大,添加0.1 mol/L Et4NBF4时效率最低,仅为63.3%,首次容量的损失主要是由于SEI膜的形成引起的[9],E0电解液在复合少量Et4NBF4后,Et4NBF4一方面可能参与成膜过程,另一方面形成的SEI膜也消耗了大量的锂源,导致首次效率大大降低,而继续添加Et4NBF4时,其自身分解产物代替了部分成膜所需要的锂源,效率升高。从表2可以看出,在第二、三次循环中AG/Li电池在添加不同浓度Et4NBF4的电解液中首次充放电容量和效率都有所上升,这表明复合盐电解液与石墨负极的相容性较好,其中E3电解液具有较高的容量和循环效率,所以在后续的研究中Et4NBF4的浓度不高于0.3 mol/L。
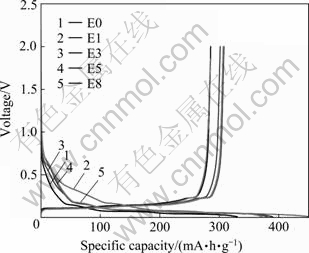
图1 在不同电解液中AG/Li电池的首次充放电曲线
Fig. 1 Initial charge-discharge curves of AG/Li half cells in different electrolytes
表2 在不同电解液中AG/Li电池的充放电数据
Table 2 Charge-discharge data of AG/Li half cells in different electrolytes
图2所示为AG/Li半电池在不同电解液中的前3次循环伏安曲线图。其中:图2(a)、(b)和(c)分别为在E0、E1和E3电解液中的循环伏安曲线,图2(d)所示为3种电解液在1 mV/s扫描速度下的循环伏安对比图。
从图2可以看出,E1和E3电解液在首次负向扫描过程中出现两个还原电流峰,在0.5 V左右出现的小峰是SEI膜形成的电流峰,可能是由于Et4NBF4参与了SEI膜的形成,使得0.5 V附近的峰更加明显,而在E0电解液中,0.5 V处SEI膜形成的峰不明显;在0 V附近的尖峰是与锂离子的嵌入过程相关的峰。此外还可以观察到,除第一周电位循环扫描过程外,几种电解液中锂离子在石墨负极中的嵌脱过程表现出很好的可逆性。对比3体系的锂离子脱嵌的氧化还原峰强度和面积,添加Et4NBF4的电解液较未添加Et4NBF4 的电解液E0与石墨材料有着更好的相容性,特别是E3电解液氧化还原峰较强,而且氧化峰和还原峰的面积相差较小,说明其首次充放电容量和效率较E0和E1高,这与恒流充放电结果一致。
图3所示为AG负极首次阴极极化过程中开路电压(OCP)、1.0、0.8、0.5、0.3、0.1和0.01 V下分别在E0和E1电解液中的交流阻抗曲线。
由图3可以看出,石墨负极的Nyquist图由一个半圆和一条斜线或者两个半圆和一条斜线组成,这种形式的EIS可以用图4所示的电路模拟[10-12]。其中:Rb为电解液、隔膜和石墨电极之间的接触阻抗;Rsei和Csei分别为SEI膜的阻抗和双电层电容,对应于高频区的半圆;Rct和Cdl分别为电荷传递阻抗和相应的双电层电容,对应于中频区域的半圆;RW为Warburg阻抗,与锂离子在电极/电解液界面间扩散有关,对应于低频区的斜线。Rb和Rsei属于欧姆阻抗,而Rct和RW属于法拉第阻抗,与界面电化学过程有关,特别是Rct与电极上电化学反应动力学更相关。在没有发生电极反应的电位区间内,Rct太大以至于不能在100 kHz~10 mHz的频率范围显示出,这种情况下,EIS谱只有一个半圆和接着的一条斜线。
图5所示为石墨负极在E0和E1体系电解液中首次阴极极化过程中的模拟阻抗曲线。
结合图3和5可以看出,接触阻抗Rb在SEI膜形成过程中变化很小,说明电解液分解和锂离子的嵌入石墨层对接触阻抗影响不大;如前所述,在没有锂离子嵌入的电位范围内电荷传递阻抗Rct很大,特别是电解液E0模拟出的阻抗值高达107,当锂离子开始嵌入石墨层,SEI膜开始形成时,Rct不断减小,这是由于电极与电解液界面上发生电化学反应,对应的电荷传递法拉第阻抗降低;观察SEI膜阻抗Rsei随首次阴极极化电位变化可以发现,在3.0~1.0 V区间,Rsei变化不大,说明在此区间内SEI膜还尚未开始形成,随着电位进一步降低,SEI膜阻抗先增大后降低,1.0~0.5 V是SEI膜的主要形成阶段,所以随着钝化膜的增厚,Rsei阻抗不断增加,而当电位进一步降低时,SEI膜基本形成,这时的Rsei与形成的钝化膜质量密切相关,石墨负极在电解液E1中形成的SEI膜阻抗明显低于在电解液E0中的阻抗,说明Et4NBF4的添加对形成优良的SEI膜起到了促进作用。
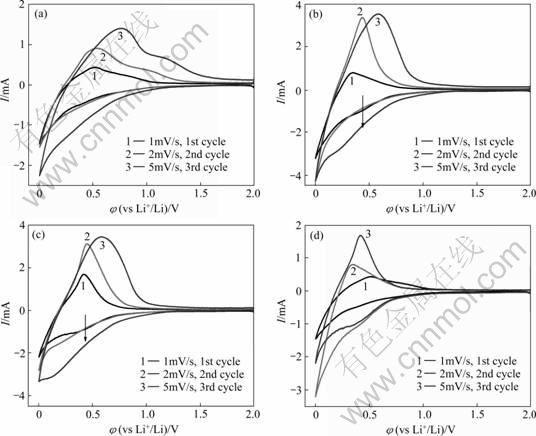
图2 AG/Li电池在不同电解液及不同扫描速度下的循环伏安曲线
Fig. 2 Cyclic voltammograms of AG/Li cells in different electrolytes and at scanning rates: (a) E0 electrolytes; (b) E1 electrolytes; (c) E3 electrolytes; (d) In three electrolytes at scanning rate of 1 mV/s
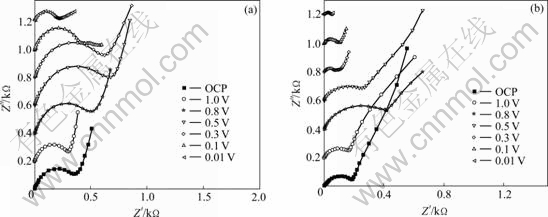
图3 首次阴极极化过程不同电位下石墨负极在电解液E0和E1中的EIS图
Fig. 3 EIS of graphite electrode in E0(a) and E1(b) electrolytes at various potentials recorded during first lithiation process
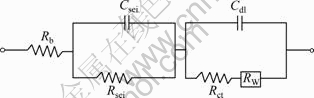
图4 用于分析EIS图的等效电路
Fig. 4 Equivalent circuit used for analysis of EIS
图6所示为AG/Li半电池在未添加Et4NBF4的电解液E0和添加0.1 mol/L Et4NBF4的电解液E1中循环3次后负极片活性物质的红外光谱。
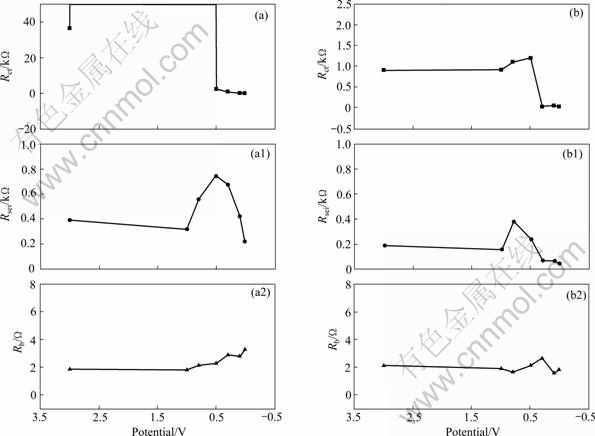
图5 石墨负极在电解液E0和E1中首次阴极极化过程的模拟阻抗
Fig. 5 Simulated impedance of graphite electrodes in E0((a), (a1), (a2)) and E1((b), (b1), (b2)) electrolytes recorded during first lithiation process
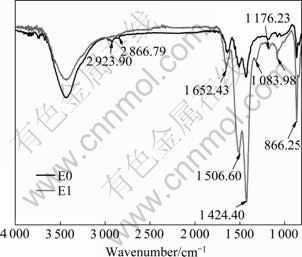
图6 石墨负极在不同电解液中循环3次后的红外光谱图
Fig. 6 FTIR specta of artificial graphite after three cycles in different electrolytes
从图6可以看出:两种试样的红外光谱特征峰位置基本相同,只是E1电解液的峰强度明显高于未添加Et4NBF4的E0电解液的峰强度,两种样品的检测 条件相同,红外光谱的峰强度在相同测试条件下一定程度上说明了特征峰所代表官能团的含量,也就是说石墨负极在E1电解液中形成的SEI膜组成含量较高,使得SEI膜稳定性更好,这和前面电化学性能测试一致。在E1电解液的石墨负极红外光谱上明显观察到 2 866~2 923 cm-1 (υ(CH)), 1 652(γas(C=O)), 1 049 (γ(C=O))和857 cm-1(δ(OCOO-))处的烷基碳酸锂(RCH2OCO2Li)和羟基氧锂(ROLi)特征峰,在1 506、 1 424和866 cm-1左右是Li2CO3的典型特征峰[13-15];如上所述,SEI膜的主要成分是ROCO2Li、Li2CO3和ROLi等,这与EC基电解液在石墨负极形成的SEI膜主要成分相似[16]。E1电解液在1 300 cm-1处的峰可能是由Et4NBF4分解产生的。总体来说,红外光谱测试说明了石墨负极上SEI膜主要成分是在充放电过程中电解液的分解产物,添加的Et4NBF4参与了石墨负极SEI膜的形成,E1电解液形成的SEI膜更为稳定。
3 结论
1) 向有机电解液中添加少量的Et4NBF4提高了石墨/Li半电池的充电容量和后续的循环效率,改善了电解液与石墨负极的相容性。
2) 石墨负极表面SEI膜主要是在首次放电过程中1.0~0.5 V区间形成,SEI膜的主要成分是ROCO2Li、Li2CO3和ROLi等,Et4NBF4参与了SEI膜的形成,并且Et4NBF4参与形成的SEI膜阻抗更低,稳定性更好。
REFERENCES
[1] WANG F M, CHENG H M, WU H C, CHU H C, CHU S Y, CHENG C S, YANG C R. Novel SEI formation of maleimide- based additives and its improvement of capability and cyclicability in lithium ion batteries[J]. Electrochim Acta, 2009, 54(12): 3344-3351.
[2] EDSTR?M K, HERSTEDT M, ABRAHAM D P. A new look at the solid electrolyte interphase on graphite anodes in Li-ion batteries[J]. J Power Sources, 2006, 153(2): 380-384.
[3] 秦银平, 庄全超, 史月丽, 江 利, 孙 智, 孙世刚. 锂离子电池电极界面特性研究方法[J]. 化学进展, 2011, 23(2/3): 390-400.
QIN Yin-ping, ZHUANG Quan-chao, SHI Yue-li, JIANG Li, SUN Zhi, SUN Shi-gang. Methods on investigating properties of electrode/electrolyte interfaces in lithium-ion batteries[J]. Progress in Chemistry, 2011, 23(2/3): 390-400.
[4] 姚万浩, 李 劼, 张忠如, 高 军, 王周成, 杨 勇. 锂离子电池电解液成膜添加剂乙烯基亚硫酸乙烯酯的电化学行为[J]. 化学学报, 2009, 67(22): 2531-2535.
YAO Wan-hao, LI Jie, ZHANG Zhong-ru, GAO Jun, WANG Zhou-cheng, YANG Yong. Electrochemical behavior of vinyl ethylene sulfite as an electrolyte film-forming additive in lithium ion batteries[J]. Acta Chimica Sinica, 2009, 67(22): 2531-2535.
[5] AURBACH D, GNANARAJ J S, GEISSLER W, SCHMIDT M. Vinylene carbonate and Li salicylatoborate as additives in LiPF3(CF2CF3)3 solutions for rechargeable Li-ion batteries[J]. J Electrochem Soc, 2004, 151(1): A23-A30.
[6] ABE K, YOSHITAKE H, KITAKURA T, HATTORI T, WANG H, YOSHIO M. Additives-containing functional electrolytes for suppressing electrolyte decomposition in lithium-ion batteries[J]. Electrochim Acta, 2004, 49(26): 4613-4622.
[7] 孙晓峰, 王新宇, 赖延清, 张治安, 夏 阳. 化学活化和化 学-物理联合活化制备石油焦基活性炭[J]. 中南大学学报: 自然科学版, 2010, 41: 50-54.
SUN Xiao-feng, WANG Xin-yu, LAI Yan-qing, ZHANG Zhi-an, XIA Yang. Petroleum coke based activated carbon prepared from chemical activation and chemical-physical activation[J]. Journal of Central South University: Science and Technology, 2010, 41: 50-54.
[8] 李凡群, 赖延清, 张治安, 高宏权, 杨 娟. 石墨负极在Et4NBF4+LiPF6/EC+PC+DMC电解液中的电化学行为[J]. 物理化学学报, 2008, 24(7): 1302-1306.
LI Fan-qun, LAI Yan-qing, ZHANG Zhi-an, GAO Hong-quan, YANG Juan. Electrochemical behaviors of Et4NBF4+LiPF6/ EC+PC+DMC electrolyte on graphite electrode[J]. Acta Phys-Chim Sin, 2008, 24(7): 1302-1306.
[9] BESENHARD J O, WINTER M, YANG J, BIBERACHER W. Filming mechanism of lithium-carbon anodes in organic and inorganic electrolytes[J]. J Power Sources, 1995, 54(2): 228-231.
[10] LEVI M D, AURBACH D. Simultaneous measurements and modeling of the electrochemical impedance and the cyclic voltammetric characteristics of graphite electrodes doped with lithium[J]. J Phys Chem B, 1997, 101(23): 4630-4640.
[11] UMEDA M, DOKKO K, FUJITA Y, MOHAMEDI M, UCHIDA I, SELMAN J R. Electrochemical impedance study of Li-ion insertion into mesocarbon microbead single particle electrode (Part Ⅰ). Graphitized carbon[J]. Electrochim Acta, 2001, 47(6): 885-890.
[12] ZHANG S S. Electrochemical study of the formation of a solid electrolyte interface on graphite in a LiBC2O4F2-based electrolyte[J]. J Power Sources, 2007, 163(2): 713-718.
[13] AURBACH D, GAMOLSKY K, MARKOVSKY B, GOFER Y, SCHMIDT M, HEIDER U. On the use of vinylene carbonate (VC) as an additive to electrolyte solutions for Li-ion batteries[J]. Electrochim Acta, 2002, 47(9): 1423-1439.
[14] HU Y, KONG W, LI H, HUANG X, CHEN L. Experimental and theoretical studies on reduction mechanism of vinyl ethylene carbonate on graphite anode for lithium ion batteries[J]. Electrochem Commun, 2004, 6(2): 126-131.
[15] WANG B, ZHANG H P, YANG L C, QU Q T, WU Y P, GAN C L, ZHOU D L. Improving electrochemical performance of graphitic carbon in PC-based electrolytes by using N-vinyl-2-pyrrolidone as an additive[J]. Electrochem Commun, 2008, 10(10): 1571-1574.
[16] AURBACH D, ZINIGRAD E, COHEN Y, TELLER H. A short review of failure mechanisms of lithium metal and lithiated graphite anodes in liquid electrolyte solutions[J]. Solid State Ionics, 2002, 148(3/4): 405-416.
(编辑 龙怀中)
基金项目:“十一五”国家科技支撑计划资助项目(2007BAE12B01);国家自然科学基金资助项目(50974136);中央高校基本科研经费资助项目(2010QZZD0101)
收稿日期:2011-05-13;修订日期:2011-09-26
通信作者:张治安,副教授,博士;电话:0731-88830649;E-mail: zza75@163.com
摘 要:采用恒流充放电、循环伏安(CV)和交流阻抗(EIS)测试方法研究四氟硼酸四乙基铵(Et4NBF4)作为锂离子电池电解液添加剂对石墨负极材料界面性质的影响,通过傅里叶变换红外光谱(FTIR)对固体电解质界面膜(SEI)的成分变化进行分析。结果表明:添加剂Et4NBF4参与了SEI膜的形成,提高了人造石墨(AG)/Li半电池充电容量和后续的循环效率,但是降低了首次充放电效率;首次放电过程中1.0~0.5 V是SEI膜形成和生长的电位区间,而0.5 V以下SEI膜进行不断的修复;添加少量Et4NBF4降低了SEI膜阻抗,提高了电解液与石墨负极的相容性。


