文章编号: 1004-0609(2006)05-0909-05
Ce0.8Y0.2O1.9固体电解质的低温燃烧合成及性能
徐红梅, 严红革, 陈振华
(湖南大学 材料科学与工程学院, 长沙 410082)
摘 要:
利用柠檬酸做还原剂, 硝酸盐做氧化剂, 采用低温燃烧合成工艺制备纳米尺寸的Ce0.8Y0.2O1.9电解质粉体, 用XRD、 IR、 TEM和SEM研究产物的微观结构和烧结性能。 XRD、 TEM和IR光谱研究表明利用低温燃烧合成工艺直接获得了单一的纳米Ce0.8Y0.2O1.9固溶体, SEM分析表明电解质粉体具有很好的烧结活性。 利用交流阻抗谱在400~800℃温度范围内测量了电解质的电化学性能, 结果表明, 800℃时氧离子电导率为0.058S/cm, 活化能为0.73eV。 采用低温燃烧合成工艺有利于降低电解质的烧结温度, 改善电解质的性能。
关键词: Ce0.8Y0.2O1.9; 低温燃烧; 固体电解质; 氧离子电导率 中图分类号: TQ133; TM911.4
文献标识码: A
Low-temperature synthesis and properties of Ce0.8Y0.2O1.9 solid electrolyte
XU Hong-mei, YAN Hong-ge, CHEN Zhen-hua
(College of Materials Science and Engineering, Hunan University, Changsha 410082, China)
Abstract: Nanosized Ce0.8Y0.2O1.9 electrolyte powders were prepared by low-temperature combustion technique using citric acid as reductant and nitrates as oxidant. XRD, IR, TEM and SEM were applied to analyze the microstructure and sinterability of the powders. XRD, IR and TEM results show that the single nanosized Ce0.8Y0.2O1.9 powders can be abtained by low-temperature combustion process, and SEM analysis shows that the electrolyte powders have good sinterablity. Impedance measurements were perfomed over the temperature range of 400-800℃. The results show that the oxygen ionic conductivity reaches 0.058S/cm and the activation energy is 0.73eV at 800℃. It can be concluded that the utilization of low-temperature combustion process can lower the sintering temperature of electrolyte and improve the properties of the final solid electrolyte.
Key words: Ce0.8Y0.2O1.9; low-temperature combustion; solid electrolyte; oxygen ionic conductivity
稀土氧化物作为固体氧化物燃料电池的电解质材料越来越受到人们的关注[1-3]。 电解质材料的离子导电率直接决定了电池的输出功率和电流密度, Y2O3稳定的ZrO2(YSZ)作为固体电解质材料已经得到了很好的研究[4]。 但是YSZ需要在比较高的操作温度(900~1000℃)才有高的离子导电率, 这使电池的连接及封装材料的选择受到很大的限制, 增加了制造成本, 而且高的操作温度容易导致组成部件之间的界面反应, 导致电池的性能下降, 缩短了电池的寿命, 所以开发中、 低温下具有较高离子电导率的新型电解质材料成为SOFC中温化的关键技术之一。 CeO2基固体电解质由于在中温范围(600~800℃)具有和YSZ在高温(900~1000℃)相当的氧离子电导率而成为最具开发潜力的中温固体电解质材料之一[5-7]。 在此工作温度下, 可以选择钢铁材料作为封装材料, 减少原材料的成本、 组成部件之间的界面扩散及组成部件之间由于热膨胀系数不同而产生的热应力, 提高电池的长期稳定性。
CeO2基固体电解质材料的一个显著特点是难以致密化[8, 9], 传统的固相法制备的粉体颗粒尺寸大, 成分分布不均匀, 在1600℃烧结时也仅获得95%的烧结密度[10], 而且在制备过程中需要反复的研磨, 容易引入杂质。 水热法[11]、 共沉淀法[12-14]、 溶胶-凝胶法[15]等湿化学法由于使反应在分子水平混合使得产物成分分布均匀, 但需要在高的热处理温度才能得到所需产物, 且工序复杂, 不适合工业化生产。 自蔓延低温燃烧合成是相对于自蔓延高温燃烧(SHS)而提出的一种制备简单和复杂氧化物的材料合成方法, 相对于固相法及湿化学法, 具有工艺简单、 实验周期短、 反应产物成分分布均匀和纯度高等特点。 且产物颗粒尺寸达到纳米级、 活性高, 可以大大降低粉体的烧结温度(降低100~200℃)。 本文作者利用柠檬酸-硝酸盐低温燃烧合成工艺制备了Ce0.8Y0.2O1.9电解质粉体, 并对其烧结性能及电性能进行了研究。
1 实验
1.1 粉体的制备及表征
实验用原料Ce(NO3)3·6H2O(含量≥99%)、 Y2O3(纯度大于99.99%)、 柠檬酸(C6H8O7·H2O, 含量≥99.5%)、 浓硝酸、 氨水、 NH4NO3均为分析纯。 按Ce0.8Y0.2O1.9中化学计量摩尔比称取Ce(NO3)3·6H2O和Y2O3, 用适量的浓硝酸在60℃将Y2O3溶解, 并与Ce(NO3)3·6H2O混合溶于适量的蒸馏水中, 加入一定量的柠檬酸, 柠檬酸与金属离子的摩尔比为1.5, NH4NO3加入量为根据催进剂热化学理论[16]使柠檬酸完全燃烧时所需氧化剂的量的1.5倍, 用氨水调节pH值为6~8, 混合均匀后在70~80℃恒温水浴加热蒸发, 当溶液成透明粘稠状时, 移到电炉上继续加热直至点燃, 凝胶一经点燃, 反应迅速蔓延, 得到的产物呈多孔海绵状。 干凝胶及燃烧产物的粉体在德国西门子D500型X射线衍射仪上(λCuKα=0.154056nm)进行物相分析, 扫描范围为20°~60°, 并用Scherrer公式D=0.9λ/βcosθ计算燃烧后产物的晶粒尺寸, λ为Cu靶Kα辐射的波长, β=(β2m-β2s)1/2是矫正后的半高宽, βm为样品衍射峰的半高宽, βs为标准CeO2(粒径>1μm)衍射峰的半高宽。 利用WQF-410型红外光谱分析仪测试凝胶及燃烧后产物的红外吸收光谱, 扫描范围为4000~400cm-1。 在TEM(H800, Japan)上对粉体的粒度和形貌进行分析。
1.2 粉体的成型与烧结
将Ce0.8Y0.2O1.9电解质粉体填充到不绣钢模具中压制成直径为13mm、 厚度为1~2mm的圆片。 先在50MPa的压力下预压, 再在200MPa压力下二次压制, 保压30s后脱模。 成型后的素坯分别在1250、 1300、 1350℃烧结, 升温速率为5℃/min, 保温4h, 然后随炉冷却。 利用Archimedes法测量烧结体的相对密度, 利用SEM(JSM6700F, Japan)对粉体的烧结行为进行显微分析。
1.3 离子电导率的测量
将1350℃烧结的圆片在金相砂纸上磨平、 抛光, 涂上Pt浆料制备Pt电极, 在850℃加热0.5h除掉有机物。 采用Pt丝做电极引线, 在TH2818型宽频LCR数字电桥上测量Ce0.8Y0.2O1.9烧结体的离子电导率, 测量温度范围为400~800℃, 频率范围为20Hz~300kHz, 测量气氛为空气。
2 结果与讨论
2.1 电解质粉体的微观结构
图1所示为Ce0.8Y0.2O1.9的干凝胶前驱体及燃烧后产物的X射线衍射谱。 凝胶前驱体中除了与NH4NO3对应的衍射峰外, 并没有其它物质的特征衍射峰存在, 金属离子和柠檬酸之间形成了稳定的非晶态凝胶, 没有游离的金属离子存在, 这是获得成分均匀的电解质粉体的前提。 燃烧后产物具有单相立方萤石结构, 除了CeO2的衍射峰, 没有Y2O3的衍射峰存在, 利用燃烧反应不需另外的热处理直接获得了单相固溶体。 利用Scherrer公式得出产物的平均晶粒尺寸为15nm。 为了进一步研究燃烧过程中凝胶前驱体的结构变化, 对干凝胶和燃烧后产物进行了红外光谱(IR)研究。 图2所示为干凝胶及燃烧后粉体在400~4000cm-1范围的红外光谱。 干凝胶在1385、 1576、 3128cm-1处的吸收谱带, 分别对应于NO-3、 羧基(C-O)、 凝胶中氢键(O—H)的吸收带。 燃烧后产物的红外光谱与干凝胶的红外光谱相比, 1385、 1576、 3128cm-1处的吸收谱带消失, 同时在411cm-1出现了一个新的吸收谱带, 对应于CeO2的红外吸收带, 这说明在燃烧反应过程中, 硝酸盐和柠檬酸之间发生了氧化-还原反应, 生成了CeO2固溶体。 图3所示为燃烧产物粉体的TEM像。 从图中可以看出, 燃烧产物的颗粒尺寸分布均匀, 颗粒大小约为40nm。
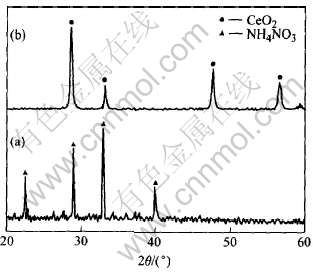
图1 干凝胶及燃烧后粉体的X射线衍射谱
Fig.1 XRD spectra of dried gel(a) and burned powder(b)
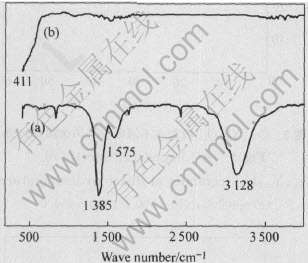
图2 干凝胶及燃烧后粉体的红外光谱
Fig.2 IR spectra of dried gel(a) and burned powder(b)

图3 燃烧后粉体的TEM像
Fig.3 TEM micrograph of burned powder
2.2 电解质粉体的烧结
图4所示为Ce0.8Y0.2O1.9电解质粉体分别在1250、 1300和1350℃保温4h时烧结体的SEM像。 从图中可以看出, 1250℃时(图4(a)), 颗粒之间形成了烧结颈, 形成连续的网络状结构, 不规则连通气孔主要集中在晶界处, 烧结体空隙大, 分布不均匀。 晶粒尺寸小, 平均晶粒尺寸为0.3μm, 相对密度为86.3%。 随着烧结温度的升高, 离子扩散系数增大, 加快了扩散和固相传质的进行, 颗粒界面进一步发育扩大, 连通的气孔通道变窄且逐步分解为封闭气孔, 烧结密度显著增加, 相对密度达到90%。 从图4(b)可以看出, 在此烧结阶段晶粒尺寸没有明显变化, 平均晶粒尺寸为0.35μm, 可以很明显地看出致密化行为已经开始, 此时主要是一些分布在晶界的封闭气孔。 随着烧结温度的继续升高, 气孔继续收缩并逐渐消失, 此时晶粒发生明显的长大, 晶粒间接触更为紧密, 烧结密度继续增加。 从1350℃烧结体的SEM像(图4(c))中可以看到, 晶界处的气孔变小并逐渐消失, 此时相对密度为95.1%, 平均晶粒尺寸为0.46μm, 比传统的固相法的烧结温度约低200℃[17], 表明低温燃烧合成工艺制备的电解质粉体有很高的烧结活性。

图4 不同烧结温度下Ce0.8Y0.2O1.9烧结体的SEM像
Fig.4 SEM micrographs of sintered Ce0.8Y0.2O1.9 at different temperatures
2.3 电解质的离子电导率
固体电解质的电极过程、 晶格和晶界过程分别有不同的时间常数, 因而在不同的频率区驰豫, 所以电解质的阻抗谱通常显示为在复平面内的一系列连续相接的半圆弧, 其中高频半圆对应于电解质的晶格响应过程, 中频对应于晶界响应过程, 低频对应于电解质和电极的界面极化响应过程, 且随温度的升高, 与过程有关的时间常数减少, 各响应过程向高频方向移动。 图5所示为Ce0.8Y0.2O1.9烧结体在不同温度时的交流阻抗谱。 烧结温度为1350℃, 保温时间为4h。 从图中可以看出, 400℃ 时交流阻抗谱由两个半圆弧组成, 低频端半圆对应于电解质和电极之间的极化电阻, 高频端对应于晶界电阻, 在400℃, 与电解质的体电阻对应的半圆弧没有观察到, 这是因为随温度的升高, 电导率增大, 时间常数(RC)减少。 随着温度的继续升高, 晶界半圆弧变小并消失, 在550℃时只有电解质和电极之间的极化响应半圆弧存在。
利用交流阻抗所测的电阻R(晶格和晶界的总电阻), 可以得出电解质的电导率, 800和600℃时的电导率分别为0.058和0.012S/cm, 与文献[18]在1600℃烧结的电导率0.062S/cm相近。 图6所示为Ce0.8Y0.2O1.9的离子电导率随温度变化的曲线图。 从图中可以看出, 电导率随温度的升高而增大, 曲线由两段组成, 在550℃出现拐点, 这表明Ce0.8Y0.2O1.9电解质的电导率与温度的关系分段符合Arrhenius定律:
![]()
式中 σ为电导率,S/cm; T为绝对温度, K; A为电导常数, 与结构有关, 与温度无关; Ea为电导活化能, eV; k为Boltamann常数, k=8.616×10-5eV/K。 根据图6的实验结果, 可以得出以下两个关系式:
ln(σT)=14.20-10.20/T (T≤823K)(2)
ln(σT)=11.99-8.42/T (T≥823K)(3)
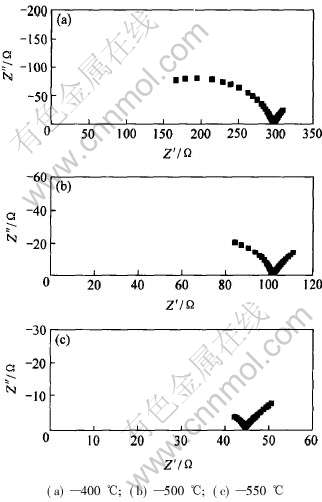
图5 Ce0.8Y0.2O1.9陶瓷在不同温度下的交流阻抗谱
Fig.5 AC impedance spectra of
Ce0.8Y0.2O1.9 ceramics at different temperatures
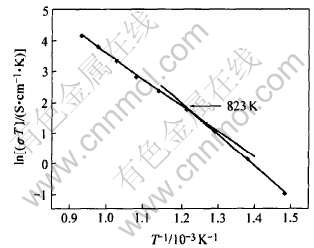
图6 Ce0.8Y0.2O1.9的离子电导率随温度的变化
Fig.6 Ionic conductivity versus reciprocal of
temperature in Ce0.8Y0.2O1.9 sample
由关系式的斜率及截距可以得出Ce0.8Y0.2O1.9电解质在不同温度区间的电导活化能及电导常数, 400~550℃之间电导活化能和电导常数分别为0.88eV和1.47×106S/cm , 550~800℃之间电导活化能和电导常数分别为0.73eV和1.6×105S/cm。 电导率与温度在不同的温度区间有不同的关系反映出Ce0.8Y0.2O1.9电解质在不同温度区间呈现不同的导电机理, 在低温时, 氧空位(Vo)带正电, 掺杂离子(Y′Ce)带负电, 氧空位和掺杂之间由于库仑吸引而形成复合缺陷(VoY′Ce), 因而使得自由氧空位的浓度减少, 氧离子的迁移受阻, 活化能增大。 随着温度的升高, 离子的热运动加剧, 复合缺陷(VoY′Ce)发生分解, 自由氧空位浓度增大, 氧离子的迁移通道增多, 而且温度升高氧离子的迁移能力也增大, 使得电导活化能降低, 电导率升高。
3 结论
利用低温燃烧合成工艺在不需要热处理的情况下直接获得了颗粒尺寸约为40nm、 组成单一的立方萤石结构的Ce0.8Y0.2O1.9电解质粉体。 由于粉体颗粒小、 活性高, 具有很好的烧结性能, 在1350℃保温4h时烧结体的致密度可以达到95%以上, 晶粒尺寸为0.46μm, 比固相法的烧结温度约低200℃。 Ce0.8Y0.2O1.9电解质在中温范围有较高的离子电导率, 烧结体在800℃时氧离子电导率为0.058S/cm, 烧结体在测量温度范围呈现两种不同的导电机理, 400~550℃温度范围电导活化能为0.88eV, 550~800℃温度范围电导活化能为0.73eV。
REFERENCES
[1]Chan S H, Chen X J, Khor K A. A simple bilayer electrolyte model for solid oxide fuel cells[J]. Solid State Ionics, 2003, 158: 29-43.
[2]Boulc H F, Djurado E. Structural changes of rare-earth-doped, nanostructured zirconia solid solution[J]. Solid State Ionics, 2003, 157: 335-340.
[3]Huang K, Goodenough J B. A solid oxide fuel cell based on Sr- and Mg-doped LaGaO3 electrolyte: the role of a rare-earth oxide buffer[J]. J Alloys Compd, 2000, 303-304: 454-464.
[4]Fonseca F C, Muccillo R. Impedance spectroscopy analysis of percolation in (yttria-stabilized zirconia)-yttria ceramic composites[J]. Solid State Ionics, 2004, 166: 157-165.
[5]Zhang T S, Ma J, Kong L B, et al. Aging behavior and conductivity of ceria-based ceramics: a comparative study[J]. Solid State Ionics, 2004, 170: 209-217.
[6]Toshiaki M, Minoru I, Atsushi M, et al. Electrochemical properties of ceria-based oxides for use in intermediate-temperature SOFCs[J]. Solid State Ionics, 2005, 176: 647-654.
[7]WANG Feng-Yun, CHEN Song-ying, WANG Qin, et al. Study on Gd and Mg co-doped ceria electrolyte for intermediate temperature solid oxide fuel cells[J]. Catalysis Today, 2004, 97: 189-194.
[8]Panhans M A, Blumenthal R N. A thermodynamic and electrical conductivity study of nonstoichiometric cerium dioxide[J]. Solid State Ionics, 1993, 60(4): 279-298.
[9]Zhen Y S, Milne S J, Brook R J. Oxygen ion conduction in CeO2 ceramics simultaneously doped with Gd2O3 and Y2O3[J]. Sci Ceram, 1988, 14: 1025-1030.
[10]Godickemeier M, Gauckler L J. Engineer of solid oxide fuel cells with ceria-based electrolytes[J]. J Electrochem Soc, 1998, 145(2): 414-420.
[11]Dikmen S, Shuk P, Greenblatt M, et al. Hydrothermal synthesis and properties of Ce1-xGdxO2-δ solid solutions[J]. Solid State Sciences, 2002, 4: 585-590.
[12]Tadokoro S K, Porfirio T C, Muccillo R, et al. Synthesis, sintering and impedance spectroscopy of 8mol% yttria-doped ceria solid electrolyte[J]. Journal of Power Sources, 2004, 130: 15-21.
[13]Tadokoro S K, Porfirio T C, Muccillo R, et al. Synthesis, sintering and impedance spectroscopy of 8mol% yttria-doped ceria solid electrolyte[J]. Journal of Powder Sources, 2004, 130: 15-21.
[14]Zhang T S, Ma J, Kong L B, et al. Preparation and mechanical properties of dense Ce1-xGdxO2-δ[J]. Solid State Ionics, 2004,167: 191-196.
[15]WANG Feng-yun, CHEN Song-ying, Cheng Soofin. Ga3+ and Sm3+ co-doped ceria based electrolytes for intermediate temperature solid oxide fuel cells[J]. Electrochemistry Communications, 2004, 6: 743-746.
[16]Tsoga A, Naoumidis A, Stover D. Total electrical conductivity and defect structure of ZrO2-CeO2-Y2O3-Gd2O3 solid solutions[J]. Solid State Ionics, 2000,135: 403-409.
[17]TIAN Chun-yan, CHAN Siu-wai. Ionic conductivities, sintering temperatures and microstructures of bulk ceramic CeO2 doped with Y2O3[J]. Solid State Ionics, 2000, 134: 809-102.
[18]ZHA Shao-wu, FU Qing-xi, LANG Yin, et al. Novel azeotropic distillation process for synthesizing nanoscale powders of yttria doped ceria electrolyte[J]. Materials Letters, 2001, 47: 351-355.
基金项目: 国家自然科学基金资助项目(50304008); 博士点基金资助项目(20030532016); 化学生物传感与计量学国家重点实验室开放基金资助项目(2005016)
收稿日期: 2005-09-30; 修订日期: 2006-03-21
通讯作者: 严红革, 教授; 电话: 0731-8821648; E-mail: zh7xhm@sina.com


