文章编号:1004-0609(2013)10-3006-09
生物浸出过程中微生物协同作用机制的研究进展
余润兰,石丽娟,周 丹,邱冠周,曾伟民
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 中南大学 生物冶金教育部重点实验室,长沙 410083)
摘 要:
在生物浸出过程中,不同类型的浸矿微生物相互影响、相互促进,提高各自的代谢活动,从而提高金属浸出率。综述浸矿微生物协同作用的类型铁氧化菌与硫氧化菌、自养菌与异养菌、吸附菌与游离菌以及常温菌与高温菌的协同作用以及它们之间的作用机制,并分析协同作用的研究思路及生物浸出过程中矿物的溶解途径,重点介绍协同作用的研究方法和关键代谢产物及其作用。
关键词:
中图分类号:Q939 文献标志码:A
Research development of microorganism synergy mechanisms during bioleaching
YU Run-lan, SHI Li-juan, ZHOU Dan, QIU Guan-zhou, ZENG Wei-min
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha 410083, China)
Abstract: During bioleaching, different types of mixed bacteria interact and cooperate with each other to improve their metabolic activities and increase the metal extracting rate. The synergy types of microorganisms, such as the synergy of iron-oxidizing bacteria and sulfur-oxidizing bacteria, the synergy of autotrophic bacteria and heterotrophic bacteria, the synergy of adsorbed bacteria and free bacteria and the synergy of mesophilic bacteria and thermophilic bacteria and the mechanism of their interactions were reviewed. And the synergy and mineral dissolution ways during bioleaching were discussed, the research methods of the synergy and the roles of important metabolites were discussed.
Key words: leaching microbes; synergy mechanism; ecological methods; functional genes; mineral dissolution
我国矿产资源丰富,但贫矿多、富矿少,传统的选冶加工技术不能经济有效地处理和利用这些贫、细、杂的矿物资源。另外,传统选冶工艺流程相对复杂,需要经过多个生产环节,要求精料和多种设备,反应剧烈、污染比较严重、成本较高。生物冶金技术是指利用浸矿微生物(主要是古菌、细菌和真菌)将矿石中的有价金属溶解到浸出液中,然后通过萃取、电积的方法提取金属离子,制备高纯度金属材料的过程。它不仅能够有效地处理多种低品位硫化矿和氧化矿,而且成本低、操作简单、环境友好[1]。在当今全球高品位矿产资源日益短缺的情况下,生物冶金技术的优势越来越明显,并在全球50多个工厂实现了工业应用[2]。
优良浸矿微生物的筛选与富集是开展生物冶金基础研究及工程化应用的关键。浸矿微生物种类繁多,按对温度的适应程度可划分为中温菌(25~42 ℃)、中度嗜热菌(45~60 ℃)、嗜热菌(60~80 ℃)和极度嗜热菌 (<80 ℃);按不同营养类型划分为自养菌和异养菌,其中自养菌又可分为铁氧化菌和硫氧化菌;按不同生长位点可分为吸附菌和游离菌。这些不同营养类型、不同生长位点的微生物在浸矿体系中共同存在,并通过各种协同作用有效地提高金属的浸出速率和浸出率。比如Acidithiobacillus ferrooxidans (A. ferrooxidans)、Leptospirillum ferrooxidans 和 Acidithiobacillus thiooxidans (A. thiooxidans)是酸性环境中浸矿的主导菌,它们的最适生长温度为30~35 ℃。其中A. ferrooxidans主要通过氧化Fe2+获得能量,也可氧化硫化矿物、单质硫和可溶硫化物,同时固定二氧化碳用以生长[3]; Leptospirillum ferrooxidans只能氧化溶液中的亚铁离子,不能氧化单质硫及还原型硫化矿; A. thiooxidans不能氧化亚铁离子,却能够生长在单质硫及一些可溶性硫化物上,还可以将浸出过程中产生的硫氧化。在同一浸矿体系中,它们会通过不同的方式的的相互影响、相互协作,正如很多研究表明[4],硫氧化菌A. thiooxidans能增强铁氧化菌A. ferrooxidans的浸矿作用。
综上所述,像这种两类或多类微生物在浸矿过程中相互作用,更好地进行单类种群不能完成或不能高效完成的物质转化,增强各自的代谢活动,从而提高金属浸出速率和浸出率的微生物作用机制称为协同作用[5]。通过对特定浸出工艺过程中的微生物群落结构、群落动态以及微生物之间及微生物与矿物之间的相互作用的研究,可以更多地了解浸矿微生物协同作用及生态规律,从而根据具体的研究目的或工业应用有选择地设计微生物群落以达到优化浸矿菌群结构和提高浸出效率的目的。
1 浸矿微生物的协同作用类型
1.1 铁氧化菌与硫氧化菌的协同作用
在生物浸出过程中,铁氧化菌和硫氧化菌是最主要的浸矿微生物,它们分别通过氧化Fe2+ 和单质硫获得能量。铁氧化菌通过氧化Fe2+生成Fe3+,后者在硫酸体系下是一种强氧化剂,可以氧化多种硫化矿,从而使金属离子和硫释放出来。单质硫在硫氧化菌作用下能持续氧化成硫酸,维持整个浸矿体系的酸性环境。通过二者的分工协作,较大幅度地提高浸出速率和浸出率。
GIAVEN等[6]采用A. ferrooxidans和A. thiooxidans两株菌分别进行了单独培养、混合培养浸出Ni3S2的研究,用A. thiooxidans单独浸出时Ni的浸出浓度为320 mg/L,用A. ferrooxidans单独浸出时Ni的浸出浓度为470 mg/L,而当采用两种菌混合浸出时Ni的浸出浓度可达到530 mg/L。因此,A. thiooxidans的加入有利于S的氧化,可以抑制钝化层生成及消除硫膜钝化层,二者之间的协同作用明显提高了金属浸出率。
XIA等[7]也研究A. ferrooxidans和 A. thiooxidans之间的协同作用,他们采用 A. ferrooxidans 和 A. thiooxidans两株菌分别对闪锌矿进行单独、混合浸出。实验结果表明:A. ferrooxidans对闪锌矿的浸出能力比A. thiooxidans的强,18 d后,锌的单独浸出率分别为61%和20%;当二者混合浸出时,锌的浸出率高达97%。另外,XRD分析结果显示,A. ferrooxidans单独浸出闪锌矿时,浸出矿渣主要有未浸出的闪锌矿和硫;A. ferrooxidans 和 A. thiooxidans混合浸出时,矿渣中检测不到硫。因此,推断A. thiooxidans可以将矿物表面的硫氧化成硫酸且更为彻底,虽然A. ferrooxidans也可以氧化硫,但在亚铁离子和硫同时存在时,A. ferrooxidans会选择亚铁离子作为能源物质,所以,A. thiooxidans在硫的氧化过程中起主导作用。即当A. ferrooxidans 和 A. thiooxidans混合培养时,A. thiooxidans可以氧化矿物表面的钝化层硫,使得浸出反应可以持续高效进行,同时,氧化硫层产生的质子也可以加快闪锌矿的浸出,因此,两株菌的协同作用在矿物高效浸出过程中发挥了重要的作用。
1.2 自养菌与异养菌的协同作用
浸矿微生物有些是异养菌、有些是兼性异养菌、还有些是自养菌,它们对有机物的利用程度有较大的差别。浸出体系中有机物的存在会一定程度上抑制自养菌的生长,尤其是生物浸出后期,微生物代谢产物积累和自身衰亡都会产生较多的有机物,从而抑制自养菌的氧化活性,最终降低金属浸出效率。而异养菌,如Acidiphilium的加入可以显著降低浸出体系中有机物的含量,最终提高自养菌氧化活性。正是因为自养菌和异养菌的这种相互影响和相互促进,它们经过混合培养的驯化后可以明显提高金属浸出率。
GURUNG等[8]研究了自养菌Acidithiobacillus ferrooxidans与异养菌Acidiphilium cryptum 在浸矿体系中的相互作用。研究表明:A. ferrooxidans 能有效氧化各种化学形态硫,可以减轻溶液中的硫代硫酸盐对A. cryptum 生长的抑制;而A. cryptum可以降解浸出体系中的部分有机物,从而减轻过量有机物对A. ferrooxidans 菌的生长抑制。LIU等[9]研究了异养菌Acidiphilium acidophilum在转录水平上对A. ferrooxidans生长代谢的影响。结果显示,混合培养时A. ferrooxidans的指数期延长2 d,细胞数量是纯培养的5倍多,培养液中亚铁离子的浓度增大,与铁离子氧化有关的基因表达量上调(见图1[9]),与固定CO2相关的基因表达量也上调(见图2[9])。混合培养时,Acidiphilium acidophilum激活了A. ferrooxidans中的铁离子氧化相关基因及固定CO2的相关基因,对A. ferrooxidans的生长代谢起到了极大的促进作用。
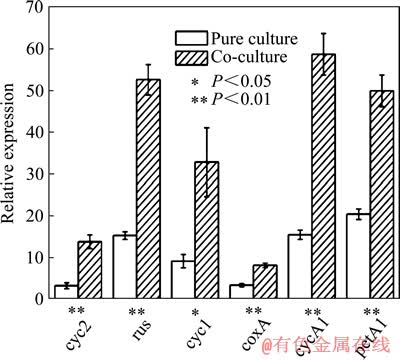
图1 在第32 h时A. ferrooxidans纯培养、混合培养铁氧化相关基因表达量的比较[9]
Fig. 1 Comparison of expression ratio of iron oxidation- related genes of A. ferrooxidans in pure culture and its co-culture with Aph. Acidophilum at 32nd h[9]
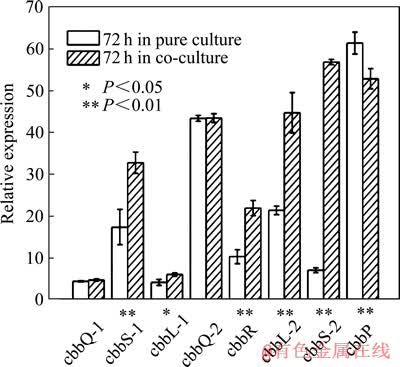
图2 在第72 h时A.ferrooxidans纯培养、混合培养CO2固定相关基因表达量的比较[9]
Fig. 2 Comparison of expression ratio of cbb genes of A. ferrooxidans in pure culture and its co-culture with Aph. Acidophilum at 72nd h[9]
1.3 吸附菌与游离菌的协同作用
在生物浸出中,浸矿微生物生长位点是不同的,有的粘附在矿物的表面,有的悬浮在浸出液中,它们分别被称为吸附菌和游离菌。虽然吸附菌与游离菌同时存在于浸矿体系中,但它们产生的代谢产物和在浸矿中所发挥的作用却有所不同。
GAUTIER等[10]做了相关的研究,他们为了考察游离菌与吸附菌分别在浸矿体系中起到的作用,特别设计了一个装置,在250 mL三角瓶的中间放置一个圆柱形的小室,小室的下端用0.1 μm微孔滤膜封住,详细结构见图3[10]。实验a分别在小室A、B都接种了Sulfolobus metallicus,在小室B放了黄铜矿;实验b只在小室A接种了Sulfolobus metallicus,在小室B放了黄铜矿;实验c不接种微生物只通入无菌空气。结果表明:实验b的铜浸出率仅是实验a的一半,也仅比实验c的浸出率高出一点,原因在于实验b中Sulfolobus metallicus不能吸附到黄铜矿的表面,在浸出过程中起关键作用的吸附微生物发挥不了作用,主要还是溶解氧对黄铜矿的化学作用,使得实验b中铜的浸出率很低。作者还做了一些补充实验,详细监测了硫中间产物的变化情况。当实验不接种Sulfolobus metallicus只通入无菌空气,可以检测到SO42-、HSO4-和HSO3-;当接种Sulfolobus metallicus并通入无菌空气,可以检测到SO42-、HSO4-、HSO3-、SO32-和S2O32-,且SO42-、HSO4-的含量要比没接种Sulfolobus metallicus的高很多。他们推断吸附的Sulfolobus metallicus可以氧化黄铜矿表面的钝化层硫,形成硫代硫酸盐、亚硫酸盐和亚硫酸氢盐;而游离菌可以进一步氧化这些硫中间产物,得到硫酸盐和硫酸氢盐,其中吸附菌在钝化层硫的消除中起到重要作用,使浸出反应持续高效地进行。
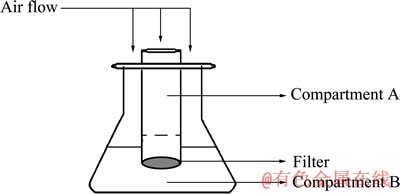
图3 改进后的250 mL锥形瓶装置图[10]
Fig. 3 Schematic diagram of modified shake flask used in inoculated experiments[10]
在生物浸出工业应用中,常常采用中温菌和高温菌混合浸出硫化矿。比如在大型堆浸的中后期及天气炎热的夏季,堆内一般具有较高的温度,黄铜矿精矿的搅拌浸出反应器中的温度一般也在60 ℃以上,此时中温菌如A. ferrooxidans、L. ferrooxidans和A. thiooxidans等生长繁殖和浸矿性能受到很大影响,而耐高温菌却可以发挥其重要作用。
邹平[11]进行了嗜热菌和中温菌混合浸出低品位硫化铜矿的研究,以解决矿堆内发热中温菌不能存活及浸出率低的问题。本文作者对以黄铜矿为主的低品位硫化铜矿分别进行了嗜热菌、中温菌单独和混合柱浸试验,矿石粒径≤80 μm、矿浆浓度10%。结果显示:中温菌柱浸196d对总铜的浸出率仅为22.51%,中温菌浸出到一定时间后,浸出率上升缓慢,趋于平缓;嗜热菌柱浸,由于高温环境引起矿石中的耗酸物质加速溶出,造成浸出体系的pH值持续较长时间的大幅度变化,常常由2.0变成5.0以上,难以维持细菌正常生长所需的pH范围,细菌难以生长,导致浸出初期出现明显的“平台期”,浸出效果也较差,且浸出率在175d以前一直较中温菌低,但在175 d以后,嗜热菌表现出极大的浸出优势,所以,采用嗜热菌柱浸的主要制约因素是前期的“平台期”。鉴于以上两个试验,嗜热菌、中高温菌结合使用,在浸出前期先加中温菌使矿石初步浸出,其中部分硫化矿如黄铁矿之类的氧化分解释放热量,使柱体的温度稍微提高,再添加高温菌。另外,中温菌氧化浸出释放的能源物质,如亚铁和硫等,可以使接种后的高温菌更快地适应柱浸环境,从而提高菌种活性,有利于持续有效的浸出。因此,嗜热菌与中温菌的配合使用,既可避免中温菌对黄铜矿浸出效果差的缺点,又可避免嗜热菌浸出初期的“平台期”,同时又可发挥嗜热菌对黄铜矿的较强的氧化浸出能力。通过对这两种菌的合理利用,既能充分发挥出各自的优势,又能相互影响、相互促进,使得黄铜矿的浸出率在较短时间内有了明显的提高。
2 浸矿微生物群协同作用
研究浸矿微生物的协同作用机制,首先从浸矿微生物入手,研究它们在各种浸出体系中的生长代谢活动、群落结构及动态以及各类功能基因的活性变化等;其次是研究生物浸出对象(各种氧化矿和硫化矿)的分步溶解途径和在浸出过程中产生的各类中间产物,尤其是原生硫化矿的生物氧化溶解途径及中间产物。综合这两部分的数据,分析参与浸矿的微生物群落动态的变化、代谢活性变化、微生物的浸矿行为及各类中间产物的生成及去向,从而揭示不同类型的浸矿微生物在浸矿体系中所发挥的具体作用、微生物与矿物间相互作用关系及不同类型浸矿微生物之间的协同作用关系,进一步阐明浸矿微生物协同作用机制。
2.1 浸矿微生物
阐明微生物在各种条件下的生长代谢及活性是微生物协同作用的研究基础,也即是研究微生物的细胞数量、种群结构和重要功能基因的表达情况等。随着生物学技术的发展,研究浸矿微生物种群结构及群落动态的方法越来越多,如ARDRA(Amplified ribosomal DNA restriction analysis)、PCR-RFLP(PCR-Restriction fragment length polymorphism)、Gene-Chip、PCR-DGGE (PCR-Denaturing gradient gel electrophoresis)和Real- time PCR 等都是些常见的技术。
微生物功能基因技术也是研究浸矿微生物协同作用的的重要手段,由于某些功能基因的活性及表达量影响着微生物浸矿性能,可以用有关浸矿性能基因的表达情况反映微生物的浸矿性能。目前,检测功能基因表达量的方法主要有功能基因芯片和Real-time PCR。
另外,在生物浸出过程中,浸矿微生物所产生的代谢产物也在一定程度上影响着微生物的协同作用,比如胞外多聚物(Extracellular polymeric substances, EPS)。很多研究表明,胞外多聚物不仅可以介导微生物吸附到矿物表面,而且能富集溶液中的Fe3+,从而增强氧化效率,提高矿物浸出速率。
2.1.1 浸矿微生物生态学研究方法
1) 变性梯度凝胶电泳
HE等[12]采用DGGE的方法研究在黄铁矿生物浸出过程中不同温度和不同初始pH对微生物群落结构的影响,通过提取不同时期浸出液中和黄铁矿表面的微生物基因组,利用基于16SrDNA的PCR-DGGE技术获得微生物群落的DNA特征指纹图谱,并对条带进行统计分析和切胶测序。DGGE分析表明,在初始pH相同的条件下,温度对微生物群落结构的影响比较明显。在30 ℃和35 ℃培养条件下,浸出液中A. ferrooxidans和A. thiooxidans是优势菌,同时,在35 ℃浸矿体系中也能检测到L. ferrooxidans,并且在40℃的体系中,L. ferrooxidans对黄铁矿的浸出起主导作用,在40和45 ℃时,A.caldus和S.thermosulfidooxidans成为优势菌。另外,研究还表明,黄铁矿表面的群落动态变化与其有类似的变化规律。
2) 核糖体DNA扩增片段限制性内切酶分析
ZHOU等[13]研究中度嗜热菌在搅拌反应器中对黄铜矿的浸出,并采用ARDRA的方法对浸出过程存在哪些菌和哪些是优势菌作了详细考察。通过DNA提取、16SrDNA基因PCR扩增、连接、转化等一系列步骤后,总共收集到51个阳性克隆子,经酶切后分析,一共有5个操作分类单位(OTUs),分别为ZY-1、ZY-2、ZY-3、ZY-4和ZY-5;通过系统发育分析发现ZY-1、ZY-2和ZY-3隶属于L. ferriphilum,ZY-4和ZY-5隶属于A.caldus。其中ZY-1、ZY-2和ZY-4在黄铜矿的浸出过程中起到主导作用,所占比例分别为33.3%、23.5%和29.4%。研究还发现,L. ferriphilum丰度很高(约67%),而这些菌多存在于低pH、金属离子含量高的环境中,与该研究黄铜矿浸出环境很相似,在实验的后期,浸出液中的离子高达17.4g/L,pH也降到1.32,从而解释了在该浸出体系中L. ferriphilum占主导地位的原因。
3) 实时荧光定量PCR
ZHANG等[14]采用Real-time PCR技术分析A.caldus、L.ferriphilum和F. thermophilium 3种菌在黄铜矿生物浸出过程中的群落动态,生物浸出初始,3种菌的接种比例为1:1:1;生物浸出15 d时,A.caldus、L.ferriphilum的细胞数量较高,分别约为69%和30%;而到第28 d时,F.thermophilium的数量明显增加,为22%,A.caldus、L.ferriphilum的细胞数量有所下降,分别为55%和23%。
ARDRA技术可以较为准确地分析微生物的种群结构,辨别优势种群和劣势种群,而Real-time PCR技术适于定量分析指定种群的动态变化,因此,二者的结合可以有效地分析微生物的种群结构和群落动态。
2.1.2 浸矿微生物功能基因活性变化
由于微生物的浸矿性能受相关功能基因控制,不同培养条件下微生物的浸矿性能会有所不同,而浸矿性能的不同体现在相关功能基因的表达情况上,所以浸矿微生物功能基因活性的研究至关重要。虽然浸矿微生物功能基因已经是研究热点,但有关协同作用功能基因的研究难度较大相关的报道也较少。
申丽等[15]通过对全国各个不同矿区的硫化矿进行试验,筛选得到各种不同氧化活性的A. ferrooxidans菌,并提取纯化样品菌株和模式菌株基因组DNA和RNA,再与全基因组基因芯片杂交。研究表明,在3217个基因中发现有967个基因为不同的菌株所特有,其余的2250个(占基因总数的70%)基因为所有A. ferrooxidans菌共有;另发现,320个高氧化活性菌特征基因, 其中,与中间代谢(硫、氮代谢)相关的基因24个,与胞壁质、肽聚糖、多聚糖和脂多糖的生物合成与降解相关的基因33个,与解毒作用有关的基因15个,与DNA代谢相关的基因36个,与能量代谢相关的基因85个,与脂肪酸和磷酸代谢相关的基因5个,与蛋白质的合成相关的基因26个,与核苷酸合成相关的基因12个,与DNA转录相关的基因15个,与调节作用相关的基因34个,与信号转导相关的基因10个,与转运和结合蛋白相关的基因25个。所以,通过对微生物相关基因表达量的检测, 就能对微生物浸矿性能进行定性与定量检测,也就可以直接了解不同微生物混合培养时的浸矿效果。
功能基因芯片技术是研究浸矿微生物功能基因表达的一种重要手段,可以反映出微生物群落的生理状况和代谢活性[16-17]。本实验室在第一代冶金微生物功能基因芯片基础上,成功构建并评估第二代冶金微生物功能基因芯片,可以更为准确快速地分析浸矿微生物功能基因表达情况[18]。LIU等[19]采用功能基因芯片技术研究外来菌种(A. thiooxidans)的侵入对土著菌群(A. caldus、L. ferriphilum、A. ferrooxidans、S. thermosulfidooxidans、Acidiphilium spp.和F.thermophilum) 氧化活性的影响。结果表明:A. thiooxidans的入侵使硫氧化菌(如A. caldus)与硫氧化相关基因的表达量下调,而铁氧化菌(如L. ferriphilum)与铁氧化相关基因的表达量明显提高。另外,新菌群的总铁、硫氧化功能基因表达量也上调。因此,外来菌种(A. thiooxidans)的加入有利于铜浸出速率和浸出率的提高。
2.1.3 浸矿微生物关键代谢产物——胞外多聚物的研究
胞外多聚物(Extracellular polymeric substances,EPS)是指附着在细菌表面或围绕在细菌周围,水道、孔隙穿通其间,形成蘑菇状膜结构,用于自我保护和相互粘附的天然有机物。EPS在微生物群体中广泛存在,在细菌的粘附聚集、信息交流、抗毒性等方面起着重要作用。EPS的成分比较复杂,主要包括多糖、蛋白质、核酸、脂肪酸、糖醛酸,且胞外聚合物成分因菌种和营养物的不同而不同[20-21]。比如氧化亚铁硫杆菌在代谢硫或亚铁的情况下,胞外聚合物的成分是不同的。代谢黄铁矿或Fe2+的A. ferrooxidans的EPS中含有糖醛酸和Fe3+,而代谢硫的A. ferrooxidans的EPS中却没有糖醛酸和Fe3+。
曾伟民[22]采用AFM考察黄铜矿精矿生物浸出过程中吸附微生物产生胞外多聚物的过程,如图4所示,生物浸出第1 d,浸矿微生物吸附到矿物表面,细胞表面有少量的胞外多聚物形成;生物浸出第3 d,吸附微生物开始不断产生胞外多聚物,在包裹微生物本身之后,开始向矿物表面延伸;生物浸出第6 d,胞外多聚物的生成量大大增加,不仅完全包裹了微生物自身,而且覆盖了微生物的生长区域。据报道[23-24],吸附微生物可以通过胞外多聚物富集溶液中的Fe3+,从而加速矿物的溶解。

图4 黄铜矿精矿生物浸出过程中吸附微生物产生的胞外多聚物的AFM像[22]
Fig. 4 AFM images of attached microorganisms on surface of slices of pure chalcopyrite[22]
胞外多聚物在生物浸出过程中的重要的作用主要体现在[25]:1) 介导浸矿微生物吸附到矿物表面;2) 通过糖醛酸等物质富集溶液中Fe3+,从而在矿物表面形成一个氧化空间用于溶解矿物,详情见图5[25]。具体而言,硫氧化菌产生的EPS显示出纯疏水的表面性质,它通过范德华力吸附到疏水基质(如硫)表面;相反,铁氧化菌产生的EPS,在pH=2的条件下,由于其含有0.5%~5%的Fe3+,并形成糖醛酸铁配合物,使细菌的EPS表面带正电,通过静电作用紧密黏附到带负电的黄铁矿表面。目前,关于浸矿微生物胞外多聚物的报道不多,浸矿微生物与矿物之间吸附和相互作用机理尚未研究清楚。随着人们研究的深入,浸矿微生物的吸附机理也将逐步得到完善。
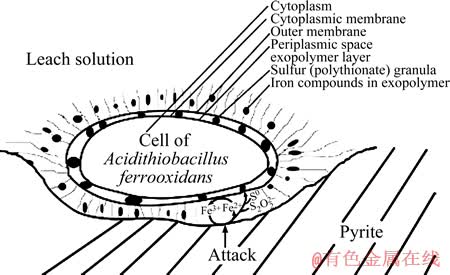
图5 A. ferrooxidans通过胞外多聚物浸出黄铁矿的作用机制模型[25]
Fig. 5 Contact mechanism model of leaching pyrite by A. ferrooxidans[25]
2.2 矿物生物浸出过程中的矿物溶解途径
2.2.1 氧化矿的生物溶解途径
氧化矿石是金属矿床受氧化作用后,形成的氧化带中的矿石。我国大部分硫化矿床的上部都有氧化带,有的矿床还被深度氧化成为大中型的氧化矿床。由于氧化矿的氧化程度不一,有些很容易被酸碱浸出,有些氧化程度较深,嵌布粒度细,风化和泥化严重,多金属共存的特点,比如氧化铅锌矿物,给浸矿工艺带来了极大困难。靠单一酸浸,其浸出率难以提高,可以借助某些微生物的催化作用使矿石中的金属溶解。RUSIN[26]做了相关的研究,用硫酸对难处理的的铁钼氧化矿浸出,钼的浸出率仅为1.8%,而微生物反应器A和B中钼的浸出率分别为93.3%和92.4%,且对微生物处理过的矿渣进一步酸浸,钼的浸出率不再增加,表明用生物方法处理过的矿石浸出很彻底。
由于RUSIN[26]对参与铁钼氧化矿浸出的每种微生物在其中发挥的作用尚不清楚,对这些微生物间的相互作用也不太了解,所以,对微生物在铁钼氧化矿浸出体系中的具体作用没有详细阐述。
2.2.2 次生硫化矿生物溶解途径
次生硫化铜矿是生物冶金应用的重要对象之一。目前,次生硫化铜矿的大规模生物堆浸在智利等国已得到广泛应用,但由于我国矿石品位及类型的差异,目前只在紫金铜矿等地有生物堆浸工业应用的报道。次生硫化铜矿主要包括辉铜矿、斑铜矿、铜蓝等,由于浸矿微生物与每一种矿物的作用方式都有所不同,且中间产物也有较大差异,所以对这3种主要的次生硫化矿的溶解途径分别做详细介绍。
1) 辉铜矿(Cu2S)
辉铜矿大部分是原生硫化铜矿氧化分解再经还原作用而成的次生矿物。含铜成分高,是一种重要的炼铜矿石。我国福建紫金山、云南东川等地都蕴含有大量辉铜矿。据文献[27-28]报道,辉铜矿的生物浸出过程主要经过以下两个阶段:
Cu2S+Fe2(SO4)3=CuSO4+CuS+2FeSO4 (3)
CuS+Fe2(SO4)3=CuSO4+S+2FeSO4 (4)
但辉铜矿的电化学溶解研究表明,在Cu2S和CuS之间存在一系列中间产物,其中一些具有稳定的组成和固定的氧化还原电位,如果辉铜矿在生物浸出过程中的变化与电化学研究结果一致,则式(3)的产物应该是Cu2-xS而不是CuS,浸出速率常数也应该是一个随浸出程度而变化的。目前的研究多是针对纯矿物和合成矿物,而对于低品位的辉铜矿和铜蓝浸出的动力学研究还比较少。
2) 斑铜矿(Cu5FeS4)
斑铜矿产于铜矿床氧化带中,常与自然铜、孔雀石、蓝铜矿、黄铜矿共生,它比黄铜矿和蓝铜易于氧化,氧化性能却比辉铜矿低。中国是世界上斑铜矿较多的国家之一,主要分布在云南东川和江西、甘肃等地。总储量为6 243万t,居世界第7位。有关报道显示,斑铜矿生物浸出分两个阶段进行,分别见反应式(5)和(6)。
Cu5FeS4 +8Fe3+→Cu3FeS4 +3Cu2++4Fe2+ (5)
Cu3FeS4 +8Fe3+→3Cu2+ +9Fe2++4S0 (6)
而斑铜矿的电化学溶解研究表明[29],斑铜矿中的铁优先溶解,随后形成一系列中间产物,主要有Cu8S5、Cu7S4、Cu39S28、CuS、Cu2S。其反应过程可用反应式(7)和(8)表示。但在酸性溶液中,铜首先从斑铜矿中释放出来,并在较高电位条件下在矿物表面上形成铜蓝。
Cu5FeS4 +3H2O→Cu5S4+Fe(OH)3+3H++3e (7)
Cu5S4+2xH2O→Cu5-xS4+xCu(OH)2+3xH++3xe (8)
3) 铜蓝(CuS)
铜蓝是一种成分为硫化铜的矿物,它的含铜量为66%。主要产于铜矿床的次生硫化物富集带中,与辉铜矿等伴生,组成含铜很富的矿石。代表性的产地如俄罗斯乌拉尔的布里亚温,铜蓝的生物浸出机制可用反应式(9)表示:
CuS+Fe2(SO4)3 =CuSO4+S+2FeSO4 (9)
在生物浸出体系中,铜蓝是很多次生硫化矿或原生硫化矿溶解的中间产物。文献报道[30-31],黄铜矿在电化学溶解过程中,当电位为0.4~0.5 V时,黄铜矿电极表面会产生一层深蓝色物质,结合SEM-EDX分析,这层物质主要为铜蓝。
2.2.3 原生硫化矿生物溶解途径
黄铜矿(CuFeS2)是主要的原生硫化矿,是一种重要的铜矿资源,约占中国70%的硫化铜矿[32]。传统的从黄铜矿中提取铜的方法是火法冶金,然而焙烧过程中释放大量的SO2气体会严重污染环境。另外,高额的投资成本和操作费用也迫使人们开始寻找替代方法。而黄铜矿的微生物浸出显示出了极大的优势。据报道,在酸性介质中黄铜矿的生物浸出机制主要分为两种模式,直接作用和间接作用。直接作用、间接作用分别可用反应式(10)和(11)表示:
CuFeS2+O2+4H+=Cu2++Fe2++2S0+2H2O (10)
CuFeS2+4Fe3+ =Cu2++5Fe2++2S0 (11)
其中,在间接作用中细菌的作用只是再生Fe3+以及氧化单质硫,可以用反应式(12)和(13)来表示:
4Fe2++4H++O2=4Fe3++2H2O (12)
S0+3/2O2+H2O=H2SO4 (13)
然而研究表明[33],黄铜矿的溶解并非简单地一步到位,而是分多个阶段进行的,溶解过程中存在的中间产物主要有CuS、Cu2S、CuxS(1<x<2)和CuSn(2<n<8)等。
黄铜矿溶解过程的第一步骤是脱铁,但是随后生成的Cu-S产物的具体结构及组分不清楚,尤其是在生物浸出过程中,很难通过XRD或EDX等手段在浸出矿渣中检测到Cu-S产物的存在。这可能有两个原因:1) 黄铜矿生物浸出过程中,Cu-S中间产物的生成量较少,超出了XRD或EDX的分析范围;2) 生成的Cu-S中间产物较易在酸性条件或微生物存在的条件下被氧化。
ACRES等[34-35]采用同步辐射XPS的方法研究黄铜矿化学浸出后产物硫价态变化情况。结果表明:化学浸出(在pH=1.0的盐酸中浸出2 h)后,矿渣中硫的主要形态有S0、S22-、SO42-、Sn2-(2<n<8)。其中Sn2- (2<n<8)是一种多聚硫化物,它不同于以前电化学分析结果里的CuxS(1<x<2)。CuxS(1<x<2)中硫的价态在-2~-1之间变化,而Sn2-(2<n<8)的价态在-1~0之间变化。另外,同步辐射XPS与同步辐射XRD方法一样不能检测到CuxS(1<x<2)物质的存在,这表明黄铜矿生物浸出过程中很少生成CuxS(1<x<2)物质。
NAVA等[30]、LEE等[36]以及PARKER等[37]对黄铜矿的氧化溶解途径作了进一步的补充。他们在电化学实验中发现黄铜矿脱铁分两种情况进行:1) 在电 位400~600 mV(vs Ag/AgCl),黄铜矿缓慢脱铁生成Cu1-xFe1-yS2 -z(y>x);2) 在电位600~700 mV (vs Ag/AgCl)区间,黄铜矿的脱铁步骤加快,生成Cu1-rFe1-sS2-t (r>x, s>y, s>r)物质。随着脱铁的完成,黄铜矿氧化生成CuS。
综上所述,黄铜矿的溶解途径主要包括脱铁、脱铜和单质硫氧化阶段。黄铜矿的脱铁速率相对脱铜要慢的多,但黄铜矿生成Cu1-xFe1-yS2-z(y>x)的速率更慢,是黄铜矿氧化溶解前期的限速步骤。当脱铜阶段完成后,黄铜矿氧化生成的单质硫会覆盖在矿物表面,形成钝化膜,从而抑制铜的持续浸出。在化学浸出中,单质硫的氧化非常困难。而在微生物浸出中,在合适条件下硫可继续被氧化成硫酸。比如,用中度嗜热混合菌浸出黄铜矿,单质硫进一步被氧化成硫酸,不仅减少了钝化产物硫还生成了硫酸,有利于铜的持续浸出使铜的浸出率明显提高。
3 结语
在生物浸出系统中,各种浸矿微生物相互联系相互影响和协同作用是它们之间较为常见的相互作用方式。混合菌群能更好地进行单类种群不能完成或不能高效完成的物质转化,提高各自的代谢活动,从而提高金属浸出率和浸出速率。通过沿用基础检测方法并结合较为先进的生态学方法和矿物学手段对特定浸出工艺过程中的微生物群落结构、群落动态以及微生物之间、微生物与矿物之间的相互作用的研究,进一步阐明浸矿微生物协同作用机制及各种生态规律。进而有选择地设计微生物群落优化浸矿菌群结构以显著提高矿物的浸出效率。然而,微生物浸出是一个复杂的过程,包含各类型的反应,如化学反应、电化学反应、生物反应与原电池反应等。而且浸矿微生物间的作用会受到温度、pH、矿石粒度、矿浆浓度、通气量、离子浓度等的不同程度影响。所以要想更多地了解和更好地利用这些浸矿微生物,还需要对这些微生物做更多更深入的探索。
REFERENCES
[1] RAWLINGS D E. Heavy metal mining using microbes [J]. Annual review of microbiology, 2002, 56: 65-91.
[2] BRIERLEY J A, BRIERLEY C L. Present and future commercial applications of biohydrometallurgy[J]. Hydrometallurgy, 2001, 59(2/3): 233-239.
[3] EECLESTON M, KELLY D P. Oxidation kinetics and chemostat growth of Thiobacillus ferrooxidans on trathionate and thiosulfate[J]. Journal of Bacteriology, 1978, 134(3): 718-727.
[4] LIZAMA H M, SUZUKI I. Bacterial leaching of a sulphide ore by Thiobacillus ferrooxidans and Thiobacillus thiooxidans: Ⅰ. Shake flask studies[J]. Biotechnology and Bioengineering, 1988, 32(1): 110-116.
[5] JAIN R, ASHISH P, SREEKRISHNAN T R, DASTIDAR M G. Autoheated thermophilic aerobic sludge digestion and metal bioleaching in a two-stage reactor system[J]. Journal of Environmental Sciences, 2010, 22(2): 230-236.
[6] GIAVENO A, DONATI E. Bioleaching of heazelwoodite by Thiobacillus spp. [J]. Process Biochemistry, 2001, 36(10): 955-962.
[7] XIA Le-xian, LIU Jian-she, XIAO Li, ZENG Jia, LI Ban-mei, GENG Mei-mei, QIU Guan-zhou. Single and cooperative bioleaching of sphalerite by two kinds of bacteria—Acidithiobacillus ferriooxidans and Acidithiobacillus thiooxidans[J]. Transactions of Nonferrous Metals of Society of China, 2008, 18(1): 190-195.
[8] GURUNG A, CHAKRABORTY R. The role of Acidithiobacillus ferrooxidans in alleviating the inhibitory effect of thiosulfate on the growth of acidophilic Acidiphilium species isolated from acid mine drainage samples from Garubathan, India[J]. Canadian Journal of Microbiology, 2009, 55(9): 1040-1048.
[9] LIU Hong-wei, YIN Hua-qun, DAI Yan-xia, DAI Zhi-min, LIU Yi, LI Qian, JIANG Hui-dan, LIU Xue-duan. The co-culture of Acidithiobacillus ferrooxidans and Acidiphilium acidophilum enhances the growth, iron oxidation, and CO2 fixation[J]. Arch Microbiol, 2011, 193(12): 857-866.
[10] GAUTIER V, ESCOBAR B, VARGAS T. Cooperative action of attached and planktonic cells during bioleaching of chalcopyrite with Sulfolobus metallicus at 70 ℃[J]. Hydrometallurgy, 2008, 94(1/4): 121-126.
[11] 邹 平. 中高温菌组合浸出黄铜矿及细菌种群结构和演替规律研究[D]. 昆明: 昆明理工大学, 2008: 3-6.
ZHOU Ping. The research about the bioleaching of chalcopyrite with mesophilic and thermophilic bacteria and the law of bacteria community structure and succession[D]. Kunming: Kunming University of Science and Technology, 2008: 3-6
[12] HE Zhi-guo, YIN Zhen, WANG Xin, ZHONG Hui, SUN Wei. Microbial community changes during the process of pyrite bioleaching[J]. Hydrometallurgy, 2012, 125/126: 81-89.
[13] ZHOU Hong-bo, ZENG Wei-min, YANG Zhi-feng, XIE Ying-jian, QIU Guan-zhou. Bioleaching of chalcopyrite concentrate by a moderately thermophilic culture in a stirred tank reactor[J]. Bioresource Technology, 2009, 100(2): 515-520.
[14] ZHANG R B, WEI M M, JI H G, CHEN X H, QIU G Z, ZHOU H B. Application of real-time PCR to monitor population dynamics of defined mixed cultures of moderate thermophiles involved in bioleaching of chalcopyrite[J]. Applied Microbiology and Biotechnology, 2009, 81(6): 1161-1168.
[15] 申 丽, 刘学端, 邱冠周. 基于基因芯片对微生物基因功能与群落结构分析的硫化矿生物浸出分析[J]. 生物工程学报, 2008, 24(6): 968-974.
SHEN Li, LIU Xue-duan, QIU Guan-zhou. Gene function and microbial community structure in sulfide minerals bioleaching system based on microarray analysis[J]. Chinese Journal of Biotechnology, 2008, 24(6): 968-974.
[16] GILCHRIST D A, FARGO D, ADELMAN K. Using ChIP-chip and ChIP-seq to study the regulation of gene expression: Genome-wide localization studies reveal widespread regulation of transcription elongation[J]. Methods, 2009, 48(4): 398-408.
[17] QIU Guan-zhou, LIU Xue-duan, ZHOU Hong-bo. Microbial community structure and function in sulfide ore bioleaching systems[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(6): 1295-1301.
[18] YIN Hua-qun, CAO Lin-hui, QIU Guan-zhou, ZHOU Ji-zhong, DAI Zhi-min, LIU Xue-duan. Development and evaluation of 50-mer oligonucleotide arrays for detecting microbial populations in acid mine drainages and bioleaching systems[J]. Journal of Microbiological Methods, 2007, 70(1): 165-178.
[19] LIU Yi, YIN Hua-qun, ZENG Wei-min, LIANG Yi-li, LIU Yao, FU Xian, LIU Xue-duan. The effect of the introduction of exogenous strain Acidithiobacillus thiooxidans A01 on functional gene expression, structure and function of indigenous consortium during pyrite bioleaching[J]. Bioresource Technology, 2011, 102(17): 8092-8098.
[20] GUIBAUD G, COMTE S, BORDAS F, DUPUY S, BAUDU M. Comparison of complexation potential of extracellular polymeric substances (EPS), extracted from activated sludges and produced by pure bacteria strains for cadmium, lead and nickel[J]. Chemosphere, 2005, 59(5): 629-638.
[21] HARNEIT K, GOKSEL A, KOCK D, KLOCK J H, GEHRKE T, SAND W. Adhesion to metal sulfide surfaces by cells of Acidithiobacillus ferrooxidans, Acidithiobacillus thiooxidans and Leptospirillum ferrooxidans[J]. Hydrometallurgy, 2006, 83(1/4): 245-254.
[22] 曾伟民. 黄铜矿生物浸出过程中钝化膜的形成机制及其消除方法探讨[D]. 长沙: 中南大学资源加工与生物工程学院, 2011: 43-44.
ZENG Wei-min. The formation mechanism of passivation layer and its elimination way during bioleaching of chalcopyrite[D]. Changsha: School of Minerals Processing and Bioengineering, Central South University, 2011: 43-44.
[23] BEECH W B, SUNNER J. Biocorrosion: Towards understanding interactions between biofilms and metals[J]. Current Opinion in Biotechnology, 2004, 15(3): 181-186.
[24] KINZLER K, GEHRKE T, TELEGDI J, SAND W. Bioleaching-a result of interfacial processes caused by extracellular polymeric substances (EPS)[J]. Hydrometallurgy, 2003, 71(1/2): 83-88.
[25] SAND W, GEHRKE T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron (Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology, 2006, 157(2): 49-56.
[26] RUSIN P. 用生物还原法提高难处理氧化矿中银和其他金属的浸出率[J]. 湿法冶金,1995, 53(1): 78-82.
RUSIN P. Improving the extraction percentage of silver and other metals in refractory oxide ore with biological reduction method[J]. Hydrometallurgy, 1995, 53(1): 78-82.
[27] THOMAS G, INGRAHAM T R, MACDONALD R J C. Kinetics of dissolution of synthetic digenite and chalcocite in aqueous acidic ferric sulphate solutions[J]. Canadian Metallurgical Quarterly, 1967, 6(3): 281-292.
[28] 刘纯鹏. 铜的湿法冶金物理化学[M]. 北京: 中国科学技术出版社, 1991: 2.
LIU Chun-peng. Physical chemistry of the copper hydrometallurgy[M]. Beijing: China Science and Technology Press, 1991: 2.
[29] 黄国智. 斑铜矿与磨矿介质之间的电化学作用及其对可浮性的影响[J]. 国外金属矿选矿, 2009, 46(1): 1-2.
HUANG Guo-zhi. Electrochemical interaction between bornite and grinding media and its effect on the floatability[J]. Metallic Ore Dressing Abroad, 2009, 46(1): 1-2.
[30] NAVA D, GONZALEZ I. Electrochemical characterization ofchemical species formedduring theelectrochemicaltreatment of chalcopyrite in sulfuric acid[J]. Electrochimica Acta, 2006, 51(25): 5295-5303.
[31] MIKHLIN Y L, TOMASHEVICH Y V, ASANOV I P, OKOTRUB A V, VARNEK V A, VYALIKH D V. Spectroscopicandelectrochemical characterizationof the surfacelayers of chalcopyrite (CuFeS2) reacted in acidic solutions[J]. AppliedSurfaceScience, 2004, 225(1/4): 395-409.
[32] DUTRIZAC J E. The kinetics of dissolution of chalcopyrite in ferric ion media[J]. Metallurgical and Materials TransactionsB, 1978, 9(3): 431-439.
[33] SHUEY R T. Semiconducting ore minerals, developments in economic geology series[M]. New York: Elsevier Scientific Publishing company, 1975: 242.
[34] ACRES R G, HARMER S L, BEATTIE D A. Synchrotron XPS studies of solution exposed chalcopyrite, bornite, and heterogeneous chalcopyrite with bornite[J].International Journal of Mineral Processing, 2010, 94(1/2): 43-51.
[35] ACRES R G, HARMER S L, BEATTIE D A. Synchrotron XPS, NEXAFS, and ToF-SIMS studies of solution exposed chalcopyrite and heterogeneous chalcopyrite with pyrite[J]. Minerals Engineering, 2010, 23(11/13): 928-936.
[36] LEE M S, NICOL M J, BASSON P. Cathodic processes in the leaching and electrochemistry of covellite in mixed sulfate-chloride media[J]. Journal of Applied Electrochemistry, 2008, 38(3): 363-369.
[37] PARKER G K, WOODS R, HOPE G A. Raman investigation of chalcopyrite oxidation[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2008, 318(1/3): 160-168.
(编辑 李艳红)
基金项目:国家自然科学青年科学基金项目(31200382);中央高校基本科研业务费青年教师助推项目(1177-721500273)
收稿日期:2012-11-15;修订日期:2013-06-20
通信作者:曾伟民,副教授,博士;电话:0731-88877472;E-mail: zengweimin1024@gmail.com
摘 要:在生物浸出过程中,不同类型的浸矿微生物相互影响、相互促进,提高各自的代谢活动,从而提高金属浸出率。综述浸矿微生物协同作用的类型铁氧化菌与硫氧化菌、自养菌与异养菌、吸附菌与游离菌以及常温菌与高温菌的协同作用以及它们之间的作用机制,并分析协同作用的研究思路及生物浸出过程中矿物的溶解途径,重点介绍协同作用的研究方法和关键代谢产物及其作用。
[11] 邹 平. 中高温菌组合浸出黄铜矿及细菌种群结构和演替规律研究[D]. 昆明: 昆明理工大学, 2008: 3-6.
[15] 申 丽, 刘学端, 邱冠周. 基于基因芯片对微生物基因功能与群落结构分析的硫化矿生物浸出分析[J]. 生物工程学报, 2008, 24(6): 968-974.
[22] 曾伟民. 黄铜矿生物浸出过程中钝化膜的形成机制及其消除方法探讨[D]. 长沙: 中南大学资源加工与生物工程学院, 2011: 43-44.
[26] RUSIN P. 用生物还原法提高难处理氧化矿中银和其他金属的浸出率[J]. 湿法冶金,1995, 53(1): 78-82.
[28] 刘纯鹏. 铜的湿法冶金物理化学[M]. 北京: 中国科学技术出版社, 1991: 2.
[29] 黄国智. 斑铜矿与磨矿介质之间的电化学作用及其对可浮性的影响[J]. 国外金属矿选矿, 2009, 46(1): 1-2.


