文章编号:1004-0609(2015)-11-3237-08
新型功能化吸附剂G-PA-SBA-15对U(VI)的吸附机理
彭国文1, 2, 3,肖方竹2,丁德馨 2,张志军2,胡 南2,王晓亮1,周 归4,黄 红4,杨锦然4
(1. 南华大学 化学化工学院,衡阳 421001;
2. 南华大学 铀矿冶生物技术国防重点学科实验室,衡阳 421001;
3. 中南大学 资源与安全工程学院,长沙 410083;
4. 南华大学 船山学院,衡阳 421001)
摘 要:
采用啤酒酵母菌为生物大孔模板,三嵌段聚合物(P123)为介孔相模板制备合成介孔氧化硅SBA-15。再采用Fe3O4为铁源,二乙基磷酰乙基三乙氧基硅烷(PTS)和氨丙基三乙氧基硅烷(APS)为有机改性基团,通过后嫁接法使有机改性基团对介孔氧化硅SBA-15进行功能化改性,得到新型功能化吸附剂G-PA-SBA-15,并通过扫描电镜、粉末X射线衍射和比表面分析仪分别表征吸附剂G-PA-SBA-15和SBA-15的结构。考察溶液pH值、吸附时间、铀初始浓度和温度等因素对吸附剂G-PA-SBA-15和SBA-15吸附铀的影响。结果表明:吸附剂G-PA-SBA-15直径均匀分布、孔径均一,吸附铀的最佳条件是pH值为6.0、吸附时间为1.0 h、铀初始浓度为20 mg/L和吸附反应温度为25 ℃。对吸附动力学模型和吸附等温模型进行分析,G-PA-SBA-15对铀的吸附动力学过程符合准二级动力学模型(相关系数R2均大于0.99), 吸附等温线符合BET等温线模型,说明该吸附体系是一个多层吸附过程。
关键词: 介孔氧化硅SBA-15; 功能化改性; 铀; 吸附动力学; 吸附等温线
中图分类号: O647.3;TQ317 文献标志码:A
Adsorption mechanisms of uranium (VI) from aqueous solution by G-PA-SBA-15
PENG Guo-wen1, 2, 3, XIAO Fang-zhu2, DING De-xin2, ZHANG Zhi-jun2,
HU Nan2, WANG Xiao-liang1, ZHOU Gui4, HUANG Hong4, YANG Jin-ran4
(1. School of Chemistry and Chemical Engineering, University of South China, Hengyang 421001, China;
2. Key Discipline Laboratory for National Defence for Biotechnology in Uranium Mining and Hydrometallurgy,
University of South China, Hengyang 421001, China;
3. School of Resources and Safety Engineering, Central South University, Changsha 410083, China;
4. Wang Chuanshan College, University of South China, Hengyang 421001, China)
Abstract: Mesoporous silica SBA-15 was synthesized using Saccharomyces Cerevisiae as the biological macroporous templet, and using P123 as the mesoporous phase templet. The novel functional adsorbent G-PA-SBA-15 was prepared using Fe3O4 as the iron source, and using PTS and APS as the organic modification group by the functional modification of mesoporous silica SBA-15 after grafting. SEM, XRD and BET were used to characterize the structures of G-PA-SBA-15 and SBA-15, and the effects of pH value, adsorption time, initial concentration of uranium ions and temperature on the adsorption of G-PA-SBA-15 and SBA-15 on uranium were investigated. The results show that the optimal uranium adsorption conditions are as follows: the pH of the solution is 6.0; the adsorption time is 1.0 h; the initial concentration of uranium ions is 20 mg/L and the adsorption temperature is 25 ℃. The adsorption kinetic models and the adsorption isotherm models of G-PA-SBA-15 on uranium were studied. The kinetic models of G-PA-SBA-15 can be described by the pseudo-second-order model well, its correlation coefficient are all above 0.99 (R2>0.99), and isotherm models are fitted to BET adsorption models, indicating that the adsorption process is a multilayer adsorption process.
Key words: mesoporous silica SBA-15; functional modification; uranium; adsorption kinetics; adsorption isotherm
核能作为一种清洁、环保和安全的能源,在世界各国倡导节能减排的大背景下凸显其使用优势[1]。铀作为重要的核燃料,在开采和利用过程中会产生大量的含铀废水。这些废水不仅具有放射性,还有很强的化学毒性,若不妥善处理,将会对生态环境和人类健康造成潜在危害。因此,必须加强对含铀废水的处理[2-3]。吸附法具有操作简单、铀去除率高且经济高效等优点,因而被认为是目前处理含铀废水的最佳方法。其中,选择合适的吸附剂是其研究的关键[4]。但现有的吸附剂存在吸附量低、吸附速率慢和选择性吸附效果不强等缺点,因此,寻找新型功能化吸附剂具有十分重要的现实意义[5]。
介孔氧化硅材料具有比表面积大、吸附能力强和良好的化学稳定性和热稳定性,并且具有耐酸和耐辐照等特点,近年来已有很多学者将其应用于放射性废水处理,并取得较好的研究成果[6-8]。然而,介孔二氧化硅材料本身并不具有活性中心,从而使其在放射性废水处理应用中受到很大的限制[9]。为了扩展介孔二氧化硅材料的应用范围,将其更加有效地应用于放射性废水处理,可以通过引入金属原子及其氧化物、或有机官能团对其表面进行功能化改性,使其具有特殊功能。
本文作者首先以啤酒酵母菌为生物大孔模板,以三嵌段聚合物P123为介孔相模板,制备合成介孔氧化硅SBA-15。再以Fe3O4为铁源,以二乙基磷酰乙基三乙氧基硅烷(PTS)和氨丙基三乙氧基硅烷(APS) 为有机改性基团,采用后嫁接法使其对介孔氧化硅SBA-15进行功能化改性,得到新型功能化吸附剂G-PA-SBA-15,研究了溶液pH 值、反应时间、铀初始浓度和温度等因素对其吸附铀的影响,并分析该吸附剂对铀的吸附性能和机理。
1 实验
1.1 主要试剂与仪器
主要试剂:啤酒酵母菌(采自于燕京啤酒衡阳分公司,经预处理后储存备用)。三嵌段聚合物(P123)、正硅酸乙酯(TEOS)、二乙基磷酰乙基三乙氧基硅烷(PTS)、氨丙基三乙氧基硅烷(APS)均为化学纯。铀标准溶液采用文献[10]方法配制,再根据实验需要稀释成对应浓度。其他试剂均为分析纯。
主要仪器:扫描电子显微镜(Hitachi S-4800型);X射线衍射仪(Rigaku/max-RA型);比表面吸附仪(BET Rise-1030型)。
1.2 新型功能化吸附剂G-PA-SBA-15的制备
1.2.1 介孔氧化硅SBA-15的合成
称取30 g所采集的啤酒酵母废弃菌丝体,经过80 ℃高温灭菌100 min后,使用蒸馏水和无水乙醇清洗3次,将所得啤酒酵母菌菌体分散在装有100 mL蒸馏水的烧杯中。然后将10 mL质量浓度为35% 浓盐酸加入烧杯中,并向其中加入1.5 g P123,在30 ℃恒温水浴下磁力搅拌直至P123完全溶解于盐酸溶液中,随后往其中加入6.5 g正硅酸乙酯,在45 ℃恒温水浴下继续磁力搅拌1.5 h,此时烧杯出现了大量的乳白色沉淀。然后将烧杯放入30 ℃的恒温鼓风干燥箱中继续反应12 h。再将悬浮液转移至聚四氟乙烯反应釜中反应2.0 h,随后在60 ℃的恒温鼓风干燥箱中继续老化48 h。取出后减压过滤,使用蒸馏水和无水乙醇将所得到的沉淀各洗涤3次,将乳白色沉淀在60 ℃的恒温鼓风干燥箱中继续干燥15 h,然后将干燥后得到的乳白色粉末置于540 ℃的马弗炉中焙烧6.0 h,去除模板即得到介孔氧化硅SBA-15。
1.2.2 介孔氧化硅SBA-15的功能化改性
将0.9 g上述合成的SBA-15悬浮于90 mL甲苯溶液中,将0.21 g按照文献[3]方法制备的纳米Fe3O4粒子放入三口烧瓶中,加入乙醇进行超声分散,随后将SBA-15悬浮液和28 mL浓盐酸加入三口烧瓶中,充分搅拌2.0 h。再将0.985 g DPTS和0.663 g APS先后迅速加入到上述溶液中,加热至120℃使甲苯溶液回流6 h,冷却至室温,减压过滤,用蒸馏水和无水乙醇将沉淀洗涤各3次,在60 ℃的恒温鼓风干燥箱中烘干12 h,得到新型功能化吸附剂G-PA-SBA-15。
新型功能化吸附剂G-PA-SBA-15的合成路线如图1所示。
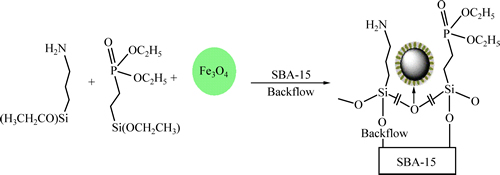
图1 G-PA-SBA-15的合成路线
Fig. 1 Synthetic route of G-PA-SBA-15
1.3 样品表征
采用SEM在加速电压为10.0 kV下观察介孔氧化硅SBA-15和新型功能化吸附剂G-PA-SBA-15的形貌。在X射线衍射仪上做了粉末X射线衍射,辐射源为Cu Kα,电压为40 kV,电流为20 mA,扫描的2θ范围为1°~6°,扫描速率为0.6(°)/min。采用比表面吸附仪对样品的比表面积和孔结构进行分析。
1.4 吸附实验
在一系列锥形瓶中,分别加入5.0 mg吸附剂G-PA-SBA-15和SBA-15以及50 mL不同浓度的铀标准溶液置于150 mL圆底烧瓶中,使用浓度为0.1 mol/L的HCl或NaOH溶液调节溶液pH值,在室温下磁力搅拌3.0 h,待吸附反应完成后,使用10000 r/min的离心机进行分离10 min,取上清液并采用三氯化钛还原/钒酸铵氧化滴定法测定铀的剩余浓度,并根据吸附前后溶液中铀的浓度计算吸附剂G-PA-SBA-15和SBA-15对铀的单位吸附量q(mg/g)。
吸附剂G-PA-SBA-15和SBA-15对铀的单位吸附量q按照式(1)计算:
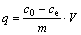 (1)
(1)
式中:q 为单位吸附量,mg/g;c0为吸附前铀的质量浓度,mg/L;ce为吸附平衡时铀的质量浓度,mg/L;V为吸附液的体积,L;m为吸附剂的质量,g。
2 结果与讨论
2.1 吸附剂的表征
2.1.1 扫描电镜分析

图2 SBA-15和G-PA-SBA-15的SEM像
Fig. 2 SEM images of SBA-15 (a) and G-PA-SBA-15 (b)
图2所示为SBA-15和G-PA-SBA-15经过扫描电镜进行结构表征的结果。从图2 (a)中可以分析发现,SBA-15是由棒状纳米粒子组成的,而且横截面为规则的六边形,SBA-15粒子的平均尺度约为200 nm。
从图2 (b)可看出,介孔氧化硅SBA-15经过纳米Fe3O4粒子磁性修饰和磷脂、氨基双功能团改性后得到的新型功能化吸附剂G-PA-SBA-15以300~350 nm的直径均匀分布,表面凹凸不平,具有较多的孔隙,为吸附铀提供了较大的表面积和更多的吸附位点,这为高效选择性吸附分离铀酰离子创造了较好的条件。
2.1.2 X射线粉末衍射分析
图3(a)所示为介孔氧化硅SBA-15的 XRD谱。从图3(a)可以看出SBA-15在0°~2.0°小角范围内(100)、(110)、(200)面具有3个较强的衍射峰,这说明介孔氧化硅SBA-15具有典型的一维六方孔道结构。
图3(b)所示为新型功能化吸附剂G-PA-SBA-15的 XRD谱,由图3(b)可知G-PA-SBA-15具有和 SBA-15 相似一维六方孔道结构的特征衍射峰。这说明介孔氧化硅SBA-15经过纳米Fe3O4粒子磁性修饰和磷脂、氨基双功能团改性后,没有改变SBA-15的一维六方孔道结构。对比G-PA-SBA-15和SBA-15可以发现,在 1.5°~2°之间G-PA-SBA-15的峰型明显变弱,强度在磁性修饰和磷脂、氨基双功能团改性后有所降低,这主要是SBA-15由于磁性修饰和磷脂、氨基双功能团改性后孔道中填入了有机物和铁的氧化物,因此导致了峰强度的降低。这也间接说明SBA-15已经成功的进行了纳米Fe3O4粒子磁性修饰和磷脂、氨基双功能团改性。
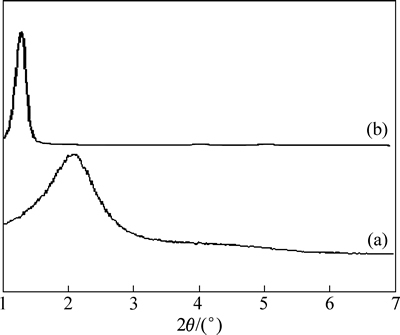
图3 SBA-15和G-PA-SBA-15的XRD谱
Fig. 3 XRD patterns of SBA-15 (a) and G-PA-SBA-15 (b)
2.1.3 孔结构分析
采用BET 分析法对SBA-15和G-PA-SBA-15的孔结构和比表面积进行分析,样品在150 ℃下经脱气处理后进行氮气吸附,表面积测定采用BET 模式, 孔径分布采用BJH 模式进行分析。结果如表1所列,G-PA-SBA-15的比表面积为599.85 m2/g,孔容为0.63251 cm3/g。与SBA-15相比,G-PA-SBA-15的比表面积有所减少,但是孔容明显增大。因此,G-PA-SBA-15对铀的有效吸附位点多于SBA-15的。
表1 样品的比表面积和孔容
Table 1 Surface area (SBET) and specific pore size (B) of adsorbents
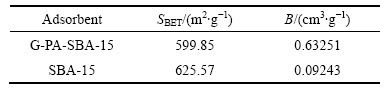
2.2 pH值对铀的吸附效果的影响
溶液 pH 是影响吸附的一个重要的因素,它不仅可以改变吸附剂表面的荷电状态,而且还可以影响金属的形态和金属离子与吸附剂的结合位点。图4所示为溶液pH值对铀的单位吸附量的影响曲线。
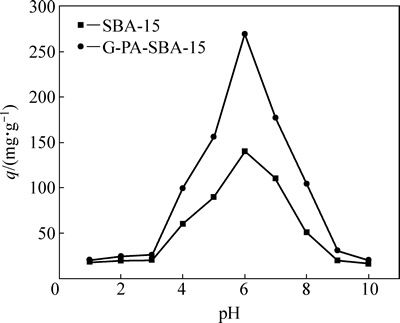
图4 溶液pH值对铀的单位吸附量的影响
Fig. 4 Effect of pH on uranium adsorption efficiency by G-PA-SBA-15 and SBA-15
由图4可知,溶液的pH对吸附剂G-PA-SBA-15和SBA-15吸附铀均有很大的影响,当溶液pH在1.0~3.0时,吸附剂G-PA-SBA-15和SBA-15对铀的吸附量随着溶液pH值的上升而缓慢增长。这是由于在溶液pH值较低时(pH<3.0),接枝在SBA-15表面上的磷酯和氨基功能团被质子化,从而形成—(H5C2O)P=OH+和—NH2H+等带正电的离子,与此时在铀溶液存在的带正电荷的UO22+产生静电排斥,导致吸附剂吸附铀效果不明显,单位吸附量增量较小。另一方面,溶液pH值较低时H+离子与UO22+竞争吸附位点,即竞争吸附剂表面上的一定有限量的吸附位点,这也将影响吸附剂对铀的吸附效果。
当pH值大于3.0后,吸附剂G-PA-SBA-15对铀的吸附量随着pH的上升而呈线性增长,吸附性能明显优于SBA-15的。这是由于随着溶液pH值的增大,G-PA-SBA-15表面上的磷酯和氨基功能基团却发生去质子化,从而带上负电性。尽管铀在高pH值的溶液中发生水解作用,但是溶液pH值在3.0~6.0时,铀仍然以带正电荷的离子UO2(OH)+和(UO22+)3(OH)5+等形式存在[11-12]。因此,吸附剂G-PA-SBA-15表面的功能团与铀酰离子之间的静电排斥作用就消失了,再通过有机改性功能团的O、N、P等原子配位作用或氢键作用,从而实现与铀酰离子发生相互吸附作用,使G-PA-SBA-15对铀的吸附量有所增加。
当pH值超过6.0后,大量存在的OH-将与UO22+结合,导致UO22+发生强烈的水解作用,并生成大量的沉淀,使其浓度急剧下降,从而造成吸附剂对铀的吸附量降低。同时,在碱性环境中,溶液中的CO32-和HCO3-均有增加,它们将与UO22+形成稳定的配合物,也会造成吸附降低[13]。因此,吸附剂G-PA-SBA-15和SBA-15对铀吸附的最佳溶液pH值均为6.0。
2.3 吸附时间对铀的吸附效果的影响
为了研究吸附剂G-PA-SBA-15和SBA-15对铀的吸附速率,本实验中考察了不同的吸附时间对吸附剂G-PA-SBA-15和SBA-15吸附铀的单位吸附量的影响,结果如图5所示。
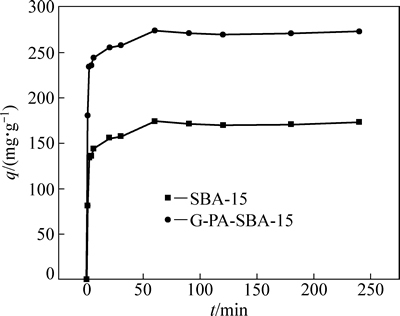
图5 吸附时间对铀的吸附效果的影响
Fig. 5 Effect of adsorption time on uranium adsorption efficiency by G-PA-SBA-15 and SBA-15
从图5中可看出,可将G-PA-SBA-15和SBA-15对铀的吸附过程分为2个阶段。第一个阶段是从0到6 min,G-PA-SBA-15和SBA-15对铀的吸附量随着时间的延长而迅猛上升,而且G-PA-SBA-15单位吸附容量明显大于SBA-15的。这是由于G-PA-SBA-15比表面积大,其表面有大量的吸附位点可与铀酰离子发生配位,从而吸附量增速较快。第二个阶段是在6 min以后,此时绝大部分G-PA-SBA-15表面的吸附位点被铀占据,而且G-PA-SBA-15是无限延伸的长程有序的内部介孔孔道结构,铀酰离子在孔道内部的吸附需要经过较长时间才能到达孔道内部,因而该过程中吸附量随着时间的延长而缓慢上升。并在60 min处吸附达到平衡,最大吸附量可达到274.46 mg/g。
2.4 铀的初始浓度对铀的吸附的影响
金属离子的浓度和溶液 pH 值作为溶液的主要化学状态指标,两者均是决定吸附剂对目标金属离子吸附效果的重要因素[14]。本实验中考察了铀的初始浓度对铀的单位吸附量的影响,结果如图6所示。
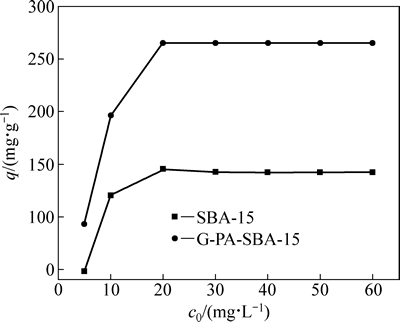
图6 铀初始浓度对铀的吸附效果的影响
Fig. 6 Effect of uranium initial concentration on uranium adsorption efficiency by G-PA-SBA-15 and SBA-15
从图6中可看出,铀的初始浓度对G-PA-SBA-15和SBA-15吸附铀的单位吸附量有很大影响。当铀的初始浓度从 5 mg/L提高到 20 mg/L时,G-PA-SBA-15吸附铀的单位吸附量从93.20 mg/g增加到265.11 mg/g。但是,当铀的初始浓度超过20 mg/L时,继续提高其浓度,吸附剂G-PA-SBA-15吸附铀的单位吸附量几乎没有增加。这是由于当溶液中铀的浓度在5~20 mg/L时,G-PA-SBA-15表面基团未达到饱和状态,对溶液中铀的吸附无制约作用。此时吸附剂G-PA-SBA-15的投加量保持不变,当溶液中铀的浓度增加时,吸附剂G-PA-SBA-15表面液膜和溶液本体之间产生了较大的浓度差,铀酰离子向吸附剂G-PA- SBA-15表面移动,并不断聚集在吸附剂表面,有利于吸附剂G-PA-SBA-15对铀酰离子的吸附,从而增加吸附剂G-PA-SBA-15对铀的吸附量。当溶液中铀的浓度超过20 mg/L时,由于吸附剂G-PA-SBA-15表面基团基本已达饱和吸附状态,因此,G-PA-SBA-15表面的单位吸附量不会随着铀浓度的升高而显著增大[15]。
2.5 温度对铀的吸附的影响

图7 温度对铀的吸附效果的影响
Fig. 7 Effect of temperature on uranium adsorption efficiency by G-PA-SBA-15 and SBA-15
为了研究不同温度对吸附剂G-PA-SBA-15和SBA-15吸附铀的影响,本实验考察了不同温度对单位吸附量的影响(见图7)。
从图7中可看出,在15~25 ℃温度变化范围中,随着温度变化,吸附剂G-PA-SBA-15和SBA-15对铀的单位吸附量均随着温度的升高而增长。但是当温度超过25 ℃后,温度变化对吸附剂G-PA-SBA-15吸附铀的影响不大,单位吸附量几乎保持不变。因此,在15~25 ℃温度变化范围中吸附剂对铀的单位吸附量随温度的升高而增大,说明在该吸附过程可能为吸热反应。其中,15~25 ℃区间内铀的单位吸附量增加幅度大于25~95 ℃区间的铀的单位吸附量增加幅度,这可能是由于温度升高导致吸附剂对铀的解吸作用增强,导致温度超过25 ℃后,温度变化对吸附剂G-PA-SBA-15和SBA-15吸附铀的影响不大。
2.6 G-PA-SBA-15对铀的吸附动力学
本实验中在铀浓度为20 mg/L、吸附剂G-PA-SBA-15的投加量为5.0 mg、溶液的pH 值为6.0的条件下,分别采用准一级和准二级反应动力学模型对吸附剂G-PA-SBA-15在15、25和35 ℃等温度下吸附铀的结果进行拟合分析(见表2)。qe, exp为实验测定的最大饱和吸附量;q1, cal和q2, cal分别为拟合吸附量。
从表2可以看出,在15、25和35 ℃,由准一级反应动力学模型计算所得到的相关系数R2分别为0.9612、0.9688和0.9694,而由准二级反应动力学模型所计算得到的相关系数R2分别为0.9913、0.9935和0.9949。结果表明:通过准二级反应动力学模型对吸附剂G-PA-SBA-15吸附铀过程的拟合,结果明显好于准一级反应动力学模型。另外,由准二级反应动力学模型所求算出来的吸附量与实验数据较为吻合。 这就表明:吸附剂G-PA-SBA-15吸附铀过程可以采用准二级反应动力学模型进行描述。同时,根据准二级反应动力学模型建立的机理,可推测G-PA-SBA-15在吸附铀的过程中,质量扩散对其吸附速率的影响基本可以忽略,这一过程主要是化学吸附过程[16]。出现这一现象的主要原因是吸附剂G-PA-SBA-15表面改性的有机官能团与铀酰离子发生了化学吸附反应。
2.7 G-PA-SBA-15对铀的吸附等温线
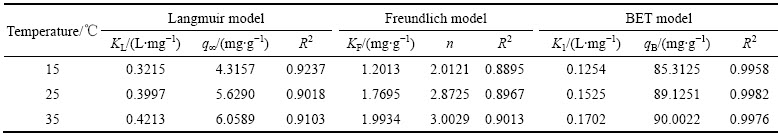
吸附等温线模型描述的是在一定温度下吸附剂对重金属离子的平衡吸附量与平衡浓度之间的变化关系。本实验在铀浓度20 mg/L、吸附剂G-PA-SBA-15的投加量为5.0 mg、溶液 pH 值为6.0的条件下,采用Langmuir、Freundlich和BET 3种吸附等温线来拟合吸附剂G-PA-SBA-15分别在15、25和35 ℃温度下对铀振荡吸附1.0 h后的等温吸附过程,拟合结果如表3所列。
从表3可以看出,在15、25和35 ℃,由Langmuir 吸附等温模型所得到的相关拟合系数R2分别为0.9237、0.9018和0.9103,由Freundlich吸附等温模型所得到的相关拟合系数R2分别为0.8895、0.8967和0.9013。而由BET吸附等温模型所得到的相关拟合系数R2明显优于前2种吸附等温模型所得到的相关拟合系数R2,分别为0.9958、0.9982和0.9976,说明BET吸附等温模型可以较为准确地对吸附剂G-PA-SBA-15吸附铀过程的进行描述。因此,吸附剂G-PA-SBA-15的吸附行为是由于指定位点对铀酰离子发生了二次吸附作用,这也符合BET吸附等温模型。
表2 G-PA-SBA-15对铀的吸附动力学参数
Table 2 Adsorption kinetic parameters of uranium by G-PA-SBA-15
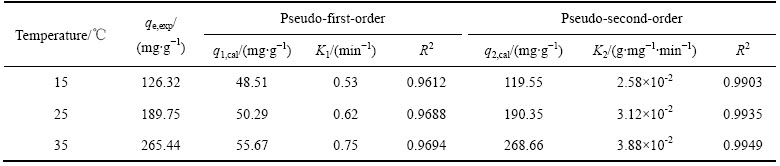
表3 G-PA-SBA-15吸附铀的等温线参数
Table 3 Kinetic parameters of uranium adsorption by G-PA-SBA-15
3 结论
1) 扫描电镜结构表征分析表明,SBA-15横截面呈规则的六边形,粒子的平均长度约为200 nm。SBA-15经过磁性修饰和磷脂、氨基双功能团改性后,所得到的新型功能化吸附剂G-PA-SBA-15以300~350 nm的直径均匀分布、孔径极为均一,这为高效选择性吸附分离铀酰离子创造了较好的条件。因此,G-PA-SBA-15吸附铀的最大吸附容量高达274.46 mg/g,在第一阶段吸附6 min时就接近吸附平衡点。
2) 经过粉末X射线衍射结果分析,与SBA-15相比,G-PA-SBA-15仍然具有一维六方孔道结构,只是发现在 1.5°~2°之间G-PA-SBA-15的峰型明显变弱,强度在磁性修饰和磷脂、氨基双功能团改性后有所降低。这主要是由于SBA-15由于磁性修饰和磷脂、氨基双功能团改性后孔道中填入了有机物和铁的氧化物,因此导致了峰强度的降低。这也间接说明SBA-15已经成功的进行了纳米Fe3O4粒子磁性修饰和磷脂、氨基双功能团改性。
3) G-PA-SBA-15吸附铀达到最大吸附量时的pH值为6.0,反应时间为1.0 h,铀的初始浓度为20 mg/L,吸附反应温度为25 ℃。
4) G-PA-SBA-15吸附铀的动力学研究表明,G-PA-SBA-15吸附铀过程可以采用准二级反应动力学模型进行描述,这可推测G-PA-SBA-15吸附铀的过程主要是化学吸附过程。
5) 吸附剂G-PA-SBA-15吸附铀的行为符合BET 吸附等温模型,这一吸附行为是由于指定位点对铀酰离子发生了二次吸附作用。
REFERENCES
[1] 杨 辰, 房 超, 童节娟. 中国发展核能的必要性[J]. 核动力工程, 2014, 35(S1): 200-202.
YANG Cheng, FANG Chao, TONG Jie-juan. Necessity of developing nuclear energy in China[J]. Nuclear Power Engineering, 2014, 35(S1): 200-202.
[2] PENG Guo-wen, DING De-xin, XIAO Fang-zhu, WANG Xiao-liang, HU Nan, WANG Yong-dong, DAI Yi-min, CAO Zhong. Adsorption of uranium ions from aqueous solution by aminegroup functionalized magnetic Fe3O4 nanoparticle[J]. J Radioanal Nucl Chem, 2014, 301: 781-788.
[3] 彭国文, 丁德馨, 胡 南, 杨雨山, 王晓亮. 纳米Fe3O4负载啤酒酵母菌对铀的吸附性能与机理[J]. 中国有色金属学报, 2012, 22(2): 604-610.
PENG Guo-wen, DING De-xin, HU Nan, YANG Yu-shan, WANG Xiao-liang. Adsorption properties and mechanism of Saccharomyces cerevisiae loaded by nano-Fe3O4 on uranium[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(2): 604-610.
[4] 李宏宇, 申利红, 张 乐, 李培佑. 咪唑型功能离子液体合成及其对铀(VI)的萃取[J]. 原子能科学技术, 2014, 48(3): 390-394.
LI Hong-jun, SHEN Li-hong, ZHANG Le, LI Pei-you. Synthesis of imidazole-type TSIL and extraction for uranium(VI)[J]. Atomic Energy Science and Technology, 2014, 48(3): 390-394.
[5] 刘淑娟, 李金英, 罗明标, 花 榕, 林海渌, 马建国. 甲醛改性多壁碳纳米管吸附铀的性能研究[J]. 原子能科学技术, 2013, 47(1): 7-13.
LIU Shu-juan, LI Jin-ying, LUO Ming-biao, HUA Rong, LIN Hai-lu, MA Jian-guo. Adsorption of uranium with multiwall carbon nanotubes modified by formaldehyde[J]. Atomic Energy Science and Technology, 2013, 47(1): 7-13.
[6] WANG Xiao-liang, PENG Guo-wen, YANG Yan, WANG Yang-fei, HE Ting-ting. Uranium adsorption by dry and wet immobilized Saccharomyces cerevisiae[J]. J Radioanal Nucl Chem, 2012, 291: 825-830.
[7] VIDYA K, DAPURKAR S E, SELVAM P, BADAMALIB S K, GUPTA N M. The entrapment of UO22+ mesoporous MCM-41 and MCM-48 molecular sieves[J]. Microporous and Mesoporous Materials, 2001, 50: 173-179.
[8] SHI Wei-qun, ZHAO Yu-liang, CHAI Zhi-fang. A preview of nano-materials and nano-technologies applied in advanced nuclear energy systerm[J]. Prog Chem, 2011, 23: 1478-1484.
[9] 郭 风, 朱桂茹, 高从堦. 有机-无机杂化介孔二氧化硅在环境保护中的应用[J]. 化学进展, 2011, 23(6): 1237-1250.
GUO Feng, ZHU Gui-ru, GAO Cong-jie. Organic-inorganic hybrid mesoporous silicas and their applications in environmental protection[J]. Progress in Chemistry, 2011, 23(6): 1237-1250.
[10] 李小燕, 刘义保, 张 明, 李 寻, 刘云海, 花 榕. 纳米零价铁去除溶液中U(VI)的还原动力学研究[J]. 原子能科学技术, 2014, 48(1): 7-13.
LI Xiao-yan, LIU Yi-bao, ZHANG Ming, LI Xun, LIU Yun-hai, HUA Rong. Reduction kinetics of U(VI) in aqueous solution by nanoscale zero-valent iron[J]. Atomic Energy Science and Technology, 2014, 48(1): 7-13.
[11] MEZAGUER M, KAMEL N, LOUNICI H, KAMEL Z. Characterization and properties of Pleurotus mutilus fungal biomass as adsorbent of the removal of uranium(VI) from uranium leachate[J]. J Radioanal Nucl Chem, 2013, 295: 393-403.
[12] GAVRILESCU M, PAVEL L V, CRETESCU I. Characterization and remediation of soils contaminated with uranium[J]. Journal of Hazardous Materials, 2009, 163: 475-510.
[13] BARNETT M O, JARDINE P M, BROOKS S C. Adsorption and transport of uranium(IV) subsurface media[J]. Soil Sci Soc Am J, 2000, 64(3): 908-917.
[14] WANG Jing-song, HU Xin-jiang, LIU Yun-guo, XIE Shui-bo, BAO Zheng-lei. Biosorption of uranium (Ⅵ) by immobilized Aspergillus fumigatus beads[J]. Journal of Environmental Radioactivity, 2010, 101: 504-508.
[15] WANG Xing-hui, ZHU Gui-ru, GUO Feng. Removal of uranium(VI) ion from aqueous solution by SBA-15[J]. Annals of Nuclear Energy, 2013, 56: 151-157.
[16] KUMAR Y P, KING P, PRASAD V S R K. Equilibrium and kinetic studies for the biosorption system of copper(II) ion from aqueous solution using Tectona grandis L.f. leaves powder[J]. Journal of Hazardous Materials, 2006, 137(2): 1211-1217.
(编辑 王 超)
基金项目:国家自然科学基金资助项目(11205084);湖南省科技厅项目(2014GK3079, 2012GK3132);衡阳市科技局项目(2014KS24);南华大学科技创新团队项目(NHCXTD04);湖南省大学生研究性学习和创新性实验项目((湘教通[2015]269号-247)
收稿日期:2014-02-09;修订日期:2015-07-22
通信作者:彭国文,副教授,博士;电话:15874720055;E-mail:pgwnh@sohu.com
摘 要:采用啤酒酵母菌为生物大孔模板,三嵌段聚合物(P123)为介孔相模板制备合成介孔氧化硅SBA-15。再采用Fe3O4为铁源,二乙基磷酰乙基三乙氧基硅烷(PTS)和氨丙基三乙氧基硅烷(APS)为有机改性基团,通过后嫁接法使有机改性基团对介孔氧化硅SBA-15进行功能化改性,得到新型功能化吸附剂G-PA-SBA-15,并通过扫描电镜、粉末X射线衍射和比表面分析仪分别表征吸附剂G-PA-SBA-15和SBA-15的结构。考察溶液pH值、吸附时间、铀初始浓度和温度等因素对吸附剂G-PA-SBA-15和SBA-15吸附铀的影响。结果表明:吸附剂G-PA-SBA-15直径均匀分布、孔径均一,吸附铀的最佳条件是pH值为6.0、吸附时间为1.0 h、铀初始浓度为20 mg/L和吸附反应温度为25 ℃。对吸附动力学模型和吸附等温模型进行分析,G-PA-SBA-15对铀的吸附动力学过程符合准二级动力学模型(相关系数R2均大于0.99), 吸附等温线符合BET等温线模型,说明该吸附体系是一个多层吸附过程。
[1] 杨 辰, 房 超, 童节娟. 中国发展核能的必要性[J]. 核动力工程, 2014, 35(S1): 200-202.
[3] 彭国文, 丁德馨, 胡 南, 杨雨山, 王晓亮. 纳米Fe3O4负载啤酒酵母菌对铀的吸附性能与机理[J]. 中国有色金属学报, 2012, 22(2): 604-610.
[4] 李宏宇, 申利红, 张 乐, 李培佑. 咪唑型功能离子液体合成及其对铀(VI)的萃取[J]. 原子能科学技术, 2014, 48(3): 390-394.
[5] 刘淑娟, 李金英, 罗明标, 花 榕, 林海渌, 马建国. 甲醛改性多壁碳纳米管吸附铀的性能研究[J]. 原子能科学技术, 2013, 47(1): 7-13.
[9] 郭 风, 朱桂茹, 高从堦. 有机-无机杂化介孔二氧化硅在环境保护中的应用[J]. 化学进展, 2011, 23(6): 1237-1250.
[10] 李小燕, 刘义保, 张 明, 李 寻, 刘云海, 花 榕. 纳米零价铁去除溶液中U(VI)的还原动力学研究[J]. 原子能科学技术, 2014, 48(1): 7-13.


