DOI: 10.11817/j.issn.1672-7207.2016.12.006
LiAlO2包覆Li1.5Ni0.25Mn0.75O2.5正极材料及其电化学性能
王起亮,王星奇,王天成,刘云建,苏明如,窦爱春,高彥涌,张志强
(江苏大学 材料科学与工程学院,江苏 镇江,212013)
摘 要:
温固相法合成Li1.5Ni0.25Mn0.75O2.5固溶体正极材料,并通过溶液法对其进行LiAlO2包覆。采用X线衍射(XRD)、扫描电镜(SEM)、透视电镜(TEM)、电化学交流阻抗谱(EIS)和恒电流充放电测试分析样品的结构、形貌及电化学性能。研究结果表明:包覆前后样品都具备α-NaFeO2型层状结构;包覆后,Li1.5Ni0.25Mn0.75O2.5的循环稳定性和倍率性能都得到显著提高。包覆量为5%(质量分数)的样品性能最优。首次放电比容量为254.64 mA·h/g。50次循环后,容量保持率由84.5%提高至98.9%。当倍率为10C时,包覆样品的放电比容量可达58.29 mA·h/g,而未包覆仅为15.27 mA·h/g。包覆5% LiAlO2的Li1.5Ni0.25Mn0.75O2.5正极材料具有最小的电荷转移阻抗。
关键词:
锂离子电池;正极材料;Li1.5Ni0.25Mn0.75O2.5;LiAlO2;表面包覆;
中图分类号:TM912 文献标志码:A 文章编号:1672-7207(2016)12-4001-08
Synthesis and property of LiAlO2 modified Li1.5Ni0.25Mn0.75O2.5 as cathode materials for Li-ion battery
WANG Qiliang, WANG Xingqi, WANG Tiancheng, LIU Yunjian, SU Mingru,
DOU Aichun, GAO Yanyong, ZHANG Zhiqiang
(School of Material Science and technology Jiangsu University, Zhenjiang 212013, China)
Abstract: Li1.5Ni0.25Mn0.75O2.5 was synthesized by co precipitation and high temperature solid state reaction, and the LiAlO2 coated Li1.5Ni0.25Mn0.75O2.5 was synthesized by solid-solution. The structure, surface morphology and electrochemical performance of the samples were characterized by X-ray diffraction (XRD), scanning electron microscope(SEM), transmission electron microscope(TEM), electrochemical impedance spectroscopy (EIS) and galvanostatic charge-discharge testing. The results show that the samples deliver the α-NaFeO2 layered structure. After coating with LiAlO2, the cyclic stability and rate capability of Li1.5Ni0.25Mn0.75O2.5 are improved effectively. The sample coated with 5%(mass fraction) LiAlO2 exhibits excellent properties. First discharge specific capacity is 254.64 mA·h/g. The capacity retaining ratio is increased from 84.5% to 98.9% after 50 cycles. The discharge capacity of LiAlO2-coated Li1.5Ni0.25Mn0.75O2.5 is 58.29 mA·h/g at 10C, while that of pristine is only about 15.27 mA·h/g. The sample coated with 5%(mass fraction) LiAlO2 has the lowest charge transfer impedance.
Key words: lithium-ion battery; cathode material; Li1.5Ni0.25Mn0.75O2.5; LiAlO2; surface coating
近年来,随着现代科学技术迅速发展,新一代电子产品及新能源汽车的开发与应用,人们对锂离子电池的性能提出了更高的要求。锂离子电池正极材料是锂离子电池的核心,它直接影响着电池的各种性能指标,决定着电池的成本[1]。已商品化的锂离子电池正极材料主要以LiCoO2为主,但Co的自然资源缺乏,价格昂贵,对环境污染较大[2]。尖晶石结构的LiMn2O4具有较高的工作电压、价格低廉、环境友好等特点, 但是较低的可逆循环容量和高温下容量的快速衰减是阻碍其商业化应用的关键因素之一[3]。LiFePO4具有安全、环保、价格低廉、性能稳定等一系列优点,使得它具有一定的应用,但其本身较低的锂离子扩散系数和电子电导率,使得其高倍率下的充放电性能不好[4]。与目前已商业化的正极材料相比,近年来新一代富锂层状固溶体正极材料xLi2MnO3·(1-x)LiMO2(M=Co, Fe, Ni1/2Mn1/2…)具有比容量高(>200 mA·h/g)、能量密度高(>250 W·h/kg)、循环性能优异、安全性好等优点,被认为是下一代锂离子动力电池的首选正极材料[5]。这种富锂正极材料将会在电动汽车领域具有很好的应用前景。目前已经报道的富锂层状固溶体正极材料中,LiMnO3和LiNi0.5Mn0.5O2按摩尔比1:1组成的Li1.5Ni0.25Mn0.75O2.5正极材料被证明是最具应用前景的正极材料之一[6]。但其存在着首次不可逆容量损失大、倍率性能差等问题,严重阻碍了该材料的实际运用。表面包覆不仅能够提高其首次库仑效率、电极材料的循环性能,而且能不同程度地改善其倍率性能。目前报道较多的包覆物主要是氧化物及氟化物等,例如Al2O3[7-8],AlF3[9],ZrO2[10],AlPO4[11],TiO2[12],ZnO[13]等。由于包覆物都是一些氧化物和聚阴离子化合物,其离子导电率很低,在提升倍率性能方面效果有限。而快离子导体的离子导电率很高,可以提升正极材料的表面电导率,进而有效提高其电化学性能[14]。目前对于采用快离子导体包覆的研究报道比较少。LiAlO2属于一种锂快离子导体,其离子电导率最高可达2×10-6 S/cm[15]。本文作者采用溶液法在富锂层状正极材料Li1.5Ni0.25Mn0.75O2.5表面包覆一层LiAlO2,研究了LiAlO2包覆对正极材料的结构、形貌与电化学性能的影响,并对其相关机理进行分析。
1 实验
1.1 材料的制备
按照化学计量比称取C4H6NiO4·4H2O(分析纯)、C4H6MnO4·4H2O(分析纯)和NaOH(分析纯)。其中,金属元素Ni和Mn的物质的量比n(Ni):n(Mn)=1:3,氢氧化钠与总金属元素的物质的量比为1:2。将C4H6NiO4·4H2O和C4H6MnO4·4H2O配成一定浓度的水溶液,然后缓慢滴入一定浓度的NaOH溶液,利用NH3·H2O溶液调节pH为11.0~12.0,充分搅拌,并控制溶液温度为60 ℃,反应完全后,过滤、洗涤、干燥得到Ni0.25Mn0.75(OH)2沉淀。按照化学计量比(锂过量5%)称取一定量的Li2CO3和Ni0.25Mn0.75(OH)2前驱体,混合球磨5 h,使其充分混合均匀。然后,在空气中于500 ℃预烧5 h,于850 ℃煅烧12 h,最后随炉冷却至室温,得到固溶体正极材料Li1.5Ni0.25Mn0.75O2.5,标记样品为a。
按照化学计量比称取实验用料,首先,将异丙醇铝(C9H21O3Al)溶解在一定量的蒸馏水中,搅拌1 h,温度控制在50 ℃。然后加入LiOH·H2O和制备好的Li1.5Ni0.25Mn0.75O2.5粉末,搅拌一段时间后,放入120 ℃的干燥箱中10 h,再放入600 ℃的管式炉中煅烧3 h,随炉冷却至室温,得到LiAlO2包覆Li1.5Ni0.25Mn0.75O2.5的正极材料。本实验中,LiAlO2的包覆量分别为正极材料Li1.5Ni0.25Mn0.75O2.5质量的1%,3%,5%,8%,分别对应样品b,c,d,e 。
1.2 材料表征测试
物相分析使用日本理学D/MAX-C型X线衍射仪,加速电压为40 kV,电流为300 mA,衍射靶为Cu Kα,扫描范围为10°~80°,扫描速度为2 (°)/min。采用JEOL公司的JSM-7001F型高分辨场发射扫描电子显微镜观察材料的表面形貌。用透射电镜(TEM,Tecnai G220 ST 型透射电子显微镜,荷兰)观测颗粒微观组织。
1.3 电池制作与性能测试
将未包覆与包覆的Li1.5Ni0.25Mn0.75O2.5作为活性物质,按照质量比m(活性物质):m(乙炔黑):m(聚偏氟乙烯PVDF)=8:1:1的比例混合,在溶剂N-甲基-2-吡咯烷酮(NMP)中混合成均匀浆料,均匀地刮涂在铝箔上。在120 ℃的干燥箱中干燥,制成极片后,放在80 ℃的真空干燥箱12 h,在充满氩气的手套箱中,以金属锂片作为负极,以1 mol/L LiPF6的(EC,DMC和EMC体积比V(EC):V(DMC):V(EMC)为1:1:1)溶液为电解液,以聚丙烯微孔膜(Celgard 2400)为隔膜,组装成CR2025扣式半电池。
常温下,将上述组装的CR2025扣式半电池采用电池自动充放电仪(深圳新威尔生产)进行充放电及循环性能测试,充放电电压为2.0~4.8 V,首次充放电电流为0.1C,循环性能测试电流为0.2C(1C=250 mA·h/g)。交流阻抗测试采用三电极体系进行,辅助电极和参比电极均采用金属锂片。测试仪器为上海辰华的CHI660D电化学工作站,交流阻抗的测试频率为0.01~1×105 Hz。
2 结果与讨论
图1所示为包覆不同质量分数LiAlO2样品的XRD图谱。由图1可见:包覆样品的XRD衍射峰与未包覆的几乎完全相同。未包覆样品a,包覆样品b和c均为单一相,未发现其他杂相。而包覆样品d,e中,除了主物相Li1.5Ni0.25Mn0.75O2.5之外,还发现了LiAlO2的特征衍射峰,样品b,c可能因为量少而未发现,该结果说明包覆后的材料中有LiAlO2相生成。 其中:20°~23°处的超晶格峰是材料过渡金属层中的Li原子和Mn原子的超晶格有序排列形成的不具有R m对称性,归属于C2/m空间群的单斜晶系,其余的衍射峰均属于层状结构α-NaFeO2的特征峰,为R
m对称性,归属于C2/m空间群的单斜晶系,其余的衍射峰均属于层状结构α-NaFeO2的特征峰,为R m空间群的六方晶系[16]。图谱中(006)/(012)和(018)/(110)处具有明显的分裂峰,表明合成的材料具有典型的层状结构特征,且结晶性良好[17]。该结果表明,LiAlO2包覆并未改变原材料的层状结构。
m空间群的六方晶系[16]。图谱中(006)/(012)和(018)/(110)处具有明显的分裂峰,表明合成的材料具有典型的层状结构特征,且结晶性良好[17]。该结果表明,LiAlO2包覆并未改变原材料的层状结构。

图1 包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5的XRD谱图
Fig. 1 XRD spectrogram for Li1.5Ni0.25Mn0.75O2.5 coated with different contents of LiAlO2
图2所示为包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5的SEM图和EDS图。从图2可以看出:包覆前后样品的晶粒表面微观形貌有较大的差别。纯相Li1.5Ni0.25Mn0.75O2.5晶粒表面清晰且光滑,而包覆不同量LiAlO2后的Li1.5Ni0.25Mn0.75O2.5晶粒表面黏有许多细小的团聚颗粒。然而,随着LiAlO2包覆量的增加,Li1.5Ni0.25Mn0.75O2.5晶粒表面粗糙程度增加,包覆物晶粒与Li1.5Ni0.25Mn0.75O2.5晶粒有分开的现象,并有团聚现象,导致晶粒长大,包覆效果不很明显。在包覆的正极材料表面检测到Al的含量,结合XRD分析结果可知:正极材料Li1.5Ni0.25Mn0.75O2.5表面的包覆物的确为LiAlO2。
图3所示为包覆LiAlO2前后样品的TEM图。从图3可以看出: 包覆前样品a表面光滑;相比样品a而言,样品b,c,d,e的颗粒表面被一层LiAlO2薄膜包覆;LiAlO2均匀包覆于正极材料表面,得到了具有类似于核壳结构的正极材料,该LiAlO2薄层对正极材料的电化学性能有着重要影响。LiAlO2薄层的包覆可以有效地阻隔正极材料Li1.5Ni0.25Mn0.75O2.5和电解液的直接接触,减少电解液对正极材料的侵蚀。LiAlO2属于快离子导体,它的包覆可以提高正极材料表面的离子导电率,可以有效地提升正极材料的倍率性能。
图4所示为在常温(25 ℃),电压范围为2.0~4.8 V,电流密度为0.1C条件下得到的不同样品的首次充放电曲线。由图4可见:所有样品在首次充电过程中都存在2个电压区域,在4.5 V出现了一个平台,这是因为当充电至4.5 V时,Li2O从Li2MnO3结构中脱出导致[18-19]。未包覆样品与表面包覆1%,3%,5%及8%LiAlO2样品的首次充放电比容量及库仑效率见表1所示。由表1可知:随着包覆量增加,首次不可逆容量损失先减小后增大,当包覆量为5%时,首次不可逆容量损失最小,首次库仑效率为75.2%,而未包覆正极材料首次库仑效率仅为68.6%。由此可见,包覆适量LiAlO2的正极材料,可以有效地抑制氧缺陷的产生,降低首次不可逆容量的损失,进而提升其首次库仑效率[20]。
图5所示为包覆不同质量分数LiAlO2样品在0.2C充放电电流下的室温循环性能图,循环50次。由图5可明显看出:包覆LiAlO2质量分数为5%的样品在50次循环后,容量基本保持不变,循环性能最好。包覆质量分数为8%的样品的放电比容量最低,循环性能最差。包覆以后样品的放电比容量比较平稳,未包覆样品的起伏相对比较大。未包覆样品循环50次以后,容量由223.5 mA·h/g降到188.9 mA·h/g,容量保持率为84.5%。而包覆5%的样品在此条件下循环50次后,放电比容量由220.1 mA·h/g降到 217.7 mA·h/g,容量保持率为98.9%。可见包覆适量的LiAlO2后,Li1.5Ni0.25Mn0.75O2.5正极材料的循环性能得到了明显的提升,但包覆量过多时,正极材料的循环性能下降。从以上数据可以说明,包覆层LiAlO2可有效地减小电解液与电极的接触面积,减缓电解液中强酸性的HF与正极材料之间副反应的发生,降低了电化学阻抗,还抑制过渡金属离子的溶解,增强正极材料的结构稳定性,从而改善材料的循环性能。但是包覆过多的LiAlO2对循环性能有害。

图2 LiAlO2包覆Li1.5Ni0.25Mn0.75O2.5的SEM图和EDS图
Fig. 2 SEM images combined with EDS results for Li1.5Ni0.25Mn0.75O2.5 coated with LiAlO2

图3 包覆LiAlO2 的Li1.5Ni0.25Mn0.75O2.5的TEM图
Fig. 3 TEM images for Li1.5Ni0.25Mn0.75O2.5 coated with LiAlO2

图4 包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5的首次充放电曲线
Fig. 4 First charge-discharge curves of Li1.5Ni0.25Mn0.75O2.5 coated with different contents of LiAlO2
表1 样品的首次充放电比容量及库仑效率
Table 1 First charge-discharge capacity and Coulomb efficiency of samples

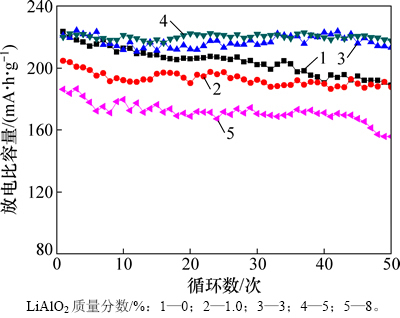
图5 包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5在0.2C倍率下的室温(25 ℃)循环性能
Fig. 5 Cycle performance of Li1.5Ni0.25Mn0.75O2.5 coated with different contents of LiAlO2 at 0.2C and 25 ℃
图6所示为包覆不同质量分数LiAlO2的样品在高温(55 ℃)下,以0.2C倍率进行充放电的循环性能,电压范围为2.0~4.8 V。从图6可以看出:经50次循环后,包覆LiAlO2的样品的高温循环性能循环曲线都较未包覆的平缓,说明通过包覆后的材料的高温循环性能有所改善。50次循环后,未包覆样品a放电比容量由217.54下降到163.12 mA·h/g,容量保持率仅为74.93%,而包覆5%的样品c由215.13下降到191.72 mA·h/g,容量保持率为89.12%。虽然此循环性能曲线与室温循环性能曲线类似,但55 ℃下的循环稳定性要明显差于25 ℃下的循环稳定性。因为高温加剧了电解液的分解和过渡金属离子的溶解,电极侵蚀比室温严重,影响材料结构的稳定性,导致高温下放电比容量比室温要低并且衰减速率加快,使得循环稳定性比室温差。另外,也可能因为升高温度加剧了充放电过程中电极的电化学极化,造成容量损失较常温下加剧。

图6 包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5在0.2C倍率下的高温(55 ℃)循环性能
Fig. 6 Cycle performance of Li1.5Ni0.25Mn0.75O2.5 coated with different contents of LiAlO2 at 0.2C rate of 55 ℃
图7所示为未包覆和包覆样品的倍率性能。从图7可看出:随着倍率的增加,两者的容量差逐渐增大。倍率为5C时,包覆5% LiAlO2样品的放电比容量最高可达102.4 mA·h/g,而未包覆样品的最高放电比容量仅为69.8 mA·h/g,当倍率增至10C时,包覆样品的放电比容量可达58.3 mA·h/g,而未包覆仅为15.3 mA·h/g。显然,包覆适量LiAlO2的样品较未包覆样品表现出更好的放电容量和放电稳定性,尤其在高倍率下。包覆样较佳的倍率性能是由于材料表面的LiAlO2抑制了电解液中的HF与正极活性物之间的副反应;由于作为包覆层的LiAlO2属于锂快离子导体,其离子电导率最高可达2×10-6 S/cm,它的包覆可以提高材料的导电性,有利于电子的快速传递和锂离子的顺利转移,而且包覆层对 SEI 膜的形成有抑制作用,从而提高了电荷转移反应动力学[21]。

图7 包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5的倍率性能
Fig. 7 Rate performance of Li1.5Ni0.25Mn0.75O2.5 coated with different contents of LiAlO2
图8所示为包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5样品的交流阻抗图,测试前Li1.5Ni0.25Mn0.75O2.5电极的电压稳定在4.3 V左右。由图8可见:Li1.5Ni0.25Mn0.75O2.5样品阻抗图谱均由高频区的半圆和低频区的直线组成。高频区的半圆弧代表正极材料表面电荷转移阻抗Rct;低频区的直线代表Li+在固相活性物质中的扩散Warburg阻抗Zw[22]。经过ZView软件模拟得到Li1.5Ni0.25Mn0.75O2.5包覆前后电极的欧姆阻抗和电荷转移阻抗,如表2所示。由表2可知:包覆后Li1.5Ni0.25Mn0.75O2.5电极表面的电荷转移阻抗明显减小,包覆5% LiAlO2的Li1.5Ni0.25Mn0.75O2.5样品的阻抗最低。这是因为LiAlO2包覆有效地抑制了电解液与正极材料的反应,减少SEI膜的生成;其次,快离子导体LiAlO2的包覆提高了电极的导电率,进而降低了正极材料的电荷转移阻抗,因此表现出良好的倍率性能。

图8 包覆不同质量分数LiAlO2的Li1.5Ni0.25Mn0.75O2.5样品的交流阻抗图谱和模拟等效电路图
Fig. 8 AC impedance of Li1.5Ni0.25Mn0.75O2.5 coated with different contents of LiAlO2 and equivalent circuit model
表2 等效电路的阻抗参数
Table 2 Impedance parameters of equipment circuit

3 结论
1) 采用溶液法在正极材料Li1.5Ni0.25Mn0.75O2.5表面,用不同质量分数的LiAlO2对其包覆,少量包覆以后,材料的结构基本没有发生变化。对Li1.5Ni0.25Mn0.75O2.5表面包覆LiAlO2材料之后,可以减少正极材料与电解液的直接接触,阻止电解液对正极材料的侵蚀,可以大大改善材料的循环性能。
2) LiAlO2的包覆量对电化学性能有较大影响,当LiAlO2包覆量为5%(质量分数)时,材料的综合性能最优,初始放电比容量为254.6 mA·h/g。经过50次循环后,容量保持率为98.9%。倍率为10C时,包覆样品的放电比容量可达58.29 mA·h/g,而未包覆仅为15.27 mA·h/g。
3) 包覆后Li1.5Ni0.25Mn0.75O2.5电极表面的电荷转移阻抗明显减小,包覆5% LiAlO2的Li1.5Ni0.25Mn0.75O2.5样品的阻抗最低。如果包覆量过多,由于出现大量团聚现象,反而破坏材料的电化学性能。
4) 适量的LiAlO2包覆对改善材料的高温循环性能有一定的作用。
参考文献:
[1] 李伟伟, 姚路, 陈改荣, 等. 锂离子电池正极材料研究进展[J]. 电子元件与材料, 2012, 31(3): 77-81.
LI Weiwei, YAO Lu, CHEN Gairong, et al. Research progress of cathode materials for lithium ion batteries[J]. Electronic Components and Materials, 2012, 31(3): 77-81.
[2] KWON N H. The effect of carbon morphology on the LiCoO2cathode of lithium ionbatteries[J]. Solid State Sciences, 2013, 21(7): 59-65.
[3] YI Xin, WANG Xianyou, JU Bowei, et al. Effective enhancement of electrochemical performance for spherical spinel LiMn2O4 via Li ion conductive Li2ZrO3 coating[J]. Electrochimica Acta, 2014, 134: 143-149.
[4] ZIOLKOWSKA D, KORONA K P,HAMANKIEWICZ B, et al. The role of SnO2surface coating on the electrochemical performance of LiFePO4cathode materials[J]. Electrochimica Acta, 2013, 108: 532-539.
[5] 赵煜娟, 冯海兰, 赵春松, 等. 锂离子电池富锂正极材料xLi2MnO3·(1-x)LiMO2(M=Co, Fe, Ni1/2Mn1/2…)的研究进展[J]. 无机材料学报, 2011, 26(7): 673-679.
ZHAO Yujuan, FENG Hailan, ZHAO Chunsong, et al. Progress of research on the Li-rich cathode materials xLi2MnO3·(1-x)LiMO2(M=Co, Fe, Ni1/2Mn1/2…) for Li-ion batteries[J]. Journal of Inorganic Materials, 2011, 26(7): 673-679.
[6] 陈来, 陈实, 胡道中, 等. 不同组分下富锂正极材料xLi2MnO3·(1-x)LiNi0.5Mn0.5O2(x=0.1-0.8)的晶体结构与电化学性能[J]. 物理化学学报, 2014, 30(3): 467-475.
CHEN Lai, CHEN Shi, HU Daozhong, et al. Crystal structure and electrochemical performance of lithium-rich cathode materials xLi2MnO3·(1-x)LiNi0.5Mn0.5O2(x=0.1-0.8)[J]. Acta Physico-Chimica Sinica, 2014, 30(3): 467-475.
[7] JUNG Y S, CAVANAGH A S, YAN Y F, et al. Effects of atomic layer deposition of Al2O3 on the Li[Li0.20Mn0.54Ni0.13Co0.13]O2 cathode for lithium-ion batteries[J]. Journal of the Electrochemical Society, 2011, 158(12): A1298-A1302.
[8] 杨志, 李新海, 王志兴, 等. 球形LiNi1/3Co1/3Mn1/3O2表面非均匀成核法包覆Al2O3的研究[J]. 中南大学学报(自然科学版), 2010, 41(5): 1703-1708.
YANG Zhi, LI Xinhai, WANG Zhixing, et al. Surface coating of spherical LiNi1/3Co1/3Mn1/3O2 with Al2O3 using heterogeneous nucleation process[J]. Journal of Central SouthUniversity (Science andTechnology), 2010, 41(5): 1703-1708.
[9] LI G R, FENG X, DING Y, et al. AlF3-coated Li(Li0.17Ni0.25Mn0.58)O2 as cathode material for Li-ion batteries[J]. Electrochimica Acta, 2012, 78: 308-315.
[10] WANG Zhiyuan, LIU Enzuo, GUO Lichao, et al. Cycle performance improvement of Li-rich layered cathode material Li[Li0.2Mn0.54Ni0.13Co0.13]O2by ZrO2coating[J]. Surface and Coatings Technology, 2013, 235: 570-576.
[11] MA Xiaoling, WANG Chiwei, HAN Xiaoyan, et al. Effect of AlPO4coating on the electrochemical properties of LiNi0.8Co0.2O2cathode material[J]. Journal of Alloys and Compounds, 2008, 453(1/2): 352-355.
[12] CHEN Yanping, ZHANG Yun, CHEN Baojun, et al. An approach to application for LiNi0.6Co0.2Mn0.2O2 cathode material at high cutoff voltage by TiO2 coating[J]. Journal of Power Sources, 2014, 256: 20-27.
[13] KONG J Z. REN C, TAI G A, et al. Ultrathin ZnO coating for improved electrochemical performance of LiNi0.5Co0.2Mn0.3O2cathode material[J]. Journal of Power Sources, 2014, 266: 433-439.
[14] LIU Dongqiang, YU Ji, SUN Yuheng, et al. Enhancement of electrochemical performance of Li[Li0.2Mn0.54Ni0.13Co0.13]O2by surface modification with Li4Ti5O12[J]. Electrochimica Acta, 2014, 115: 399-406.
[15] OKADA K, MACHIDA N, NAITO M, et al. Preparation and electrochemical properties of LiAlO2-coated Li(Ni1/3Mn1/3Co1/3)O2 for all-solid-state batteries[J]. Solid State Ionics, 2014, 255: 120-127.
[16] LIU Yunjian, GAO Yanyong, DOU Aichun. Influence of Li content on the structure and electrochemical performance of Li1+xNi0.25Mn0.75O2.25+x/2cathode for Li-ion battery[J]. Journal of Power Sources, 2014, 248: 679-684.
[17] FU Fang, HUANG Yiyin, WU Peng, et al. Controlled synthesis of lithium-rich layered Li1.2Mn0.56Ni0.12Co0.12O2oxide with tunable morphology and structure as cathode material for lithium-ion batteries by solvo/hydrothermal methods[J]. Journal of Alloys and Compounds, 2014, 618: 673-678.
[18] PARK S H, KANG S H, JOHNSON C S, et al. Lithium–manganese–nickel-oxide electrodes with integrated layered–spinel structures for lithium batteries[J]. Electrochemistry Communications, 2007, 56(9): 262-268.
[19] 刘云建, 王亚平, 刘三兵, 等. LiNi0.2Li0.2Mn0.6O2正极材料的合成与碳包覆[J] . 中南大学学报(自然科学版), 2013, 44(2): 482-486.
LIU Yunjian, WANG Yaping, LIU Sanbing, et al. Synthesized andcarbon-coating ofLiNi0.2Li0.2Mn0.6O2 cathodes[J]. Journal of Central SouthUniversity (Science andTechnology), 2013, 44(2): 482-486.
[20] YI Tingfeng, SHU Jie, ZHU Yanrong, et al. Structure and electrochemical performance of Li4Ti5O12-coated LiMn1.4Ni0.4Cr0.2O4 spinel as 5 V materials[J]. Electrochemistry Communications, 2009, 11: 91-94.
[21] SHU Hongbo, CHEN Manfang, FU Yanqing, et al. Improvement of electrochemical performance for spherical LiFePO4via hybrid coated with electron conductive carbon and fast Li ion conductive La0.56Li0.33TiO3[J]. Journal of Power Sources, 2014, 252: 73-78.
[22] LIU Yunjian, LIU Sanbing, WANG Yaping, et al. Effect of MnO2 modification on electrochemical performance of LiNi0.2Li0.2Mn0.6O2 layered solid solution cathode[J]. Journal of Power Sources, 2013, 222: 455-460.
(编辑 赵俊)
收稿日期:2015-12-10;修回日期:2016-03-16
基金项目(Foundation item):国家自然科学基金资助项目(51304081);江苏省自然科学基金资助项目(BK20140581);江苏省高等学校大学生实践创新训练计划项目(201410299010Z)(Project(51304081) supported by the National Natural Science Foundation of China; Project(BK20140581) supported by the Natural Science Foundation of Jiangsu Province; Project(201410299010Z) supported by the Practice Innovation Training Program for the Jiangsu College Students)
通信作者:刘云建,博士,副教授,从事新能源材料及电化学研究;E-mail:lyjian122331@163.com
摘要:通过共沉淀-高温固相法合成Li1.5Ni0.25Mn0.75O2.5固溶体正极材料,并通过溶液法对其进行LiAlO2包覆。采用X线衍射(XRD)、扫描电镜(SEM)、透视电镜(TEM)、电化学交流阻抗谱(EIS)和恒电流充放电测试分析样品的结构、形貌及电化学性能。研究结果表明:包覆前后样品都具备α-NaFeO2型层状结构;包覆后,Li1.5Ni0.25Mn0.75O2.5的循环稳定性和倍率性能都得到显著提高。包覆量为5%(质量分数)的样品性能最优。首次放电比容量为254.64 mA·h/g。50次循环后,容量保持率由84.5%提高至98.9%。当倍率为10C时,包覆样品的放电比容量可达58.29 mA·h/g,而未包覆仅为15.27 mA·h/g。包覆5% LiAlO2的Li1.5Ni0.25Mn0.75O2.5正极材料具有最小的电荷转移阻抗。


