文章编号:1004-0609(2008)10-1885-08
生物玻璃增强多孔羟基磷灰石生物陶瓷的制备及其性能
马 莉,周科朝,李志友,黄苏萍
(中南大学 粉末冶金国家重点实验室,长沙 410083)
摘 要:
研究多孔羟基磷灰石(HA)生物陶瓷的制备方法及性能。采用颗粒尺寸为500~600 μm的炭粉,以体系为SiO2-Na2O-CaO-MgO-Al2O3的生物玻璃为高温粘结剂,通过一定的混料、压制和烧结工艺,可制得孔隙率为30%~48%,抗弯强度达11.65 MPa,大孔孔径约500~600 μm、小孔孔径1~20 μm并孔隙相互连通的多孔陶瓷。采用扫描电镜(SEM)、X射线衍射仪(XRD)、电子万能实验机对样品的微观结构和抗弯强度进行分析,还通过分析天平,采用阿基米德原理对样品孔隙率进行测量。结果表明:随着烧结温度的升高,气孔率逐渐减小,抗弯强度逐渐增加。通过控制炭粉的含量,可以有效的控制多孔烧结体的孔隙率、大孔的分布及孔径。生物玻璃的加入可以促进材料的液相烧结,使多孔羟基磷灰石生物陶瓷致密化,改善其力学性能,同时随着生物玻璃含量的增加孔隙率减少。
关键词:
中图分类号:TQ 174.75 文献标识码: A
Porous bioglass reinforced hydroxyapatite materials produced with carbon particles
MA Li, ZHOU Ke-chao, LI Zhi-you, HUANG Shu-ping
(Key State Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: Carbon particles were used as pore formers to produce porous structures of a SiO2-Na2O- CaO-MgO-Al2O3 glass reinforced hydroxyapatite, and its microstructure and properties were studied. The experimental results show: that porous hydroxyapatite (HA) bioceramics can be obtained with porosity of 30%-48%, and the maximum bending strength of 11.65 MPa. Two separate range distributions of the pores size between 500-600 μm and 1-20 μm were observed. With the sintering temperature increasing, porosity decreases gradually, while bending strength increases. bioglass can improve the mechanical properties of materials, because bioglass will improve densification, thereby reducing porosity. By controlling the content of the carbon can effectively control the porosity, pore size and distribution of pore size. The final microstructure consists of hydroxyapatite, and β-tricalcium phosphate. X-ray diffraction analysis reveals different percentages of phases when porous glass reinforces hydroxyapatite specimens sintering at different temperatures. The biological response of these materials is yet to be tested.
Key words: porous hydroxyapatite; pore formers; carbon; porous ceramic; bioglass
早在19世纪20年代陶瓷就开始用于人体组织的置换。随后人们广泛研究了能够用于人体组织置换的各种生物材料。其中磷酸钙陶瓷属于生物活性陶瓷,其主要成分是Ca和P,是构成人体骨组织的重要无机物质。当植入人体后,在体液的作用下,钙和磷会游离于材料表面,被机体组织所吸收,并与人体骨组织发生化学键合,生长出新的组织,因而成为目前人工骨替代的研究热点。在钙磷陶瓷的研究中,以羟基磷灰石(HA)和β-磷酸钙(β-TCP)最为活跃和成熟[1-4]。
多孔生物陶瓷,除了具有生物陶瓷的优点外,由于具有多孔结构,更适合于修补骨缺损部位。WINTER等[5-6]的研究表明:HA植入的密度与植入后的生理反应息息相关。致密的HA植入体内后新生骨组织仅能在表面形成骨质,虽然附着紧密,但不能长入到HA的内部。多孔HA植入体内后,能使界面的软硬组织长入孔隙内,形成纤维组织和新生骨组织交叉结合状态。这种界面能保持正常的代谢关系,骨-材料的界面结合具有生理性结合。当孔隙率超过30%以后,孔隙之间能够相互连通,新生组织可以长入孔隙内部,这样不仅获得良好的界面结合,还由于新生骨组织的长入降低了多孔HA的脆性,又提高了抗折强度。此外,由于多孔而降低了HA材料的刚性,有利于界面应力的传导,符合界面力学要求,使界面能保持稳定,从而提高了种植效应。所以,在生物材料的研究中,多孔材料具有重大意义。
近年来,人们发明了一系列多孔陶瓷的制备方法,如添加造孔剂法、有机泡沫浸渍法、溶胶-凝胶法等。在研制多孔生物陶瓷时,人们最常用的方法是造孔剂法[7-8]。常用的造孔剂为有机造孔剂,如萘、聚甲基丙烯酸甲酯、石蜡等,这些有机造孔剂在升温热解过程中,热膨胀系数不断增加,当到达热解温度时,有机造孔剂的热膨胀系数常可达到羟基磷灰石的热膨胀系数的几十倍[9],巨大的热膨胀系数差别导致烧结过程中产生大量的裂纹,从而使强度降低。碳的热膨胀系数与羟基磷灰石的相近,因而有望减少微裂纹的产生,从而提高羟基磷灰石的力学性能[8]。
多孔生物陶瓷强度的提高一直是研究的难点和热点。成分单一的多孔生物陶瓷强度很低,很难用于临床研究。生物玻璃的添加不仅能大大地改善多孔生物陶瓷的强度[10-12],而且有研究表明硅酸盐生物玻璃的加入还可以改善羟基磷灰石在骨组织中的降解性能,使多孔陶瓷与骨的接触面变得粗糙,从而改善了羟基磷灰石与骨的结合性能[13]。
本文作者采用热膨胀系数与羟基磷灰石相近的炭粉做造孔剂,并添加一定量的生物玻璃,通过严格控制可燃烧的造孔剂的含量和尺寸,经过成型和严格控制烧结工艺制得孔径可控的多孔生物陶瓷。用微机控制电子万能实验机、SEM、XRD等实验设备和方法测定和分析了多孔生物陶瓷的抗弯强度、显微结构、物相组成以及根据阿基米德定律测定了多孔陶瓷的孔隙率,并分析了不同的工艺参数对样品孔隙率、抗弯强度以及物相组成的影响。
1 实验
本实验所用羟基磷灰石粉末是用水热法合成的。即以Ca与P摩尔比为1.667称取硝酸钙和磷酸氢二氨并将其分别配成一定浓度的溶液。在室温下,以一定的速度均匀地往(NH4)2HPO4溶液中滴加Ca(NO3)2溶液,并滴加氨水调节pH值到9~11左右,搅拌后放入高压斧中,先从室温升温到160 ℃,然后保温,陈化一段时间。得到的悬浮液再经过过滤,用蒸馏水和酒精洗涤数次,在50 ℃的恒温干燥箱中干燥若干小时得到高纯度HA超细粉末。采用日本RIGAKU/MAX- 3A型X射线衍射(XRD)分析仪分析水热法合成的羟基磷灰石的物相,如图1所示。从中可以看出,合成的羟基磷灰石和PDF卡片上标准的羟基磷灰石峰值吻合的很好。
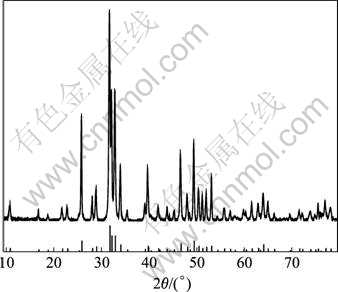
图1 羟基磷灰石(HAP)的XRD谱
Fig.1 XRD pattern of hydroxyapatite (HAP) power
采用炭粉做造孔剂,形状为球形、严格筛分后得到粒径为425~600 μm,振实密度为0.62 g/cm3。生物活性玻璃采用Ca-Na-Si-Mg-Al体系的生物玻璃,以化学纯SiO2、Na2CO3、CaCO3、MgCO3和Al2O3作为原料通过熔融方法制得。
将羟基磷灰石粉末与生物活性玻璃、炭粉颗粒及聚乙烯醇粘结剂充分混合,炭粉颗粒加入量为6%~24%(质量分数)。用矩形钢模压制得到素坯,采用单向加压,压制压力约为40 MPa。使用硅碳棒炉对素坯进行烧结,通过炭粉的TG-DSC分析(见图2)确定造孔剂的排除温度(从图2可知最佳排除温度为450~750 ℃),并制定合理的烧结制度,烧结气氛为空气,烧结温度为1 050~1 200 ℃。
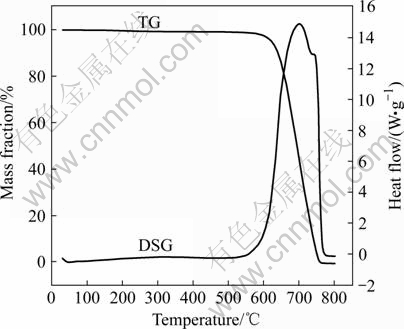
图2 炭粉TG-DSC曲线
Fig.2 TG-DSC curves of carbon power
采用日本RIGAKU/MAX-3A型X射线衍射分析仪(XRD)分析所得多孔羟基磷灰石生物陶瓷的物相;采用日本电子光学公司生产的型号为JSM-5600LV扫描电子显微镜(SEM)观察气孔微观结构和形貌;样品于多次浸入融化的高密度切片石蜡中,使其充分填充孔隙并冷却,并去除表面多余的石蜡,用阿基米德定律测定气孔率;采用三点弯曲法在微机控制电子万能试验机(型号为凯强力(KQL)KD11-2,最大容许测试力为1 800 N)上测试所得多孔羟基磷灰石生物陶瓷样品的抗弯强度,其中样品尺寸约为55 mm×10 mm×5 mm,跨距为38 mm,加载速率为0.5 mm/min。
2 结果和讨论
羟基磷灰石是一种生物性能良好的生物活性材料,但它在不同的烧结温度下物相易发生变化。图3所示为不同烧结温度下得到的多孔生物陶瓷的XRD谱。将其衍射分析数据与ASTM卡片相比较表明所得的生物陶瓷不仅有HA(或缺钙HA),而且还生成了β-TCP。此外,经过高温烧结,样品中已难以看出玻璃非晶相的峰包存在,说明玻璃相发生了晶化。从图1中可以看出,未经烧结的HA生料无β-TCP特征峰存在。随着烧结的进行,原料粉末中的羟基磷灰石与生物玻璃发生反应,致使原料中的羟基磷灰石缺钙,而缺钙HA由于不稳定,部分HA逐渐转变成β-TCP相。烧结后样品中所含β-TCP和HA比例取决于磷灰石的缺钙程度,同时烧结温度对于其组成也有一定影响。在1 050~1 200 ℃烧结温度范围内,从图3(b)中2θ约为27?、30?、31?~34?的峰强变化可以看出,1 050 ℃与其他3组数据的差别最大。从这几个峰的差别可知,随着温度的升高,HA的含量在减少,而β-TCP的含量在增加,但1 100~1 200 ℃的变化不是很明显。这说明在此温度区间内,烧结温度对羟基磷灰石脱钙反应造成的影响相对较小。另外,随着温度的升高,峰位趋向于向右偏移。
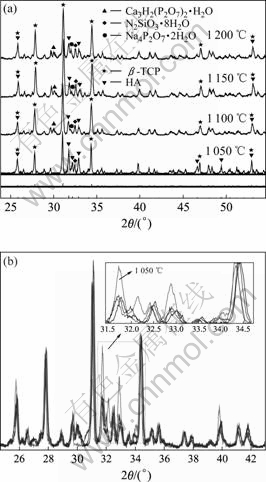
图3 含9%生物玻璃多孔生物陶瓷在不同烧结温度下的XRD谱
Fig.3 XRD patterns of porous bioceramic with 9% bioglass, sintered at different temperatures
此外由于新生成β-TCP降解性能优于HA,它的降解会使其钙磷离子溶于组织中,骨组织利用其中的Ca、P成分,从而引起组织的矿化物沉积,在陶瓷周围及其孔隙中形成骨组织。因此,β-TCP的生成有助于支架材料的降解和新骨的生成[14-15]。
2.2.1 烧结温度对多孔生物陶瓷烧结性能和强度的影响
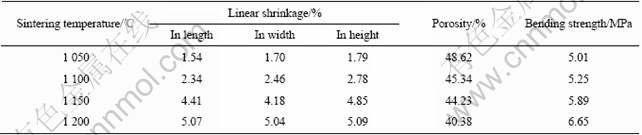
表1所列为烧结温度对样品的线收缩率、相对密度、孔隙率和强度的影响。从中可以看到,在碳含量和玻璃含量相同的情况下,随着烧结温度的升高,线收缩率逐渐增大,样品孔隙率逐渐降低,抗弯强度逐渐增大。当烧结温度为1 200 ℃时,样品线收缩率大于5%,孔隙率降低至40.38%,抗弯强度可达6.65 MPa。
表1 烧结温度对样品的线收缩率、孔隙率和抗弯强度的影响
Table 1 Effect of sintering temperatures on linear shrinkage, porosity and bending strength of samples(3%BG, 18% C)
根据烧结原理,在烧结初期,颗粒之间开始只有点接触,但是随着温度的增加,一方面,HA内部颗粒之间在高温和表面能的作用下,物质通过不同的途径和机理向颗粒的颈部和内部小气孔部位填充,使颈部逐渐长大,颗粒间接触面积扩大,颗粒聚集,体积收缩,小气孔率减少,致密化程度升高。另一方面,生物玻璃开始软化并逐渐熔化形成液相,在高温和表面能的作用下,玻璃液相以空隙作为通道,通过表面扩散和流动等物质迁移形式,在HA颗粒或团聚体表面形成一层液相膜,促进HA颗粒及团聚体的移动和重排,以达到最密实的排布,从而使样品体积收缩,气孔率减少,致密化程度升高,这样就导致了样品强度的增大。
2.2.2 造孔剂数量对多孔生物陶瓷烧结性能和强度性能的影响
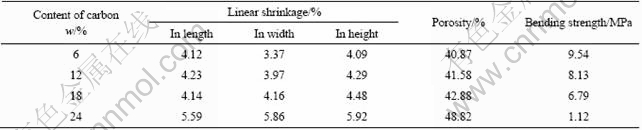
表2所列为造孔剂含量对样品的线收缩率、相对密度、孔隙率和强度的影响。从中可以看出,4组样品的开孔隙率均大于40%,在生物玻璃含量和烧结温度相同的情况下,随着造孔剂用量的提高,多孔陶瓷样品的收缩率基本上也呈增大趋势,孔隙率也随之升高,抗弯强度逐渐降低。当炭粉含量为24%时,抗弯强度最低,其值仅为1.12 MPa。这是因为一方面:随着造孔剂含量的增加,HA烧结团聚体之间空隙、通道等总体积也随之增大开孔隙率上升。同时造孔剂含量的增加使陶瓷颗粒间的距离增加,必然会减少颗粒间的结合程度,从而大幅度地降低样品的强度。
表2 造孔剂含量对样品的线收缩率、孔隙率和抗弯强度的影响
Table 2 Effect of content of carbon on linear shrinkage, porosity and bending strength of samples(1 150 ℃, 9% BG)
2.2.3 生物玻璃含量对多孔生物陶瓷烧结性能和强度性能的影响
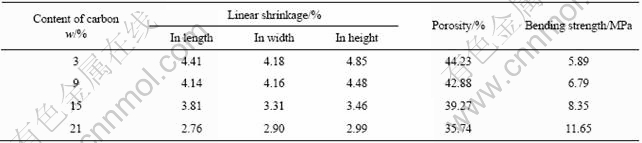
表3所列为生物玻璃含量对样品的线收缩率、相对密度、孔隙率和强度的影响。从中可以看到,在炭含量和烧结温度相同的情况下,随着生物玻璃含量的增加,多孔陶瓷样品的线收缩率逐渐减小,孔隙率逐渐减小,抗弯强度逐渐增大。这是因为添加生物玻璃会在样品烧结时产生液相,坯体内的陶瓷颗粒会受到毛细管力的作用以及液相本身的粘性流动,使颗粒调整位置、重新分布以达到最密实的排布,故使样品逐渐致密化,即孔隙率减小。多孔陶瓷在烧结时液相增多,故陶瓷颗粒会受到毛细管力的作用向空隙处发生移动,随着陶瓷颗粒间距离的减少,样品收缩,孔隙减少,多孔陶瓷样品的抗弯强度也逐渐增加,而且当玻璃含量达到21%时,抗弯强度高达11.65 MPa。
表3 生物玻璃含量对样品的线收缩率、孔隙率和抗弯强度的影响
Table 3 Effect of content of bioglass on linear shrinkage, porosity and bending strength of samples(1 150 ℃, 18%C)
此外,还发现随着玻璃含量的增加,多孔陶瓷的线收缩率逐渐减小。这是由于添加生物玻璃在样品烧结时产生液相,足够多的液相很容易在羟基磷灰石颗粒表面包覆一层膜,同时可能与羟基磷灰石固相颗粒边缘发生反应,反应生成更大的固体颗粒。这种情况最终导致多孔陶瓷的线收缩率减小。
2.3.1 孔隙宏观和微观形貌
图4所示为所制样品的宏观孔隙与微观孔隙之间的关系。可以看出,宏观气孔(造孔剂燃烧后留下的孔洞)即大孔在尺寸上基本与原造孔剂颗粒尺寸保持一致,且宏观孔的形态基本为球形,与炭粒的形貌基本吻合。由大量的SEM照片可观测到气孔分布变宽,既有500~600 μm的大孔,也有5~20 μm的小孔,以及1~2 μm的微孔。大孔为炭粒烧失所留,小孔为玻璃颗粒熔化迁移残留,微孔一方面是由于HA烧结团聚体晶粒长大所固有,另一方面是由于过筛时大颗粒中夹杂小颗粒造孔剂,同时在混料中,部分造孔剂被进一步的磨细,压碎引起的,最终导致气孔孔径分布范围加宽。有研究表明,只有那些具有良好连通性的大孔及孔壁粗糙的物质才具有良好的生物学活性和骨诱导性。而这些因磨碎的炭粉颗粒形成的小孔和微孔正好为大孔孔壁提供了一定的粗糙度,这为骨的诱导性和生物学活性提供了条件。此外,孔隙大小对于新生骨组织的长入速率和长入程度起着非常重要的作用。大孔隙(>50 μm)有利于细胞和离子的运输,从而有助于新骨的生长。研究也表明小孔隙(<20 μm=可以增加蛋白吸附面积,也有可促进新生骨的生长。WOODARD等[16]研究表明支架材料中含有多尺度孔隙支架材料的骨传导性优于仅具有单一孔隙的支架 材料。

图4 样品宏观孔隙和微观孔隙SEM像
Fig.4 SEM images of HA scaffold: (a), (b) Morphologies of macropores; (c), (d), (e), (f), (g), (h) Morphologies of micropores
2.3.2 不同烧结温度样品的SEM像
图5所示为不同烧结温度下样品的SEM像。从中可以看出,运用造孔剂法制备的多孔羟基磷灰石生物陶瓷坯体经烧结后可以得到具有丰富微孔结构的陶瓷,多孔陶瓷的微观形貌表明材料内部有较多连通的孔隙,晶粒形状规整,分布均匀,晶粒间呈颈部连接,微孔丰富。由于烧结温度都在1 050 ℃以上,陶瓷颗粒间的点接触已经形成了面接触,颗粒间的界面已经形成,烧结过程中的常见的瓶颈结构已非常明显,表明已经完成了较好的烧结。烧结工艺对多孔陶瓷的结构有显著影响。图5(a)显示的1 050 ℃烧结温度下的陶瓷晶粒较小,晶粒间呈较小的颈部连接,孔隙较多,并相互贯通。随着烧结温度的增加,大、中孔逐渐减小至消失,烧结团聚体中颗粒逐渐增大,晶粒间的 界面增大,孔隙大小更趋于均匀化。从图5(c)显示的 1 150 ℃烧结温度下陶瓷的微观结构看出,晶粒较大,许多晶粒间已连成一片。这是因为高温下,高的表面能使颗粒向孔隙部位移动,从而使大、中孔隙逐渐减小,致密度提高。说明SEM所观测的结果与上述物理性能测试结果(表1)相吻合,进一步证实了随着烧结温度的提高,孔隙率逐渐减小。
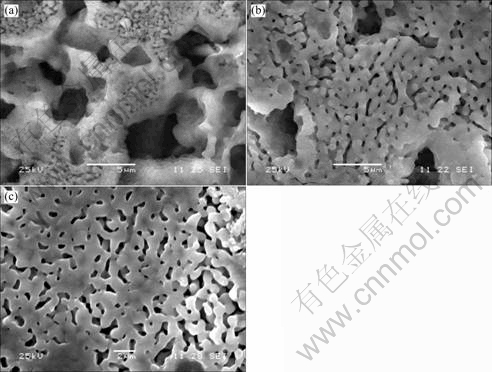
图5 不同烧结温度下样品的SEM像
Fig.5 SEM images of samples sintered at different temperatures: (a) 1 050 ℃; (b) 1 100 ℃; (c) 1 150 ℃
2.3.3 不同生物玻璃含量样品的SEM照片
图6所示为不同玻璃含量样品的SEM像。从中可以看到,陶瓷颗粒大小比较均匀,微孔丰富。当生物玻璃含量为3%时,陶瓷颗粒间的接触基本上是面接触,颗粒间存在明显的界面,孔隙较多,如图6(a)所示;当生物玻璃含量增加到15%时,颗粒间烧结颈已经变宽,颗粒与颗粒之间不再是简单的面接触,已经几乎连成一体,其中部分颗粒已经连成一片,如图6(b)所示。孔隙减少,并逐渐致密化。这是因为添加的玻璃相会在烧结时产生液相,坯体颗粒间的距离会受毛细管力的作用而缩短,从而使坯体收缩。随着引入的液相增加,更多的液相可以促进颗粒重排、烧结中的扩散传质,使颗粒致密化加强,收缩也就越多。同时玻璃相的增多可以弥补坯体中的缺陷,增强其抗弯强度。说明SEM所观测的结果与上述物理性能测试结果(表3)相吻合,也进一步证实了随着玻璃含量的增加,多孔生物陶瓷的抗弯强度增大。

图6 不同玻璃含量于1 150 ℃烧结时样品的SEM像
Fig.6 SEM images of specimens sintered at 1 150 ℃ with different bioglass contents: (a) 3% bioglass; (b) 15% bioglass
3 结论
1) 通过采用尺寸为500~600 μm炭粉作造孔剂,并添加生物玻璃为高温粘结剂,可制得大孔孔径约为500~600 μm,小孔孔径约为1~20 μm,且大孔通过小孔达到相互贯通的多孔生物陶瓷。样品微裂纹较少、强度较高。
2) 烧结温度的升高会使晶粒长大,在高温和表面能的作用下,颗粒聚集,体积收缩,气孔率减少,致密化程度升高,这样就导致了样品强度的增大,孔隙度减小。
3) 生物玻璃含量对多孔生物陶瓷的物相组成也有一定的影响,但影响较小。此外,生物玻璃的加入使样品的抗弯强度明显升高。当生物玻璃的含量为21%时,可制得抗弯强度高达11.65 MPa,孔隙率大于30%的多孔生物陶瓷。
REFERENCES
[1] RIPAMONTI U, CROOKS J, KIRKBRIDE A N. Sintered porous hydroxyapatites with intrinsic osteoinductive activity: geometric induction of bone formation[J]. South African Journal of Science, 1999, 95(8): 335-338.
[2] YUAN H P, KURUSHINA K, DE BRUJIN J D, LI Y B, DE GROOT K, ZHANG X D. A preliminary study on osteoinduction of two kinds of calcium phosphate ceramics[J]. Biomaterials, 1999, 20: 1799-1806.
[3] RIPAMONTI U. Osteoinduction in porous hydroxyapatite implanted in heterotopic sites of different animal models[J]. Biomaterials, 1996, 17: 31-35.
[4] 赵中伟, 陈爱良, 陈星宇, 孙培梅, 李洪桂. 脉冲阴极电沉积羟基磷灰石涂层[J]. 中国有色金属学报, 2005, 15(12): 2023-2027.
ZHAO Zhong-wei, CHEN Ai-liang, CHEN Xing-yu, SUN Pei-mei, LI Hong-gui. Pulsed cathode electrodeposition of hydroxyapatite coatings[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(12): 2023-2027.
[5] 黄占杰. 磷酸钙陶瓷生物降解研究的进展[J]. 功能材料, 1997, 28(1): 1-4.
HUANG Zhan-jie. Development of biodegradable calcium phosphate ceramics[J]. Journal of Functional Materials, 1997, 28(1): 1-4.
[6] 杨志明. 从临床观点探讨人骨材料研究[J]. 材料导报, 2000, 14(3): 6-8.
YANG Zhi-ming. Artificial materials for bone repair from clinical point of view[J]. Materials Review, 2000, 14(3): 6-8.
[7] 王欣宇, 韩颖超, 戴红莲, 李世普, 贺建华. 烧结条件对多孔HA生物陶瓷种植体性能的影响[J]. 中国有色金属学报, 2003, 13(3): 671-674.
WANG Xin-yu, HAN Ying-chao, DAI Hong-lian, LI Shi-pu, HE Jian-hua. Effects of sintering condition on property of porous HA bioceramic implant[J]. The Chinese Journal of Nonferrous Metals, 2003, 13(3): 671-674.
[8] 姚秀敏, 谭寿洪, 江东亮. 多孔羟基磷灰石陶瓷的制备[J]. 无机材料学报, 2000, 15(3): 467-472.
YAO Xiu-ming, TAN Shou-hong, JIANG Dong-liang. Preparation of porous hydroxyapatite ceramics[J]. Journal of Inorganic Materials, 2000, 15(3): 467-472.
[9] Thermo physical properties of solid matter [M]. New York: Plenum Publish Corporation, 1977.
[10] GEORGIOU G, KNOWLES J C. Glass reinforced hydroxyapatite for hard tissue surgery-part 1: Mechanical properties[J]. Biomaterials, 2001, 22: 2811-2815.
[11] OKTAR F, GOLLER G. Sintering effects on mechanical properties of glass-reinforced hydroxyapatite composites[J]. Ceram Int, 2002, 28: 617-621.
[12] KALITA S J, BOSE S, HOSICK H L, BANDYOPADHYAY A. CaO-P2O5-Na2O based sintering additives for hydroxyapatite (HAP) ceramics[J]. Biomaterials 2004, 25: 2331-2339.
[13] KAZUTAKA S, FUJIBAYASHIA S, NEOA M, ANAN Y, OGAWA T, KOKUBO T, Takashi Nakamura. Accelerated degradation and improved bone-bonding ability of hydroxyapatite ceramics by the addition of glass[J]. Biomaterials 2006, 27: 4738-4744.
[14] KURASHINA K, KURITA H, WU Q, OHTSUKA A, KOBAYASHI H. Ectopic osteogenesis with biphasic ceramics of hydroxyapatite and tricalcium phosphate in rabbits[J]. Biomaterials, 2002, 23: 407-412.
[15] GERBER T, TRAYKOVA T, HENKEL K O. Development and in vivo test of sol-gel derived bone grafting materials[J]. Journal of Sol-Gel Science and Technology, 2003, 26: 1173-1178.
[16] WOODARD J R, HILLDORE A J, LAN S K, PARK C J, MORGAN A W, EURELL J A C, CLARK S G, WHEELER M B, JAMISON R D, WAGONER J A J. The mechanical properties and osteoconductivity of hydroxyapatite bone scaffolds with multi-scale porosity[J]. Biomaterials 2007, 28: 45-54.
收稿日期:2007-11-26;修订日期:2008-04-28
通讯作者:周科朝,教授;电话:0731-8836264;E-mail: mali0331@eyou.com
(编辑 陈爱华)


