文章编号:1004-0609(2008)12-2259-06
嗜酸热异养菌TC-2的分离鉴定及其对微生物浸矿的影响
吴学玲1, 2,朱若林1,丁建南1, 2,江雪梅1,魏娇娇1,李 云1,马婷婷1,邱冠周1, 2
(1.中南大学 资源加工与生物工程学院,长沙 410083;
2.中南大学 生物冶金教育部重点实验室,长沙 410083)
摘 要:
从云南腾冲酸性热泉分离出一株嗜酸热异养菌TC-2。该菌呈长杆状,细胞大小为(2.0~5.0) μm×(0.3~0.5) μm,革兰氏染色反应为阴性,能形成芽孢。该菌生长温度范围为45~70 ℃,最适生长温度为55 ℃,适宜生长的pH值为1.5~4.0,最适宜生长的pH值为2.5,该菌能利用多种有机物生长。16S rDNA序列分析显示其与Alicyclobacillus sendaiensis的16S rDNA相似性大于99%。该菌自身没有浸矿作用,但对Acidianus manzaensis、Sulfolobus metallicus和Metallosphaera sedula等高温浸矿菌的浸矿有一定促进作用。
关键词:
嗜酸热异养菌(Alicyclobacillus sendaiensis);分离;鉴定;黄铜矿;生物浸出;
中图分类号:Q 939 文献标识码:A
Isolation, characterization of heterotrophic acidothermophile TC-2 and its influence on bioleaching of chalcopyrite
WU Xue-ling1, 2, ZHU Ruo-lin1, DING Jian-nan1, 2, JIANG Xue-mei1, WEI Jiao-jiao1,
LI Yun1, MA Ting-ting1, QIU Guan-zhou1, 2
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Biometallurgy of Ministry of Education, Central South University, Changsha 410083, China)
Abstract: A heterotrophic acidothermophilic bacterium TC-2 was isolated from an acid spring sample collected in Tengchong, Yunnan, China. The gram-negative-staining cells of the strain were straight long rods, 2.0?5.0 ?m in length and 0.3?0.5 ?m in diameter. The temperature range for growth was from 45 ℃ to 70 ℃ with an optimum temperature of 55 ℃. The pH range for growth at 55 ℃ was from 1.5 to 4.0 with an optimum at 2.5. This bacterium can use a wide variety of organic compounds to support fast growth, but can not utilize chalcopyrite as energy source. 16s rRNA gene Analysis reveal that this strain closely relates to Alicyclobacillus sendaiensis, with over 99% sequence similarity between each other. Co-bioleaching of chalcopyrite with Acidianus manzaensis,Sulfolobus metallicus and Metallosphaera sedula shows that the strain TC-2 can improve leaching rates of the sulphide minerals.
Key words: heterotrophic acidothermophile(Alicyclobacillus sendaiensis); isolation; characterization; bioleaching; chalcopyrite
应用于微生物冶金的浸矿菌中,研究较多的是嗜中温的嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)、嗜酸氧化硫硫杆菌(At.thiooxidans)和氧化亚铁钩端螺旋菌(Leptospirillum ferrooxidans)等[1?5]。然而金属硫化矿的微生物浸出是一个放热过程,随着浸矿进程,浸矿系统的温度会逐步上升,在高温度条件下浸矿菌仍然保持正常的浸矿活性相当重要,因此一些从酸性热泉中分离到的嗜酸热古菌如金属硫叶菌(Sulfolobus metallus)、勤奋金属球菌(Metallosphaera sedula)等在浸矿过程中的作用逐渐成为研究热点[6?9]。但目前无论是中温浸出还是高温浸出,微生物冶金还多集中于对单一菌种的研究。
优良的微生物浸矿体系是一个复杂的生态系统,各菌种之间相互协调,共同作用,完成整个浸矿过程。国内外研究表明,单一菌种浸矿效果通常不佳,特别对于复杂的原生硫化矿更是如此,大量实验结果表明混合菌对金属的浸出效率明显高于单一菌[10?16]。在这样的浸矿体系中,不仅存在大量已知具有浸矿能力的自养菌,还存在一些作用不明确的专性异养菌。这些异养菌的性质和功能目前尚不明确,尤其是与高温浸矿菌共栖的嗜酸热异养菌则更未见报道。因此,为研究这些异养菌与浸矿菌之间是否存在着某种互惠关系以及它们对浸矿菌的浸矿是否有促进作用, 本文作者分离鉴定了一株与高温浸矿菌共栖的专性异养菌TC-2,并将该菌与高温浸矿菌混合,进行了黄铜矿浸矿实验。
1 材料和方法
将采自云南腾冲的酸性热泉水样在170 r/min和60 ℃条件下,用异养菌培养基富集。培养基配方如下(g?L?1):(NH4)2SO4(2.0),KCl(0.1),MgSO4?7H2O(0.5),K2HPO4(0.5),葡萄糖(1.0)及酵母提取物(0.1),用KOH或H2SO4溶液调整pH值至2.5。富集过程中观察菌液浊度和气味的变化,当浑浊程度明显增加并伴随有挥发性芳香气味时,取10 mL菌液转接入100 mL新鲜培养基,在相同条件下继续富集,这样连续富集3次。将第3次富集物用无菌水梯度稀释,分别取0.1 mL 的10?5、10?6、10?7和10?8稀释液涂布在pH3.0的琼脂平板上,平板培养基配方与富集培养基完全相同。每级稀释液涂三个平板,于60 ℃培养箱中静置培养。两天后从平板上长出的菌落里,挑选一个单菌落,命名为TC-2,接入液体富集培养基中,用前述富集过程中观察菌液变化的方法监测TC-2的生长。然后用前述同样的涂布方法将该菌液涂布在新的相同平板上。这样连续用平板分离3次,以保证TC-2单菌落的纯度,最后得到异养菌株TC-2的纯培养物。
除非另有说明,鉴定过程中所用培养基均为前述异养菌富集培养基。
1.2.1 形态和生理特性研究
为评估温度、起始pH和不同碳源对TC-2菌株生长的影响,首先将TC-2培养在pH2.5的培养基中,离心收集稳定期菌细胞,用pH2.5的稀硫酸洗涤两次。将收集的菌细胞以相同的菌浓度重新悬浮在3组装有100 mL新鲜培养基的250 mL三角瓶中,第1组所有三角瓶中培养基的pH均调至2.5,以相同的振摇速度(180 r/min),在不同的温度下培养,用来确定TC-2菌株的最适生长温度;第2组三角瓶中培养基的pH分别调至1.5~4.0,置于60 ℃的相同温度下培养,以确定该菌株的最适生长pH;第3组三角瓶中培养基的葡萄糖分别用不同的糖、醇、有机酸等取代,在pH2.5、60 ℃下培养,以测定TC-2对不同碳源的利用情况。每4 h从各三角瓶中取菌液在UV2300分光光度计(Techcomp)上,于波长600 nm处,测定光密度值 (Optical Density, OD)。
离心收集60 ℃下,培养于pH2.5富集培养基中的对数生长期TC-2细胞,取少量细胞制片,做革兰氏染色,在光学显微镜(NOVEL)下观察,剩余的送湖南师范大学生命科学学院电镜室进行扫描电镜(SEM, JEOLJSM?6360 LV)分析。
1.2.2 16S rRNA 基因扩增、克隆和测序
收集稳定期菌体,分别用pH2.5的稀H2SO4溶液洗涤两次和 TE 试剂洗涤两次;加入480 μL TE,振荡溶解菌体,加入5 μL溶菌酶,在37 ℃保温3~5 h;加入20%SDS摇匀后再加入5 μL蛋白酶K,55~65 ℃水浴5~10 min,直至澄清;加入100 μL 量浓度为5 mol/L的NaCl和80 μL CTAB/NaCl,在65 ℃水浴10 min;加入等体积氯仿:异戊醇(24?1),12 000 r/min离心10 min;取上清液加入等体积的异丙醇,12 000 r/min离心5 min去上清液,沉淀用70%乙醇洗两次后晾干;加入200 μL TE溶解DNA,加入5 μL RNA酶,在37 ℃保温2~5 h;加入等体积(24?1)氯仿:异戊醇重新抽提,再用异丙醇析出DNA,用70%乙醇洗涤两次,晾干后加入30~40 μL TE待用。
以提取的基因组DNA为模板,采用27f/1492r引物对,在梯度PCR仪(Biometra)上进行16S rRNA基因扩增。反应体系为:2.5 μL 10×Taq Buffer、2.5 μLMgCl2、1 μL 10×dNTPs、1 μL引物27f、1 μL引物1492R、1 μL Taq DNA polymerase、1 μL模板DNA,加无菌水至25 μL体系。对照组将模板DNA换成等体积无菌水。扩增条件:94 ℃预处理5 min, 94 ℃变性40 s,52 ℃退火45 s和72 ℃延伸90 s, 共30个循环,最后72 ℃保温 10 min。
扩增产物经琼脂糖凝胶电泳后用回收试剂盒(OMEGA)进行纯化,使用连接试剂盒(Promega)与pGEM-T vecter连接并转化到E.coilDH5α中,涂平板,筛选阳性克隆,PCR克隆检测,确定转化成功的克隆子送北京三博远志公司测序。根据TC-2及其相近种属的16S rRNA基因序列,用MEGA3.1软件构建系统进化树,进行系统发育分析。
1.3.1 菌种与矿物
高温浸矿菌Acidianus manzaensis、S. metallus和M. sedula由中南大学资源加工与生物工程学院分离鉴定,接种前分别在9 K培养基中转接2代,离心收集第二代对数生长期菌细胞,用pH2.0左右的稀硫酸溶液洗涤2次,留作浸矿接种物。异养菌TC-2培养在前述富集培养基中,采用与浸矿菌相同的方法收集菌细胞,作为浸矿接种物。
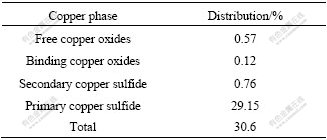
实验用黄铜矿来自中南大学资源加工与生物工程学院矿物系。矿石经破碎后细磨成粉,过?76 ?m筛,原子吸收分光光度法测定化学成分,物相分析测定矿物组成(见表1和2)。
表1 实验用黄铜矿的主要化学组成
Table 1 Major chemical constituents of experimental chalcopyrite

表2 黄铜矿的物相组成
Table 2 Copper mineralogy of chalcopyrite
1.3.2 实验方法
在250 mL三角瓶中精确加入200 mL 不含Fe2+或S0的9 K培养基,矿浆浓度3%(w/v)。设置TC-2、A. manzaensis、A. manzaensis+TC-2、S. metallus+M. sedula、S. metallus+M. sedula+TC-2和无菌对照6组进行不同处理,每组接入相当于30 mL原菌液的浸矿菌细胞,在含TC-2组中加接相当于10 mL原菌液的TC-2菌细胞,对照组除不接种外,其他均与其他组相同。
实验开始前对所有已装好培养液的三角瓶进行称量,记录各瓶的起始质量,同时测定各瓶的起始Cu2+浓度,实验在pH1.8、60 ℃和振摇速度180 r/min的条件下进行。实验开始后,定期测定浸矿液中Cu2+浓度。实验开始后的第一次取样和测定时,先用灭菌蒸馏水将每瓶的质量调整到起始质量,然后再取上清液1 mL,取样后,各瓶均补加1 mL培养基,称量后继续浸矿实验,此后每次取样均照此程序进行。Cu2+采用原子吸收分光光度法测定。
实验结束时,滤除菌液,收集黄铜矿浸渣,用pH1.6左右的稀硫酸洗涤3次,冷冻真空干燥后测定Cu的含量,计算出Cu的浸出率。
2 结果与讨论
2.1.1 TC-2的形态特征与生理生化特性
菌株TC-2为杆状,大小约(2.0~5.0) μm×(0.3~0.5) μm,产芽孢,革兰氏染色反应为阴性。扫描电镜下,菌株呈长杆状,两端圆形,如图1所示。

图1 菌株TC-2的SEM像
Fig.1 SEM image of strain TC-2
TC-2菌株是与高温浸矿菌共栖的嗜酸热异养菌,实验表明,其最佳生长温度为55 ℃,如图2所示,最适生长pH为2.5,如图3所示,与仙台脂环酸芽胞杆菌(Alicyclobacillus sendaiensis)相近[17]。

图2 温度对菌株TC-2生长的影响
Fig.2 Effect of temperature on growth of TC-2 strain

图3 pH值对菌株TC-2生长的影响
Fig.3 Effect of pH value on growth of TC-2 strain
菌株TC-2能利用果糖、麦芽糖、鼠李糖、木糖、甘露醇、谷氨酸、甘露糖、树胶醛糖、蔗糖、淀粉、半乳糖、葡萄糖等多种有机物作为碳源和能源,但不能利用氨基乙酸、乙酸、乳糖、色氨酸、天冬氨酸、柠檬酸、甘油、核糖等有机物(见表3)。
表3 菌株TC-2对各种糖的利用情况
Table 3 Various sugar utilization of TC-2

菌株TC-2虽然与高温浸矿菌同属嗜酸热菌,并常与后者共栖,但TC-2单独浸出黄铜矿的实验结果显示,该菌本身不具备黄铜矿浸出能力,如图4所示。从图4可以看出,TC-2纯菌浸出液和无菌浸出液中铜离子浓度变化曲线相差不大,无菌浸出液中铜离子浓度在浸矿实验中期甚至还略高于TC-2纯菌浸出液。

图4 TC-2纯菌对黄铜矿的浸出
Fig.4 Pure chalcopyrite leaching of TC-2
2.1.2 系统发育分析
通过PCR反应,从菌株TC-2的基因组DNA中扩增出接近全长的1475bp 16S rDNA序列,序列分析结果显示该菌与仙台脂环酸芽孢杆菌(Ab. sendaiensis)的亲缘关系最为接近,两者的16S rDNA序列相似性达到99%。基于16S rDNA序列,使用Clustal X1.8 和MEGA3.01软件构建的系统发育树也说明菌株TC-2在系统发育上最接近于仙台脂环酸芽孢杆菌(Ab. sendaiensis)(见图5)。

图5 基于16S rDNA序列的系统发育树
Fig.5 Phylogenetic tree based on 16S rDNA sequences
2.1.3 鉴定结论
脂环酸芽孢杆菌是一类喜温嗜酸菌,目前共有8个种:Ab. acidiphilus, Ab. Acidocauldarius, Ab. Acidoterrstris, Ab. cycloheptanicus, Ab. Herbarius, Ab. hepsperidum, Ab. pomorum 和 Ab. sendaiensis[14]。TC-2是从采自云南腾冲的酸性热泉中分离出来的脂环酸芽孢杆菌,该菌与高温浸矿菌共栖,16S rDNA系统发育分析结果、形态特征和生理特性研究表明它应归入脂环酸芽孢杆菌(Ab. sendaiensis)。
图6所示为A. manzaensis和S. metallus + M. sedula两种黄铜矿浸出液中Cu2+浓度的变化趋势。由图6可见,混合菌的浸出速率略高于A.manzaensis纯菌浸出液,浸渣分析结果表明,混合菌的铜浸出率为79.5%,纯菌的为78.8%。图7显示了同样的Cu2+变化趋势,但菌株TC-2对S. metallus+M. sedula 浸矿的促进作用显著高于前述实验,浸渣分析结果表明S. metallus+ M.sedula+TC-2和S. metallus+M. sedula两种处理的金属铜浸出率分别为78.1%和72.8%。黄铜矿浸矿实验结果说明,嗜酸热异养菌TC-2对高温浸矿菌浸出黄铜矿具有一定的促进作用。
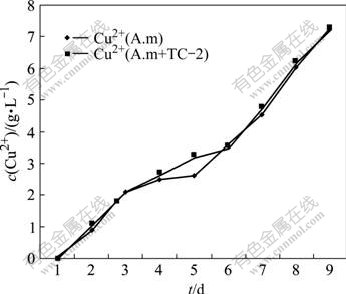
图6 菌株TC-2对A. manensis 浸矿能力的影响
Fig.6 Effect of TC-2 strains on leaching capacity of A. manensis (A.m: A. manzaensis)

图7 菌株TC-2对S. metallus和M. sedula浸矿能力的影响
Fig.7 Effect of TC-2 strains on S. metallus and leaching capacity of M. sedula (S.m: S. metallus)
3 结论
1) 从云南腾冲酸性热泉样品分离出一株嗜酸热异养菌TC-2,该菌最适宜生长温度55 ℃,最适生长pH2.5,能利用多种有机物进行专性异养生长。形态特征、生理生化特性及基于16Sr RNA基因序列的系统发育分析结果表明,菌株TC-2与仙台脂环酸芽孢杆菌(Ab. sendaiensis)的亲缘关系最为接近,据此初步鉴定TC-2为仙台脂环酸芽孢杆菌一新菌株。
2) 菌株TC-2虽然本身没有浸矿能力,但当它与高温浸矿菌混合时,能促进后者对黄铜矿的浸出。TC-2对A. manzaensis浸出黄铜矿具有一定的促进作用,对S. metallicus和M. sedula浸出黄铜矿则有显著促进作用。
[1] 周吉奎, 钮因键. 硫化矿物生物冶金进展[J]. 金属矿山, 2005, 346: 24?30.
ZHOU Ji-kui, NIU Yin-jian. Advance in research of biological metallurgy of sulfide ore[J]. Metal Mine, 2005, 346: 24?30.
[2] 廖梦霞, 邓天龙. 难处理硫化矿生物湿法冶金研究进展Ⅰ: 微生物氧化工艺技术研究[J]. 稀有金属, 2004, 28(4): 767?770.
LIAO Meng-xia, DENG Tian-long. Biohydrometallurgical progresses of refractory sulfidesⅠ: Process parameters of bacterial oxidation[J]. Chinese Journal of Rare Metals, 2004, 28(4): 767?770.
[3] 廖梦霞, 汪模辉, 邓天龙. 难处理硫化矿生物湿法冶金研究进展Ⅱ: 氧化机制、强化细菌浸出与生物反应器设计[J]. 稀有金属, 2004, 28(5): 931?935.
LIAO Meng-xia, DENG Tian-long. Biohydrometallurgical progresses on refractory sulfides Ⅱ[J]. Chinese Journal of Rare Metals, 2004, 28(5): 931?935.
[4] ROHWERDER T, GEHRKE T, KINZLER K, SAND W. Bioleaching review part A: Progress in bioleaching: fundamentals and mechanisms of bacterial metal sulfide oxidation[J]. Appl Microbiol Biotechnol, 2003, 63: 239?248.
[5] OLSON G J, BRIERLEY J A, BRIERLEY C L. Bioleaching review part B: Progress in bioleaching: applications of microbial processes by the minerals industries[J]. Appl Microbiol Biotechnol, 2003, 63: 249?257.
[6] 周洪波, 曾伟民, 李 莹, 邱冠周, 柳建设. 硫化矿高温生物浸出工艺研究和应用进展[J]. 金属矿山, 2006, 10: 4?13.
ZHOU Hong-bo, ZENG Wei-ming, LI Ying, QIU Guan-zhou, LIU Jian-se. Advances in research and application of bioleaching process for sulfide ores using thermophilic microorganism[J]. Metal Mine, 2006, 10: 4?13.
[7] 徐晓春, 孙雪南, 阮仁满, 车小奎. 高温浸矿微生物的选育探索[J]. 稀有金属, 2002, 26(3): 210?213.
XU Xiao-chun, SUN Xue-nan, RUAN Ren-man, CHE Xiao-kui. Strategy for isolating moderately thermophilic and acidophilic bioleaching bacterium[J]. Chinese Journal of Rare Metals, 2002, 26(3): 210?213.
[8] 李宏煦, 董清海, 苍大强, 王淀佐. 高温浸矿菌sulfolobus的生长及浸矿性能[J]. 北京科技大学学报, 2007, 29(1): 20?24.
LI Hong-hao, DONG Qing-hai, CANG Da-qiang, WANG Dian-zuo. Thermophilic microorganism sulfolobus growth and leaching chalcopyrite properties[J]. Journal of University of Science and Technology Beijing, 2007, 29(1): 20?24.
[9] 郭养浩, 林 晖, 孟 春. 酸嗜热菌FD-LH对高矿浆浓度黄铜矿的生物氧化[J]. 福州大学学报: 自然科学版, 2007, 35(1): 133?136.
GUO Yang-hao, LIN Hui, MENG Chun. Study on characteristics of bioleaching process by thermophilic FD-LH substrate[J]. Journal of Fuzhou University: Natural Science, 2007, 35(1): 133?136.
[10] OKIBE N, JOHNSON D B. Biooxidation of pyrite by defined mixed cultures of moderately thermophilic acidophiles in pH-controlled bioreactors: Significance of microbial interactions [OL]. http: www.interscience.wiley.com. 2004?08?05.
[11] SHI Shao-yuan, FANG Zhao-xing. Bioleaching of marmatite flotation concentrate by Acidithiobacillus ferrooxidans and Leptospirillum ferrooxidans[J]. Trans Nonferrous Met Soc China, 2004, 14(3): 569?575.
[12] HUGUES P, FOUCHER S, GALL?-CAVALLONI, MORIN D. Continuous bioleaching of chalcopyrite using a novel extremely thermophilic mixed culture[J]. Int J Min Processing, 2002, 66(1): 107?119.
[13] DEVECIA H, AKCILB A, ALPA I. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron[J]. Hydrometallurgy, 2004, 73: 293?303.
[14] TSURUOKA N, ISONO Y, SHIDA O, HEMMI H, NAKAYAMA1 T, NISHINO1 T. Alicyclobacillus sendaiensis sp. nov., a novel acidophilic, slightly thermophilic species isolated from soil in Sendai, Japan[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53: 1081?1084.
[15] DONATI E, CURUTCHET G, POGLIANI, TEDESCO P. Bioleaching of covellite using pure and mixed cultures of Thiobacillus ferrooxidans and Thiobacillus thiooxidans[J]. Process Biochem, 1996, 31(2): 129?134.
[16] FALCO L, POGLIANI C. A comparison of bioleaching of covellite using pure cultures of Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans or a mixed culture of Leptospirillum ferrooxidans and Acidithiobacillus thiooxidans[J]. Hydrometallurgy, 2003, 71: 31?36, 84.
[17] STOTT M B, SUTTON D C. Comparative leaching of chalcopyrite by selected acidophilic bacteria and archaea[J]. Geomicrobiol J, 2003, 20(3): 215?230.
基金项目:国家创新研究群体科学基金资助项目(50621063);国家重点基础研究发展计划资助项目(2004CB619201)
收稿日期:2008-03-19;修订日期:2008-06-18
通讯作者:邱冠周,教授,博士;电话:0731-8879212;E-mail: xueling0714@yahoo.com.cn
(编辑 何学锋)

