网络首发时间: 2014-05-09 17:05
离子液体电化学性质及其IrCl3溶解度的研究
北京航空航天大学化学与环境学院仿生智能界面科学与技术教育部重点实验室
摘 要:
为了选择合适的离子液体体系来进行电沉积制备Ir层,并为离子液体中电沉积制备Ir层提供理论基础,需要研究离子液体的电化学性质以及IrCl3在离子液体体系中的溶解度。本文利用电导率仪测定BMIC等4种纯离子液体及其复合离子液体的电导率,利用循环伏安法(CV)测定离子液体的电化学窗口,利用紫外-可见分光(UV-Vis)光度计测定了IrCl3在离子液体中的溶解度。结果表明:纯离子液体的电导率随温度的升高而逐渐增大;纯离子液体的电化学窗口宽度随温度的升高而有所减小;IrCl3在纯离子液体中的溶解度与溶液温度及离子液体的离子作用能密切相关,在相同温度下IrCl3在纯离子液体中的溶解度顺序为BUPYBF4>BMIBF4>HMIBF4;复合离子液体的电化学窗口与其组成中电化学窗口宽度较窄的纯离子液体的电化学窗口一致,电导率值则处于两种纯离子液体之间;IrCl3在由相同阴离子组成的复合离子液体BUPYBF4+BMIBF4中的溶解度与纯BUPYBF4基本相同,而在由相同阳离子组成的复合离子液体BMIC+BMIBF4中的溶解度则有很大的提高。BMIC+BMIBF4的复合离子液体不仅保持了纯离子液体的电化学性质的优势,还克服了纯离子液体对于IrCl3溶解度偏低的缺点。与纯离子液体相比,BMIC+BMIBF4的复合离子液体体系更适合用于电沉积制备Ir层。
关键词:
中图分类号: TQ153.1;O646
作者简介:钱建刚(1964-),男,江苏张家港人,博士,副教授,研究方向:电化学、金属材料防腐蚀;电话:010-82339870;E-mail:qianjg@buaa.edu.cn;
收稿日期:2013-08-23
基金:国家自然科学基金项目(51071014);航空科学基金项目(2010ZE51055)资助;
Electrochemical Properties of Ionic Liquids and Solubility of IrCl3
Qian Jiangang Li Xin Luan Haijing Li Haiting Li Pengrui
Key Laboratory of Bio-Inspired Smart Interfacial Science and Technology of Ministry of Education,School of Chemistry and Environment,Beihang University
Abstract:
In order to choose a proper ionic liquid solution system to electrodeposit Ir layer and provide theoretical bases for electrodepositing Ir layer in ionic liquid,it is necessary to study the electrochemical properties and solubility of IrCl3 in ionic liquid. Electric conductivity of four different ionic liquids was studied using conductivity meter and electrochemical window,which was measured by cyclic voltammetry( CV) method. The IrCl3 solubility in ionic liquids was studied using ultraviolet-visible( UV-Vis) spectrophotometer.The results showed that as the temperature rose,the conductivity of ionic liquids increased and the electrochemical window of ionic liquid narrowed slightly; the solubility of IrCl3 in ionic liquids was influenced by the ionic interaction energy and the temperature of ionic liquids. The order of solubility of the ionic liquids was BUPYBF4> BMIBF4> HMIBF4 at the same temperature; the electrochemical window of the composited ionic liquid by two different ionic liquids was the same with the narrower one,and the conductivity of the composited ionic liquid was between the two kind pure ionic liquids; the solubility of IrCl3 in the composited BMIBF4+ BUPYBF4 ionic liquid changed little compared with that in the pure BUPYBF4,while that in the composited BMIBF4+ BMIC ionic liquid increased much. The composited BMIBF4+ BMIC ionic liquid showed similar electrochemical properties with the pure ionic liquid,but it could dissolve more IrCl3 than the pure ionic liquid. So it was more helpful to the electrodeposition of Ir layer.
Keyword:
ionic liquid; composited ionic liquid; electrochemical properties; solubility; IrCl3;
Received: 2013-08-23
金属Ir的熔点高达2400℃,且化学惰性很强,在2100℃以下能保持很低的耗氧率,与碳在2280℃的低共熔点以下也很难反应[1,2,3],而且不溶于所有的无机酸,能抵御许多熔融试剂和高温硅酸盐的侵蚀,这些都是其他金属所不具备的。由于Ir在高温下具有优良的抗氧化和耐腐蚀性能,因此Ir常常被沉积在需要耐高温的关键零件的表面,如导弹巡洋舰涡轮发动机、火箭燃烧室内壁、气体涡轮发动机、火力发电机、汽车工业及其他特殊结构件的表面,在航空、航天、航海及民用高技术领域等具有广泛的应用前景[4,5]。然而,Ir却是一种几乎无延展性的脆性金属,而且许多时候Ir在经过热或冷成形加工工序后都会表现出明显的加工硬化现象,因此,Ir的成形是一个亟待解决的关键技术问题。电沉积技术可以在基体表面逐渐长成所需形状的材料,具有易操作、低成本、低能耗等优点,是一种常用材料制备成型技术。利用电沉积技术有望解决此关键技术问题。
目前制备Ir层的主要方法有: 水溶液中电沉积[6,7]、熔融盐体 系中电沉 积[8]、化学气相 沉积[9]、溅射物理气相沉积[10]、等离子喷涂[11]和基体表面直接生长[12]等。在水溶液中电沉积制备Ir层由于阴极存在析氢副反应,获得的Ir层存在较大应力。利用高温熔盐电沉积制备Ir层存在操作温度过高、能耗大、强腐蚀等问题。化学气相沉积制备Ir层所需设备昂贵、成本高。溅射物理气相沉积制备Ir层沉积速率较慢,而且不适合沉积在形状复杂的部件上。等离子喷涂所获得的Ir层孔隙率较高,不能作为保护涂层来使用,特别是在超高温环境下。利用化学还原在基体表面直接生长制备Ir层工艺较复杂、效率低,并且Ir呈颗粒状分布,没有形成致密的涂层。
离子液体具有很好的热稳定性、优良的导电性、不挥发、不燃烧、电化学窗口宽等适合在电化学中应用的优点[13],作为电解液既可以起溶剂的作用,又可以起电解质的作用,因而在金属电沉积方面获得广泛应用[14]。与水溶液相比,在离子液体中进行电沉积可避免在阴极上产生副反应,而且可以电沉积在水溶液中无法获得的材料,如硅、锗、铝、钛等[15]; 离子液体还具有比水更优良的热稳定性,可以应用于较宽的温度范围内。与有机电解液相比,离子液体具有不易挥发,高温下不易燃,操作更安全等优点。与高温熔盐相比,高温熔盐工作温度较高,腐蚀性较强,所以在应用上受到一定的限制,而离子液体在室温下就可以获得在高温熔盐中电沉积才能获得的金属,无须一般熔盐的高温工作条件,因而简化了工艺设计,降低了生产成本[16]。更为重要的是,由于离子液体的可设计性,可以对其阴、阳离子进行有选择性的组合,从而获得能够满足电沉积要求的离子液体。因此,离子液体是一种理想的“绿色”电解液,在电沉积中的应用极具潜力[17]。
目前,金属在离子液体中的电沉积已获得了广泛研究,许多金属都能在离子液体中通过电沉积的方法获得[18]。但许多金属元素的盐类在离子液体中的溶解度都不高,有关离子液体中金属盐的溶解度的研究报道也非常少[19],目前也罕见在离子液体中电沉积制备Ir层的报道,原因可能是Ir Cl3在纯离子液体中的溶解度较小,无法满足电沉积的需要。因此,如何提高Ir Cl3在离子液体中的溶解度成为能否在离子液体中电沉积制备出Ir层的关键。本文对不同类型的纯离子液体及其相互复合形成的复合离子液体体系的电化学性质和IrC l3的溶解度进行了研究,并探讨了Ir Cl3在离子液体特别是复合离子液体体系中的溶解度的变化规律,为离子液体中进行电沉积制备质量较好的Ir层提供坚实的基础。
1 实 验
1. 1 药 品
氯化1-丁基-3-甲基咪唑 ( BMIC,纯度大于99% ,上海成捷化学有限公司) ,1-丁基-3-甲基四氟硼酸盐( BMIBF4,纯度大于99% ,上海成捷化学有限公司) ,1-己基-3-甲基四氟硼酸盐( HMIBF4,纯度大于99% ,上海成捷化学有限公司) ,N-丁基吡啶四氟硼酸盐( BUPYBF4,纯度大于99% ,上海成捷化学有限公司) ,Ir Cl3( 99. 5% ) 。
1. 2 过 程
测量离子液体电导率和电化学窗口的实验均在充满氩气的手套箱内进行,利用DDS-307型电导率仪测量不同温度下离子液体的电导率值。利用Chi660D电化学工作站,以Pt丝作对电极和参比电极,以Au电极作工作电极,测定不同温度下离子液体的循环伏安曲线,由此获得其电化学窗口的大小。测量离子液体中Ir Cl3的溶解度采用如下方法: 首先利用Cintra10e紫外-可见分光光度计测定含有Ir Cl3离子液体的紫外-可见吸收光谱,确定其吸收峰位置; 然后配制一系列以该离子液体作溶剂的已知Ir Cl3浓度的溶液,测量其在吸收峰位置的吸光度值,绘制出吸光度-浓度标准曲线;再测量在该离子液体中Ir Cl3含量达到饱和时溶液的吸光度值,利用所得的吸光度-浓度标准曲线反推出饱和溶液中IrC l3的浓度。在配制Ir Cl3饱和溶液的过程中,由于Ir Cl3在离子液体中的溶解比较缓慢,除了向离子液体中加入过量的Ir Cl3外,还需将溶液搅拌48 h,以确保Ir Cl3在溶液中能达到饱和。由于Ir Cl3饱和溶液的吸光度值较高,超出了紫外-可见分光光度计的量程,因此需将饱和溶液进行适当稀释后测量其吸光度。Ir Cl3饱和溶液稀释时,先将饱和 溶液置于 离心管中 以5000r·min- 1的速率离心2 min,以确保未溶解的Ir Cl3沉淀于离心管底部,然后用注射器抽取0. 2 ml上层溶液,将这0. 2 ml上层溶液用离子液体稀释至10 ml,稀释后的溶液的浓度为饱和溶液的1 /50,其吸光度满足了紫外-可见分光光度计的量程要求。
2 结果与讨论
2. 1 离子液体的电导率
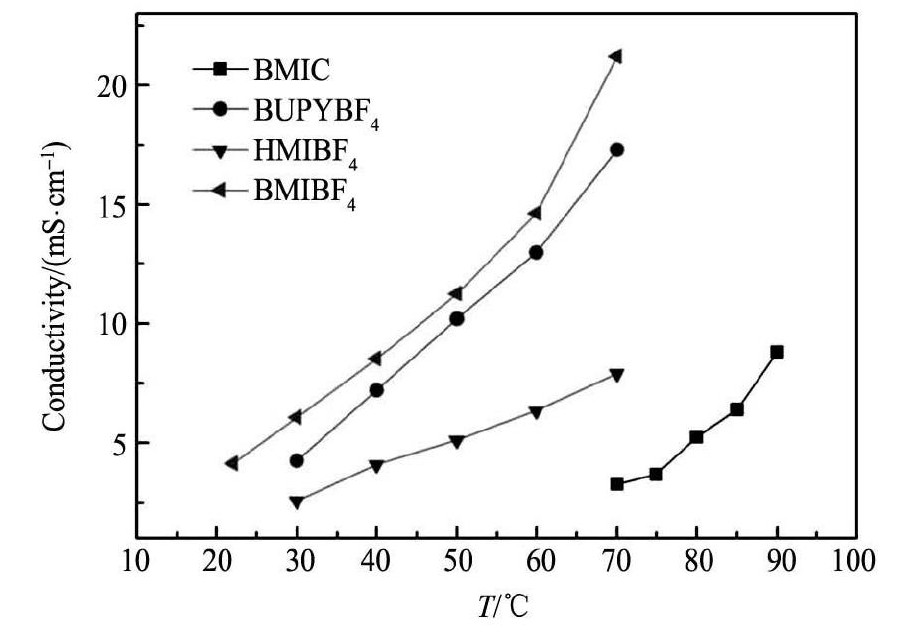
图1为各种离子液体的电导率-温度曲线。由图1可以看出: 被测离子液体的电导率均随温度的升高而逐渐增大; 在相同温度下,BMIBF4的电导率最高,BUPYBF4稍低,而HMIBF4的电导率则明显低于前两种离子液体的; BMIC在65℃以下是固体,在70℃时4种被测离子液体的电导率顺序为BMIBF4> BUPYBF4> HMIBF4> BMIC。在阳离子种类相同的情况下,BMIBF4的电导率高于BMIC。阴离子种类相同的情况下,HMIBF4的电导率比BMIBF4小。离子液体的电导率与其粘度、阴阳离子大小和分子量、阴阳离子的类型都有关系,但其中粘度的影响最为明显[20],粘度越大,离子的迁移率越低,离子液体的电导率越小。BMIC常温下为固体,即使加热至其熔点以上30℃,BMIC仍保持较高的粘度,所以其电导率相对其他离子液体都较低。一般来说,咪唑类离子液体取代基上的碳链越长,粘度越大,因此HMIBF4的粘度比BMIBF4的大; 其电导率相应的比BMIBF4小。
图 1 离子液体的电导率-温度关系曲线Fig. 1 Plots of conductivity against temperature in different ionic liquids
2. 2 离子液体的电化学窗口
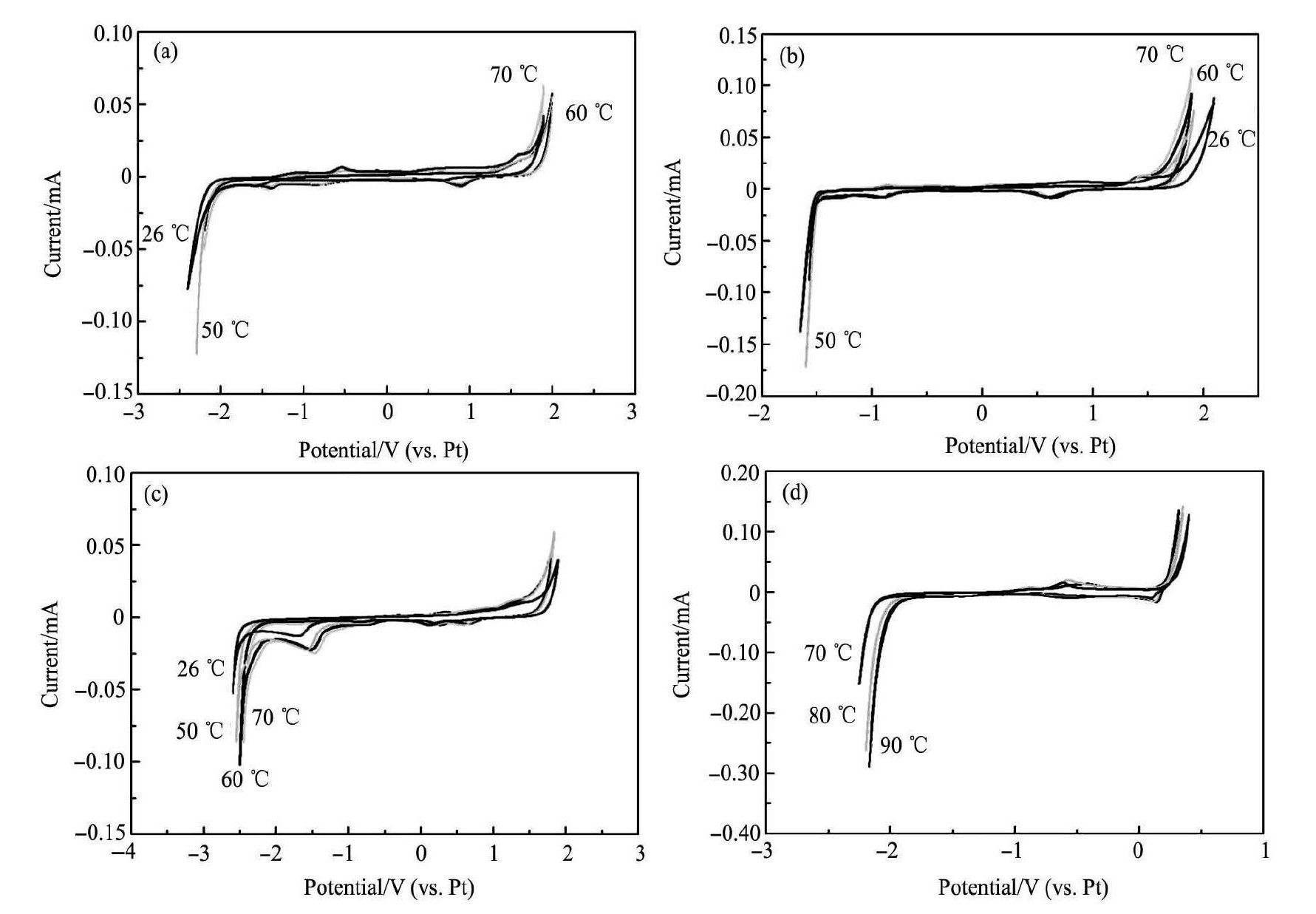
图2为离子液体在不同温度下的循环伏安曲线。由图2可以看出: 离子液体的电化学窗口宽度都随温度的升 高而有所 减小。室温下BMIBF4,HMIBF4两种离子液体的电化学窗口宽度相当,而且由于HMI+与BMI+属于同一类型的阳离子,因此HMIBF4与BMIBF4的还原峰位置也基本相同;BMIBF4,HMIBF4,BUPYBF4氧化峰位置相同,这是由于它们含有相同的阴离子; 而BUPYBF4的还原峰的电位明显高于其他离子液体,说明BUPY+比较容易被还原; BMIC的氧化峰远低于其他离子液体,说明Cl-相比较其他阴离子更易被氧化。在同一温度下,离子液体的电化学窗口大小顺序为:BMIBF4≈HMIBF4> BUPYBF4> BMIC。
图 2 离子液体在不同温度下的循环伏安曲线Fig. 2 Cyclic voltammograms recorded at different temperatures in different liquids
( a) HMIBF4; ( b) BUPYBF4; ( c) BMIBF4; ( d) BMIC
2. 3 纯离子液体中 Ir Cl3的溶解度
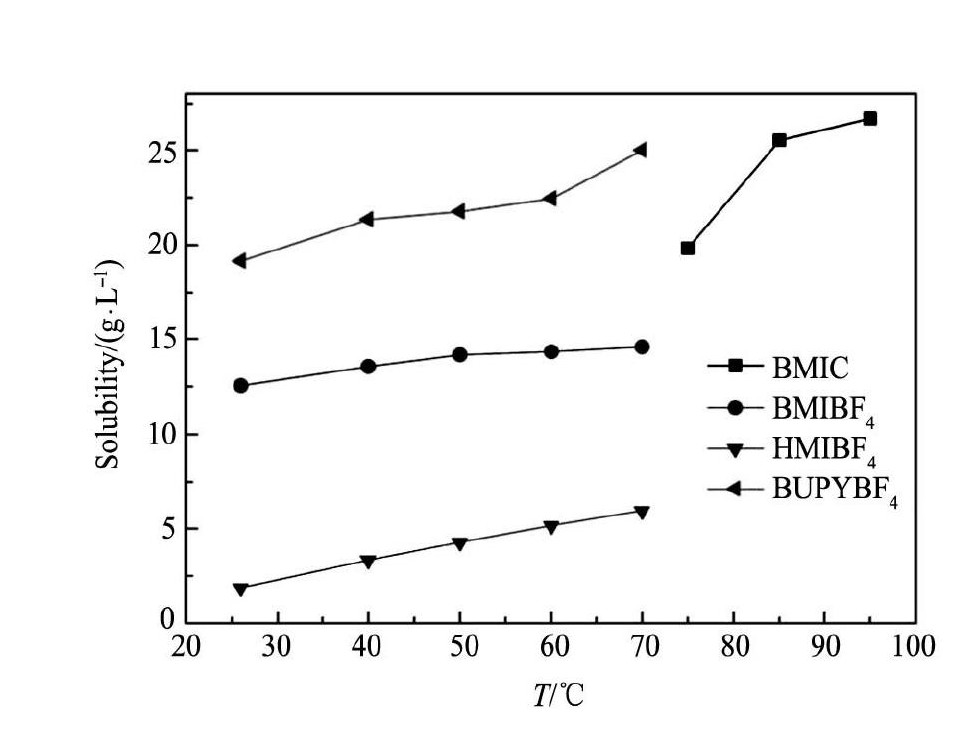
根据Ir Cl3溶解在不同种类的离子液体后所产生的特征吸收峰( 选定BMIC离子液体在430 nm,BMIBF4,HMIBF4,BUPYBF43种离子液 体均在495 nm) ,分别在峰值处测定吸光度值与Ir Cl3在不同离子液体中浓度之间的关系( 即标准曲线) ,再由标准曲线测得在不同纯离子液体中Ir Cl3的溶解度与温度的关系,结果如图3所示。
由图3可以看出: Ir Cl3在不同离子液体中的溶解度均随温度的升高而增大; Ir Cl3在BUPYBF4和BMIC中的溶解度相对较高( 但BMIC在室温下呈固态,需加热至65℃以上熔化后使用,相比于其他室温下呈液态的离子液体,这是BMIC在实际使用中存在的不足) ; Ir Cl3在HMIBF4中的溶解度较小。
图 3 不同纯离子液体中 Ir Cl3的溶解度与温度关系曲线Fig. 3 Plots of solubility against temperature for Ir Cl3in different ionic liquids
Ir Cl3溶解于离 子液体的 过程可描 述如下:Ir Cl3在离子液体中可发生如下解离,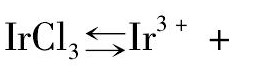
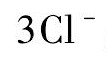
当温度升高时,离子液体中离子团簇的热运动加速,热运动加速后离子团簇可以克服离子作用能的阻碍,从而促进Ir Cl3在离子液体中的解离,因此离子液体中Ir Cl3的溶解度均随温度的升高而增大。
BF4的电负性并不强,因此,以BF4为阴离子的离子液体 的氢键作 用较弱; 在BUPYBF4,BMIBF4,HMIBF43种离子液体中离子所带电荷数相同,阳离子尺寸几乎相同,因此,3种离子液体库仑力的差异也很小,最终导致影响离子之间的相互作用力的因素为这几种离子液体所含阳离子的范德华力的差异。从分子量看,HMI+,BMI+,BUPY+的分子量依次减小,范德华力也依次减小;从分子构型看,咪唑类阳离子比吡啶类阳离子BUPY+多一条支链,离子间的范德华力会更强,而HMI+比BMI+的支链更长,范德华力也更强[22],因此,Ir Cl3在BUPYBF4,BMIBF4,HMIBF43种离子液体中的溶解度依次逐渐降低。
Ir Cl3在BMIC中的溶解度较高,是因为BMIC解离后能提供Cl-离子,而Cl-能与Ir Cl3结合形成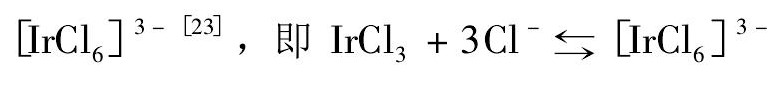
2. 4 复合离子液体
通过对上述各种纯离子液体的电化学性质和Ir Cl3溶解度的研究,发现单独的纯离子液体往往在某方面存在不足,尤其是纯离子液体对于Ir Cl3的溶解度偏低,难以满足电沉积制备Ir层的需要,因此,希望通过离子液体的复合来克服单独纯离子液体所存在的不足。将具有相同阴离子的离子液体BUPYBF4与BMIBF4以体积比1∶1进行复合,将具有相同阳离子的离子液体BMIC与BMIBF4以体积比1∶1进行复合,探讨复合后其电化学性质和Ir Cl3溶解度的变化。
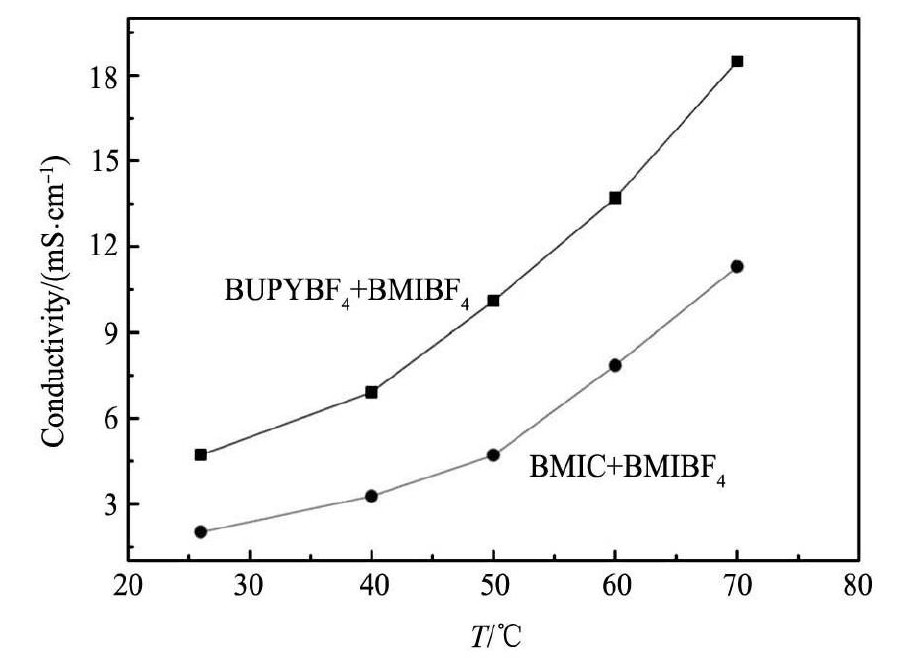
2. 4. 1复合离子液体的电化学性质实验结果表明: 复合离子液体的电化学窗口与其组成中电化学窗口较窄的离子液体一致,即BUPYBF4与BMIBF4组成的复 合离子液 体的电化 学窗口与BUPYBF4一致,BMIC与BMIBF4组成的复合离子液体的电化学窗口与BMIC一致。这是因为对于复合离子液体中的两种不同阴离子,当电位升高时,较容易被氧化的阴离子率先被氧化; 同理,对于复合离子液体中的两种不同阳离子,当电位降低时,较容易被还 原的阳离 子率先被 还原。图4为BUPYBF4与BMIBF4以体积比1∶1复合和BMIC与BMIBF4以体积比1∶1复合后离子液体的电导率与温度关系图。由图4与图1对比可知,当两种离子液体混合后,其混合离子液体的电导率处于两者之间。BMIC与BMIBF4以体积比1∶1复合后在常温下呈现液态,其粘度较BMIBF4要大,电导率较BMIBF4要小。
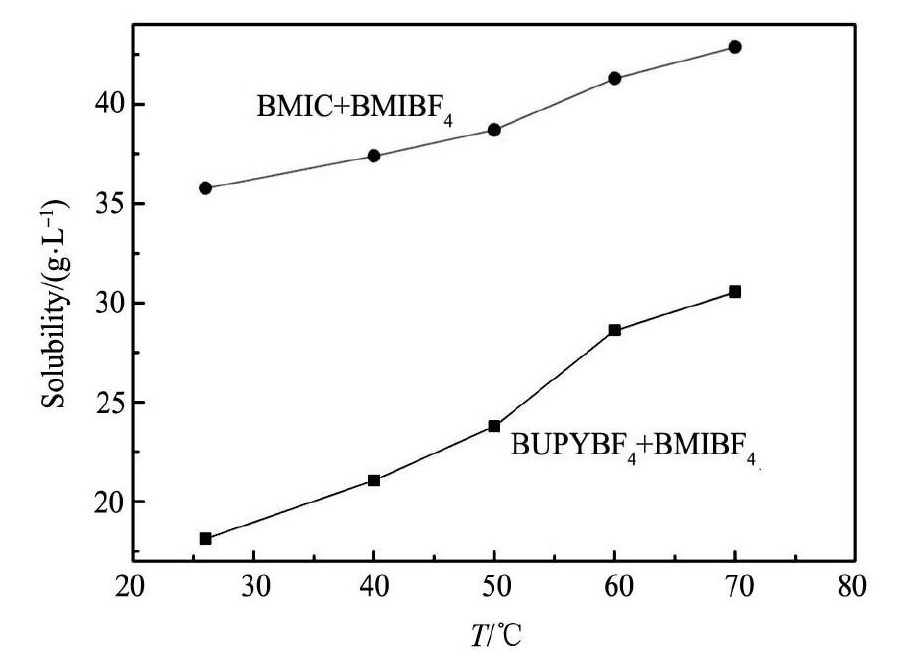
2. 4. 2 Ir Cl3在复合离子液体中的溶解度图5为复合离子液体体系中Ir Cl3的溶解度与温度关系图。由图5可以看出: Ir Cl3在BUPYBF4+ BMIBF4的复合离子液体体系中的溶解度与在单独纯的BUPYBF4离子液体中的溶解度相当; 而Ir Cl3在BMIC + BMIBF4复合离子液体体系中的溶解度比在单独纯离子液体BMIC或BMIBF4体系中的溶解度都有很大的提高。这说明Ir Cl3在BUPYBF4+BMIMBF4组成的复合离子液体中的溶解度并没有发生明显的变化; 而在BMIC + BMIMBF4组成的复合离子液体中的溶解度则有很大的提高。在向BUPYBF4中加入等体积的BMIBF4形成复合离子液体体系后,体系的阴离子种类并未发生改变,而新增加的BMI+虽然增大了离子液体中的范德华力作用,但由于相当数量的BUPY+存在,离子液体中存在的离子团簇将会选择性地向BUPY+比较多的地方扩散,即向着最终离子作用能比较低的状态发展。所加入的BMI+并未阻碍离子团簇的运动,复合离子液体体系对Ir Cl3的溶解能力与纯的BUPYBF4几乎相同。因此,Ir Cl3在BUPYBF4与BMIBF4组成的复合离子液体体系中的溶解度相比纯的BUPYBF4并没有明显变化。在BMIC与BMIBF4的复合离子液体体系中,一方面体系中的Cl离子与Ir3 +结合形成 [Ir Cl6]3 -,另一方面BMIBF4的引入使得混合离子液体中的氢键作用大大减弱,离子作用力降低后[Ir Cl6]3 -可以更容易扩散至溶液中,这两种因素都有助于提高混合离子液体体系对Ir Cl3的溶解度[24]。而纯BMIC由于需加热至65℃才能熔化,因而即使将其加热至90℃ ,其提供游离Cl-及 [Ir Cl6]3 -扩散的能力都十分有限,其离子作用能还是要远高于加入BMIBF4后的复合体系。
图 4 复合离子液体体系的电导率-温度曲线Fig. 4Plots of conductivity against temperature in composited ionic liquid
图 5 复合离子液体体系中 Ir Cl3的溶解度与温度关系图Fig. 5 Plots of solubility against temperature for Ir Cl3in composited ionic liquids
与纯BMIC离子液体相比,BMIC + BMIBF4的复合离子液体体系的优点在于在室温条件下该复合离子液体呈液态,扩大了电沉积的温度范围; 与纯BMIBF4离子液体相比,Ir Cl3在BMIC + BMIBF4复合离子液体体系中的溶解 度有很大 的提高,BMIC + BMIBF4的复合离子液体体系不仅基本保持了离子液体电导率高、电化学窗口宽的优点,同时也克服了纯离子液体对Ir Cl3溶解度偏低的缺点,这一改善将为电沉积制备出质量较好的Ir层创造有利条件。
3 结 论
1. 离子液体的电导率随温度的升高而逐渐增大,70℃时离子液体的电导率顺序为BMIBF4>BUPYBF4> HMIBF4> BMIC; 离子液体的电化学窗口宽度随温度的升高而有所减小; 离子液体中的阴离子决定氧化峰的位置,阳离子决定还原峰的位置,相同温度下,离子液体的电化学窗口大小顺序为BMIBF4≈HMIBF4> BUPYBF4> BMIC。
2. Ir Cl3在离子液体中的溶解度与温度和离子间作用能有关。温度升高,Ir Cl3在离子液体中的溶解度增大。IrC l3在BMIC中发生反应Ir Cl3+ 3Cl[IrC l6]3 -,因此BMIC中Ir Cl3的溶解度较高。在相同温度下Ir Cl3在其他3种离子液体中的溶解度顺序为BUPYBF4> BMIBF4> HMIBF4。
3. 在体积比为1∶1的复合离子液体中,复合离子液体的电化学窗口与其组成中电化学窗口较窄的离子液体一致,电导率值则位于其组成的两种离子液体的电导率之间; Ir Cl3在BUPYBF4+BMIBF4复合离子液体中的溶解度较BUPYBF4基本不变,而在BMIC + BMIBF4复合离子液体中的溶解度相比BMIC或BMIBF4都有很大的提高。BMIC与BMIBF4的复合离子液体体系在室温下呈液态,而且Ir Cl3的溶解度也较高,克服了单独的纯离子液体对Ir Cl3溶解度偏低的缺点,为电沉积制备质量较好的Ir层创造了有利条件。