网络首发时间: 2015-04-07 09:26
氰化浸金过程中孔雀石反应的热力学
省部共建复杂有色金属资源清洁利用国家重点实验室
昆明理工大学国土资源工程学院
云南省金属矿尾矿资源二次利用工程研究中心
昆明理工大学冶金与能源工程学院
摘 要:
针对氰化浸金过程中孔雀石的浸出反应进行热力学计算,分别绘制了在温度298.15 K、压强0.1 MPa条件下Cu CO3Cu(OH)2-H2O体系、Cu CO3Cu(OH)2-CN-H2O体系和Cu CO3Cu(OH)2-Au-CN-H2O体系的E-pH图,依据E-p H图中稳定区域的大小及其变化情况,分析了孔雀石氰化浸出过程中的热力学影响因素。结果表明:碱性环境下,当不存在络离子时,孔雀石不能溶解;Cu CO3Cu(OH)2-H2O体系中添加1×10-2mol·L-1CN-后,孔雀石能够在碱性溶液中溶解,固态孔雀石稳定区域缩小,铜氰络合物的稳定区域出现;当氰化物浓度由1×10-2mol·L-1提高到0.1 mol·L-1时,Cu(CN)-2的稳定区域消失,Cu(CN)2-3的稳定区域缩小,Cu(CN)3-4的稳定区域出现。研究发现碱性无氧环境中金可在孔雀石与氰根的共同作用下生成金氰络合物。另外,碱性环境下孔雀石与氰根反应的副产物(CN)2会氧化分解生成CN-和CNO-,同时CN-自身在氧气的作用下也会发生氧化反应。
关键词:
中图分类号: TF831
作者简介:崔毅琦(1980-),女,河南南阳人,博士,副教授,研究方向:稀贵金属选冶的研究;电话:15287126700;E-mail:cuiyq111@126.com;
收稿日期:2014-03-13
基金:国家自然科学基金项目(51104077);云南省应用基础研究基金项目(2010ZC022)资助;
Thermodynamics of Malachite in Gold Cyanide Leaching
Cui Yiqi Meng Qi Tong Xiong Dong Peng
State Key Laboratory of Complex Nonferrous Metal Resources Clean Utilization
Faculty of Land Resource Engineering,Kunming University of Science and Technology
Yunnan Province Engineering Research Center for Reutilization of Metal Tailings Resources
Faculty of Metallurgical and Energy Engineering,Kunming University of Science and Technology
Abstract:
The thermodynamic calculations were performed for malachite leaching in the cyanide solution,and the potential-p H( Ep H) diagrams of Cu CO3Cu( OH)2-H2 O,Cu CO3Cu( OH)2-CN-H2 O,Cu CO3Cu( OH)2-Au-CN-H2 O were obtained at temperature of298. 15 K and pressure of 0. 1 MPa. Based on the stable region and the area changes of each material in the E-p H diagrams,the affecting factors of malachite leaching in cyanide solution were analyzed. The results showed that malachite was insoluble in the absence of complex ions in alkaline solution. And the stable region of copper cyanide complexes appeared and the stable region of solid malachite shrank with 1 × 10- 2mol·L- 1CN-being added to an alkaline Cu CO3Cu( OH)2-H2 O system. With cyanide concentration increased from 1 × 10- 2to 0. 1 mol·L- 1,the stable region of Cu( CN)-2disappeared,the stable region of Cu( CN)2-3shrank and the stable region of Cu( CN)3-4appeared. It was found that in an alkaline oxygen-free environment gold could be leached under the combined effect of malachite and cyanide. In addition,the by-products( CN)2which was produced by the reaction between malachite and cyanide in alkaline environment could be decomposed into CN-and CNO-,and the oxidation reaction of CN-would occur with the presence of oxygen.
Keyword:
thermodynamics; malachite; potential-pH diagrams; gold cyanide leaching;
Received: 2014-03-13
含铜金矿属难处理矿石,铜矿物在氰化浸金过程中会造成氰化物耗量增大,金的浸出率降低[1,2]。现阶段,含铜金矿的处理手段主要有预处理-氰化浸出和非氰浸出两大类。预处理方法又包括预先浸铜、预先浮铜、加压浸出、微生物氧化等方法[3,4,5]; 非氰浸金技术主要有硫代硫酸盐法、硫脲法、卤素法等,这些浸出剂对铜矿物不敏感,可选择性浸取金,但成本较高、一些关键技术尚未突破,还未能应用于实际生产中[6,7]。
孔雀石是铜金矿石中常见的铜矿物,具有一定代表性,研究其氰化浸出反应行为对含铜金矿处理有一定的指导意义。目前,金氰化浸出过程中孔雀石溶解反应的理论研究较少[8,9,10],本文主要绘制了电势-p H( E-p H) 图,并利用其进行孔雀石氰化浸出行为的研究。E-p H图是表示理想标准状态下不同电势和p H值范围中产物的存在形式,可很好地预测物质浸出反应进行方向,对物质浸出溶解理论研究有重要意义。
1孔雀石氰化浸出反应
孔雀石( Cu CO3Cu ( OH)2) 在氰化浸出过程中与Na CN发生反应,其产物Cu CN可与CN-继续反应生成Cu( CN)2,Cu( CN)23,Cu( CN)34等配合物[11,12,13,14,15],造成氰化物消耗,主要反应如下:
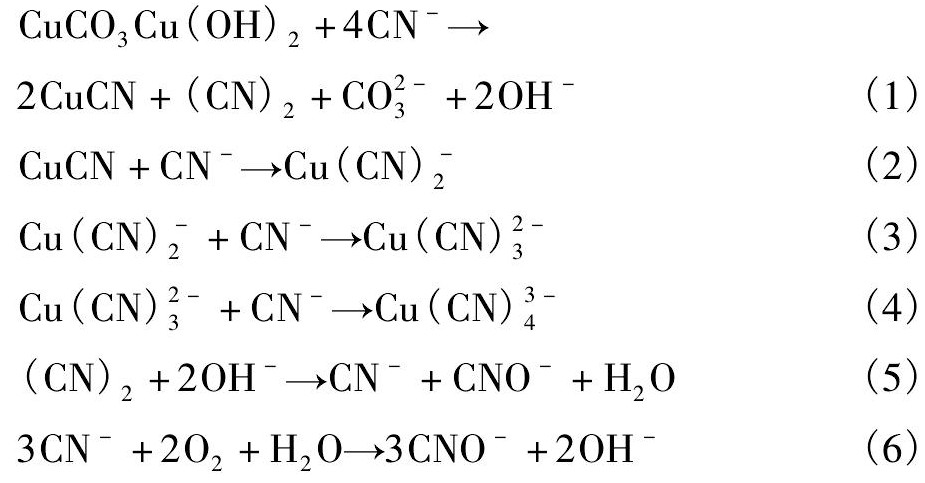
其中,各物质标准吉布斯自由能( ΔfGmΘ) 见表1,依据表1计算上述 各反应式 吉布斯自 由能变化 ( ΔrGmΘ) ,结果见表2。
从表1,2知,( 1) - ( 6) 式 ΔrGmΘ< 0 ,表明在标准状态下孔雀石与氰化物反应可自发正向进行,当浸出体系中存在较多CN-时,Cu CN会进一步络合氰根生成多配位数的铜氰络合物。碱性环境下氰根氧化产物( CN)2会分解生成CN-和CNO-,而CN-自身在氧气的作用下也会发生氧化反应。
2孔雀石氰化浸出过程的热力学
为进一步考察孔雀石氰化浸金过程中的浸出行为,在温度298. 15 K、压强0. 1 MPa条件下分别绘制Cu CO3Cu( OH)2-H2O体系、Cu CO3Cu( OH)2CN-H2O体系、Cu CO3Cu( OH)2-Au-CN-H2O体系的E-p H图。
2.1CuCO3Cu(OH)2-H2O体系E-pH图
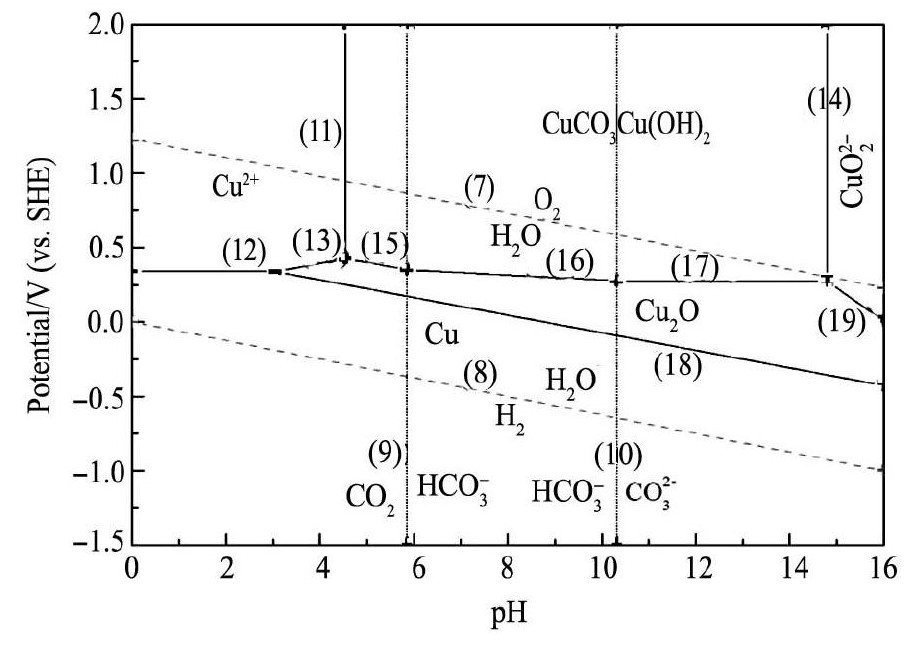
通过计算得到Cu CO3Cu ( OH )2-H2O体系Ep H平衡式结果( 见表3) ,绘制的Cu CO3Cu( OH)2H2O体系E-p H图见图1。
从图1知,在没有配位体存在的条件下,孔雀石相对稳定,孔雀石在p H < 4. 54、E > 0. 35 V酸性条件下可溶解形成Cu2 +,而在弱碱性或强碱性条件下,孔雀石不会溶解,在E > 0. 27 V时仍以Cu CO3Cu( OH)2形式存在,E < 0. 27 V以下分解为Cu2O,在p H > 14. 8时,生成Cu O22。
2.2CuCO3Cu(OH)2-CN-H2O体系的E-pH图
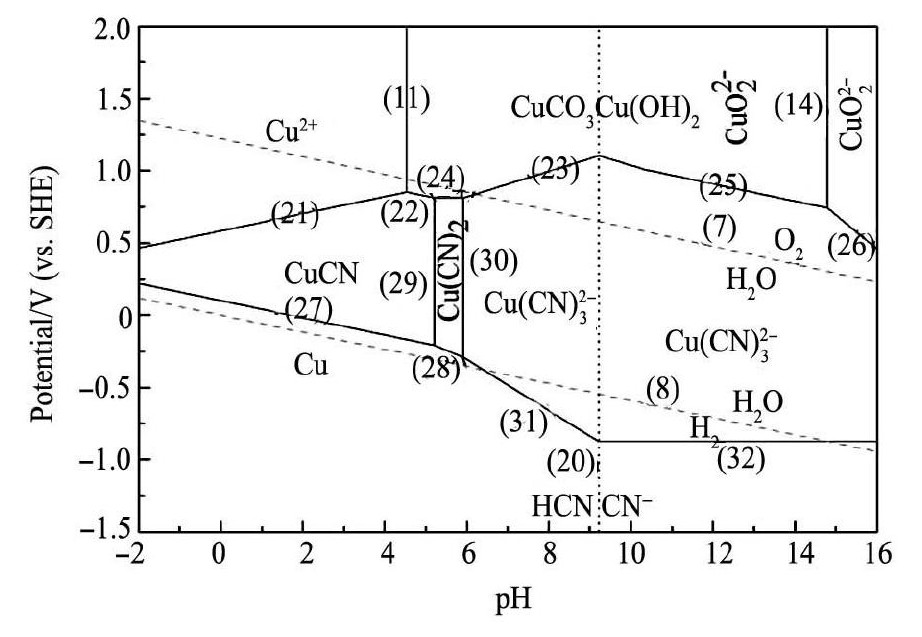
通过计算得到Cu CO3Cu ( OH )2-CN-H2O体系的E-p H平衡式结果见表4,分别绘制氰根浓度为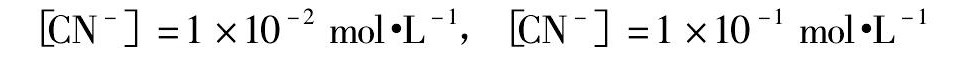
表1 各物质吉布斯自由能 Table 1 Gibbs free energy data for all species ( k J·mol- 1) 下载原图
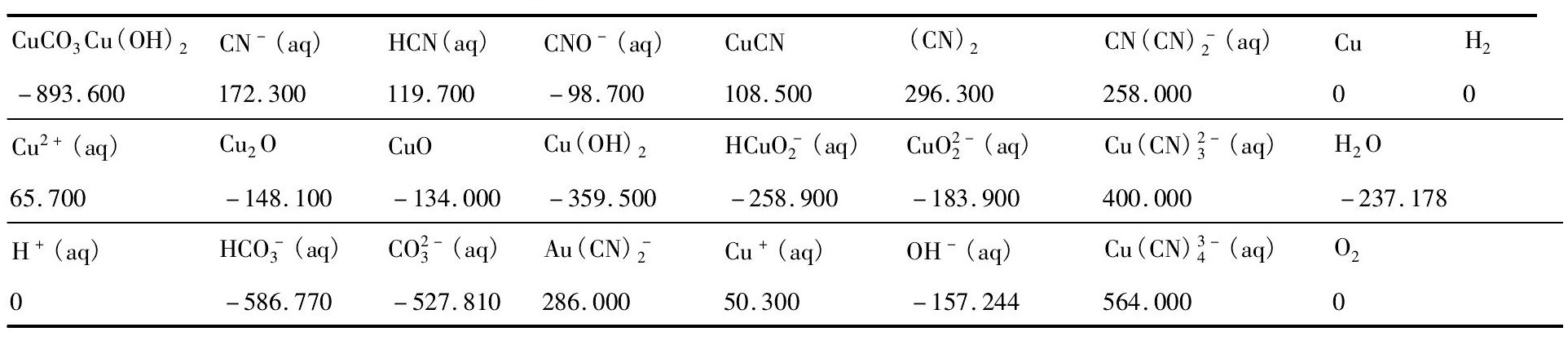
表1 各物质吉布斯自由能 Table 1 Gibbs free energy data for all species ( k J·mol- 1)
表2 各反应式吉布斯自由能变 Table 2 Change of Gibbs free energy for each reaction ( k J·mol- 1) 下载原图

表2 各反应式吉布斯自由能变 Table 2 Change of Gibbs free energy for each reaction ( k J·mol- 1)
图1Cu CO3Cu ( OH)2-H2O 系 E-p H 图( [Cu ( Ⅱ) ] = 1 × 10- 2mol·L- 1) Fig.1 E-p H diagram for Cu CO3Cu( OH)2-H2O system ( [Cu ( Ⅱ) ]= 1 × 10- 2mol·L- 1)
从图2知,Cu CO3Cu ( OH)2-H2O体系中添加氰化物后,在p H < 5. 22、较低电位下,孔雀石转化成Cu CN。Cu( CN)2仅在p H = 5. 22 ~ 5. 91之间存在,稳定区域较小,稳定性不高。当p H > 5. 22则转化为二氰合铜、三氰合铜,其中在p H > 5. 91,E > - 0. 10 V条件下会以稳定的Cu( CN)23形式存在。此外,孔雀石稳定区域较未添加CN-时缩小, 可见,碱性环境下孔雀石由于CN-作用变得易于溶解浸出。
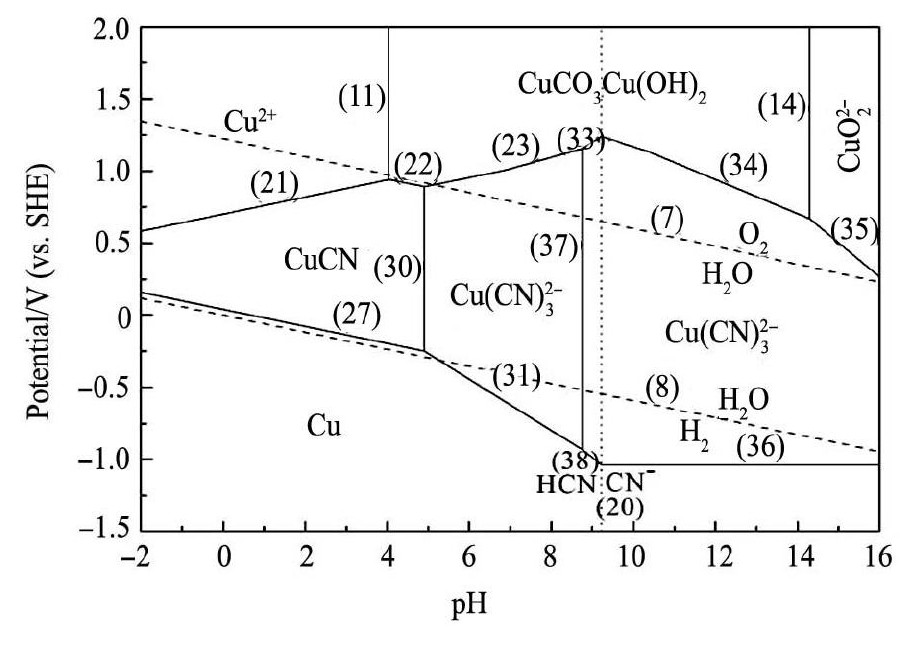
从图3知,当氰化物 组分浓度 由1 × 10- 2mol·L- 1提高到1 × 10- 1mol·L- 1时,孔雀石主要生成高配位数的铜氰络合物,Cu( CN)2稳定区域消失,同时在p H > 8. 76条件下铜会以配合物Cu ( CN)34形式存在,这表明氰根浓度的增大有利于高配位数铜氰络合物的形成。
2.3CuCO3Cu(OH)2-Au-CN-H2O体系的EpH图
通过计算得到Cu CO3Cu( OH)2-Au-CN-H2O体系的E-p H平衡式见表4,绘制Cu CO3Cu ( OH )2Au-CN-H2O体系E-p H图,见图4。
从图4可知,在p H = 0 ~ 14范围内,金均可氰化浸出形成Au( CN)2,在p H = 0 ~ 9. 22时,随着p H升高,Au( CN)2( I) /Au( 0) 电势逐渐降低; 当p H > 9. 22时进入CN-稳定区域,此时Au( CN)2/ Au( 0 ) 电势达到最低值为 - 0. 98 V,并高于Cu ( CN)34( I) /Cu( 0) 电势值 - 1. 04 V,属于孔雀石氰化反应产物Cu( CN)34稳定区域。
此外,孔雀石氰化溶解Cu CO3Cu( OH)2( Ⅱ) /Cu( CN)34( I) 还原电势远高于Au( CN)2( I) /Au ( 0) 氧化电势,碱性无氧气环境下孔雀石与金在氰根作用下可发生如下反应:
表3 Cu CO3Cu( OH)2-H2O 体系的反应式与 E-p H 平衡式( 298. 15 K) Table 3 Equilibrium reactions and E-p H equations of Cu CO3Cu( OH)2-H2O system at 298. 15 K 下载原图

表3 Cu CO3Cu( OH)2-H2O 体系的反应式与 E-p H 平衡式( 298. 15 K) Table 3 Equilibrium reactions and E-p H equations of Cu CO3Cu( OH)2-H2O system at 298. 15 K
表4 Cu CO3Cu( OH)2-CN-H2O 体系和 Cu CO3Cu( OH)2-Au-CN-H2O 体系的反应式与 E-p H 平衡式( 298. 15 K ) Table 4Equilibrium reactions and E-p H equations of Cu CO3Cu ( OH)2-CN-H2O system and Cu CO3Cu ( OH)2-Au-CNH2O system at 298. 15 K 下载原图

表4 Cu CO3Cu( OH)2-CN-H2O 体系和 Cu CO3Cu( OH)2-Au-CN-H2O 体系的反应式与 E-p H 平衡式( 298. 15 K ) Table 4Equilibrium reactions and E-p H equations of Cu CO3Cu ( OH)2-CN-H2O system and Cu CO3Cu ( OH)2-Au-CNH2O system at 298. 15 K
图2 Cu CO3Cu( OH)2-CN-H2O 体系 E-p H 图 Fig.2E-p H diagram for Cu CO3Cu ( OH )2-CN-H2O system ( [Cu( Ⅱ) ] = 1 × 10- 2mol·L- 1,[CN-] = 1 ×10- 2mol·L- 1)
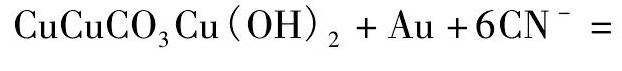
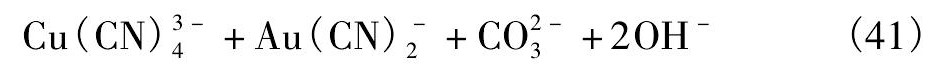
图3 Cu CO3Cu( OH)2-CN-H2O 体系 E-p H 图 Fig.3E-p H diagram for Cu CO3Cu ( OH )2-CN-H2O system ( [Cu( Ⅱ) ]= 1 × 10- 1mol·L- 1,[CN-]= 1 × 10- 1mol·L- 1)
其吉布斯自由能变 ΔrGmΘ= - 132 k J·mol- 1< 0,这表明该反应式可以正向自发进行。
图4 Cu CO3Cu( OH)2-Au-CN-H2O 体系 E-p H 图 Fig.4 E-p H diagram for Cu CO3Cu ( OH )2-CN-H2O system ( [Cu( Ⅱ) ]= 1 × 10- 1mol·L- 1,[CN-]= 1 × 10- 1 mol·L- 1,Au( I) ]= 1 × 10- 4mol·L- 1)
3结论
1. 碱性无氰环境下孔雀石自身不会发生溶解,而碱性环境中在氰根络合作用下,孔雀石可自发溶解,且增大氰根浓度更易形成高配位数铜氰络合物。
2. 金氰化浸出电位在孔雀石氰化反应产物Cu ( CN)34稳定区域内; 碱性无氧环境下孔雀石与金在氰根作用下可自发进行浸出反应。
3. 碱性环境 下孔雀石 与氰根反 应副产物 ( CN)2会氧化分解生成CN-和CNO-,同时CN自身在氧气的作用下也会发生氧化反应。