K3AlF6-Na3AlF6-AlF3体系组成对α-Al2O3溶解度和溶解速度的影响
北京有色金属研究总院能源材料与技术研究所
摘 要:
采用EDTA络合滴定法研究了粉末状α-Al2O3在K3AlF6-Na3AlF6-AlF3体系中的溶解度和溶解速度。探讨了K3AlF6、AlF3含量和温度对氧化铝在K3AlF6-Na3AlF6-AlF3体系中溶解度和溶解速度的影响,并测定了K3AlF6-Na3AlF6-AlF3体系初晶温度30℃以上溶解度和溶解速度,比较了含钾冰晶石熔盐体系和传统钠冰晶石基熔盐体系Al2O3溶解度方面的差异。实验结果表明:K3AlF6-Na3AlF6-AlF3体系中的α-Al2O3溶解速度很快,在510 min内溶解已经达到饱和;850℃时,KR每增加0.2,Al2O3溶解度增加约0.5%(质量分数);随着K3AlF6含量的增加Al2O3溶解度相应的增加,相对于高钾冰晶石含量体系而言,较低K3AlF6含量时,增加K3AlF6的量对提高氧化铝溶解度幅度更加显著;与传统钠冰晶石电解质体系相比K3AlF6-Na3AlF6-AlF3体系Al2O3的溶解度明显增大,当KR≥0.3时,差异愈加显著。
关键词:
α-Al2O3;低温体系;EDTA滴定法;溶解度;溶解速度;
中图分类号: TF821
作者简介:孟庆勇(1984-),男,安徽滁州人,硕士研究生;研究方向:电化学冶金;阚素荣,通讯联系人(E-mail:ksr8065@163.com);
收稿日期:2010-01-20
基金:国家“863”计划资助项目(2008AA030503-3);
Alumina Solubility and Dissolution Rate of α-Al2O3 in K3AlF6-Na3AlF6-AlF3 System
Abstract:
α-Al2O3 powder solubility and dissolution rate in K3AlF6-Na3AlF6-AlF3 system were investigated by EDTA complexometric titration.the influence of K3AlF6,AlF3 content and temperature on α-Al2O3 powder solubility and dissolution rate in K3AlF6-Na3AlF6-AlF3 system were discussed.α-Al2O3 solubility and dissolution rate in K3AlF6-Na3AlF6-AlF3 system above crystallization temperature 30 ℃ were measured,and compared the difference of α-Al2O3 power solubility in elpasolite containing molten salt system and traditional cryolite base system.The results demonstrated that α-Al2O3 dissolved quickly in K3AlF6-Na3AlF6-AlF3 system,and saturated within 510 min.And KR=(m(K3AlF6)/(m(K3AlF6)+m(Na3AlF6)) in weight) increased every 0.2,α-Al2O3 power solubility increased about 0.5%.With increasing K3AlF6 content,α-Al2O3 solubility increased correspondingly,and alumina solubility increased significantly with the same increasing level of K3AlF6 content when K3AlF6 content was lower.Compared with traditional cryolite system,alumina solubility increased obviously in K3AlF6-Na3AlF6-AlF3 system when KR≥0.3.
Keyword:
alumina; low temperature system; EDTA titration; solubility; solution rate;
Received: 2010-01-20
铝熔点为660 ℃, 得到液体铝只需温度850~900 ℃即可, 而现行铝电解温度约为950~970 ℃
1 实 验
1.1 药品处理和装置
Na3AlF6, K3AlF6: 均为上海实验试剂有限公司生产的分析纯试剂, 由于试剂比较稳定, 将样品120 ℃恒温真空干燥24 h, 密闭保存使用。 AlF3: 重庆仙峰锶盐化工有限公司生产的无水AlF3, 真空密闭储存以备用。 Al2O3: 为河南济源兄弟材料有限公司生产的α-Al2O3(粒度80 μm)。
实验装置如图1所示。 由电阻炉、 不锈钢坩埚、 高纯石墨坩埚、 温度控制器、 铂铑热电偶、 搅拌桨和搅拌器组成。
高纯石墨坩埚: 内径60 mm, 外径82 mm, 高85 mm, 装入固体电解质量180 g(实验过程中通入Ar, 以减少石墨坩埚和石墨搅拌器的氧化)。坩埚盖子: 带孔的耐火砖圆盘。 搅拌桨: 自行设计的高纯石墨搅拌桨, 搅拌速度设定为120 r·min-1。 热电偶: 精确校准铂铑热电偶。 温度控制器: 北京市朝阳自动化仪表厂生产的XMT-420数字式仪表。
图1 Al2O3溶解度和溶解速度测量装置示意图
Fig.1 Schematic diagram for experiment of alumina solubility measurement
1.2 实验步骤
将电阻炉炉温设定到初晶点以上30 ℃, 升温速度6~8 ℃·min-1, 温度恒定后, 放入按组成称量好的样品, 炉膛中通氩气保护, 待电解质熔化后加入18 g(过量)的氧化铝粉末(将粉末状Al2O3预先在电阻炉中预热约15 min, 以免加入的氧化铝冷却熔盐电解质), 同时开启搅拌器搅拌, 每5 min取样一次, 分别在5, 10, 15, 20 min取样4次。 取样前关闭搅拌器, 静置熔体30 s使得未溶解悬浮于熔盐电解质中的氧化铝沉淀到坩埚底部, 然后用不锈钢管通过耐火砖孔口蘸取液体电解质取样。 收集凝固后的电解质时, 剔除不锈钢管最下沿部分试样, 以免带入底部未溶解固态的氧化铝, 引起后续化学分析中氧化铝含量偏高。 最后将冷却后固体电解质试样放入试样袋中干燥保存, 作好标记以便进行化学分析。
1.3 Al2O3含量分析方法
采用Al2O3化学分析法, Al2O3采用晶形较为稳定的α-Al2O3。 Na3AlF6-AlF3-Al2O3体系氧化铝溶解度的测定通常采用AlCl3法
其中: V为空白实验中, 滴定45 ml标准EDTA溶液消耗硝酸锌(0.05 mol·L-1)标准溶液的体积(ml); V1为滴定过剩EDTA(络合溶液中Al3+过量, 过剩EDTA与Zn2+络合)试样溶液所消耗硝酸锌(0.05 mol·L-1)标准溶液的体积; mo为称取待测量的固体电解质质量; 0.00135为1 ml 0.05 mol·L-1 EDTA标准溶液相当于铝的量(g)(1 ml 0.05 mol·L-1 EDTA标准溶液络合反应掉Al3+质量为0.00135 g)。
用分析天平精确称取约0.2 g试样于铂金坩埚中, 加入5 g焦硫酸钾, 在750 ℃左右条件下加热固体电解质和焦硫酸钾混合物25 min, 使得焦硫酸钾充分分解熔融盐, 消除F-对以后Al3+络合滴定的干扰。 用去离子水提取熔融产物于锥形瓶中, 用精密pH试纸调节pH值约5.5。 然后再分别加入45 ml 0.02 mol·L-1的EDTA溶液、 20 ml 1 mol·L-1醋酸-醋酸钠缓冲溶液, 电炉上加热煮沸溶液3 min, 使得EDTA完全络合其中的Al3+。 冷却络合后的溶液, 并加入3~4滴二甲酚橙指示剂。 用0.05 mol·L-1的标准Zn(NO3)2进行滴定, 计算出铝含量。
本次实验中测定了9个K3AlF6-Na3AlF6-AlF3体系实验点, 其组成、 实验编号、 初晶温度如下表1所示。 其中KR=[m(K3AlF6)/(m(K3AlF6)+m(Na3AlF6))质量比]。
表1 实验体系组成、 初晶温度、 实验编号
Table 1Composition, serial number and crystallized temperature of the experimental systems
| Experimental serial number |
KR | w(AlF3)/% | Crystallized temperature/℃[16] |
1 |
0.1 | 22 | 900.2 |
2 |
0.1 | 26 | 899.9 |
3 |
0.1 | 30 | 851.8 |
4 |
0.3 | 22 | 862.3 |
5 |
0.3 | 26 | 831.8 |
6 |
0.3 | 30 | 762.8 |
7 |
0.5 | 22 | 805.4 |
8 |
0.5 | 26 | 802.8 |
9 |
0.5 | 30 | 673.2 |
2 结果与讨论
实验测得K3AlF6-Na3AlF6-AlF3体系9个组分的氧化铝的溶解度如表2所示。
2.1恒定温度和AlF3含量时, K3AlF6含量对氧化铝溶解度和溶解速度的影响
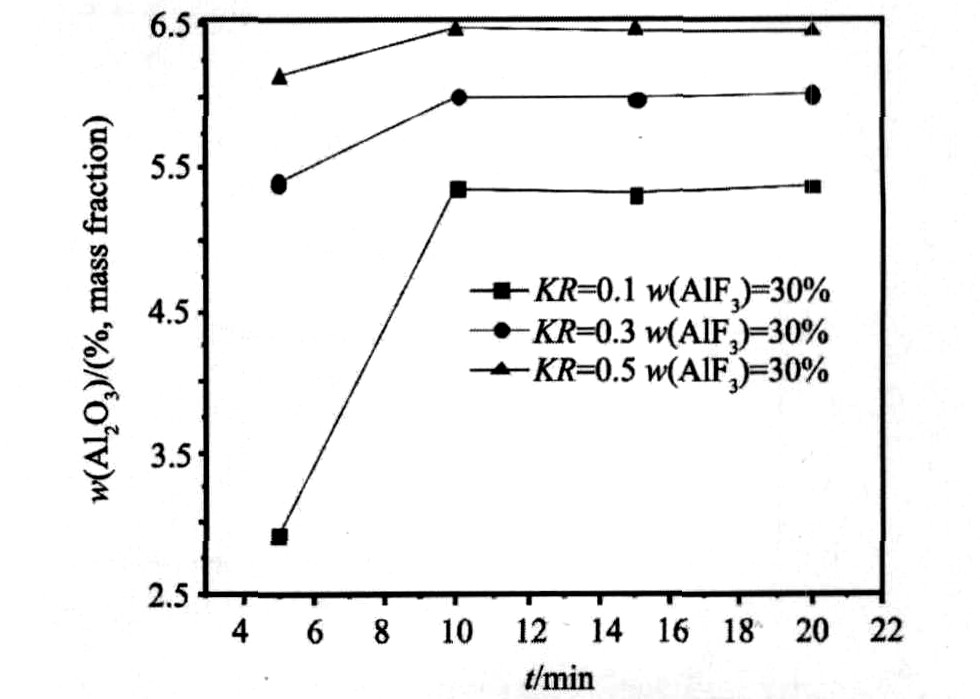
图2为相同w(AlF3)=30%, 不同KR条件下, 3个体系在温度为850 ℃条件下的氧化铝溶解量随时间的变化曲线。
从表2和图2可以看出在实验范围内, 3个体系氧化铝溶解速度均较快, 在5~10 min内Al2O3的溶解均达到饱和, 10 min后Al2O3溶解量保持恒定。 随着KR的增加(K3AlF6含量的增加), Al2O3溶解度明显增大, KR每增加0.2, Al2O3溶解度分别增加0.65%和0.46%。 从溶解速度来看, KR=0.1, KR=0.3和KR=0.5 3个体系在5 min时溶解量分别占各自饱和溶解量(溶解度)的54.5%, 90%和95%, 表明增加K3AlF6含量不仅可以有效提高其氧化铝的溶解度而且氧化铝溶解速度也相应增加。
表2K3AlF6-Na3AlF6-AlF3体系氧化铝的溶解度(实验温度为体系初晶温度以上30 ℃)
Table 2 Analytical results of Al2O3solubility
| Experimental serial number |
KR | w(AlF3)/% | Solubility (w(Al2O3))/% |
1 |
0.1 | 22 | 7.38 |
2 |
0.1 | 26 | 6.03 |
3 |
0.1 | 30 | 5.35 |
4 |
0.3 | 22 | 8.27 |
5 |
0.3 | 26 | 6.71 |
6 |
0.3 | 30 | 6.00 |
7 |
0.5 | 22 | 8.15 |
8 |
0.5 | 26 | 7.06 |
9 |
0.5 | 30 | 6.25 |
图2 850 ℃不同体系下Al2O3的溶解度和溶解速度
Fig.2 Solubility and solution rate of Al2O3 in different systems at 850 ℃
2.2恒定AlF3含量, 过热度30 ℃时K3AlF6含量对氧化铝溶解度和溶解速度的影响
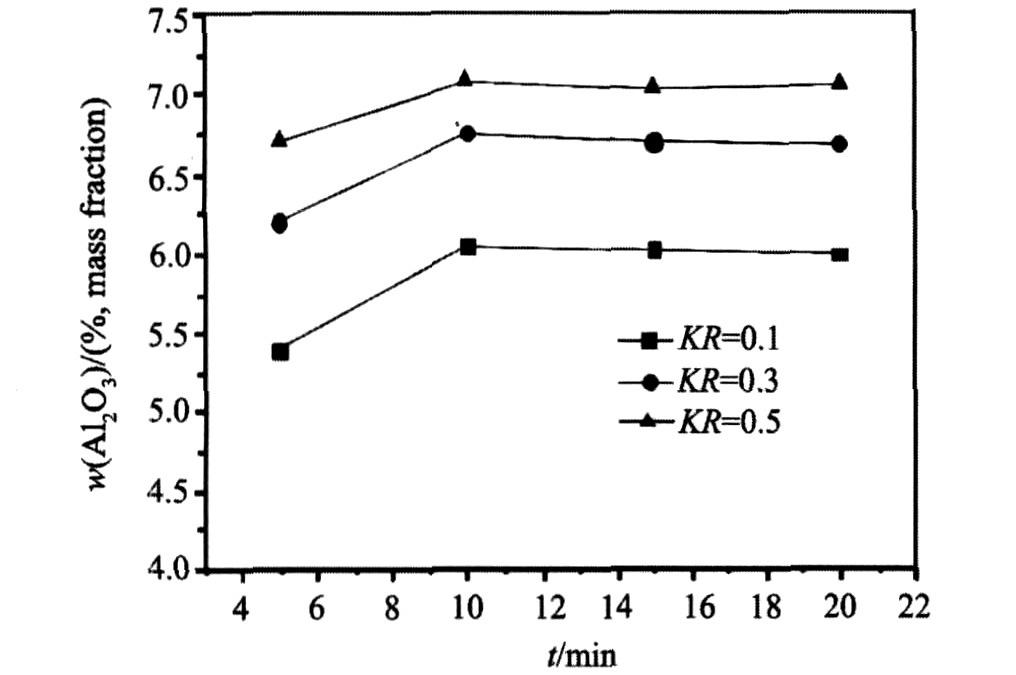
图3为w(AlF3)=26%, KR分别为0.1, 0.3和0.5, 温度为其初晶温度30 ℃以上, Al2O3溶解量随时间变化曲线。
由表2(实验温度为体系初晶温度以上30 ℃)和图3看出, 在实验范围内, 3个体系在其初晶点以上30 ℃, 恒定AlF3含量26%时, 随着KR增加, Al2O3的溶解度逐渐增加, KR=0.3时较KR=0.1时Al2O3的溶解度增加了0.68%(Al2O3), KR=0.5时较KR=0.3, Al2O3的溶解度增加了0.35%(Al2O3)。 结果表明在K3AlF6含量较低的情况下, 增加K3AlF6含量能够较大幅度的增加氧化铝的溶解度; 在K3AlF6含量相对较高的情况下, 增加K3AlF6含量对氧化铝溶解度的影响没有低K3AlF6含量时显著。 在实验范围内, 3个体系的溶解速度都很快, 基本上5~10 min内溶解度达到饱和, 3个体系溶解速度没有太大差异。
2.3恒定K3AlF6含量, 过热度30℃时AlF3含量对氧化铝溶解度和溶解速度的影响
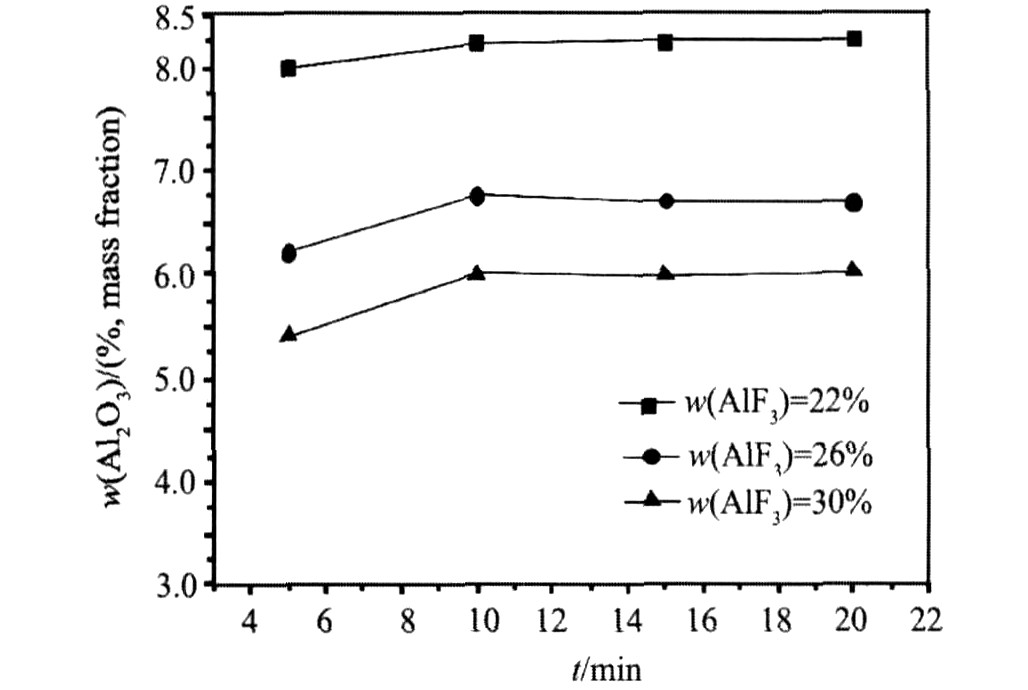
图4为KR含量为0.3, w(AlF3)含量分别为22%, 26%, 30%, 温度为其初晶温度以上30 ℃,
图3 不同体系下, w(AlF3)=26%时Al2O3的溶解度和溶解速度
Fig.3 Solubility and solution rate of Al2O3 in different systems (w(AlF3)=26%)
图4 KR=0.3时不同AlF3含量, Al2O3的溶解度和溶解速度
Fig.4 Solubility and solution rate of Al2O3 in different systems (KR=0.3)
Al2O3的溶解量随时间变化曲线。
从表2和图4可以看出, 恒定KR含量为0.3, 随着AlF3含量的增加, Al2O3溶解度明显降低, w(AlF3)=26%时的溶解度较w(AlF3)=22%溶解度减小1.53% w(Al2O3); w(AlF3)=30%时的溶解度较w(AlF3)=26%溶解度减小0.71%(Al2O3)。 其原因有: 1) AlF3含量的增加, 电解质酸度的增加(分子比减小), 使得体系溶解氧化铝的能力降低; 2) AlF3含量的增加, 降低了体系的初晶温度, 相同过热度的条件下, 体系的温度也相应的降低, 从而导致Al2O3溶解度的降低。 结果表明, 降低分子比(增加AlF3含量), 其优点是可以降低电解质的初晶温度, 得到较低初晶温度的电解质体系, 但是却较大幅度的降低氧化铝在电解质体系中的溶解度, 因此必须综合考虑两方面得影响, 合理控制AlF3含量以获得最佳性质的电解质体系。 从溶解速度看, 在实验范围内, 3个体系没有太大差别。
2.4过热度30 ℃含钾冰晶石熔盐体系和传统钠冰晶石基熔盐体系Al2O3溶解度的比较
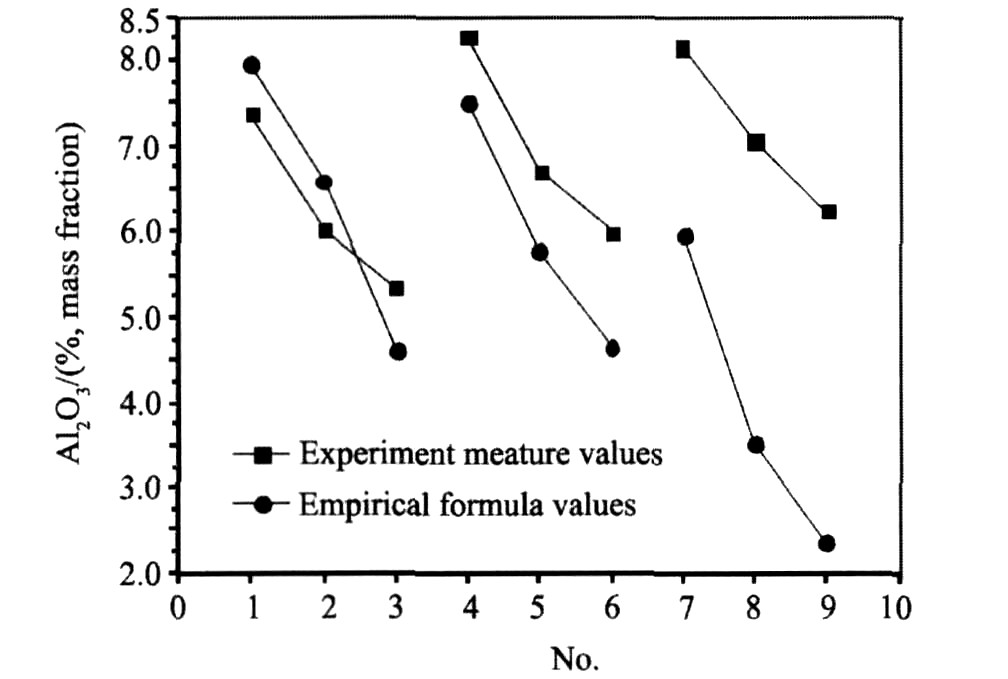
Solheim A
图5 为其结果, (此经验公式的温度范围850~1050 ℃, 实验中的有少量的实验点温度低于850 ℃, 定性的比较两种体系溶解Al2O3的能力), 得出含钾冰晶石体系和钠冰晶石体系溶解氧化铝能力差异。
t: 摄氏温度/℃
由图可以看出随着KR增加, 含钾冰晶石体系Al2O3溶解度溶解度较钠冰晶石Al2O3溶解度溶解度逐渐增加。 KR=0.1时, 由于K3AlF6含量很小两者的Al2O3溶解度相差很小; 当KR大于0.3时含钾冰晶石氧化铝溶解度明显的较钠冰晶石体系溶解度要高。 KR=0.3体系较钠冰晶石基体系氧化铝溶解度增加1%(Al2O3)左右; KR=0.5体系较钠冰晶石基体系氧化铝溶解度增加逾2%(Al2O3), K3AlF6含量增加明显的提高了氧化铝的溶解度。 当KR≥0.3时钾冰晶石基体系较传统钠冰晶石基体系氧化铝溶解度显著增加的趋势愈加明显。
图5 含钾冰晶石熔盐体系和传统钠冰晶石基熔盐体系Al2O3溶解度的比较
Fig.5 Comparison of experimental values and empirical formula values
3 结 论
1. 在实验范围内, K3AlF6-Na3AlF6-AlF3体系中的α-Al2O3溶解速度很快, 在5~10 min内溶解已经达到饱和。 850 ℃时, KR每增加0.2(Al2O3)溶解度增加约0.5%, 溶解速度随KR增加而增大。
2. 在实验范围内, 初晶温度上30 ℃, 固定AlF3含量, 随着K3AlF6含量的增加Al2O3溶解度相应的增加, 相对于高钾冰晶石含量体系而言, 较低K3AlF6含量时, 增加K3AlF6的量对提高氧化铝溶解度幅度更加显著。 对于钠冰晶石体系添加适当K3AlF6含量, 可以获得合适的氧化铝溶解度, 实现低温条件下铝电解。
3. 在实验范围内, 初晶温度上30 ℃, 固定K3AlF6含量, 随着AlF3含量的增加, Al2O3溶解度呈现下降的趋势。 AlF3可以显著降低电解质的初晶温度, 但也降低了Al2O3溶解度。
4. 与传统钠冰晶石电解质体系相比, K3AlF6-Na3AlF6-AlF3体系Al2O3的溶解度明显增大, 当KR≥0.3时, 差异愈加显著。
参考文献
[12] Schmidt H,Borchardt G.Self-diffusion of boron in TiB2[J].J.Appl.Phys.,2003,93:907.