氢化法制备氢化锂的工艺研究
北京有色金属研究总院矿物资源与冶金材料研究所
摘 要:
研究了金属锂吸氢速率与温度之间的关系,在金属锂氢化过程中,随温度上升,吸氢速率缓慢上升,在190℃左右达到阶段峰值;之后随着温度上升,吸氢速率下降,在280480℃之间吸氢速率微弱;当温度大于500℃后,吸氢速率迅速上升,并在665℃左右达到最大值。根据此规律通过实验确定了金属锂的最佳氢化工艺条件:温度665700℃、压力5055 kPa,在此条件下制得的氢化锂中氢的平均含量约为12.63%,与氢化锂中氢的理论含量(12.68%)较接近,且产物中氢具有很好的成分均匀性。氢化锂中杂质Fe,Cr,Al,Si含量都低于50×10-6,相比金属锂变化不大。而在坩埚中心处氢化锂中的Na,Ca和Ni含量比其他地方略高。这是由于氢化锂先从坩埚壁处开始凝固,其中心部位最后凝固,凝固过程中Na,Ca和Ni等杂质向中心富集的缘故。
关键词:
中图分类号: TQ131.11
作者简介:王宝明(1984-),男,江苏人,硕士研究生;研究方向:有色金属冶金;王力军,通讯联系人,(E-mail:gold@grinm.com);
收稿日期:2009-11-30
Preparation of Lithium Hydride by Hydrogenation
Abstract:
Relation between hydrogenation rate and temperature was studied.The hydrogenation rate increased with the raise of temperature at the beginning and reached a peak value at about 190 ℃.Then the rate decreased and almost no hydrogen absorption occurred in the range of 280480 ℃.The hydrogenation rate increased again when the temperature was higher than 500 ℃ and achieved a maximum at about 665 ℃.It was found that the optimal temperature range for hydrogenation of lithium was between 665 to 700 ℃ and with the pressure ranged from 50 to 55 kPa.The content of H element in the synthesized LiH was 12.63%,which was close to its theoretical value(12.68%).There was good composition homogeneity of H in the lithium hydride.The contents of Fe,Cr,Al and Si were lower than 50×10-6,which was no big variation compared with that of metallic lithium.While the contents of Na,Ca and Ni in the center of the pot were higher than that in other places.It was largely due to the solidification process of LiH started from the wall of the pot firstly and then to the center,during which impurities(Na,Ca and Ni) concentrated to the center.
Keyword:
hydrogenation;lithium hydride;hydrogen pressure;
Received: 2009-11-30
氢化锂的氢密度(单位体积内所含氢原子的个数)大于液态氢, 和水的氢密度接近, 并且锂的中子吸收截面较大, 因此被认为是目前最有效的中子屏蔽材料
1 实 验
1.1 氢化锂制备条件
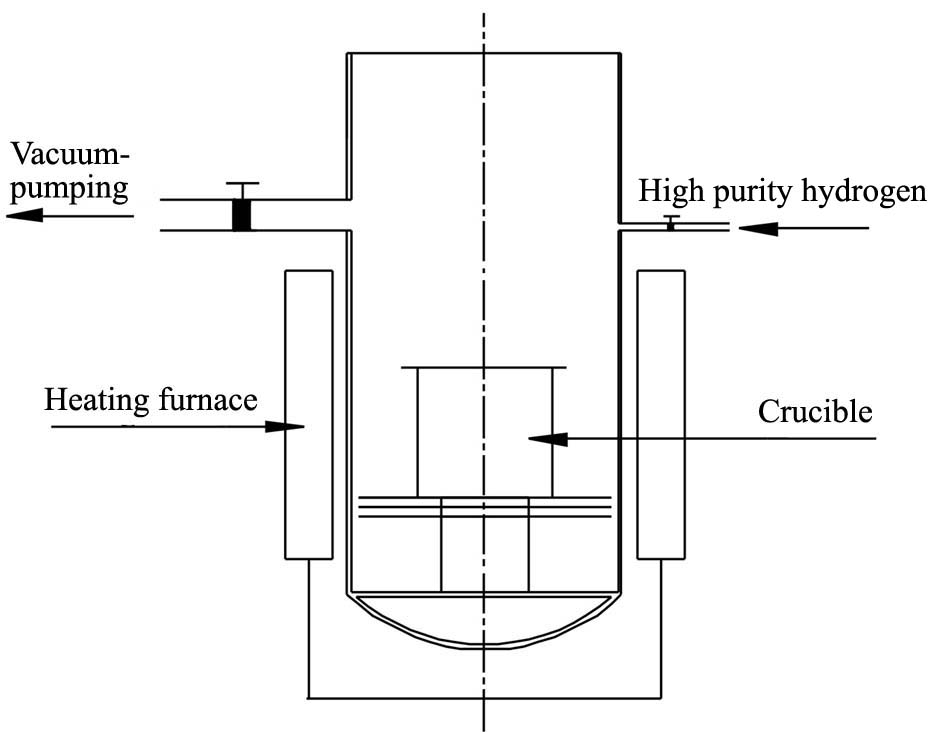
本实验采用如图1所示的真空氢化系统装置, 氢化炉的温度可达到 950 ℃, 真空度可达2×10-3 Pa。 原料为纯度大于99.9%金属锂(主要杂质含量见表1)和高纯氢气。
将金属锂装入坩埚并放进炉内, 用机械泵、 扩散泵抽真空至1×10-3 Pa时, 给氢化炉供电升温, 此时氢气净化炉升温至400 ℃左右准备供气, 以一定的流速通入经净化后的氢气使炉内保持一定的压力。 当温度上升至最大吸氢温度时, 停止加热保温直至无吸氢反应为止。 待吸氢速率变得缓慢后继续升高温度, 保证无吸氢反应。
1.2 氢化过程中吸氢速率表征方法
金属锂的吸氢速率与很多因素有关, 如温度、 氢压力、 金属锂的质量以及金属锂与氢气的接触面积等。 依据本实验的实际需要, 只研究在其他因素不变的前提下, 金属锂氢化速率随温度、 氢压力的变化趋势。 为了表征金属锂氢化过程中的吸氢速率, 向真空炉中充入一定量的氢气, 停止供氢并立即测量此t1时刻炉内氢气的压力P1及温度T1, 炉内开始发生金属锂的吸氢反应。 经过一定时间后, 在时刻t2再次记录炉内氢气压力P2及温度T2值。 根据克拉伯龙方程PV=nRT, 可得t1, t2时刻炉内氢气的物质的量n1, n2, 即:
图1 真空氢化系统示意图
Fig.1 Schematic diagram of the vacuum hydrogenation system
表1 金属锂中杂质含量(%, 质量分数)
Table 1 Contents of impurities in lithium(%, mass fraction)
| Elements | Al | Fe | Ni | Na | Ca | Si |
| Content | <0.002 | <0.002 | <0.002 | <0.005 | <0.005 | <0.005 |
吸氢速率v表示单位时间内单位面积的金属锂所吸收氢气的物质的量, 即:
则:
式中, v为金属锂吸氢反应的平均速率(mol/(S·cm2)); V为真空炉的体积(m3); S为当金属锂呈固态时, S表示锂与氢气接触的表面积; 当金属锂呈液态时, S表示坩埚的面积(cm2); t1, t2为 记录的两个时刻点(s); n1, n2为t1, t2时刻炉内氢气的物质的量(mol); P1, P2为 t1, t2时刻炉内的压力(Pa); T1, T2为t1, t2时刻炉内的温度(K)。
2 结果与讨论
2.1 氢化速率与温度之间的关系
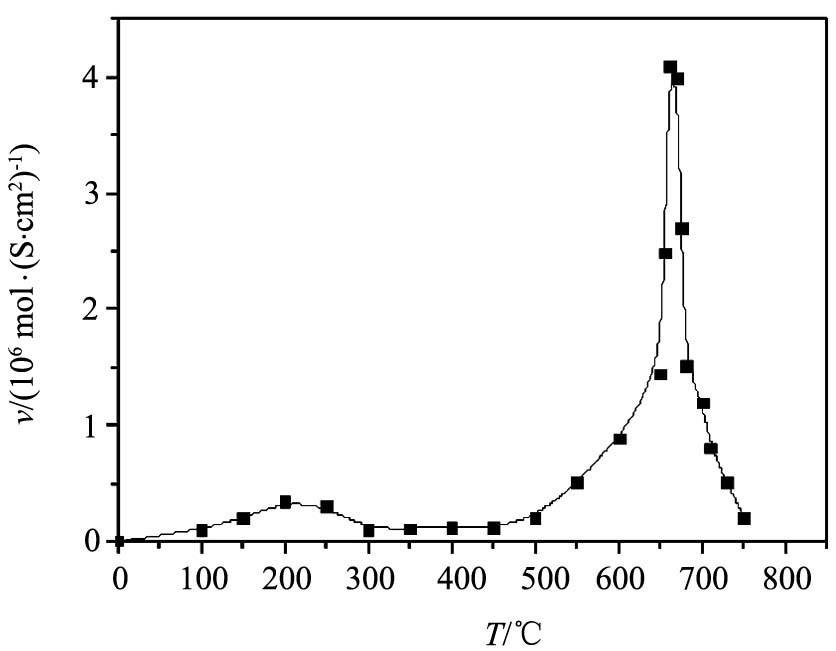
不同温度下吸氢反应速率不同, 因此本实验研究了从室温到750 ℃的吸氢规律, 每60 s记录炉内压力及温度一次, 然后利用式(3)可以计算出整个过程的吸氢速率。 吸氢速率随温度的变化趋势如图2所示, 随温度上升, 吸氢速率缓慢上升, 在190 ℃左右达到阶段峰值。 之后随着温度上升, 吸氢速率下降, 在280~480 ℃之间吸氢速率微弱。 当温度高于500 ℃后, 吸氢速率迅速上升, 并在665 ℃左右达到最大值, 当大量吸氢过后, 金属锂吸氢量趋于饱和, 吸氢速率逐渐变小。
在初始升温时, 金属锂呈固态, 吸氢反应极其缓慢。 随着温度的上升, 金属锂逐渐熔化, 出现明显的吸氢反应, 在190 ℃左右达到阶段峰值, 且随着反应的进行在熔融锂表面形成固体氢化锂壳层。 反应因气-固扩散控制而进行得很慢, 因此在 280~480 ℃之间吸氢速率微弱。 随着温度的持续上升, 当表面的固体壳逐渐熔化后, 反应速率显著增加, 并在665 ℃左右吸氢速率达到最大值, 且伴随产生大量的热, 使物料温度急剧上升。
2.2 制备氢化锂的工艺
制备氢化锂的工艺主要是控制金属锂氢化过程中的温度和氢压力。 温度和氢压力分别通过加热炉和供氢速率来控制。
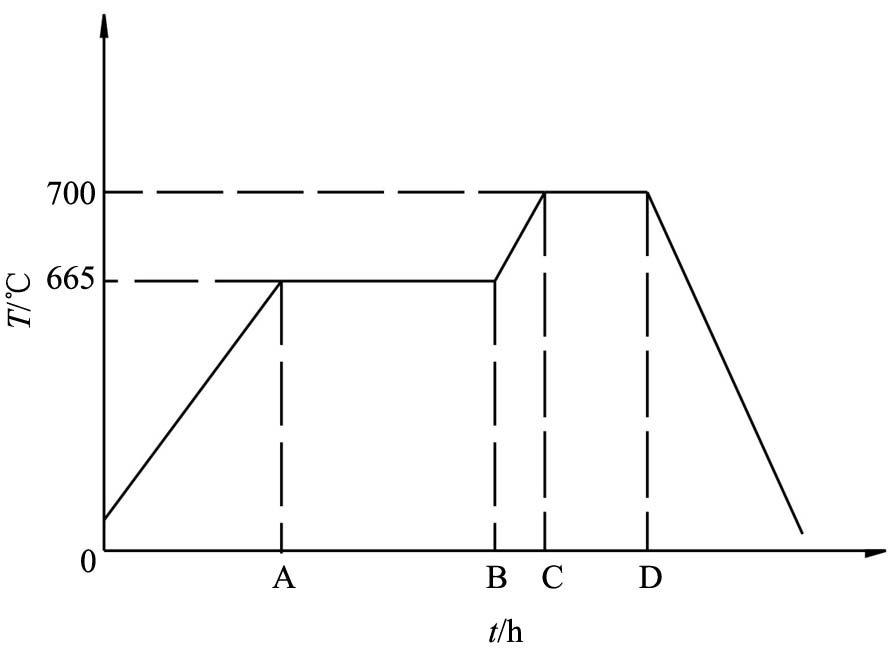
图3是本实验金属锂氢化过程中的升温曲线。 实验通过加热系统升温, 在A时刻升至665 ℃时, 停电使炉温保持在665 ℃左右一直持续到B时刻, 然后继续通电加热使系统升温, 在C时刻升高温度至700 ℃并保温, 直至反应无吸氢反应为止, 在D时刻关闭电源让其自然冷却, 在此之间保持炉内的压力为50~55 kPa。
金属锂氢化过程的反应式为:
图2 不同温度下的吸氢速率曲线
Fig.2 Curve of rate of hydrogen absorption at different temperatures
图3 金属锂氢化过程中的升温曲线
Fig.3 Temperature curve of the process of hydrogenation
该反应为放热反应, Q
当大量吸氢过后, 锂和氢化锂的组成发生了变化, 熔化温度随着氢化锂含量的不同而变化。 由表2
将氢压力控制在50~55 kPa之间, 在此压力区间有利于对金属锂氢化速度的控制。 当氢压力过低时, 金属锂氢化速率较慢, 反应时间较长, 氢化效率较低; 当氢压力过高时, 金属锂氢化速率太快, 大量的生成热使物料温度急剧升高, 氢化过程较难控制, 并且会伴随有大量金属锂的挥发, 继而附着在坩埚、 炉壁、 炉盖及真空计上, 造成设备的腐蚀或损毁。
3 氢化锂质量测试
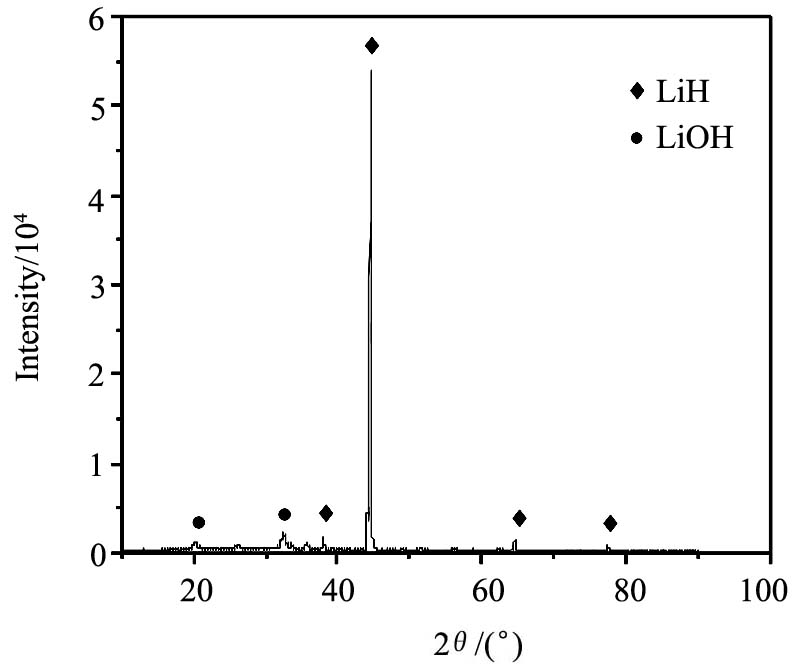
对金属锂和氢气的反应产物做X射线衍射分析, 如图4所示。 从图中可知, 产物主要成分是LiH, 未发现金属锂的特征峰, 说明锂的氢化反应较完全。 图中氢氧化锂的峰主要源于制样过程中样品被暴露在空气中与水发生了反应
将坩埚壁到坩埚中心沿着半径方向分成3个区域, 从每个区域取样, 分别标为LiH-1, LiH-2, LiH-3, 利用原子吸收光谱法
表2 氢化锂含量与熔点的关系
Table 2Relationship between the content of lithium hydride and melting points
| Content of lithium hydride/% | 99.8 | 26.0~98.0 | 20.0 | 13.0 |
| Melting points/℃ | 688 | 685 | 666 | 624 |
表3 氢化锂中杂质含量(%, 质量分数)
Table 3 Contents of impurities in lithium hydride(%, mass fraction)
| Number | Ca | Na | Ni | Fe | Cr | Al | Si |
| LiH-1 | 0.0010 | <0.0050 | 0.0150 | <0.0020 | <0.0010 | <0.0020 | <0.0050 |
| LiH-2 | 0.0045 | <0.0050 | 0.0026 | <0.0020 | <0.0010 | <0.0020 | <0.0050 |
| LiH-3 | 0.0120 | 0.0420 | 0.0590 | <0.0020 | <0.0010 | <0.0020 | <0.0050 |
图4 金属锂和氢气反应产物的XRD图
Fig.4 X-ray diffraction pattern for reaction products of lithium and hydrogen
从表3可知, 合成的氢化锂中杂质Fe, Cr, Al, Si含量都低于50×10-6, 相比金属锂(表1)变化不大。 坩埚中心处氢化锂中的Na, Ca和Ni含量略高, 这是由于氢化锂先从坩埚壁处开始凝固, 中心部位最后凝固, 凝固过程中Na, Ca和Ni等杂质向中心富集的缘故。 由于液态氢化锂对不锈钢坩埚存在一定的腐蚀, 导致其中Ni的含量明显高于金属锂中Ni含量, 这符合Pawel
实验还测定了氢化锂中锂的含量。 将坩埚分为上下5个部分, 分别从每一部分取出一块透明状氢化锂标为1~5, 测其锂含量。 表4为测量结果, 测得产物中锂的平均含量为87.37%, 由于样品中杂质含量较低, 产物中氢含量可视为12.63%, 与氢化锂中氢的理论含量(12.68%)较相近, 说明氢化较完全。 同时, 各部分的锂含量(标准偏差为±0.046%)相近, 说明氢化锂中氢具有很好的均匀性。
表4 氢化锂中锂含量测量结果(%, 质量分数)
Table 4Measurement results the content of lithium in lithium hydride(%, mass fraction)
| Number | 1 | 2 | 3 | 4 | 5 |
| Content of lithium | 87.36 | 87.42 | 87.30 | 87.38 | 87.40 |
| Average value | 87.37 |
4 结 论
1. 实验研究了从室温加热到750 ℃的吸氢规律, 随温度上升, 吸氢速度缓慢上升, 在190 ℃左右达到阶段峰值。 之后随着温度上升, 吸氢速率下降, 在280~480 ℃之间吸氢速率微弱。 当温度高于500 ℃后, 吸氢速率迅速上升, 并在665 ℃左右达到最大值。
2. 金属锂的最佳氢化工艺条件是将温度控制在665~700 ℃, 并保持炉内压力控制在50~55 kPa。
3. 氢化锂中杂质Fe, Cr, Al, Si含量都低于50×10-6, 相比金属锂变化不大。 而坩埚中心处氢化锂中的Na, Ca和Ni含量略高。
4. 氢化产物中氢含量约为12.68%, 与氢化锂中氢的理论含量(12.68%)相近, 说明氢化完全。 制备的氢化锂中氢含量均匀。
参考文献
注释
1Distribution Ratio and Separation Coefficient of Single Rare Earth and Aluminium in Chloronaphthenic Acid System