文章编号:1004-0609(2008)S1-0341-07
化学共沉淀-热分解法制备Sm2Fe17合金前驱体
薛 平,田庆华,郭学益
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
以化学共沉淀-热分解法制备Sm2Fe17合金前驱体。探讨溶液pH值、反应物浓度、反应温度以及陈化温度等对沉淀过程粒度和形貌等的影响,研究煅烧、氢预还原温度和时间对产物晶型的影响,确定实验的最优条件;采用红外光谱、XRD以及SEM等手段进行检测。结果表明,该前驱体化学成分配比准确,钐铁摩尔比约为2?17,结构完整,并且粒度分布均匀,完全符合作为磁性材料前驱体要求。
关键词:
中图分类号:TM 273 文献标识码:A
Preparation of Sm2Fe17 alloy precursor by chemical coprecipitation-decomposition method
XUE Ping, TIAN Qing-hua, GUO Xue-yi
(School of Metallurgical Science & Engineering, Central South University, Changsha 410083, China)
Abstract: Sm2Fe17 alloy precursor was prepared by chemical co-precipitation and heat decomposition method. A variety of factors influencing the particle size and morphology such as solution pH value, reactant concentration, reaction temperature and aging time were investigated. The reaction temperature and time of calcination and deoxidization beforehand by hydrogen gas which influenced the product state were analyzed, and the optimum conditions were also determined using infrared spectrum, XRD and SEM. The results show that the component of the precursor is accurate, the mole ratio of Sm and Fe is 2?17, the structure is integral and the particle size is well distributed. It can meet the requirements of being the precursor of the magnetic material.
Key words: Sm2Fe17 alloy precursor; chemical co-precipitation; magnetic material
三元Sm2Fe17Nx永磁间隙材料自1990年被发现以来[1],因其具有高磁能积、高矫顽力、高剩磁以及高居里温度和具有耐氧化性等特点而倍受关注。它本身固有的性能类似甚至优于NdFeB磁性材料性能,所以,很有可能成为主要稀土永磁材料。工业上生产Sm2Fe17Nx永磁材料一般分2步:制备单相Sm2Fe17合金和对Sm2Fe17合金进行氮化处理。前一个反应过程是影响最终产物磁性能的关键因素。目前,制备Sm2Fe17合金最常用的方法有快淬法[2]、机械合金化 法[3]、粉末冶金法[4]、氢化歧化法[5]、还原/扩散法[6]等,最近还发展了铸造法[7]、溅射沉积法[8]、熔体雾化沉积法等[9]。然而,上述方法存在一些不足,制约了其发展,如快淬法对结构十分敏感,需要严格控制配料成分;机械研磨法由于需要对样品进行长时间的球磨,极易造成粉末氧化以及粉末冶金法的生产周期长,能耗大等。为了解决这个问题,本研究组发展了化学共沉淀法,如薛平等[10-11]以热力学为指导采用此法在碳酸盐体系制备了钐铁和钐钴合金前驱体。在此,本文作者采用化学共沉淀法在草酸盐体系中制备合金氧化物前驱体,在此基础上进行煅烧和氢还原。着重研究多种因素对沉淀前驱体形貌、粒度以及物相的影响。
1 实验
实验材料包括Sm2O3,FeCl2以及草酸;所有试剂均为分析纯;蒸馏水用于配制溶液。用Sm2O3和HCl反应制备SmCl3,用草酸和氨水反应配制草酸铵。反应装置包括:恒温磁搅拌仪,真空过滤器,真空干燥箱和管式电阻炉。
采用射线分析仪和红外分析仪分析物相,采用扫描电镜观察粒子微观形貌,采用激光粒度分析仪测量粒子粒径及分布。
在一定条件下,取一定计量比的SmCl3,FeCl2和(NH4)2C2O4作为反应试剂。反应物在300 r/min的搅拌速度下,平行加入到一个反应器皿中。然后,将悬浮液过滤直到AgNO3不能检测到氯离子为止。经过过滤以及干燥滤饼获得沉淀粉末。最后,用上述分析仪检测沉淀粉末。根据以前的研究[12],可以大致确定影响沉淀粒子粒径范围,如表1所示。
表1 各种影响因素的实验值范围
Table 1 Experimental range of factors

2 结果及讨论
沉淀过程影响粒子平均粒径及分布的因素包括溶液pH值、反映物浓度、反应温度以及陈化时间。
2.1.1 pH值影响
图1所示为在不同pH值条件下所制备粒子的平均粒径。可以看出,粒子平均粒径先随pH值增大而减小,然后慢慢增大。这是由于本实验所用沉淀剂为草酸盐,草酸根在水溶液中发生如下二级离解反应:
![]() =
=![]() ,K1=5.38×10-2
,K1=5.38×10-2
![]() =
=![]() ,K2=5.42×10-5
,K2=5.42×10-5
式中 K1和K2分别为一级和二级电离常数[13]。
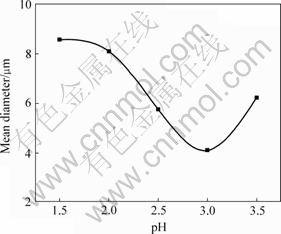
图1 pH值与沉降物平均粒度的关系
Fig.1 Relationship between pH value and mean diameter (Temperature: 25℃, [SmCl3]=0.05 mol/L, [FeCl2]=0.43 mol/L, [![]() ]=1.0 mol/L, Aging time: 75 min)
]=1.0 mol/L, Aging time: 75 min)
从以上电离平衡式可以看出,草酸根离子的活度随pH值的增加而增加。因此,在草酸沉淀生成过程中,调节pH值,其实质是调节草酸根离子的浓度。当pH值很低,草酸根浓度小,由于晶核生长速度高于成核速度,使得粒子粒径较大;当pH值较高且草酸根浓度较高时,反应瞬间晶核形成速度较快,由于成核速度明显高于晶核生长速度,因而粒子粒径较小;而当草酸根浓度过高时,由于粒子密度高,布朗运动使得粒子由于相互碰撞而长大,同时团聚现象加重。这是因为浓度提高,单位体积生成粒子数增加,粒子间因范德华力和表面张力作用,相互碰撞的几率增加,促使团聚现象产生而且加重,这正与实验结果相吻合。
2.1.2 反应物浓度影响
图2所示为不同金属离子浓度下所制备的粒子的平均粒径。本实验中,料液浓度为0.05~0.20 mol/L,其中钐与铁摩尔比始终保持为2?17。结果表明,温度对粒度有较大影响。前驱体粒度在实验范围内随反应物浓度增加而增大,当反应物浓度较高时,由于粒子密度高,布朗运动使得粒子由于相互碰撞而长大,同时团聚现象加重。这是因为浓度提高,单位体积生成粒子数增加,粒子间因范德华力和表面张力作用,相互碰撞的几率增加,促使团聚现象产生而且加重[14]。根据离子成核和生长模型[15-16],将成核与生长阶段分开将有利于形成均匀粒子。
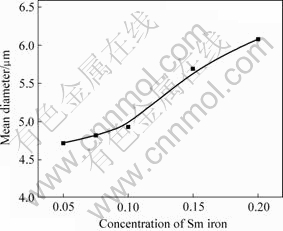
图2 不同金属离子浓度与沉降物平均粒度的关系
Fig.2 Relationship between different metal ion concentration and mean diameter (pH=3.0, Temperature: 25 ℃, [![]() ]=1.0 mol/L, Aging time: 75 min)
]=1.0 mol/L, Aging time: 75 min)
2.1.3 反应温度的影响
反应温度对沉淀物粒径的影响见图3。可见,随着反应温度提高,均匀粒子的平均粒径也增加。这是因为反应温度对晶粒生长及晶核形成速度均有影响。若反应温度低,则不利于晶粒的扩散与成长,产生的沉淀粒度细,沉淀剂分解不完全,反应不完全,产品收率低;若反应温度高,则增加了构晶离子的扩散速度,有利于晶粒的生长而形成沉淀;反应温度高还可促使微小颗粒重新溶解,所以,其基本趋势是随温度增加,产品平均粒度增加。
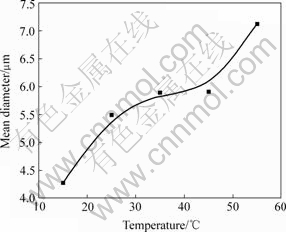
图3 反应温度与沉降物平均粒度的关系
Fig.3 Relationship between temperature and mean diameter (pH=3.0, [SmCl3]=0.05 mol/L, [FeCl2]=0.43 mol/L, [![]() ]= 1.0 mol/L, Aging time: 75 min)
]= 1.0 mol/L, Aging time: 75 min)
2.1.4 陈化时间对粒径的影响
陈化时间对沉降物平均粒径的影响见图4。可以看出,陈化时间对粒子平均粒径没有很大的影响。在保证一定陈化时间下,延长陈化时间对沉淀率和对粉末平均粒度影响不大,但是对粒度分布影响很大。粒度分布表明,随着陈化时间的延长,沉淀产生二次长大,产生双峰现象。该结论可用表面物理化学理论解释:在陈化过程中,沉淀的活性形态逐渐转变为非活性形态,使得到的沉淀具有完整粗大的结构。共沉淀刚结束,得到的溶液对每一组元来说是过饱和溶液。随着陈化时间的延长,各组元的草酸盐晶粒粗化,从而使部分晶粒长大,部分晶粒粒径不变,形成双峰分布;另一方面,随着溶解度逐渐降低,溶液中残余金属离子浓度逐渐降低,当陈化一定时间后,各沉淀物在溶液中的溶解度均达到普通晶体的溶解度,溶液成为真正的饱和溶液,达到平衡态。若陈化时间继续增加,则各金属离子残余浓度不再变化,粒度及其分布也不变化。
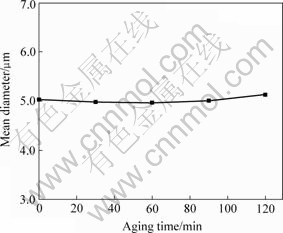
图4 陈化时间与沉降物平均粒度的关系
Fig.4 Relationship between aging time and mean diameter (pH=3.0, Temperature: 25 ℃, [SmCl3]=0.05mol/L, [FeCl2]= 0.43 mol/L, [![]() ]=1.0 mol/L)
]=1.0 mol/L)
根据以上实验,可以确定最优实验条件如下:pH=3.0,温度为25 ℃,[SmCl3]=0.05 mol/L,[FeCl2]= 0.43 mol/L,陈化时间为75 min。然后,在上述条件下进行实验,所得沉淀物用XRD,IR和SEM进行分析。
2.1.5 沉淀物相分析
沉淀物成分用XRD和IR分析,其结果如图5和图6所示。图5表明,所有粒子的XRD图都有明显的特征峰。本研究所获得的沉淀物晶型良好,并且不同于其他研究所得沉淀物。根据相关文献和以往分析结果,可以确定该沉淀物由FeC2O4和Sm2(C2O4)3组成。
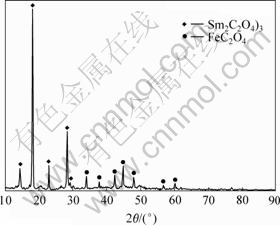
图5 前驱体X射线衍射谱
Fig.5 X-ray diffraction spectra of precipitate
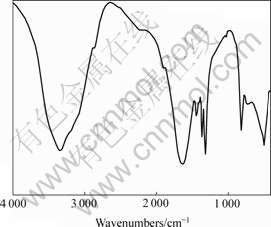
图6 沉淀物粒子红外分析
Fig.6 Infrared spectrum analysis of precipitate
从图6可以看出,在3 338.34 cm-1处的尖锐峰是羟基的振动吸收峰;在1 619.98 cm-1处的C=O电子对的振动峰和3 338.34 cm-1处的尖锐吸收峰组成了草酸根离子的吸收峰。在1 444.34 cm-1处的吸收峰对应C=N电子对,这可以认为是溶液中铵根离子与金属离子少许配合所致。在816.92 cm-1处的峰是由C—Cl键形成。在500~1 400 cm-1的其他吸收振动峰大部分都是一些有机官能团所致。从上面分析可知,沉淀物是由草酸钐和草酸铁、吸附的铵根离子、氯离子以及有机官能团组成。
2.1.6 沉淀物形貌
前驱体形貌特征如图7所示。可见,相特征呈立方状,棱角分明,分布均一,且分散性良好。大粒子由立方球形组成,可见团聚过程是一个粒子生长过程,并且粒子的生长具有方向性和选择性。

图7 前驱体SEM像
Fig.7 SEM micrograph of precipitate
热分解包括草酸钐脱水和分解生成氧化钐,氧化亚铁的脱水和分解生成氧化铁,具体反应为:
![]()
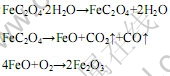
2.2.1 前驱体差热分析
在N2气氛下,升温速率β=10 K/min时,对上述物质进行DSC-TGA分析,结果见图8。
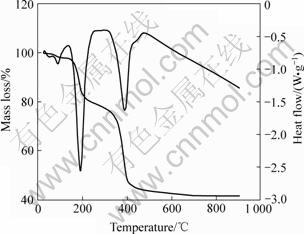
图8 前驱体DSC-TG图
Fig.8 DSC-TG curves of precipitate
从图8可知,在200 ℃之前,主要是附着水的脱除,而在200 ℃左右,有较大的失重,这是两者失去结晶水所致;在400 ℃左右,又有较大的失重,此时主要是两者的草酸盐分解成氧化物所致;在600 ℃以后,质量几乎不变,可以认为两者分解反应已经完成,所以,热分解完全的温度应该大于600 ℃。
2.2.2 煅烧温度对晶型的影响
根据DSC-TG分析结果,分别考察3组煅烧温度对沉淀物物相的影响,结果见图9。从图9可以看出,当煅烧温度为600 ℃时,尖锐峰主要为氧化铁产生的峰,有少量杂峰。当温度逐渐升高时,在2θ=28?,30?和46?处峰逐渐形成,对照PDF卡片可知,该处为氧化钐的峰。所以,升高温度对热分解有利,但是温度不能太高,否则会增大粉末粒度。
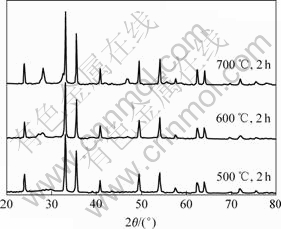
图9 不同煅烧温度下沉淀粒子的X射线衍射谱
Fig.9 XRD patterns of precipitate at different temperatures
2.2.3 保温时间对晶型的影响
恒定煅烧温度为600 ℃,改变保温时间,考察其对热分解产物的相态的影响,结果见图10。可见,逐渐增加保温时间,各个峰几乎没有变化,所以,此处应该选取保温时间为2 h。
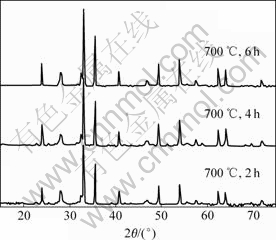
图10 不同保温时间沉淀粒子的X射线衍射谱
Fig.10 XRD patterns of precipitate at different reaction times
2.3.1 氢还原温度对晶型的影响
由于氧化钐为高熔点物质,所以,在钙热还原氧化钐之前必须对铁的氧化物进行预还原,以减少钙还原氧化钐的影响。分别考虑3个不同还原温度的影响,结果见图11。可见,在450℃时,产物主要为Fe和FeSmO3;在650 ℃时,产物为Fe和Sm2O3;在850 ℃时,产物为Fe和Sm2O3。但是,此时得到不同晶型的Sm2O3,所以,此处温度为650 ℃。
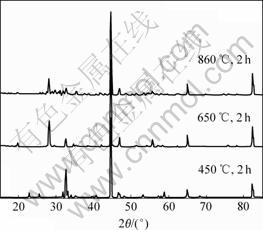
图11 不同氢还原温度沉淀粒子的X射线衍射谱
Fig.11 XRD patterns of precipitate at different reduction temperatures
2.3.2 氢还原保温时间对晶型的影响
图12所示为恒温不同还原保温时间对产物晶型的影响。可见,当保温1 h时,某些峰还不尖锐;当保温2h时,各处峰相当尖锐,表明产物晶型完整,对照PDF卡片,产物为Fe和Sm2O3;当保温3 h时,28?处峰不但没有变尖锐,反而变低,并且周围有少量杂峰形成,发现该产物含有不同晶型的Sm2O3,对后续工艺不利,所以,此处保温时间选为2 h。
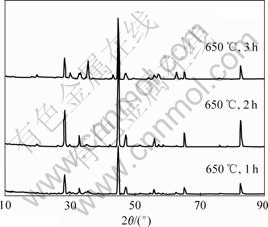
图12 不同氢还原保温时间沉淀粒子的X射线衍射谱
Fig.12 XRD patterns of precipitate at different hydrogen reaction times
根据上述最优条件,即pH=3.0,恒速搅拌,温度为25 ℃,[SmCl3]=0.05 mol/L,[FeCl2]=0.43 mol/L,陈化时间为75 min,煅烧温度和时间分别为600 ℃和2 h,氢还原温度和保温时间为650 ℃和2 h,进行一组实验,其SEM分析结果如图13所示。可以看出,铁粉和氧化钐粒度小,分布均匀,且铁粉呈多孔状,完全符合后续还原扩散反应要求。

图13 氢还原后产物SEM像
Fig.13 SEM micrograph of reduction product
3 结论
Sm2Fe17粒子粒径以及产物晶型的最佳实验条件如下:pH为3.0,恒速搅拌,温度为25 ℃,[SmCl3]=0.05 mol/L,[FeCl2]=0.43 mol/L,[![]() ]=1.0 mol/L,陈化时间为75 min,煅烧温度和时间分别为600 ℃和2 h,氢还原温度和保温时间为650 ℃和2 h。在此最佳实验条件下制备Sm2Fe17合金前驱体的粒径小,分布均匀,平均粒径为4~8 μm,粒径分布范围为1~12 μm,沉淀后的草酸沉淀粉末呈块状和类球状,晶型规整有序,棱角平滑,经煅烧预还原后的沉淀粉末基本上保持了沉淀粉末的形状,只是铁粉有些变化,呈多孔状,这样更有利于后续还原扩散反应制备Sm2Fe17合金。
]=1.0 mol/L,陈化时间为75 min,煅烧温度和时间分别为600 ℃和2 h,氢还原温度和保温时间为650 ℃和2 h。在此最佳实验条件下制备Sm2Fe17合金前驱体的粒径小,分布均匀,平均粒径为4~8 μm,粒径分布范围为1~12 μm,沉淀后的草酸沉淀粉末呈块状和类球状,晶型规整有序,棱角平滑,经煅烧预还原后的沉淀粉末基本上保持了沉淀粉末的形状,只是铁粉有些变化,呈多孔状,这样更有利于后续还原扩散反应制备Sm2Fe17合金。
REFERENCES
[1] COEY J M D, SUN Hong. Improved magnetic properties by treatment of iron-based rare earth intermetallic compounds in ammonia[J]. Magnetism and Magnetic Materials, 1990, 87(3): 251-254.
[2] FUKUNAGA H, AIKAWA T, NAGAOKA S. Improvement in hard magnetic properties of rapidly quenched Sm-Fe-N flakes by Zn-coating[J]. J Magn Magn Mater, 1996,157: 105-106.
[3] TERESIAK A, KUBIS M, MATTERN N. Influence of nitrogenation on structure development and magnetic properties of mechanically alloyed and annealed Sm-Fe powders[J]. J Alloy and Compounds, 1999, 292: 212-220.
[4] ARLOT R, IZUMI H, MACHIDA K. Particle size dependence of the magnetic properties for zinc-coated Sm2(Fe0.9Co0.1)17N2.9 powders[J]. J Magn Magn Mater, 1997, 172: 119-127.
[5] YAN Jun, ZHOU Shou-zeng, ZHANG Mao-cai. The preparation and magnetic properties of Sm2Fe17Nx compounds[J]. Materials Letter, 1991, 12: 242-245.
[6] 邓庚凤, 孙光飞, 陈菊芳, 王洪涛, 胡国辉, 方克明. 还原扩散法制备Sm2Fe17Nx磁粉的研究[J]. 稀土, 2005, 26(6): 49-52.
DENG Geng-feng, SUN Guang-fei, CHEN Ju-fang, WANG Hong-tao, HU Guo-hui, FANG Ke-ming. Investigation on Sm2Fe17Nx magnet powder made by reduction-diffusion[J]. Rare Earth, 2005, 26(6): 49-52.
[7] SHIMODA T, NATORI E, TOMITA C. Development of injection molded rare earth magnet[R]. Ohio: University of Dayton, School of Engineering, 1985: 297-308.
[8] CADIEU F J, CHEUNG T D, WICKRAMASEKARA L. Magnetic properties of sputtered Nd-Fe-B films[J]. Journal of Magnetism and Magnetic Materials,1986, 54: 535-536.
[9] BRYANT G F, CHIU T S L. Simplified roll-temperature model: Spray-cooling and stress effects[J]. Metals Technology, 1982, 9: 485-492.
[10] XUE Ping, GUO Xue-yi, TIAN Qing-hua, DUAN Lian, LI Dong. Thermodynamic analysis on preparing precursor of Sm2Fe17 alloy by chemical co-precipitation[J]. Hydrometallurgy of China, 2007, 3: 136-138
[11] LI Ping, GUO Xue-yi, XUE Ping, HUANG Kai, LIU Rong-yi. Preparation of SmCo5 by chemical coprecipitation-diffusion method(CPRD)[C]. EPD Congress, 2006: 819-825.
[12] XUE Ping, GUO Xue-yi, TIAN Qing-hua, JIANG Rong-quan. Thermodynamic analysis and its application to preparing Sm-Fe alloy oxide precursor by wet-chemical co-precipitation[C]//EPD Congress 2008. Materials Processing Fundamentals, Smelting and Refining, 2008: 439-447.
[13] 向 柠, 陈洪龄, 徐南平. 超细氧化钇粉体的制备[J]. 高校化学工程学报, 2002, 16(1): 48-52.
XIANG Ning, CHEN Hong-ling, XU Nan-ping. Preparation of ultra-fine yttrium oxides powders[J]. Journal of Chemical Engineering of Chinese Universities, 2002, 16(1): 48-52.
[14] 屈 芸, 孙曰圣, 肖鉴谋. 草酸沉淀法制备Y2O3?Eu3+粉体粒度控制[J]. 江西化工, 2004, 3: 123-127.
QU Yun, SUN Yue-sheng, XIAO Jian-mou. Synthesis of Y2O3?Eu3+ powders by precipitation method of oxalic acid and control of particle size[J]. Jiangxi Chemical Industry, 2004, 3: 123-127.
[15] MATIJEVIC E. Preparation and properties of uniform size colloids[J]. Chem Mater, 1993(5): 483.
[16] SUGIMOTO T. Preparation of mono-dispersed colloidal particles[J]. Advance colloidal and Interface Sci, 1987(28): 65.
通讯作者:田庆华,博士;电话:0731-8877863;E-mail: qinghua@mail.csu.edu.cn


