苯酚冲击负荷对前置反硝化系统脱氮的影响
路聪聪1, 2,王淑莹1,葛士建1,张琼1,杨锦辉1,彭永臻1
(1. 北京工业大学 北京市水质科学与水环境恢复重点实验室,
北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京,100124;
2. 中冶建筑研究总院有限公司,北京,100088)
摘 要:
验和长期前置反硝化SBR工艺处理含苯酚生活污水。研究结果表明:随着苯酚质量浓度(0~175 mg/L)增大,2个试验中污泥氨氧化速率均逐渐减小,短期试验中最大比基质利用速率由2.898 d-1变成0.694 d-1;在前置反硝化系统中,平均氨氧化速率为4.091 mg/(g·h),是静态试验(1.812 mg/(g·h))的2.26倍,且氨氧化速率与苯酚质量浓度的比值为一恒定值(-0.031±0.005);在0~5 h内苯酚与氨氮同时被去除,去除率分别为24.2%和23.5%;受苯酚冲击系统硝化作用破坏后通过自身结构调整15~18 d可恢复至正常水平;较高质量浓度(60~90 mg/L)的苯酚毒性抑制作用使微生物形态结构受到不可逆破坏,微生物胞外聚合物中DNA质量分数由2.53 mg/g增加至34.6 mg/g。
关键词:
中图分类号:X703 文献标志码:A 文章编号:1672-7207(2014)06-2130-07
Effect of phenol load on nitrogen removal in pre-denitrification process
LU Congcong1, 2, WANG Shuying1, GE Shijian1, ZHANG Qiong1, YANG Jinhui1, PENG Yongzhen1
(1. Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering,
Engineering Research Center of Beijing, Beijing University of Technology, Beijing 100124, China;
2. Central Research Institute of Building and Construction Co. Ltd., MCC Group, Beijing 100088, China)
Abstract: The pre-denitrification SBR process of treating municipal waste water including phenol was investigated with the combination of short-term and long-term tests. The results show that the ammonia oxidation rate decreases gradually with the increase of concentration of phenol (0-175 mg/L), with the specific substrate ulitization rates ranging of 2.898-0.694 d-1.The average ammonia oxidation rate is 4.091 mg/(g·h) in pre-denitrification system and 2.26 times short-term test result (1.812 mg/(g·h)). The ratio of ammonia oxidation rate to phenol concerntration keeps at -0.031±0.005. The phenol and ammonia can be removed at 0-5 h with the respective removal efficiencies of 24.2% and 23.5%. Moreover, the ammonia oxidation damage can be recovered to normal levels after 15-18 d through microbial own structure function change. However, the toxicity inhibition at the high phenol concentrations exhibites an irreversible damage, and DNA concentration in extracellular polymer substance varies from 2.53 mg/g up to 34.6 mg/g.
Key words: phenol; ammonia oxidation rate; inhibition and recovery
通过硝化反硝化作用完成污水生物脱氮过程是一种经济有效的生物处理技术。自养硝化菌在好氧状态下将水中含氮污染物(主要为氨氮)氧化成亚硝酸盐或硝酸盐;在缺氧状态下,异养菌利用水中有机物将氮氧化物还原为氮气释放至空气中,这2个过程将水中氮去除。完成硝化反硝化生物脱氮作用的微生物有较强的适应能力,但脱氮效率易受到不同外界物质的影响与干扰,如多环芳烃(PAHs)、硫氰酸(SCN—)、氢氰酸(CN—)以及酚类化合物都会对硝化作用产生抑制[1-2]。硝化菌对环境变化比反硝化菌群的对环境的变化敏感,更易受到冲击而产生抑制。Neufeld等[3]通过研究氰化物和2,3,6-三甲基苯酚对硝化菌的抑制作用时发现,低质量浓度不影响高质量浓度下抑制反应进行;李娟英等[4]在对苯酚及其衍生物的硝化抑制研究中发现,5种酚类化合物对硝化细菌的抑制程度由大到小的顺序为:邻甲基酚—2, 4-二氯苯酚—苯酚—对硝基酚—对氨基酚;Kelly等[5]通过对6种不同类型的化学毒物进行硝化抑制试验发现,亲电溶剂(1-chloro-2, 4-dinitrobenzene, CDNB)对硝化作用影响最大,2,4-二硝基苯酚抑制较快且可以引起亚硝酸盐积累。Chakraborty等[6]在厌氧-缺氧-好氧反应器中进行苯酚冲击试验中发现厌氧区、缺氧区恢复至正常水平的时间分别为22 d和7~9 d,好氧区由于硝化菌抑制淘洗无法恢复。试验周期、污泥种类、反应器工况的差异使得硝化反应毒物抑制、微生物毒性试验结果有一定差异,无法建立一个较客观统一的实际预测体系。为此,本文作者将毒物冲击短期和长期试验相结合,通过批次小试和前置反硝化试验对比考查不同苯酚质量浓度冲击对活性污泥系统硝化过程的影响,对生物氨氧化速率、菌种优先级、系统沿程氨氮去除及抗毒性物质恢复进行系统分析,以便为污水处理中活性污泥系统微生物抗有机物毒性抑制提供有效的理论与工程依据。
1 材料与方法
1.1 短期影响试验
试验前将接种污泥曝气20 h,沉淀过滤以去除泥中残余NH4+-N,NO2--N和有机物,清洗后对污泥氨氧化作用进行不同梯度苯酚质量浓度的冲击试验。将清洗后的污泥置于6个1.5 L 反应瓶中,保证初始污泥质量浓度为(3 000±150) mg/L。加入碳酸氢铵溶液和不等量的苯酚溶液,使各反应器初始氨氮质量浓度为50 mg/L ,苯酚质量浓度分别为0,15,35,55,95和175 mg/L。同时进行微孔曝气与磁力搅拌,控制反应温度为室温(25±1)℃,曝气过程控制DO质量浓度在 4.0 mg/L左右,pH为 7.2~7.8。静置试验反应装置见图1。
图1 静态试验反应装置
Fig. 1 Schematic diagram of static test
1.2 长期影响试验
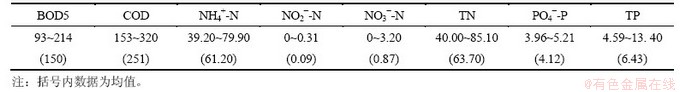
试验污泥取自某污水处理厂硝化性能良好的二沉池回流污泥,呈黄褐色,沉降性良好。污水取自某小区生活污水,水质特性参数见表1。
试验采用具备自动控制系统的序批式反应器(sequencing batch reactor ,SBR),有效容积为5 L,见图2。反应器的电气阀门及仪表检测器与可编程控制器(PLC)连接,能够与上位机相关控制软件进行数据通信。该自控系统能够实现对SBR进水泵、搅拌器、曝气阀及排水阀的开启及调控,在线监测检测器将反应器中的DO及温度信息反馈至控制软件。

图2 前置反硝化反应装置
Fig. 2 Schematic diagram of pre-denitrification process
表1 原水水质(质量浓度)
Table 1 Wastewater characteristics of step feed process mg/L
SBR前置反硝化(缺氧/好氧)生物脱氮系统共运行180 d,每天运行4个周期,每周期进水2.5 L,排水比为50%。单周期时间设置如下:进水7 min,缺氧搅拌75 min,好氧搅拌180 min,沉淀60 min,排水1 min,静置37 min。
在反应器进水的同时向反应器中加入苯酚,根据反应器内苯酚初始质量浓度的不同,试验分为5个阶段,每个阶段的苯酚初始质量浓度及运行时间分别为:R1阶段,0 mg/L,1~36 d;R2阶段,15 mg/L,37~76 d;R3阶段,30 mg/L,77~112 d;R4阶段,60 mg/L,113~153 d;R5阶段,90 mg/L,153~180 d。
反应器内接种污泥质量浓度为(3 000±150) mg/L,采用磁力搅拌器使系统混合均匀。鼓风曝气的曝气量恒定为70 L/h,通过德国WTW pH/oxi340i仪在线监测反应过程中的pH,DO质量浓度和温度。DO质量浓度为 1~3 mg/L,,pH为7.2~8.1,温度控制在22~25 ℃。
1.3 检测方法
MLSS和MLVSS采用标准方法测定[7]。水样通过0.45 μm中速滤纸过滤后检测各项指标。氨氮(NH4+-N)、亚硝酸盐和硝酸盐(NO2--N 和NO3--N)采用美国LACHAT公司QuikChem 8500流动注射全自动分析仪测定;COD采用COD快速测定仪5B-3(A)测定; DO,pH,温度及ORP采用德国WTW pH/oxi340i仪在线监测。苯酚使用Waters 1525高效液相色谱仪,配waters 2875 双通道检测器及Breeze色谱操作软件测定。色谱柱选用Waters Symmetry #C18 (4.6 mm×250 mm,5 μm );流动相体积分配为V(甲醇):V(5%乙酸)=7:3;进样体积为20 μL;流量为1.0 mL/min;柱温为25 ℃;检测波长范围为190~700 nm。
2 结果与讨论
2.1 苯酚对氨氧化菌的短期影响
2.1.1 硝化过程
氨氮和氮氧化物在不同苯酚质量浓度下的变化见图3。由图3可知:苯酚使得硝化细菌酶系统毒性受到抑制,反应初始存在迟滞期(氨氮降解较缓慢),且迟滞期随着系统内苯酚初始质量浓度的增加,在苯酚质量浓度为90 mg/L时,初始3 h氨氮质量浓度变化小于3 mg/L,氨氮氧化停滞,该阶段没有氮氧化物积累;3 h后氨氮质量浓度明显下降,最大硝化速率为0.982 1 mg/(g·h);随着苯酚初始质量浓度的增大,最大比基质利用速率由2.898 d-1变成0.694 d-1,氨氮氧化速率逐渐降低(苯酚各梯度的氨氮氧化速率为2.3),硝化反应时间由4 h逐渐延长至12 h;在苯酚质量浓度为175 mg/L时,苯酚降解后硝化作用能够继续完成,细菌活性受到暂时影响但硝化功能并没有受到破坏。苯酚仅与胞外酶或细胞膜上的酶(主要为氨氧化单加氧酶,AMO) 发生作用,未对细胞造成永久性的破坏和解体,随着苯酚降解,抑制解除硝化作用能够顺利完成[8-9]。
从图3(e)可见:试验结束时,氮氧化物积累质量浓度为30.1 mg/L,系统存在氮损失且随苯酚质量浓度的增大而增大,低苯酚质量浓度下平均氮损失21.7%;高苯酚质量浓度(175 m/L)下总氮损失高达65.3%。Tallec等[10-11]研究活性污泥硝化过程发现,当DO质量浓度小于0.3 mg/L 时,N2O积累最大仅为2.8%,因此,在硝化过程中,N2O导致的氮损失可忽略不计。总氮损失产生的主要原因有同化作用、同步硝化反硝化作用(simultaneous nitrification and denitrification,SND)以及N2O损失[12]、氨逃逸[13]。在短期试验中,同化作用量较少,N2O产生量较少,故SND和氨逃逸作用是氮损失的主要原因。
2.1.2 苯酚降解与硝化优先级比较
有机碳源对硝化细菌有抑制作用,微生物生理活性不同导致有机物异养氧化与氨氮硝化存在反应时间差异。以静态试验中苯酚质量浓度175 mg/L为例,典型周期内NH4+-N和NO2--N与苯酚质量浓度的变化关系见图4。从图4可见:当苯酚存在时,异养菌氧化有机物和硝化菌硝化作用在不同阶段存在优先级差异;0~5 h内苯酚与氨氮协同降解,两者降解率分别为24.2%和23.5%,这与Min等[14]的研究结果相同,苯酚降解不仅发生在除有机物阶段,同时发生在硝化阶段;在5 h苯酚降解出现拐点,在2.5 h内苯酚迅速完全降解,生物量占据优势的异养菌对溶解氧的竞争能力强,使得苯酚降解速率达到最大,为4.44 g/(g·h);而氨氮氧化在6 h时 氨氮氧化速率(ammonia oxidation rate,RAO)发生变化,由0.88 mg/(g·h)增加至3.01 mg/(g·h)。在反应后期,由于系统有机物(苯酚)质量浓度降低,异养菌的活性受到限制,硝化菌则由于溶解氧充足、氨氮质量浓度较高,而逐渐成为优势种群氨氮被较快去除。在高苯酚质量浓度下,当苯酚降解与氨氮氧化同步发生,苯酚质量浓度低于抑制常数52.871 mg/L时,硝化速率明显增大。而Liu等[15-16]的研究表明,当苯酚质量浓度降至较低或完全降解时,硝化作用才会发生。
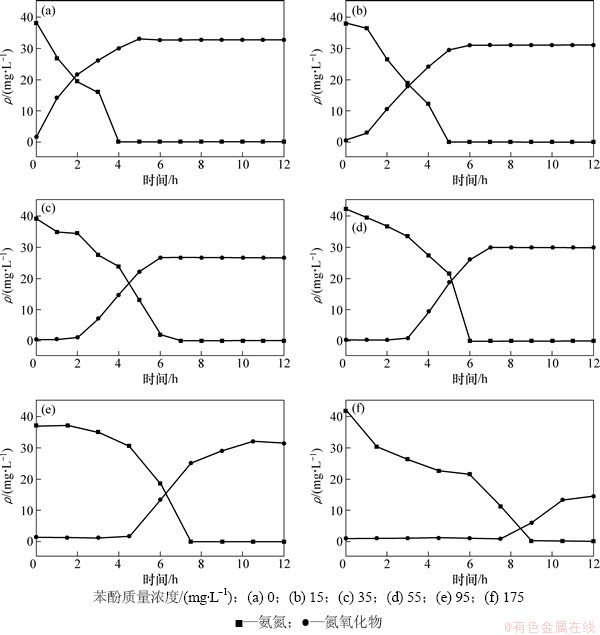
图3 氨氮和氮氧化物在不同苯酚质量浓度下的变化
Fig. 3 Variation of NH4+-N and NOX--N at different phenol mass concentrations
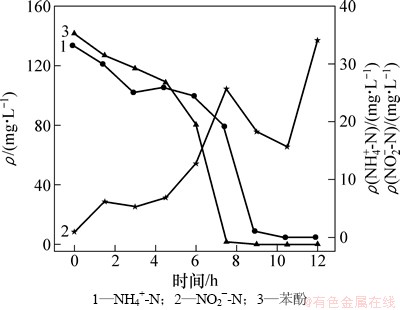
图4 典型周期内NH4+-N和NO2--N与苯酚质量浓度的变化
Fig. 4 Variation of mass concentration of NH4+-N , NO2--N and phenol in a typical cycle
Mosquera-Corral等[17]通过研究氨氧化菌时发现:当 ρ(TOC)/ρ(N)高于0.3时,氨氧化菌活性受到抑制,氨氮的转化率降低至10%。对于普通活性污泥系统,苯酚抑制常数KI远高于纯硝化菌群系统的抑制常数(KI=20 mg/L),但高质量浓度苯酚仍会影响异养菌和硝化菌的竞争;在C与N的质量浓度之比即ρ(C)/ρ(N)为1.5时(ρ(phenol)/ρ(N)= 0.5),氨氮转化率降低3.34%,硝化作用受影响但能够正常进行。合适的ρ(C)/ρ(N)是保证污水有机物去除及高效脱氮除磷的必要条件[18]。
2.2 苯酚长期影响下系统的脱氮效果
2.2.1 苯酚对系统沿程氨氮质量浓度的影响
图5所示为系统运行期间R1~R5这5个阶段进出水氨氮质量浓度及去除率的变化情况。
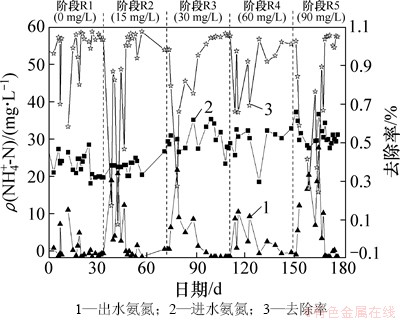
图5 前置反硝化系统氨氮沿程变化
Fig. 5 Variation of ammonia in pre-denitrification process
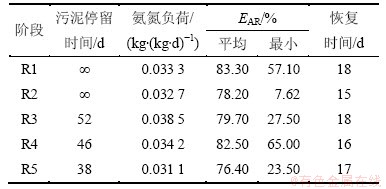
系统氨氮负荷较稳定,均在0.031 1~0.385 0 kg/(kg·d)之间变化,见表2。在该过程中,氨氮去除率EAR最小值随各阶段苯酚质量浓度的不同变化较大。
R1阶段为系统启动阶段,NH4+-N初始质量浓度为25 mg/L左右,经过 18 d后系统趋于稳定,EAR由最低57.1%上升至98.0%。
在R2阶段,苯酚的毒性冲击作用干扰系统内微生物生理代谢,氨氮氧化酶活性受到抑制,EAR波动较大,由99.17%降低为7.62%,出水氨氮质量浓度高达22.45 mg/L。经过13 d的驯化适应,系统氨氮去除率得到恢复,上升至97.81%。
在R3阶段,原水水质波动进水NH4+-N平均质量浓度为31.31 mg/L,高质量浓度冲击使得出水氨氮质量浓度再次出现波动,氨氮去除率最低为27.50%,略比R2阶段的高。经过R2阶段的驯化,菌群的迁移变化及苯酚对硝化可逆性抑制的适应使得系统具有初步的抗苯酚冲击能力。
在R4阶段中,EAR均在65%以上,出水未出现较大的水质波动,苯酚质量浓度增加对硝化作用影响进一步减弱。此时,系统内苯酚降解菌已经得到富集,对苯酚毒物冲击能够及时解除,保证脱氮作用进行。
在R5阶段中,苯酚的质量浓度超过抑制常数,在该质量浓度条件下系统有较大波动,在R4阶段保持稳定的EAR突降至23.45%,持续17 d恢复稳定。该苯酚质量浓度超过了微生物对毒物调节的阈值,使得趋于稳定的微生物协同作用受到破坏。
由表2可知:在R1~R5阶段中,苯酚冲击后系统均出现波动,氨氮氧化作用破坏后经过15~18 d可恢复至正常水平,系统恢复时间并没有出现较大差异。与SRT相比,恢复期时间短于污泥停留时间,这说明系统恢复的主要原因不是种群筛选淘洗,而是微生物自身结构功能改变对环境的适应。经过15~18 d驯化,微生物通过改变细胞膜强度、通透性以及分泌胞外聚合物来适应环境因素的变化。
表2 不同阶段的氨氮负荷、氨氮去除率EAR和恢复时间
Table 2 Ammonia nitrogen load, ERE and recovery time
2.2.2 沿程总氮去除变化
对180 d试验的沿程TN进行分析,前置反硝化工艺由于好氧出水的特点使系统氮去除率较低。苯酚主要在好氧阶段完成降解,在缺氧段降解量较少,可忽略不计。前置反硝化系统沿程出水TN及去除率变化见图6。由图6可知:随着苯酚梯度增加,出水TN质量浓度由最初的19.23 mg/L增加至28.56 mg/L,TN去除率也由56.82%降至48.70%。该现象与苯酚对氨氧化菌冲击试验结论不同,长期试验后苯酚抑制解除并未实现可逆性恢复达到未抑制状态,系统脱氮功能降低。

图6 前置反硝化系统沿程出水TN及去除率变化
Fig. 6 TN and removal rate of pre-denitrification process
经分析认为,出水TN水质变差与细胞活性减弱有关。在苯酚长期影响下,系统内微生物形态结构受到一定程度破坏。通过对系统污泥的胞外聚合物(extracellular polymeric substances,EPS)分析发现,当苯酚质量浓度在0~90 mg/L之间变化时,EPS质量分数由48.3 mg/g增加至87.2 mg/g,蛋白质质量浓度降低42.11%,而多糖质量浓度则增加了248.4%,蛋白质与多糖质量浓度之比由21.88降至3.63。在苯酚高质量浓度下,充足的碳源不仅能被细胞利用合成自身组织结构,还能产生大量胞外多糖类物质,此时,DNA质量浓度在R1~R3阶段中较稳定,平均质量分数为2.53 mg/g;在R4和R5阶段则出现大幅度上升,最大质量分数高达34.6 mg/g。Sponza[19-20]发现酿酒工业废水的活性污泥和城市污水的活性污泥EPS 以蛋白质为主,其质量分数为70~71 mg/g,核酸质量分数仅为6.2~6.5 mg/g。苯酚的毒性作用使得细胞结构发生变异,絮体中微生物死亡、细胞自溶导致EPS 中蛋白质、多糖等含量增加。同时,细胞结构发生不可逆破坏,在EPS提取过程中细胞易破碎,使得试验在R4和R5阶段DNA质量浓度急剧升高。
2.3 苯酚长短期硝化速率对比
采用氨氮氧化速率(ammonia oxidation rate,RAO)来表示不同苯酚条件下的硝化性能。前置反硝化系统内的RAO通过计算典型周期内NH4+-N质量浓度变化得出:
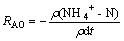
式中:ρ为参与反应的生物量,mg/L;t为反应时间,min。
图7所示为不同初始苯酚质量浓度下的静态试验和SBR典型周期内的RAO。从图7可见:静态毒物冲击试验过程中氨氧化速率较低,在0.982~2.898 mg/(g·h)之间,各苯酚质量浓度差异较小。与之相反,前置反硝化系统内的氨氧化速率波动较大,由6.893 mg/(g·h)降至2.790 mg/(g·h),平均RAO为4.091 mg/(g·h),是静态试验(1.812 mg/(g·h))的2.26倍。RAO变化与毒物刺激效应自由基含量、微生物结构变化有关。苯酚降解菌的逐渐富集使得系统抗苯酚冲击能力提高,减弱了苯酚对硝化细菌酶促反应的抑制作用,RAO的变化原因不仅是苯酚的毒性作用,而且是硝化自养菌与异养苯酚降解菌竞争作用[18]。
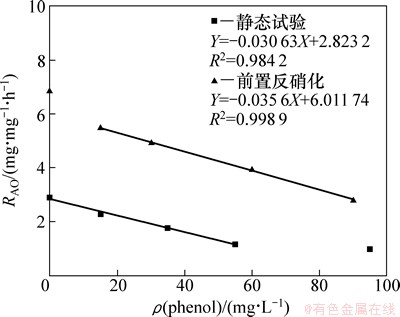
图7 不同苯酚质量浓度下静态试验与前置反硝化系统内RAO的变化
Fig. 7 RAO variation in static test and pre-denitrification process
RAO随苯酚质量浓度的增大而递减,在一定范围内该递减速率与苯酚质量浓度呈线性关系,见图7。静态试验中RAO比前置反硝化系统的小,然而,氨氮氧化速率与苯酚质量浓度的比值为一恒定值(-0.031±0.005)。尽管试验周期、运行模式、种群分布不同,在同样苯酚质量浓度冲击条件下,RAO变化速率相同。根据该现象可推测不同质量浓度下苯酚对氨氧化速率抑制规律。
苯酚作为生物抑制剂,低质量浓度苯酚对硝化菌(AOB和NOB)具有刺激作用,高质量浓度则抑制作用明显。以前置反硝化系统为例,苯酚质量浓度为15,30和90 mg/L时抑制率分别为3.34%,54.71%和74.2%。高质量浓度(90 mg/L)下硝化作用仍未被完全抑制,该试验结果高于Kim等[21-22]研究中的苯酚抑制质量浓度。生物活性污泥系统菌种丰富,当含有硝化菌的同时有大量可降解苯酚的异养菌存在[23],其代谢作用使得毒性有机物降解速度加快,减弱对硝化过程的影响,污水处理过程的苯酚阈值提高[24]。这是苯酚抑制质量浓度、RAO与前人研究结果不同的主要原因。
3 结论
(1) 当苯酚初始质量浓度在0~90 mg/L变化,最大比基质利用速率由2.898 d-1变成0.694 d-1。低苯酚质量浓度下系统平均氮损失21.7%,SND和氨逃逸作用是氮损失的主要原因。
(2) 苯酚与氨氮在0~5 h内协同降解,降解率分别为24.2%和23.5%;5 h后苯酚降解出现拐点,降解率最大为4.44 g/(g·h),而氨氮氧化6 h时,氨氮氧化速率发生变化,由0.88 mg/(g·h)增加至4.44 mg/(g·h)。在ρ(C)/ ρ(N)为1.5时(ρ(phenol)/ρ(N)=0.5),氨氮转化率降低3.34%。
(3) 氨氮氧化作用破坏后经过15~18 d可恢复至正常水平,系统恢复的主要原因是微生物自身结构功能改变对环境的适应。
(4) 当苯酚质量浓度在0~90 mg/L变化时,TN去除率由56.82%降至48.70%。低苯酚质量浓度下胞外聚合物的DNA质量分数较稳定,平均质量分数为2.53 mg/g,在高苯酚质量浓度下为34.6 mg/g。
(5) 静态试验中氨氧化速率为0.982~2.898 mg/(g·h),前置反硝化系统平均氨氧化速率为4.091 mg/(g·h)。
参考文献:
[1] Amor L, Eiroa M, Kennes C, et al. Phenol biodegradation and its effect on the nitrification process[J]. Water Res, 2005, 39(13): 2915-2950.
[2] Staib C, Lant P. Thiocyanate degradation during activated sludge treatment of coke-ovens wastewater[J]. Biochem Eng J, 2007, 34(2): 122-130.
[3] Neufeld R, Greenfield J, Rieder B. Temperature, cyanide and phenolic nitrification inhibition[J]. Water Res, 1986, 20: 633-642.
[4] 李娟英, 赵庆祥, 江敏. 苯酚及其衍生物对氨氮生物硝化的抑制研究[J]. 环境工程学报, 2008, 2(1): 27-30.
LI Juanying, ZHAO Qingxiang, JIANG Min. Inhibition of phenol and its derivatives on ammonia nitrification[J]. Chinese Journal of Environmental Engineering, 2008, 2(1): 27-30.
[5] Kelly R T, Henriques I D S, Love N G. Chemical inhibition of nitrification in activated sludge[J]. Biotechnol Bioeng, 2004, 85(6): 683-694.
[6] Chakraborty S, Veeramani H. Response of pulse phenol injection on an anaerobic-anoxic-aerobic system[J]. Bioresour Technol, 2005, 96(7): 761-767.
[7] American Public Health Association. Standard methods for the examination of water and wastewater[M]. Baltimore: Port City Press, 2005: 1-20.
[8] Groeneweg J, Sellner B, Tappe W. Ammonia oxidation in nitrosomonas at NH3 concentrations near km: Effects of pH and temperature[J]. Water Res, 1994, 28(12): 2561-2566.
[9] Denyer S P, Stewart G S A B. Mechanisms of action of disinfectants[J]. International Biodeterioration & Amp, Biodegradation, 1998, 41(3/4): 261-268.
[10] Tallec G, Garnier J, Billen G, et al. Nitrous oxide emissions from denitrifying activated sludge of urban wastewater treatment plants, under anoxia and low oxygenation[J]. Bioresour Technol, 2008, 99(7): 2200-2209.
[11] Kampschreur M J, Nico C G Tan, Cristian Picioreanu, et al. Effect of dynamic process conditions on nitrogen oxides emission from a nitrifying culture[J]. Environ Sci Technol, 2008, 42(2): 429-435.
[12] 巩有奎, 王淑莹, 王莎莎, 等. DO 对短程反硝化过程中N2O 产量的影响[J]. 中南大学学报(自然科学版), 2012, 43(1): 395-400.
GONG Youkui, WANG Shuying, WANG Shasha, et al. Effect of DO on N2O emission during nitrite denitrification process[J]. Journal of Central South University (Science and Technology), 2012, 43(1): 395-400.
[13] 卢刚, 郑平, 胡宝兰, 等. 内环流颗粒污泥床硝化反应器的氮损失[J]. 浙江大学学报, 2006, 32(3): 323-328.
LU Gang, ZHENG Ping, HU Baolan, et al. Nitrogen loss in internal-loop granular sludge bed nitrifying reactor[J]. Journal of Zhejiang University, 2006, 32(3): 323-328.
[14] Min W L, Jong M P. Reviewed biological nitrogen removal from coke plant wastewater with external carbon[J]. Water Environment Research, 1998, 70(5): 1090-1095.
[15] Liu Y Q, Tay J H, Ivanov V, et al. Influence of phenol on nitrification by microbial granules[J]. Process Biochem, 2005, 40: 3285-3289.
[16] Yamagishi T, Leite J, Ueda S, et al. Simultaneous removal of phenol and ammonia by an activated sludge process with cross-flow filtration[J]. Water Res, 2001, 35(13): 3089-3096.
[17] Mosquera-Corral A, Gon Z, Lez F, et al. Partial nitrification in a SHARON reactor in the presence of salts and organic carbon com pounds[J]. Process Biochemistry, 2005, 40: 3109-3188.
[18] Painter H A. Microbial transformation of inorganic nitrogen[J]. Prog Water Technol, 1977, 8(4/5): 3-29.
[19] Sponza D T. Extracellular polymer substances and physicochemical properties of flocs in steady and unsteady-state activated sludge systems[J]. Process Biochemistry, 2002, 37: 983-998.
[20] Sponza D T. Investigation of extracellular polymer substances (EPS) and physicochemical properties of different activated sludge flocs under steady-state conditions[J]. Enzyme and Microbial Technology, 2003, 32: 375-385.
[21] Kim S S, Kim H J. Impact and threshold concentration of toxic materials in the stripped gas liquor on nitrification[J]. Korean J Chem Eng, 2003, 20(6): 1103-1110.
[22] Young M K, Park D H, Lee, et al. Inhibitory effects of toxic compounds on nitrification process for cokes wastewater treatment[J]. J Hazard Mater, 2008, 152(3): 915-921.
[23] Yamagishi T, Leite J P, Ueda S, et al. Simultaneous removal of phenol and ammonia by an activated sludge process with cross flow filtration[J]. Water Res, 2001, 35(13): 3089-3096.
[24] Ramos A F, Gomez M A, Hontoria E, et al. Biological nitrogen and phenol removal from saline industrial wastewater by submerged fixed-film reactor[J]. J Hazard Mater, 2007, 142: 175-183.
(编辑 陈灿华)
收稿日期:2013-05-22;修回日期:2013-07-23
基金项目:高等学校博士学科点专项科研基金(优先发展领域)资助项目(20111103130002);2012年学科与研究生教育-创新人才培养计划-博士生创新基金资助项目(YB201210)
通信作者:王淑莹(1953-),女,黑龙江肇源人,教授,博士生导师,从事污水深度脱氮处理理论及应用;电话:010-67392627;E-mail:wsy@bjut.edu.cn
摘要:采用短期静态试验和长期前置反硝化SBR工艺处理含苯酚生活污水。研究结果表明:随着苯酚质量浓度(0~175 mg/L)增大,2个试验中污泥氨氧化速率均逐渐减小,短期试验中最大比基质利用速率由2.898 d-1变成0.694 d-1;在前置反硝化系统中,平均氨氧化速率为4.091 mg/(g·h),是静态试验(1.812 mg/(g·h))的2.26倍,且氨氧化速率与苯酚质量浓度的比值为一恒定值(-0.031±0.005);在0~5 h内苯酚与氨氮同时被去除,去除率分别为24.2%和23.5%;受苯酚冲击系统硝化作用破坏后通过自身结构调整15~18 d可恢复至正常水平;较高质量浓度(60~90 mg/L)的苯酚毒性抑制作用使微生物形态结构受到不可逆破坏,微生物胞外聚合物中DNA质量分数由2.53 mg/g增加至34.6 mg/g。


