DOI:10.19476/j.ysxb.1004.0609.2019.01.25
羊栖菜对水环境中Cd2+的吸附特性
张晓梅1,毕诗杰1,苏红1,郭芮1,刘红英2
(1. 河北农业大学 食品科技学院,保定 071000;
2. 河北农业大学 海洋学院,秦皇岛 066000)
摘 要:
以非活性羊栖菜粉为吸附剂,研究羊栖菜对水溶液中Cd2+的吸附特性。结果发现:在最佳吸附pH为5,温度为313.15 K,吸附剂浓度为1 g/L,Cd2+初始浓度为40 mg/L左右时,羊栖菜对镉离子的去除率的最大值为92.54%,且吸附10 min时,即达到最大去除率93.95%;在60 min时,基本达到吸附平衡,羊栖菜对Cd2+的去除具有快速、去除率高的特点。动力学实验数据符合准二级动力学模型,Langmuir 对热力学实验平衡数据的拟合较高,最大理论吸附容量为68.49 mg/g。通过方程拟合和SEM分析发现吸附过程发生了离子交换。FTIR分析显示,羟基、羧基等官能团在吸附过程中发挥了作用,通过解吸可以实现羊栖菜粉的再生和循环利用。
关键词:
文章编号:1004-0609(2019)-01-0211-11 中图分类号:X703.1 文献标志码:A
随着现代工业的不断快速发展,镉矿床的开采、有色金属的冶炼、电镀、玻璃、油漆以及陶瓷、化纤等大量工业废水的排放造成了水域环境的镉污染[1]。与空气、土壤等污染相比,重金属造成的水域污染日益严重[2-3]。镉及其化合物可溶于水,且镉类化合物具有很高的脂溶性、生物富集性和毒性,能在动植物和水生生物体内富集,参与食物链循环,最终危害人类生命健康[1, 4-5]。镉可经皮肤渗透、呼吸系统、食物链进入人体,在肝脏、肾脏和骨质中累积,尤其对肾脏有明显的损害作用[6-7],同时,会严重损害儿童的记忆能力[8]。在重金属的去除方面,海藻作为生物吸附剂具有高效廉价、适应性好、选择性强、易获得等优势[9],近年来,海藻在重金属去除方面的研究受到了广泛的关注。迄今为止,我国用于研究镉污染的海藻类型覆盖了褐藻、红藻、绿藻等各领域,其中主要的有海带[10]、鼠尾藻[11]、江蓠[12]、龙须菜[13]、小球藻[14]、浒苔[15]等,研究发现,褐藻对金属的吸附量比红藻和绿藻高[16-17],且相关研究多数集中于环境因素对吸附过程的影响,而对海藻-金属相互作用机理的探讨认识仍处于初级阶段。相对于活性藻体的生物积累而言,非活性藻体的生物吸附具有吸附容量大、速度快、选择性好、适应性强等优势[18-19]。生物吸附中藻体对重金属的去除机制包括离子交换、表面络合、螯合、吸附、静电作用、微沉淀等,海藻对金属离子的吸附过程是一个复杂的物理化学过程,是多种机理共同作用的结果[20-21]。海藻与重金属的相互作用是吸附研究中不可或缺的一部分,本文作者在充分考察环境因素对吸附影响的基础上,研究了羊栖菜(Sargassum fusiforme, S.fusiforme)对镉离子吸附的动力学和热力学,通过扫描电镜(Scanning electron microscope, SEM)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)初步分析羊栖菜对Cd2+的吸附机理,并以HNO3和EDTA-2Na为解吸助剂,研究了羊栖菜对Cd2+的解吸效果,以期为羊栖菜在水环境重金属的去除方面提供基础资料。
1 实验
1.1 材料与试剂
羊栖菜在渤海养殖。
高纯镉(99.999%)购自济南众标科技有限公司;浓硝酸、浓盐酸为国产优级纯试剂;氢氧化钠、氯化钠、氯化钙、乙二胺四乙酸二钠为国产分析纯试剂。
1.2 仪器与设备
FD-1型冷冻干燥机:北京德天佑科技发展有限公司;HZQ-F全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;ZEEnit 700P原子吸收光谱仪:德国耶拿分析仪器股份公司。
1.3 实验方法
1.3.1 吸附剂的制备
将羊栖菜冲洗沥干,用脱脂滤纸除去表面水分,适当剪切后置于冷冻干燥托盘,样品厚度不超过1 cm,预冻后真空冷冻干燥。样品取出后磨粉,过孔径为150 μm的标准筛,用自封袋收集,于内置有效干燥剂的干燥器中保存。
1.3.2 实验方法
采用Batch平衡法[22],将冻干过筛后的羊栖菜粉与不同性质的吸附溶液混合,振荡一定时间后,离心分离上清液,测定吸附后上清溶液中目标金属离子浓度。
环境因子实验:采用控制变量法,在1~7范围内调节吸附液pH以确定最佳pH;在0.5~10 g/L范围内确定最佳的吸附剂浓度;在10~100 mg/L之间调节Cd2+初始浓度,将吸附剂的吸附效果最大化;在不同的温度下进行吸附,比较温度对吸附平衡的影响;改变溶液中其他离子的种类和浓度,考察不同离子及其强度对吸附效果的影响。
动力学模拟实验:改变吸附温度或Cd2+初始浓度,按Batch平衡法进行动力学模拟实验。用Lagergren 准一级动力学模型、准二级动力学模型、Elovich方程拟合所得实验数据,考察羊栖菜粉对镉离子的吸附动力学特性。
热力学模拟实验:配制浓度分别为10、20、40、60、80、100 mg/L的Cd2+溶液,在不同温度下,按Batch平衡法进行热力学模拟实验,用Langmuir模型、Freundich模型、Tempkin模型及Dubinin- Radushkevich(D-R)模型考察羊栖菜粉对镉离子的吸附热力学特性。
解吸实验:分为吸附和解吸两个过程,解吸助剂选择无机试剂HNO3、有机试剂EDTA-2Na,采用控制变量法考察解吸助剂种类及浓度对解吸效果的影响。
羊栖菜粉表面特征分析:将吸附Cd2+前后的羊栖菜粉干燥后,喷金,采用15 kV的加速电压进行扫描,分析羊栖菜粉的表面形态;对比吸附前后的能谱图,根据金属离子含量变化进行定性分析。
羊栖菜粉红外光谱分析:将吸附Cd2+前后的羊栖菜粉进行干燥,粉碎,过筛。将干燥后的样品粉末和KBr粉末按质量比为1:100,在玛瑙研钵中研磨成细粉,压制成厚度均匀的透明薄片,扫描样品的红外吸收图谱。
1.4 数据处理与分析
通过式(1)计算去除率RE(%),式(2)计算吸附容量Q(mg/g)[20, 23],采用式(3)计算解吸效率Rde(%)[24]:
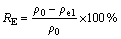 (1)
(1)
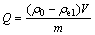 (2)
(2)
 (3)
(3)
式中:ρ0为调节pH后吸附前Cd2+的初始浓度;ρe1为吸附完成后的溶液中Cd2+的浓度,ρe2为解吸完成后溶液中Cd2+的浓度,单位均为 mg/L;V为吸附溶液的体积,单位为L;m为添加的吸附剂质量,单位为g。
本文图中数据及拟合均用Origin 8.6进行处理,其中红外光谱图是以光谱扫描结果保存TXT格式数据,转换CVS格式后导入Origin 8.6作图而得。
2 结果与分析
2.1 环境因素实验
2.1.1 吸附液pH
图1所示为羊栖菜粉对Cd2+去除率随吸附液体系pH的变化趋势图,pH会同时影响吸附剂表面的吸附位点和溶液中金属离子的理化状态,往往对吸附效率变化呈显著影响[25]。吸附体系pH由2上升至4左右时,RE呈上升趋势,且速度快,在偏酸的吸附体系中时,羊栖菜粉表面有限的吸附位点被大量的H+占据,会阻碍Cd2+的靠近,随着pH的增大,溶液中H+浓度逐渐减小,离子结合位点(比如—COO、PO43-等)与Cd2+接触量增加,可提高金属离子去除率[26];pH在4~6时,去除率RE处于平台期,当pH继续增大,去除率出现小幅度下降,可能是因为溶液中OH-浓度的不断增大,使吸附过程与沉淀过程同时存在,导致吸附剂实际吸附量下降。实验选取5作为该吸附液体系的最佳pH。
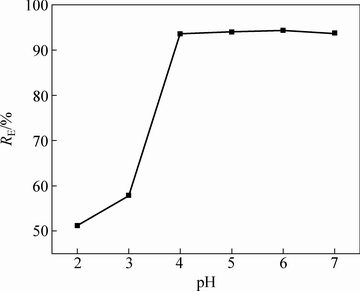
图1 pH值对羊栖菜吸附Cd2+的影响
Fig. 1 Effect of pH value on biosorption of Cd2+ by S.fusiforme
2.1.2 吸附剂浓度
图2所示为Cd2+吸附液浓度为10、50、100 mg/L下,不同吸附剂浓度对Cd2+去除率的影响。在低Cd2+浓度(10 mg/L)下,随吸附剂浓度的不断增大,镉离子的RE均在91.77%以上,但其吸附容量下降迅速,可选取0.5 g/L作为最佳吸附剂浓度;在中Cd2+浓度 (50 mg/L)下,吸附剂浓度由0.5 g/L增大至1.0g/L时,羊栖菜粉对Cd2+的去除率上升迅速,且吸附容量有一定程度的增大,后随吸附剂浓度增大,RE变化进入平台期,但吸附容量下降迅速,因此,中Cd2+浓度时,选择1.0 g/L为最佳吸附剂浓度;以100 mg/L的浓度进行实验,在保证较高去除率的情况下,尽量选取有较大吸附容量的点,选择2.5 g/L作为最佳吸附剂浓度。在吸附液浓度一定时,羊栖菜粉对Cd2+的去除率随吸附剂浓度的增大而增大,但吸附容量一般随之降低,在吸附液Cd2+浓度较高时,吸附容量呈先增大后减小的趋势,可能是因为有限的吸附剂在过高的金属浓度下,对金属离子的总吸附量受到限制。随着Cd2+初始浓度的增大,需要适当增大吸附剂浓度来保证较高的去除率。
2.1.3 Cd2+初始浓度
在吸附剂浓度一定的情况下,羊栖菜粉对Cd2+的去除率随金属离子初始浓度的增大而降低,但吸附容量逐渐增大,直至羊栖菜粉表面结构的吸附位点对金属离子的吸附与解吸逐渐趋于动态平衡。Cd2+浓度由40 mg/L上升至60 mg/L时,羊栖菜粉对Cd2+的去除率下降程度最大(6.04%),而吸附容量的增大程度非最大值,综合考虑去除率及吸附容量,在保证羊栖菜粉对Cd2+的去除率在90%以上的条件下,选取40 mg/L作为Cd2+最佳初始浓度。
2.1.4 温度
调节吸附过程的温度由293.15 K变化至333.15 K,羊栖菜粉对Cd2+的去除率总体上呈先上升后下降的趋势,但幅度变化十分微小,最大值出现在313.15 K,说明适当升高温度有助于吸附过程的进行,其原因可能是温度的适当升高可以使羊栖菜粉颗粒膨胀,吸附剂比表面积增大,物理吸附作用加强[27]。温度由313.15 K继续上升,去除率有一定程度下降,可能是由于温度过高使得吸附剂表面参与吸附的官能团发生变化[28]。综合考虑升温所需要的能源消耗和去除率上升程度较小,可选择以常温作为实验温度。
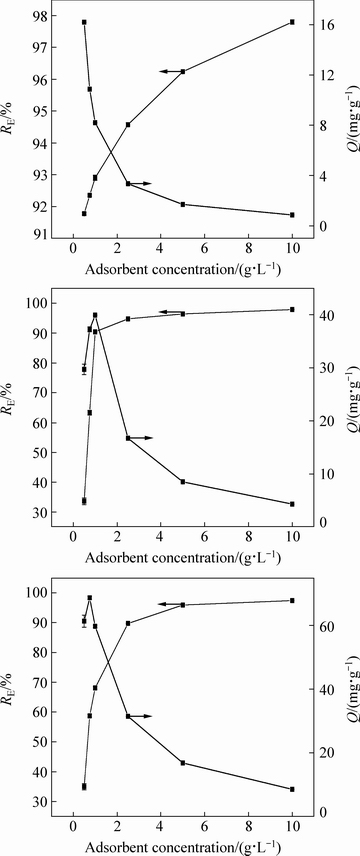
图2 吸附剂浓度对羊栖菜吸附Cd2+的影响
Fig. 2 Effect of absorbent concentration on biosorption of Cd2+ by S.fusiforme
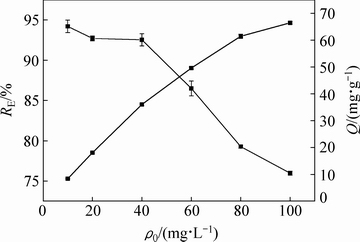
图3 金属离子初始浓度ρ0对吸附效果的影响
Fig. 3 Effect of initial concentration of metal ions on adsorption
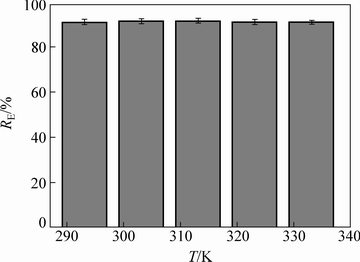
图4 温度对羊栖菜吸附Cu2+ 的影响
Fig. 4 Effect of temperature on biosorption of Cu2+ by S.fusiforme
2.1.5 离子强度
2.1.5.1 干扰离子
图5表明,吸附液中存在Na+、Ca2+时,会严重降低羊栖菜粉对Cd2+的去除率,干扰离子浓度越大对Cd2+的去除干扰程度越大,且相同浓度下Ca2+对Cd2+去除率的干扰性大于Na+。图6所示为对干扰离子强度与吸附容量的关系进行分析[20],发现吸附量与相应的离子强度的平方根之间存在一定程度的线性关系,其线性方程分别为Q(Na+)=0.2515-0.1467I1/2,Q(Ca2+)=0.2084-0.0254I1/2,R2均在0.94以上。
2.1.5.2 共存离子
以单一Cd2+体系为参照,比较其他共存金属离子对Cd2+的吸附效果。由图5可以看出,吸附液体系中有其他金属共存时,会严重干扰羊栖菜粉对Cd2+的吸附,大大降低其去除率。单一体系中,羊栖菜对Cd2+的RE为65.10%,有相同浓度Pb2+存在时,RE下降了28.17%;当相同浓度的Cu2+存在时,RE下降了46.64%;两种离子同时存在时,RE下降了51.69%。Cu2+对Cd2+吸附的干扰性大于对Pb2+吸附的干扰性,说明Cu2+对Cd2+吸附位点的竞争力比Pb2+的强[16],且吸附液中两种金属离子同时存在时,对Cd2+吸附的干扰性大于单一金属离子的干扰性。在吸附剂浓度一定时,其表面所存在的金属离子的结合位点有限,吸附液中其他金属离子浓度的增加,会加剧金属离子和目标离子对有限吸附位点的竞争,降低目标金属离子的去除率,且共存离子种类的不同对目标金属离子的干扰性存在差异。离子强度表现 出的不同影响特征,可能是金属离子自身性质不同导致了与藻类表面吸附位点的结合出现差异性,反映出藻类在吸附不同金属离子时主要吸附机制的差异性[20]。
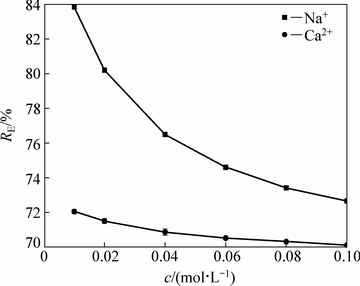
图5 干扰离子种类及浓度I对吸附效果的影响
Fig. 5 Effects of disturbing ion species and concentration on adsorption

图6 干扰离子强度与吸附容量的关系
Fig. 6 Relationship between interference ion intensity and adsorption capacity

图7 共存金属离子对吸附效果的影响
Fig. 7 Effect of coexisting metal ions on adsorption
2.2 吸附动力学分析
常用于描述生物吸附体系动力学数据的模型有准一级动力学方程[29]、准二级动力学方程[30]和Elovich方程[20, 23],其计算公式如下:
准一级动力学方程:
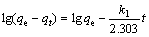 (4)
(4)
准二级动力学方程:
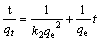 (5)
(5)
Elovich方程:
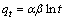 (6)
(6)
式中:qt、qe分别为吸附时间为t时和吸附平衡时的吸附容量,mg/g;k为动力学速率常数;α、β为叶洛维奇常数。
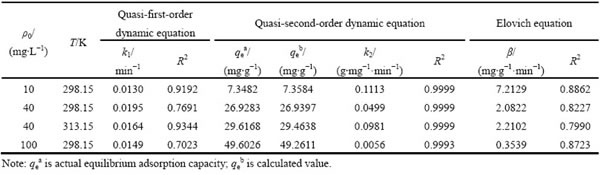
以上述3种方程对动力学实验数据进行拟合发现(见表1),一级动力学方程相关性系数范围为0.7023~0.9344,Elovich方程相关性系数范围为0.7990~0.8723,均相对较小,说明羊栖菜对Cd2+的吸附不符合该两种方程。准二级动力学方程对数据的拟合度较高,其相关性系数均在0.9993及以上,且由该方程计算的理论吸附量与实验实际吸附量基本一致。根据准二级动力学方程的假设:速率控制步骤是化学反应,该机理涉及吸附剂官能团与金属离子的电子共享或电子得失[23],说明羊栖菜对Cd2+的吸附过程发生了离子交换反应。在Cd2+初始浓度为40 mg/L的条件下,吸附环境温度由298.15 K改变为313.15 K时,羊栖菜粉对Cd2+的吸附量由26.93 mg/g上升至29.62 mg/g,说明适当升高吸附环境的温度有助于羊栖菜粉对Cd2+的吸附,这与温度因素所得的结论相一致。相同条件下,随金属离子初始浓度的升高,羊栖菜对Cd2+的吸附量增大(见图8(a));K2随着初始浓度的增大而逐渐变小,说明到达吸附平衡所用的时间逐渐变长(见图8(b))。

图8 羊栖菜吸附Cd2+的准二级动力学方程拟合
Fig. 8 Pseudo-second-order model simulation of Cd2+ adsorption by S.fusiforme
表1 动力学方程拟合参数
Table 1 Fitting parameters of kinetic equation
2.3 吸附热力学分析
用于描述固体吸附剂吸附重金属的等温线模型主要有Langmuir模型[31]、Freundlich模型[32]、 Tempkin模型[33]及Dubinin-Radushkevich(D-R)模型[34],其计算公式分别为
Langmuir模型:
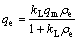 ;
; (7)
(7)
Freundlich模型:
 (8)
(8)
Tempkin模型:
 ;
;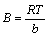 (9)
(9)
D-R模型:
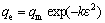 ;
; ;
; (10)
(10)
式中:qe为重金属平衡吸附容量,mg/g(式(7)~(9)中)或mol/L(式(10)中);ρe为金属离子平衡浓度,mg/L;qm为理论饱和吸附容量,mg/g(式(7)~(9)中)或mol/L(式(10)中);ρ0为金属离子初始浓度,mg/L;RL为分离因子;kL、kF、k分别为Langmuir常数、Freundlich常数和D-R常数;A、B为Tempkin常数;n为非均相因子;R为普式气体常数,8.3145 J/(mol·K);T为热力学温度,K;ε为Polanyi电位;分离因子RL[24]用于判断吸附是否趋向于有利吸附平衡,RL>1为不利吸附,RL=1为线性吸附,0<RL<1为有利吸附;RL=0为不可逆吸附。E为吸附自由能[20, 24],kJ/mol。E的大小可用于判断吸附过程是物理吸附还是化学吸附,若E<8 kJ/mol,则吸附过程为物理吸附;若8 kJ/mol<E<16 kJ/mol,则吸附过程为化学吸附,发生离子交换(见图9)。
以上述4种模型对热力学实验数据进行拟合,结果见表2。由表2中数据可知,Langmuir模型对数据的拟合度较高,其相关性系数为0.9860~0.9913,理论最大吸附容量为68.49 mg/g,高于改性甘蔗渣(12.38 mg/g)[35]、改性板栗内皮(51.28 mg/g)[36]等,说明羊栖菜对具有较高的吸附容量。由KL计算的RL为0.0630和0.1046,均在0~1之间,说明吸附过程为有利吸附。Freundlich模型中n值大于1,表明吸附过程易于进行。
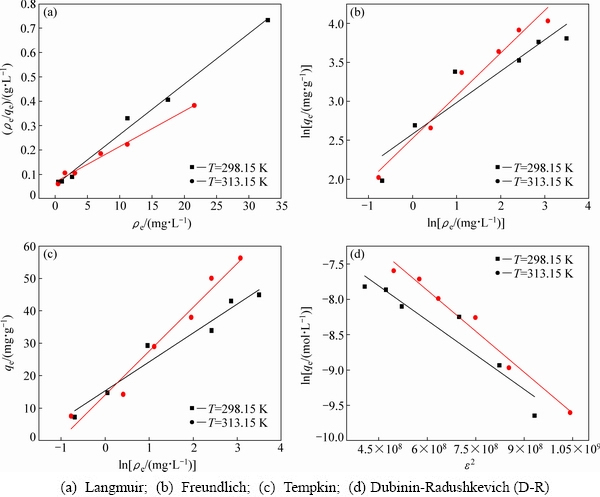
图9 羊栖菜吸附Cd2+的热力学方程拟合
Fig. 9 Thermodynamic equation fitting of Cd2+ adsorption by S.fusiforme
表2 等温吸附模型及拟合参数
Table 2 Simulation of isotherm models and corresponding parameters
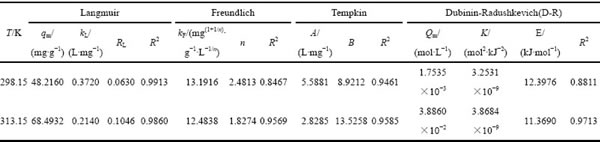
Tempkin模型R2低于Langmuir等温模型,说明Tempkin等温线不适用于描述该吸附过程;由Dubinin- Radushkevich(D-R)模型参数k值计算吸附自由能E,其值为12.3976 kJ/mol和11.3690 kJ/mol,均在8~16 kJ/mol范围内,说明羊栖菜粉对Cd2+的吸附以化学吸附为主,发生了离子交换,该结果与吸附动力学中得到的结论一致。
2.4 电镜及能谱分析
通过SEM像可以看出(见图10),羊栖菜粉表面微观结构在吸附前后有明显不同,吸附前,羊栖菜粉表面有部分聚集物,但整体平整;吸附后,羊栖菜粉表面凹凸不平,结构多孔,可能是由于在吸附过程中发生了硝化,但更多官能团的暴露有利于吸附过程的进行。以能谱图对羊栖菜粉吸附重金属前后的元素变化进行定性分析(见图11),发现吸附前,羊栖菜粉中含有C、O、Na、Mg、Al、Si、K、S、Cl、I、Ca等元素,未检测出Cd元素;吸附后,羊栖菜粉中元素为C、O、Na、Mg、Al、S、Ca、Cl、Cd,说明Cd成功吸附到了羊栖菜表面。吸附前后K、I等离子含量有变化(见表3),在一定程度上说明吸附过程发生了离子交换。

图10 Cd2+吸附前后羊栖菜的SEM像
Fig. 10 SEM images of Cd2+ before and after adsorption by S.fusiforme

图11 能量色散X射线光谱对羊栖菜的化学分析
Fig. 11 Chemical analysis of S.fusiforme by energy- dispersive X-ray spectroscopy
2.5 红外光谱分析
由FTIR图谱可发现(见图12),9处相对明显的吸收峰,对比羊栖菜吸附Cu2+前后的主要吸收峰的变化,发现吸附后主要吸收峰的峰强有不同程度的增大,且多处谱带发生位移,其中特征区[9, 24, 37]:伸缩振动υO—H由3373 cm-1移动至3379 cm-1;υC=O 由1620 cm-1移动至1614 cm-1;υC—C由1419 cm-1移动至1423 cm-1;υasC—O由1253 cm-1移动至1261 cm-1;指纹区基本无变化,说明参与吸附过程的主要官能团有—OH、—COO-。
表3 羊栖菜吸附Cd2+前后能谱分析的元素组成
Table 3 Energy spectrum analysis of element composition of S.fusiforme before and after Cd2+ absorption
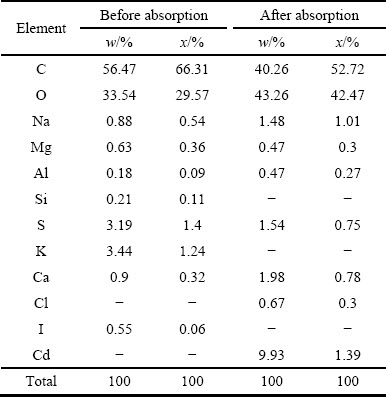
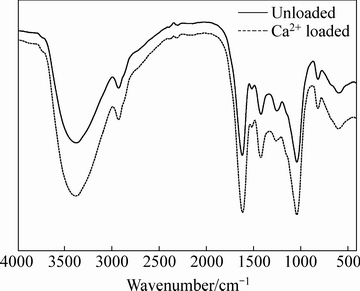
图12 羊栖菜吸附Cd2+前后红外光谱图
Fig. 12 FTIR spectra of Cd2+ before and after adsorption by S.fusiforme
2.6 解吸实验
选取不同浓度的无机试剂HNO3和有机试剂EDTA-2Na作为解吸剂,考察不同解吸助剂种类及浓度对解吸效果的影响(见图13)。以HNO3为解吸助剂,Rde随HNO3浓度的升高而升高,最高为86.20%,但采用0.10 mol/L或更高浓度的HNO3作为解吸助剂时,容易发生硝化反应,不利于吸附剂的再生和循环利用。有学者研究发现,有机配位体可以与吸附剂表面基团竞争溶液中的重金属离子,从而到达解吸的目的,同时,有机配位体也可以与目标金属离子结合后再次以结合物状态与吸附剂表面结合位点进行络合,增大目标金属离子的吸附容量[38-39]。本实验以EDTA-2Na为解吸助剂,其解吸率(Rde)随浓度的升高呈先升高后降低的趋势,但整体变化不明显,以0.1 mol/L和0.3 mol/L的EDTA-2Na为解吸助剂时,解吸率有一定程度的降低,可能是因为溶液中EDTA-2Na和金属离子的结合物与吸附剂结合位点相结合的缘故。0.05 mol/L EDTA-2Na的Rde 最高(86.86%),与0.5 mol/L HNO3的Rde(86.20%)基本相当。综合考虑,选取0.05 mol/L EDTA-2Na作为解吸助剂具有相对较大的优势。EDTA-2Na上的有机配体在一定浓度时可以与吸附剂表面参与吸附的官能团共同竞争溶液中的金属离子,有效促使羊栖菜上吸附的金属离子重新释放到溶液中去,从而减小金属离子吸附量,达到解吸的目的,促进吸附剂的再生。
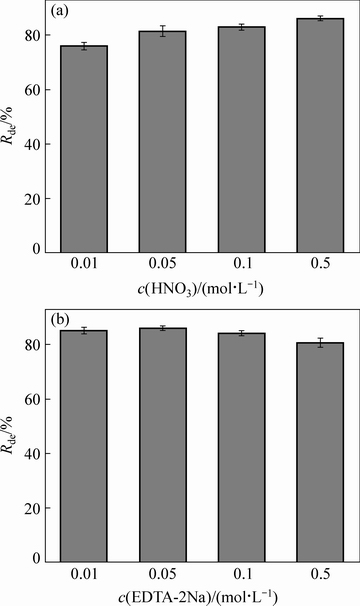
图13 解吸助剂种类及浓度对解吸效果的影响
Fig. 13 Effects of desorption promoter type and concentration on desorption
3 结论
1) 羊栖菜粉对的吸附过程受到多种环境因素的影响,其中pH的影响较大。在最佳吸附pH为5、温度313.15 K条件下,1g/L的羊栖菜粉对40 mg/L Cd2+的去除率有最大值92.54%,且吸附10 min时即达到最大去除率的93.95%,在60 min时基本达到吸附平衡。适当升高温度有利于吸附过程的进行。
2) 溶液中其他离子,尤其是金属离子的存在会严重干扰羊栖菜粉对Cd2+的吸附,且浓度越大,干扰性越大,共存离子种类的不同对目标金属离子的干扰性存在差异。目标离子的吸附量与相应的离子强度的平方根之间存在一定程度的线性关系。
3) 动力学实验数据符合准二级动力学模型,Langmuir 可以很好地拟合热力学实验得到平衡数据,最大理论吸附容量为68.49 mg/g。通过方程拟合和SEM分析发现吸附过程发生了离子交换。FTIR分析显示羟基、羧基等官能团在吸附过程中发挥了作用。
4) 解吸实验结果显示,0.05 mol/L EDTA-2Na对羊栖菜粉上Cd2+的解吸率为86.86%,通过解吸可实现羊栖菜吸附剂的再生和循环利用。羊栖菜可以有效地去除水环境中的镉离子,吸附容量大,可再生,具有开发为镉离子吸附剂的潜能。
REFERENCES
[1] 戴世明, 吕锡武. 镉污染的水处理技术研究进展[J]. 安全与环境工程, 2006, 13(3): 63-65.
DAI Shi-ming, LU Xi-wu. Advances on cadmium pollution water treatment technology[J]. Safety and Environmental Engineering, 2006, 13(3): 63-65.
[2] KUMAR S R, AGRAWAL M, MARSHALL F. Heavy metal contamination of soil and vegetables in suburban areas of Varanasi, India[J]. Ecotoxicology & Environmental Safety, 2007, 66(2): 258-266.
[3] 岳 霞, 刘 魁, 林夏露, 周 琪, 毛国传, 邹宝波, 赵进顺. 中国七大主要水系重金属污染现况[J]. 预防医学论坛, 2014(3): 209-213.
YUE Xia, LIU Kui, LIN Xia-lu, ZHOU Qi, MAO Guo-chuan, ZOU Bao-bo, ZHAO Jin-shun. Current situation of heavy metal pollution in seven major water systems in China[J]. Prev Med Trib, 2014(3): 209-213.
[4] ULUTURHAN E, KUCUKSEZGIN F. Heavy metal contaminants in Red Pandora (Pagellus erythrinus) tissues from the Eastern Aegean Sea, Turkey[J]. Water Research, 2007, 41(6): 1185-1192.
[5] MCGEER J C, SZEBEDINSZKY C, MCDONLD D G,WOOD C M. Effects of chronic sublethal exposure to waterborne Cu, Cd or Zn in rainbow trout. 1: Iono-regulatory disturbance and metabolic costs[J]. Aquatic Toxicology, 2000, 50(3): 231-243.
[6] 肖春文, 罗秀云, 田 云, 卢向阳. 重金属镉污染生物修复的研究进展[J]. 化学与生物工程, 2013, 30(8): 1-4.
XIAO Chun-wen, LUO Xiu-yun, TIAN Yun, LU Xiang-yang. Research progress of bioremediation of heavy metal cadmium pollution[J]. Chemistry & Bioengineering, 2013, 30(8): 1-4.
[7] 龚建军. 重金属污染及其分析方法研究进展[J]. 绿色科技, 2017(4): 94-96.
GONG Jian-jun. Research progress and analyzing methods of heavy metal pollution[J]. Journal of Green Science and Technology, 2017(4): 94-96.
[8] 王 岙. 食品中铅、镉污染状况分析及控制对策研究[D]. 长春: 吉林大学, 2006: 6.
WANG Ao. Study on pollution of Pb and Cd in food and controlling countermeasures[D]. Changchun: Jilin University, 2006: 6.
[9] 丁 洋, 靖德兵, 周连碧, 杨晓松, 吴亚君. 板栗内皮对水溶液中镉的吸附研究[J]. 环境科学学报, 2011, 31(9): 1933-1941.
DING Yang, JING De-bing, ZHOU Lian-bi, YANG Xiao-song, WU Ya-jun. The adsorption of aquatic cadmium (Ⅱ) by chestnut inner shell[J]. Acta Scientiae Circumstantiae, 2011, 31(9): 1933-1941.
[10] 苏 峰. 海带对镉离子的生物吸附研究[D]. 长沙: 湖南大学, 2009: 19.
SU Feng. Study on cadmium (Ⅱ) biosorption on Laminaris japonica[D]. Changsha: Hunan University, 2009: 19.
[11] 吴海一, 詹冬梅, 刘洪军, 丁 刚, 刘 玮, 李美真. 鼠尾藻对重金属锌、镉富集及排放作用的研究[J]. 海洋科学, 2010, 34(1): 69-74.
WU Hai-yi, ZHAN Dong-mei, LIU Hong-jun, DING Gang, LIU Wei, LI Mei-zhen. Study on accumulation and degradation of heavy metals by the Brown alga Sargassum thunbergii[J]. Marine Sciences, 2010, 34(1): 69-74.
[12] 黄鹤忠. 江蓠对N、P和重金属Cd~(2+)、Cr~(6+)、Cu~(2+)、Ni~(2+)污染的去除效应及其生理生化响应[D]. 扬州: 扬州大学, 2013: 20-21.
HUANG He-zhong. The bioremoval of nitrogen, phosphorus, cadmium, chromium, copper and nickel by Gracilaria and its physiological and biochemical responses[D]. Yangzhou: Yangzhou University, 2013: 20-21.
[13] 王增焕, 林 钦, 李刘冬, 王许诺. 大型海藻对重金属镉、铜的富集动力学研究[J]. 中国环境科学, 2013, 33(1): 154-160.
WANG Zeng-huan, LIN Qin, LI Liu-dong, WANG Xu-nuo. Kinetic study on the bioconcentration of cadmium and copper by large-sized seaweed Gracilaria lemaneiformis[J]. China Environmental Science, 2013, 33(1): 154-160.
[14] 陈和祥, 谭凤仪, 邓 丹, 赵春宝. 预处理对小球藻吸附Cd(Ⅱ)、Pb(Ⅱ)和Cu(Ⅱ)的影响[J]. 环境科学与技术, 2015(4): 160-165.
CHEN He-xiang, TAN Feng-yi, DENG Dan, ZHAO Chun-bao. Effect of pretreatment of Chlorella vulgaris Beijerinck biomass on adsorption of Cd(Ⅱ),Pb(Ⅱ)and Cu(Ⅱ)[J]. Environmental Science &Technology, 2015(4): 160-165.
[15] 郭赣林, 朱 明, 徐军田, 徐 静, 陈建华. 浒苔对重金属Cu2+、Cd2+的生物吸附及其生理反应[J]. 海洋环境科学, 2011, 30(6): 850-852.
GUO Gan-lin, ZHU Ming, XU Jun-tian, XU Jing, CHEN Jian-hua. Biosorption of Cu2+ and Cd2+ by Enteromorpha prolifera and their physiological responses[J]. Marine Environmental Science, 2011, 30(6): 850-852.
[16] ROMERA E, GONZALEZ F, BALLESTER A, BLAZQUEZ M L, MUNOZ J A. Biosorption with algae: A statistical review[J]. Critical Reviews in Biotechnology, 2006, 26(4): 223.
[17] BRINZA L, DRING M J, GAVRILESCU M. Environmental engineering and management journal marine micro and macro algal species as biosorbents for heavy metals[J]. Environmental Engineering & Management Journal, 2007, 6(3): 237-251.
[18] 刘学虎, 张 清. 非活性藻类吸附重金属的研究[J]. 山东化工, 2002(3): 15-17.
LIU Xue-hu, ZHANG Qing. Research on the biosorption of heavy metals by nonliving algae[J]. Shandong Chemical Industry. 2002(3): 15-17.
[19] 李 靖. 非活体藻类生物吸附及海带生物吸附剂的初步研究[D]. 长沙: 中南林业科技大学, 2009: 3-8.
LI Jing. Preliminary study on biosorption of nonliving algae and kelp bio-adsorbent[D]. Changsha: Central South University of Forestry and Technology, 2009: 3-8.
[20] 王建龙,陈 灿. 重金属生物吸附[M]. 北京: 科学出版社, 2015: 475-480.
WANG Jian-long, CHEN Can. Heavy metal biosorption[M]. Beijing: Science Press, 2015: 475-480.
[21] 邓莉萍, 苏营营, 苏 华, 王新亭, 朱校斌. 大型海藻吸附水体中重金属离子的机理及影响因素[J]. 海洋科学, 2008, 32(8): 91-96.
DENG Li-ping, SU Ying-ying, SU Hua, WANG Xin-ting, ZHU Xiao-bin. Mechanism and influence factors of biosorption heavy metal ions by macroalgae[J]. Marine Sciences, 2008, 32(8): 91-96.
[22] DO D D. Adsorption analysis: Equilibria and kinetics[M]. London: Imperial College Press, 1998: 2.
[23] 高宝玉,许 醒,岳钦艳. 阴离子生物质吸附材料[M]. 北京: 科学出版社, 2015: 289-230, 236-245.
GAO Bao-yu, XU Xing, YUE Qin-yan. Anion biomass adsorption material[M]. Beijing: science Press, 2015: 289-230, 236-245.
[24] 黄灵芝. 黑藻生物吸附剂吸附水体中重金属离子的研究[D]. 长沙: 湖南大学, 2011: 34.
HUANG Ling-zhi. Adsorption of heavy metal ions from aqueous solution onto Hydrilla verticillata[D]. Changsha: Hunan University, 2011: 34.
[25] 徐鲁荣, 王 宪, 陈丽丹, 李文权. 环境因子对海藻吸附重金属的影响[J]. 厦门大学学报(自然版), 2003, 42(6): 772-776.
XU Lu-rong, WANG Xian, CHEN Li-dan, LI Wen-quan. The effects of environmental factors on macroalgae biosorption of heavy metals[J]. Journal of Xiamen University(Natural Science), 2003, 42(6): 772-776.
[26] 李彩云. 北方水体中藻类富集Cd2+的研究[D]. 西安: 西北农林科技大学, 2015: 6.
LI Cai-yun. Study on Cd2+ accumulation on algae in north water[D]. Xi’an: Northwest Agriculture and Forestry University, 2015: 6.
[27] HOLAN Z R, VOLESKY B, PRASETYO I. Biosorption of cadmium by biomass of marine algae[J]. Biotechnology & Bioengineering, 1993, 41(8): 819-825.
[28] 董彩娥. 三种褐藻对重金属Cu2+, Zn2+, Cr3+, Ni2+的吸附研究[D]. 广州: 广州大学, 2015: 21, 38.
DONG Cai-e. Studies on the absorption of heavy metal Cu2+, Zn2+, Cr3+, Ni2+ by three brown algal biomass[D]. Guangzhou: Guangzhou University, 2015: 21, 38.
[29] 孙小莉, 曾庆轩, 冯长根. 多胺型阴离子交换纤维吸附铬(Ⅵ)的动力学[J]. 物理化学学报, 2009, 25(10): 1951-1957.
SUN Xiao-li, ZENG Qing-xuan, FENG Chang-gen. Kinetics of adsorption of chromium (VI) by polyamine anion exchange fibers[J]. Journal of Physical Chemistry, 2009, 25(10): 1951-1957.
[30] 代群威, 董发勤, NOONAN M J, 张 伟. 面包酵母菌在铅铜模拟废水中的吸附动力学[J]. 中国有色金属学报, 2010, 20(4): 788-794.
DAI Qun-wei, DONG Fa-qin, NOONAN M J, ZHANG Wei. Adsorption kinetics of bread yeast in Pb-Cu simulated wastewater[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(4): 788-794.
[31] SLEWWAND B G N, VITHANAGE M, WIJESEKARA S S R M, RAJAPAKSHA A U, JAYARATHNA D G L M, MOWJOOD M I M. Characterization of aqueous Pb(II) and Cd(II) biosorption on native and chemically modified alstonia macrophylla saw dust[J]. Bioremediation Journal, 2012, 16(2): 12.
[32] SAEED A, LGBAL M, AKHTAR M W. Removal and recovery of lead(II) from single and multimetal (Cd, Cu, Ni, Zn) solutions by crop milling waste (black gram husk)[J]. Journal of Hazardous Materials, 2005, 117(1): 65-73.
[33] AZIAM R, CHIBAR M, EDDAOUDI H, SOUDANI A, ZERBET M, SINAN F. Kinetic modeling, equilibrium isotherm and thermodynamic studies on a batch adsorption of anionic dye onto eco-friendly dried Carpobrotus edulisplant[J]. The European Physical Journal Special Topics, 2017, 226(5): 977-992.
[34] DUBININ M M. The potential theory of adsorption of gases and vapors for adsorbents with energetically nonuniform surfaces[J]. Chemical Reviews, 1960, 60(2): 235-241.
[35] 熊佰炼. 甘蔗渣吸附废水中Cd2+和Cr3+的研究[D]. 重庆: 西南大学, 2009: 42.
XIONG Bai-lian. Investigation of the adsorption characteristics of the bagasses to Cd2+ and Cr3+ in wastewater[D]. Chongqing: Xinan University, 2009: 42.
[36] 杨娜娜. 改性板栗内皮对水溶液中Pb2+和Cd2+的吸附与解析研究[D]. 保定: 河北农业大学, 2015: 53.
YANG Na-na. Lead and cadmium adsorption and dissociation from water using modified chestnut endothelium[D]. Baoding: Agricultural University of Hebei, 2015: 53.
[37] 高金波,吴 红. 分析化学实验指导[M]. 北京: 中国医药科技出版社, 2016.
GAO Jin-bo, WU Hong. Experimental guidance of analytical chemistry[M]. Beijing: China Medical Science and Technology Press, 2016.
[38] PARDO M T. Sorption of lead, copper, zinc, and cadmium by soils: Effect of nitriloacetic acid on metal retention[J]. Communications in Soil Science & Plant Analysis, 2000, 31(1/2): 31-40.
[39] SHUMAN L M. Effects of nitrilotriacetic acid on metal adsorption isotherms for two soils[J]. Soil Science, 1995, 160(2): 92-100.
Adsorption characteristics of Sargassum fusiforme on cadmium ion in water environment
ZHANG Xiao-mei1, BI Shi-jie1, SU Hong1, GUO Rui1, LIU Hong-ying2
(1. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China;
2.Ocean College, Hebei Agricultural University, Qinhuangdao 066000, China)
Abstract: The adsorption characteristics of Cd2+ in aqueous solution were studied by using inactive Sargassum fusiforme(S.fusiforme)as adsorbent. The results show that the maximum removal rate of Cd2+ is 92.54% under condition of the optimum adsorption pH 5, the temperature 313.15 K, the concentration of adsorbent 1 g/L and the initial concentration of Cd2+ about 40 mg/L, and when the adsorption is carried out for 10 min, the maximum removal rate is 93.95%, the adsorption reaches equilibrium at 60 min. The removal of Cd2+ is rapid and the removal rate is high. The kinetic experiment data conforms to the quasi-second-order kinetics model, Langmuir has a high fitting degree for the equilibrium data of thermodynamic experiments, and the maximum theoretical adsorption capacity is 68.49 mg/g. By means of equation fitting and SEM analysis, it is found that the ion exchange occurs during the adsorption process. FTIR analysis show that hydroxyl, carboxyl and other functional groups play a role in the adsorption process. The regeneration and cyclic utilization of S.fusiforme can be achieved by desorption.
Key words: Sargassum fusiforme(S.fusiforme); Cd2+; environmental factor; adsorption mechanism; desorption
Foundation item: Project(2016SPGCA18) supported by the Hebei Province Food Science and Engineering “Double First-Class” Construction Fund Project, China; Project(17227117D) supported by the Science and Technology Plan of Hebei Province, China
Received date: 2017-10-23; Accepted date: 2018-12-25
Corresponding author: LIU Hong-ying; Tel: +86-335-3150261; E-mail: liu066000@sina.com
(编辑 李艳红)
基金项目:河北省食品科学与工程“双一流”建设资金项目(2016SPGCA18);河北省科技计划资助项目(17227117D)
收稿日期:2017-10-23;修订日期:2017-12-25
通信作者:刘红英,教授,博士;电话:0335-3150261;Email:liu066000 @sina.com
摘 要:以非活性羊栖菜粉为吸附剂,研究羊栖菜对水溶液中Cd2+的吸附特性。结果发现:在最佳吸附pH为5,温度为313.15 K,吸附剂浓度为1 g/L,Cd2+初始浓度为40 mg/L左右时,羊栖菜对镉离子的去除率的最大值为92.54%,且吸附10 min时,即达到最大去除率93.95%;在60 min时,基本达到吸附平衡,羊栖菜对Cd2+的去除具有快速、去除率高的特点。动力学实验数据符合准二级动力学模型,Langmuir 对热力学实验平衡数据的拟合较高,最大理论吸附容量为68.49 mg/g。通过方程拟合和SEM分析发现吸附过程发生了离子交换。FTIR分析显示,羟基、羧基等官能团在吸附过程中发挥了作用,通过解吸可以实现羊栖菜粉的再生和循环利用。
[1] 戴世明, 吕锡武. 镉污染的水处理技术研究进展[J]. 安全与环境工程, 2006, 13(3): 63-65.
[3] 岳 霞, 刘 魁, 林夏露, 周 琪, 毛国传, 邹宝波, 赵进顺. 中国七大主要水系重金属污染现况[J]. 预防医学论坛, 2014(3): 209-213.
[6] 肖春文, 罗秀云, 田 云, 卢向阳. 重金属镉污染生物修复的研究进展[J]. 化学与生物工程, 2013, 30(8): 1-4.
[7] 龚建军. 重金属污染及其分析方法研究进展[J]. 绿色科技, 2017(4): 94-96.
[8] 王 岙. 食品中铅、镉污染状况分析及控制对策研究[D]. 长春: 吉林大学, 2006: 6.
[9] 丁 洋, 靖德兵, 周连碧, 杨晓松, 吴亚君. 板栗内皮对水溶液中镉的吸附研究[J]. 环境科学学报, 2011, 31(9): 1933-1941.
[10] 苏 峰. 海带对镉离子的生物吸附研究[D]. 长沙: 湖南大学, 2009: 19.
[11] 吴海一, 詹冬梅, 刘洪军, 丁 刚, 刘 玮, 李美真. 鼠尾藻对重金属锌、镉富集及排放作用的研究[J]. 海洋科学, 2010, 34(1): 69-74.
[12] 黄鹤忠. 江蓠对N、P和重金属Cd~(2+)、Cr~(6+)、Cu~(2+)、Ni~(2+)污染的去除效应及其生理生化响应[D]. 扬州: 扬州大学, 2013: 20-21.
[13] 王增焕, 林 钦, 李刘冬, 王许诺. 大型海藻对重金属镉、铜的富集动力学研究[J]. 中国环境科学, 2013, 33(1): 154-160.
[14] 陈和祥, 谭凤仪, 邓 丹, 赵春宝. 预处理对小球藻吸附Cd(Ⅱ)、Pb(Ⅱ)和Cu(Ⅱ)的影响[J]. 环境科学与技术, 2015(4): 160-165.
[15] 郭赣林, 朱 明, 徐军田, 徐 静, 陈建华. 浒苔对重金属Cu2+、Cd2+的生物吸附及其生理反应[J]. 海洋环境科学, 2011, 30(6): 850-852.
[18] 刘学虎, 张 清. 非活性藻类吸附重金属的研究[J]. 山东化工, 2002(3): 15-17.
[19] 李 靖. 非活体藻类生物吸附及海带生物吸附剂的初步研究[D]. 长沙: 中南林业科技大学, 2009: 3-8.
[20] 王建龙,陈 灿. 重金属生物吸附[M]. 北京: 科学出版社, 2015: 475-480.
WANG Jian-long, CHEN Can. Heavy metal biosorption[M]. Beijing: Science Press, 2015: 475-480.
[21] 邓莉萍, 苏营营, 苏 华, 王新亭, 朱校斌. 大型海藻吸附水体中重金属离子的机理及影响因素[J]. 海洋科学, 2008, 32(8): 91-96.
[23] 高宝玉,许 醒,岳钦艳. 阴离子生物质吸附材料[M]. 北京: 科学出版社, 2015: 289-230, 236-245.
[24] 黄灵芝. 黑藻生物吸附剂吸附水体中重金属离子的研究[D]. 长沙: 湖南大学, 2011: 34.
[25] 徐鲁荣, 王 宪, 陈丽丹, 李文权. 环境因子对海藻吸附重金属的影响[J]. 厦门大学学报(自然版), 2003, 42(6): 772-776.
[26] 李彩云. 北方水体中藻类富集Cd2+的研究[D]. 西安: 西北农林科技大学, 2015: 6.
[28] 董彩娥. 三种褐藻对重金属Cu2+, Zn2+, Cr3+, Ni2+的吸附研究[D]. 广州: 广州大学, 2015: 21, 38.
[29] 孙小莉, 曾庆轩, 冯长根. 多胺型阴离子交换纤维吸附铬(Ⅵ)的动力学[J]. 物理化学学报, 2009, 25(10): 1951-1957.
[30] 代群威, 董发勤, NOONAN M J, 张 伟. 面包酵母菌在铅铜模拟废水中的吸附动力学[J]. 中国有色金属学报, 2010, 20(4): 788-794.
[35] 熊佰炼. 甘蔗渣吸附废水中Cd2+和Cr3+的研究[D]. 重庆: 西南大学, 2009: 42.
[36] 杨娜娜. 改性板栗内皮对水溶液中Pb2+和Cd2+的吸附与解析研究[D]. 保定: 河北农业大学, 2015: 53.


