中国有色金属学报 2004,(05),831-835 DOI:10.19476/j.ysxb.1004.0609.2004.05.022
纳米TiO2的燃烧合成及其光催化性能
东北大学理学院,东北大学材料冶金学院,东北大学材料冶金学院,东北大学材料冶金学院 沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110004
摘 要:
以TiOSO4为原料, 加入燃烧剂, 采用燃烧合成法制备了纳米TiO2;考察了燃烧剂的种类、燃烧剂的加入量、pH值、点火温度、煅烧时间等对产物的影响;以甲基橙溶液为实验对象, 研究了该TiO2的光催化性能。结果表明:以柠檬酸为燃烧剂, 当TiO (NO3) 2和柠檬酸的摩尔比为9∶15, 溶液pH>5, 点火温度为550℃时合成TiO2。XRD测试表明, 合成产物为单一锐钛矿型, 晶体粒度为14.8nm;TEM测试表明, 产品粒度分布均匀;当用高压汞灯照射2h时, 甲基橙的降解率为91%。
关键词:
中图分类号: O643
收稿日期:2003-08-07
Combustion synthesis of nanosized titania and its photocatalytic activity
Abstract:
Nanosized titania was synthesized by combustion process by using TiOSO4 as raw material and citric acid as fuel. Preparing conditions were studied, such as fuels, amount of fuels, pH value, ignition temperature, calcinations time, etc. The results show that when molar ratio of Ti to citrate is 9∶15 then pH>5 and ignition temperature is 550 ℃, TiO2 is prepared. XRD tests show that the products are anatase and the crystallite size is 14.8 nm, and TEM tests indicate that the powders are uniform. Photocatalytic activity was carried out. After the solution of cymene orange is illuminated for 2 h with UV lamp as light source, degradation efficiency of the solution is 91%.
Keyword:
titania; photocatalytic; combustion synthesis; nanosized;
Received: 2003-08-07
目前, 纳米TiO2被广泛地用于化工、 环保、 医药卫生、 电子工业等领域
燃烧合成是利用化学反应自身放热制备材料的新技术
1 实验
1.1 纳米TiO2的合成与表征
称取一定量TiOSO4固体, 加水加热溶解, 向溶液中滴加浓氨水, 溶液中出现白色絮状沉淀, 调溶液pH=7, 此时溶液呈现糊状。 将沉淀反复洗涤过滤, 直至滤液中无SO
向TiO (NO3) 2溶液中加入一定量柠檬酸溶液, 调节溶液pH>5, 将溶液加热至一定温度, 溶液发生燃烧反应, 得到蓬松的TiO2粉体。
采用日本理学D/MAX-RB X射线衍射仪研究合成粉体的物相, 按Scherrer公式用半高宽化法计算平均晶粒尺寸。 用EM400T透射电子显微镜观察颗粒形貌, 其样品制备为: 将TiO2粉体放于乙醇溶剂中, 超声震荡分散, 然后用铜网捞出。 用Nicolet 510P红外光谱仪表征其红外透射性。
1.2 TiO2的光催化性能实验
配制20 mg/L 的甲基橙溶液, 加入TiO2粉体, 使其浓度为0.5 g/L, 调整溶液的pH值, 将该混合溶液放于烧杯中, 烧杯置于流动自来水浴中, 保持反应溶液温度, 用磁力搅拌器搅拌。 用250 W高压汞灯在溶液上部15 cm处照射, 每隔一定时间取样, 样品经离心分离, 取上层清液测定甲基橙溶液的吸光度。 吸光度用6010紫外可见分光光度计在λ=480 nm处测量。
2 结果与讨论
2.1 燃烧剂的选择
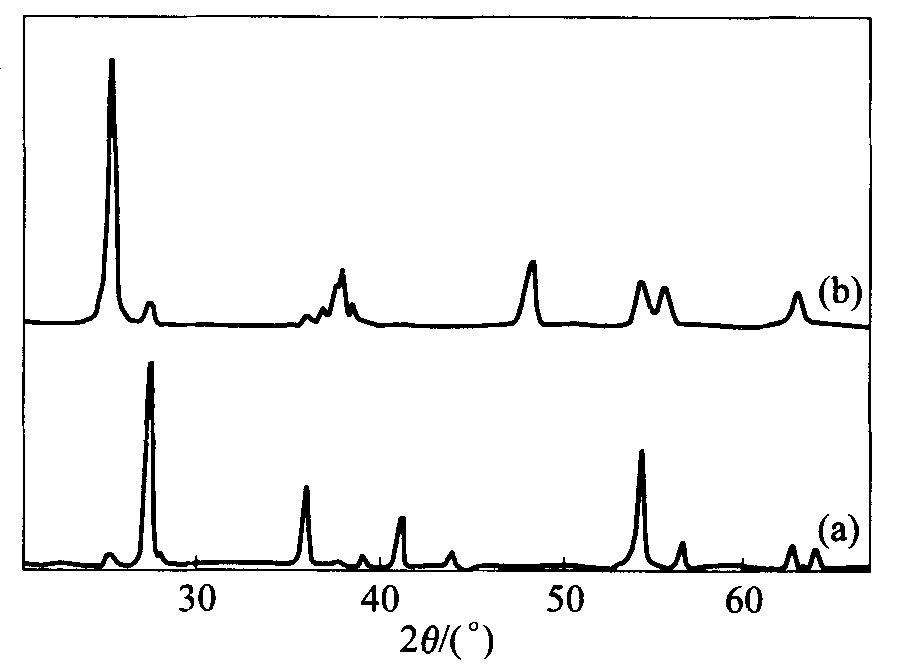
选择尿素、 柠檬酸、 三乙醇胺、 甘氨酸进行实验, 各种燃烧剂的加入量为按所发生化学反应理论计算应加入量的2倍。 当选用柠檬酸为燃烧剂时, 所得产物外观最为蓬松, 颜色均匀。 以尿素和柠檬酸为燃烧剂所得的产物, 结果如图1所示。 从图1可以看出: 用尿素作燃烧剂, 所得TiO2主要为金红石型, 晶粒尺寸为40 nm; 以柠檬酸为燃烧剂时, TiO2主要以锐钛型存在, 晶粒尺寸为20 nm。 据报道, 作为光催化剂, 锐钛型TiO2的反应活性高于金红石型
图1 不同燃烧剂时产物的XRD谱
Fig.1 XRD patterns of products with different fuels (a) —Urea; (b) —Citric acid
TiO2的金红石型比锐钛型稳定, 将锐钛型TiO2在高温下处理, 可转变为金红石型。 当以柠檬酸作燃烧剂时, TiO2主要是锐钛型, 以尿素作燃烧剂时, TiO2主要是金红石型, 说明以柠檬酸作燃烧剂时燃烧合成的温度低于以尿素作燃烧剂时的温度。 同时, 由于以柠檬酸作燃烧剂时产生的气体量大于以尿素作燃烧剂时产生的气体量, 所以产物更加蓬松, 颗粒更加细小。
2.2 燃烧剂加入量
按照推进剂热化学理论, 以柠檬酸为燃料, TiO (NO3) 2为氧化剂时, 合成TiO2的反应如下:
即TiO (NO3) 2和柠檬酸的反应摩尔比为9∶5。 据此, 改变反应摩尔比为9∶1, 9∶2.5, 9∶5, 9∶10, 9∶15, 9∶20进行实验。 当反应摩尔比为9∶1, 9∶2.5和9∶5时, 产物外观不蓬松, 颜色不均匀。 当反应摩尔比大于9∶5时, 外观蓬松, 颜色均匀。 对后3个样品进行X射线衍射分析, 产物晶粒尺寸结果见表2。 从表2可以看出, 增加柠檬酸加入量可使产品TiO2的粒度减小。 其减小的原因可认为是由于随着柠檬酸加入量的增多, 生成了更多的气体, 这有利于粉体粒度更加细小。 但是, 当增
加柠檬酸加入量时, 一方面会由于富燃料使体系的燃烧温度升高, 不利于锐钛型TiO2的生成; 另一方面, 会使最后TiO2产品中有更多的有机物残留, 为除去有机物, 需煅烧更长时间。 该实验选择TiO (NO3) 2和柠檬酸的摩尔比为9∶15。
表1 柠檬酸加入量对TiO2粒度的影响
Table 1 Effect of citric acid amounton crystallite size
| n (TiO (NO3) 2) /n (citric acid) | TiO2 crystallite size/nm |
| 9∶10 | 20.2 |
| 9∶15 | 14.8 |
| 9∶20 | 11.8 |
2.3 pH的影响
TiO2+在水中极易水解, 生成TiO (OH) 2沉淀。 TiO (OH) 2的Ksp=1×10-29, 为防止TiO2+的水解, 溶液中[H+]应大于1 mol/L。 因此, 当以尿素等作为燃烧剂时, 溶液中[H+]均需大于1 mol/L, 即溶液保持强酸介质。 但是, 当以柠檬酸作燃烧剂时, 由于柠檬酸可以和TiO2+络合, 因此, 增大溶液的pH值, 不会有TiO (OH) 2沉淀产生, 溶液的pH值可任意调节。
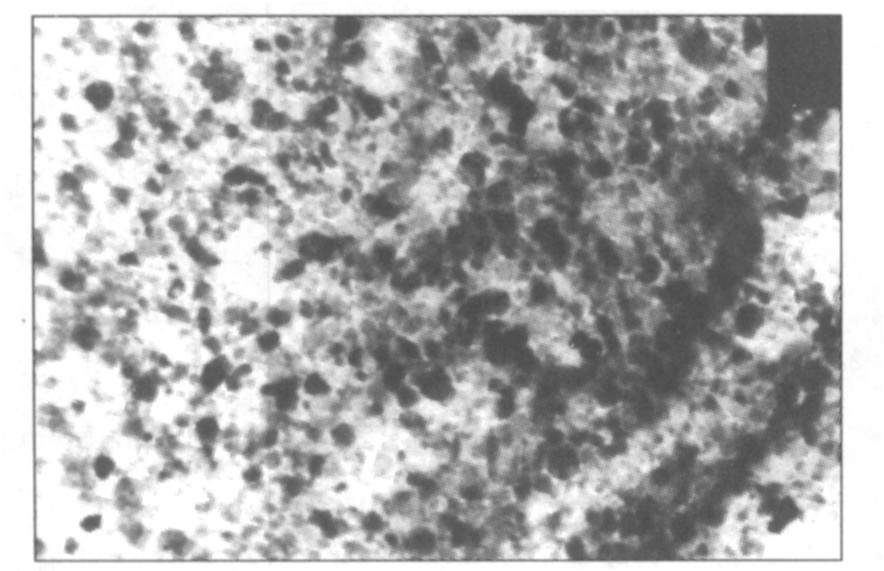
向TiO (NO3) 2溶液中加入柠檬酸后, 用氨水调节溶液的pH分别为1、 3、 5、 7、 10。 当pH≥5时, 燃烧所得产物外观好, X射线衍射检测结果表明样品均为单一锐钛型, 粒度为14.8 nm。 pH=7时, TiO2的TEM像如图2所示。 由图2可见, 样品粒度为10~20 nm, 分布均匀, 和XRD的检测结果相符合。 样品选区电子衍射谱如图3所示, 计算各衍射环对应晶面的面间距d值, 和锐钛型TiO2的标准d值相同, 证明所制样品是锐钛型TiO2。
图2 产物的TEM像 (放大10万倍)
Fig.2 TEM photograph of product
2.4 点火温度的选择
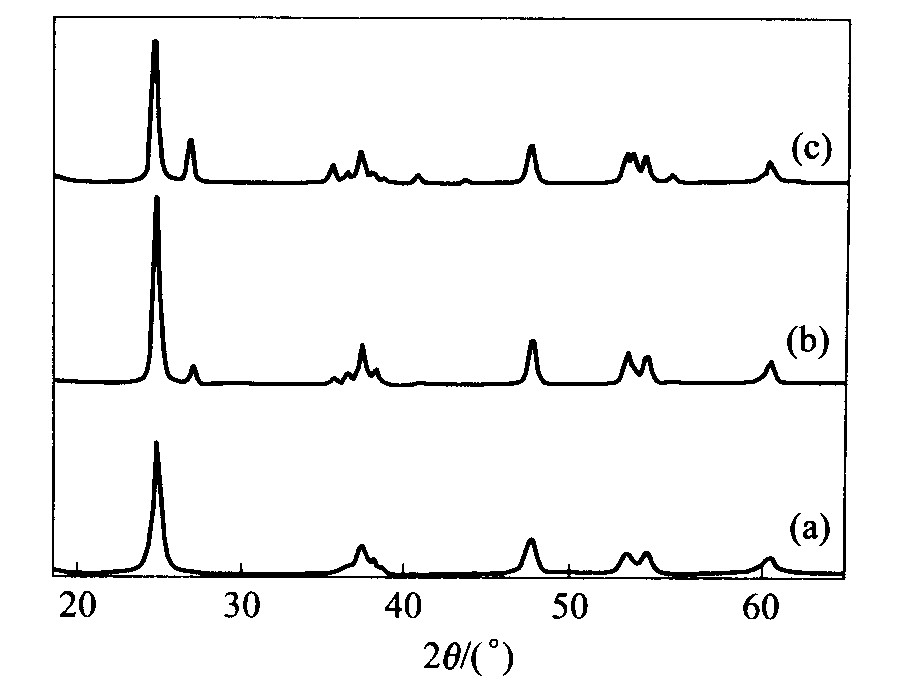
对于TiO2粉体, 点火温度高, 有可能使其发生由锐钛型向金红石型的转变。 分别控制点火温度为550、 600、 650 ℃, 样品的XRD谱如图4所示。 提高点火温度, 有金红石型产品生成。 实验中控制温度为550 ℃。
图3 产物的电子衍射谱
Fig.3 Selected area electron diffraction of product
图4 不同点火温度时产物的XRD谱
Fig.4 XRD patterns of products at different ignition temperatures (a) —550 ℃; (b) —600 ℃; (c) —650 ℃
2.5 煅烧温度和煅烧时间的选择
一般来讲, 提高煅烧温度及延长煅烧时间会使粉体晶型更好, 结晶度更高。 同时, 煅烧会使过量的燃烧剂分解、 氧化而除去。 但是, 对于TiO2粉体, 高温煅烧有可能使其发生锐钛型向金红石型的转变, 所以必须选择适当的温度。 选择在600 ℃时分别煅烧1、 2、 3 h, 从样品的XRD谱可以看出, 3个样品中TiO2都是锐钛型, 没有金红石型出现。
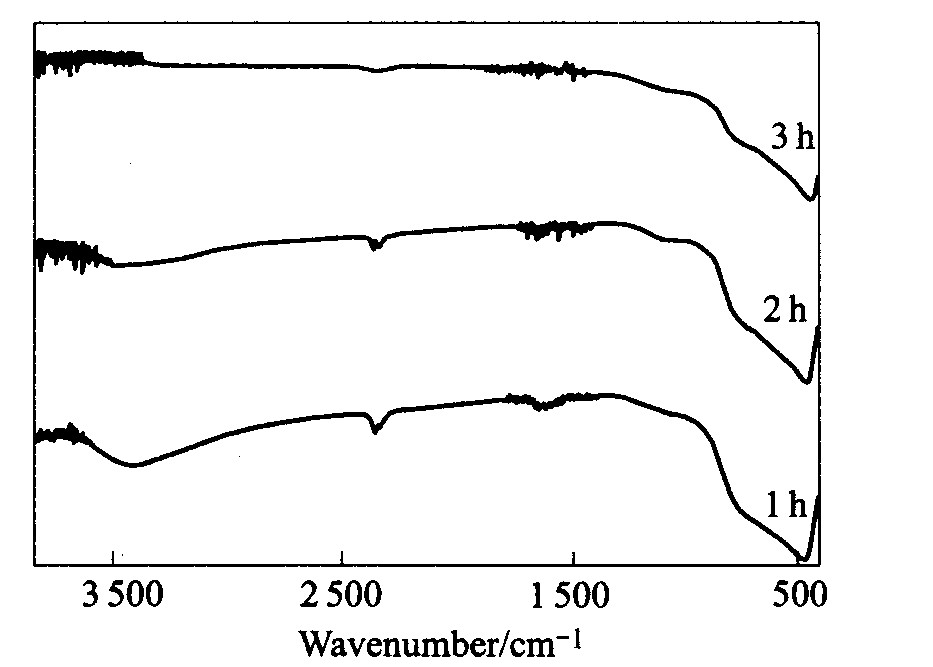
对以上3个样品, 还进行了红外分析, 红外谱如图5所示, 谱图中3 400 cm-1处的吸收峰是有机物中—OH的吸收峰, 1 650 cm-1处的吸收峰是>C=O的吸收峰, 450 cm-1处的吸收由TiO2引起, 2 350 cm-1处的峰是杂峰, 由空气中CO2引起。 由图5可见, 延长煅烧时间, 有机物的吸收峰逐渐减弱, 表明煅烧有利于有机物的除去。
图5 不同煅烧时间产物的红外谱
Fig.5 IR spectra of products at different calcination durations
2.6 TiO2光催化性能实验
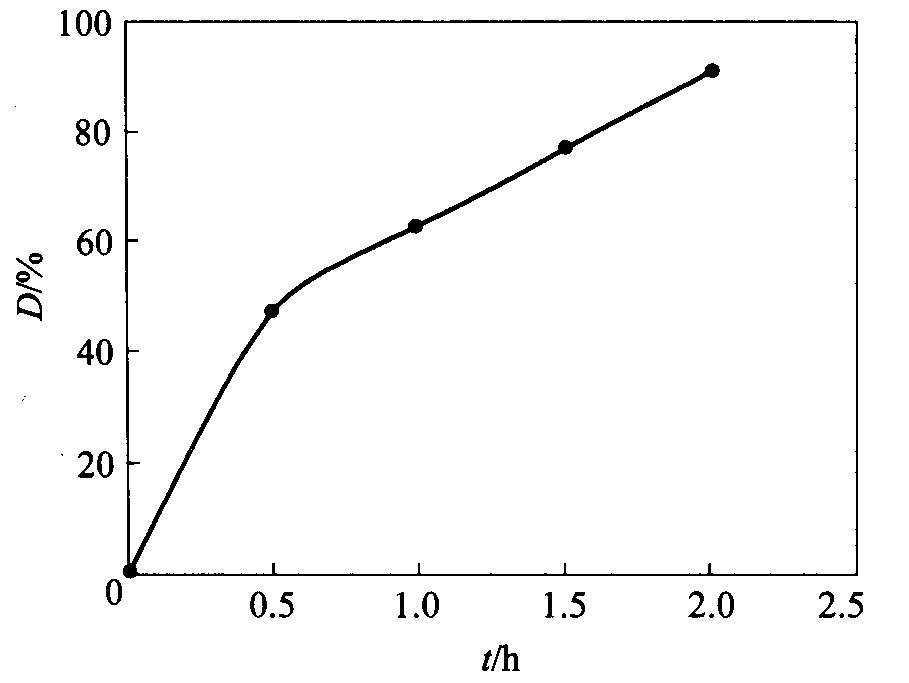
配制20 mg/L甲基橙溶液, 以高压汞灯照射, 测量不同时间甲基橙溶液的吸光度, 考察在未加入TiO2时, 紫外光对甲基橙的降解情况。 另配一份20 mg/L甲基橙溶液, 加入TiO2使其浓度为0.5 g/L, 以高压汞灯照射进行光降解实验。 以降解率对降解时间作图, 结果如图6所示。 降解率D= (A0-A) /A0 (A0为未加入TiO2时任一时间甲基橙溶液的吸光度; A为加入TiO2时同一时间甲基橙溶液的吸光度) 。 由图6可见, 当降解2 h时, 降
图6 甲基橙降解率与时间的关系
Fig.6 Curve of cymene orange degradation vs time
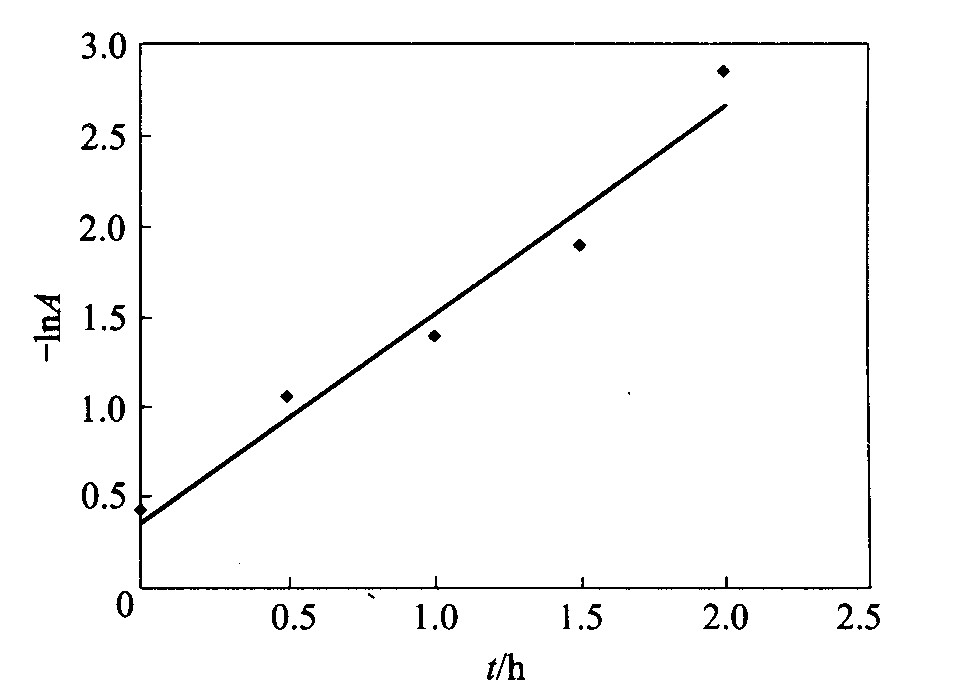
解率为91%, 降解基本完成。 考察甲基橙降解的动力学曲线, 以-lnA对t作图 (见图7) , 曲线方程为: -lnA=-1.17t+0.315, 相关系数r=0.989 7, 表明降解速率符合一级动力学方程。
图7 甲基橙降解动力学曲线
Fig.7 Degradation rate of cymene orange
3 结论
1) 以柠檬酸为燃烧剂, 当TiO (NO3) 2和柠檬酸的摩尔比为9∶15, 溶液pH>5, 控制点火温度为550 ℃时, 燃烧合成, 得到的TiO2为单一锐钛矿型, 粒度14.8 nm, TEM像显示产品粒度分布均匀。
2) 以合成TiO2为光催化剂, 以高压汞灯为光源, 降解甲基橙溶液, 光照2 h, 甲基橙的降解率达91%, 降解速率符合langmuir一级动力学方程, 反应速率常数为0.019 5 min-1。
3) 实验原料价廉易得, 工艺设备简单, 实验条件容易控制, 为TiO2的工业化生产进行了有益的探索。
参考文献