骨粉/PLLA新型内固定复合材料的制备
樊 新,陈 剑,阮建明,邹俭鹏,周忠诚,罗业聪
(中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
摘 要:
摘 要:用骨粉和聚-L-乳酸复合制得骨粉/PLLA内固定复合材料,研究骨粉加入量对复合材料的力学性能的影响,对骨粉进行粒度分析和红外光谱分析,对制得的复合材料进行XRD和SEM表征。研究结果表明:所用骨粉为超微米级颗粒,可为其与聚-L-乳酸基体材料提供很大的接触面积,增加复合材料的力学性能;脱脂脱蛋白皮质骨粉主要含有羟基磷灰石,大量的蛋白质等有机化合物均被除去;由于骨粉的加入使复合材料的结晶度和抗弯强度有所降低,而弹性模量有所升高,不同含量骨粉的复合材料的抗弯断口形貌也发生了变化;所得骨粉/PLLA复合材料具有良好的生物活性,是骨科内固定器件中的理想可降解生物材料。
关键词:
中图分类号:TB33 文献标识码:A 文章编号:1672-7207(2008)06-1213-06
Fabrication of novel bone meals/PLLA composites for
internal fixation plates
FAN Xin, CHEN Jian, RUAN Jian-ming, ZOU Jian-peng, ZHOU Zhong-cheng, LUO Ye-cong
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: The bone meals/PLLA composites used in internal fixation plates for bone surgery were prepared by bone meals and poly(L-lactide). The effect of the mass fractions of bone meals on the mechanics performance of composites was studied. The bone meals were characterized by granularity analysis and IR spectrum, respectively, and the composites were characterized by XRD and SEM, respectively. The results show that due to the large interface area resulting from the incorporation of supermicron bore meals into PLLA matrix, the mechanical properties of composites increase greatly. The bone meals are comprised of hydroxyapatite and a spot of organic compound such as protein, and the mechanical properties of composites such as bending strength and elastic modulus are improved due to the addition of supermicron bone meals grain. The composites with excellent bioactivity are ideal degradable biomaterials for internal fixation devices.
Key words: bone meals; poly(L-lactide); composites; bending strength; elastic modulus
目前,作为骨科最常用的内固定材料的金属材料,由于其坚固可靠,对骨折起到了很好的中和保护、平衡加压等作用,有利于骨折部位的愈合,因而在骨科内固定器件中应用较广。但金属材料也存在以下不足:
a. 金属材料与骨组织的力学相容性差;
b. 金属内固定板的组织相容性不好;
c. 需二次手术。
鉴于金属内固定材料具有以上缺点,生物相容性好的可生物降解材料在骨科内固定材料中的应用受到广大研究者的青睐。可生物降解材料中的聚乳酸类材料,在体内可完全降解,不需二次手术,是理想的骨科内固定材料,在骨科领域日益受到关注,是近年来国内外学者研究的热点[1-8]。然而,聚乳酸高分子材料(PLLA)不具有生物活性和骨结合能力,且由于降解过程中产生的乳酸在人体内容易引起炎症反应[9-11],因而需要寻找一种能够与聚乳酸高分子材料形成复合材料的物质,以期克服聚乳酸高分子材料存在的不足。
异体去抗原的动物皮质骨,是经过一系列理化技术制备的天然生物衍生物材料, 经理化处理, 脱脂脱蛋白,其抗原性被消除,植入人体后不引起明显的免疫排斥反应,而残留的胶原成分也有助于与rhBMP-2的结合[12],具有良好的组织亲合性和结合力,能起骨传导作用,与骨组织能形成直接的骨性连接[13];同时,富含基质材料所必要的氨基酸序列,并且具有与宿主骨骼同源性的结构排列,宿主组织细胞较易接近而予以吸收清除[14]。这类材料来源丰富,制作方便,并在其功能适应性、组织相融性、理化性质、生物降解性以及造价方面优于人工合成材料。因而,本文作者选择异体去抗原皮质骨与聚乳酸高分子材料进行复合制作骨科内固定材料。异体去抗原皮质骨的加入能够对材料的初始力学强度及强度衰减速度进行调控,同时,使得聚乳酸高分子复合材料具有生物活性和骨结合能力,并且能调节PLLA降解过程人体体液的pH值,避免炎症反应的出现[15]。所以,骨粉与PLLA 复合制成的可吸收骨折内固定器具有更好的生物活性和力学性能,且可避免炎症反应,在骨折内固定材料中有着广阔的应用前景。
1 实验方法
1.1 试剂和仪器
试剂有:L-乳酸(荷兰PURAC公司生产,化学纯,含量90%),辛酸亚锡(荷兰PURAC公司生产,分析纯);苯(汕头光华化学厂,分析纯);乙酸乙酯(天津博迪化工有限公司,分析纯);三氯甲烷(天津科米欧试剂厂,分析纯);二氯甲烷(天津科米欧试剂厂,分析纯);无水乙醇(天津科米欧试剂厂,分析纯);甲醇(上海化学试剂有限公司,分析纯);甲苯(上海化学试剂有限公司,分析纯);实验过程所用水均为自制去离子水。
仪器有:恒温水浴锅;真空干燥箱;XD-98型X射线衍射仪;KYKY-2800扫描电镜;比表面积仪;MASTERSIZER2000激光粒度分析仪;日本岛津GCMS-QP2010色谱质谱仪;WZZ-2A数字自动旋光仪;美国Nicolet-210型红外光谱仪。
1.2 骨粉的制备
取检疫合格的小牛皮质骨,粉碎,置于体积比为1?1的甲醇和三氯甲烷溶液中,脱脂12 h,然后,用双氧水脱蛋白16 h,于100 ℃干燥6 h。用无水酒精作为湿磨剂,球磨8 h。过滤,于100 ℃干燥4 h,得脱脂脱蛋白皮质骨粉。
1.3 PLLA的制备
以L-乳酸制备粗L-丙交酯,采用水洗重结晶法提纯丙交酯5次。以纯化后的L-丙交酯为反应物、辛酸亚锡为催化剂,采用开环聚合的方法合成PLLA[16-17]。将安瓿瓶在100 ℃干燥2 h,加入纯化后的丙交酯和催化剂(摩尔比为12 000?1),高真空下封管,于140 ℃进行聚合。聚合完后,将制得的粗PLLA溶于CH2Cl2,用C2H5OH溶液沉析提纯,于40 ℃真空干燥14 h制得纯PLLA。用凝胶渗透色谱法(GPC)测定PLLA粘均相对分子质量为5.4×105 Da,相对分子质量分布系数为1.8。
1.4 骨粉/PLLA复合材料的制备
将PLLA溶于CH2Cl2中,搅拌,制取5% PLLA溶液,按不同比例加入脱脂脱蛋白皮质骨粉,超声分散1 h,直至骨粉颗粒在溶液中呈凝胶状,将所得混合物倒在玻璃上,流延成膜,于40 ℃真空干燥,除去复合材料中的溶剂,制得骨粉/PLLA复合材料。
1.5 材料的表征
将制得的脱脂脱蛋白皮质骨粉用无水乙醇稀释,超声分散。用激光粒度分析仪测试骨粉的粒度分布;用比表面积仪测试骨粉的比表面积;用X射线粉末衍射仪(XRD)分别对骨粉和复合材料的晶体结构进行表征;用红外光谱仪和元素分析仪分析脱脂脱蛋白骨粉的成分及含量。
1.6 骨粉/PLLA内固定螺钉的成形加工及其力学性能测试
将制得的骨粉/PLLA复合膜剪成条型,放入模具中,在88 MPa的压力下预压,使其固定和紧密接触,加热聚乳酸至180~190 ℃后,在110 MPa的压力下压制成形,制得骨粉/PLLA复合材料条状样。
根据需要可以将骨粉/PLLA复合材料成型样品通过机床加工成各种规格的螺钉,满足各种骨科内固定器件的临床需要。
采用三点抗弯法[18]测定其抗弯强度和弹性模量。试样长度为37 mm,跨距为30 mm,加载速度为 5 mm/min,抗弯强度σb和弯曲弹性模量Eb分别按以下公式进行计算:
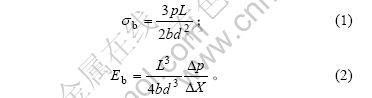

样品经喷金处理后,在KYKY-2800扫描电镜(SEM)上观察骨粉/PLLA复合材料成形样品的抗弯断口形貌。
2 结果与讨论
2.1 骨粉的粒度分析
图1所示为球磨48 h后的脱脂脱蛋白皮质骨粉的粒径分布图。从图1可知,骨粉平均粒径为1.39 μm,最大粒径为10 μm左右,所得骨粉颗粒为超微米级。采用比表面仪测得骨粉的比表面积为34.7 m2/g。骨粉的粒径越小,比表面积越大,与聚乳酸基体材料的接触面积就越大,所得骨粉/PLLA复合材料的力学性能就越好。

图1 皮质骨粉的粒度分布
Fig.1 Granularity distribution of cortex bone meals
2.2 骨粉的红外光谱分析
图2所示为脱脂脱蛋白皮质骨粉的红外光谱图。从图2可知,1 038.5 cm-1和960.3 cm-1处出现强吸收峰,此为羟基磷灰石(HA)的特征峰;3 394.16 cm-1处的吸收峰为骨粉中水的吸收峰,并掩蔽了其中的OH-伸缩振动峰;2 972.24 cm-1处的吸收峰对应于N—H的伸缩振动峰,1 544.8 cm-1处的吸收峰为氨基化合物的吸收峰[19];2 928.61 cm-1处的吸收峰对应于C—H的振动峰;1 448.56 cm-1的吸收峰为CO32-的特征峰。红外光谱分析结果表明骨粉主要成分为磷灰石等无机物,仅含少量蛋白质等有机化合物,说明经理化处理后除去了骨粉中大部分蛋白质等有机化合物。
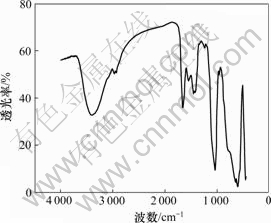
图2 皮质骨粉的红外光谱图
Fig.2 IR spectrum of cortex bone meals
2.3 元素分析
皮质骨粉经脱脂脱蛋白后的元素分析结果如表1所示。从表1可知,骨粉的主要元素为钙、磷,骨粉经理化处理后还含有部分碳、氮元素,表明其为不完全脱蛋白骨粉;同时,分析结果中还含有少量的锌、镁、铁等生物活性细胞以及酶催化所必需的微量元素,而铝和锆等元素含量非常少,这些元素主要来自于骨粉的球磨过程,符合国家标准,对人体无害。
表1 脱脂脱蛋白后皮质骨粉的成分
Table 1 Composition of degreased and deproteined cortex
bone meals %
2.4 骨粉及骨粉/PLLA复合材料的XRD表征
脱脂脱蛋白皮质骨粉、PLLA及骨粉/PLLA复合材料的XRD如图3所示。从图3可知,自然骨的主要成分为结晶度低的羟基磷灰石(HA),其XRD图谱中出现HA的特征衍射峰(2θ=25.9°和31.8°),为单一的HA相,无其他无机杂相存在。在骨粉/PLLA复合材料的XRD图谱中,2θ=16.63°和18.86°处出现较强的衍射峰,分别对应于聚乳酸的(200)和(203)晶面,在2θ=31.6°出现HA的特征衍射峰;与PLLA的XRD图谱相比,复合材料中PLLA的衍射峰强度有所降低,这是由于PLLA为半结晶聚合物,加入皮质骨粉与之进行复合后的复合材料中的PLLA结晶度降低所致,与文献[20]中报道结果相似。

1—骨粉;2—骨粉/PLLA;3—PLLA
图3 样品的XRD图谱
Fig.3 XRD patterns of samples
2.5 骨粉/PLLA复合材料的力学性能与微观结构
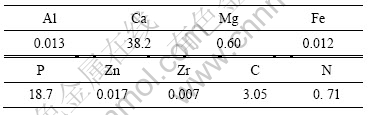
图4所示为骨粉/PLLA复合材料所测定的抗弯强度、弹性模量与骨粉含量的关系图。从图4可知,加入脱脂脱蛋白皮质骨粉后,形成的骨粉/PLLA复合材料的抗弯强度稍微降低,而弹性模量稍微升高。抗弯强度降低主要是由于骨粉和聚合物之间没有发生键合作用,骨粉相对于聚乳酸来说是惰性填料,仅起到了稀释作用。增加骨粉的含量,实际上相当于减少复合材料的实际承载负荷的有效面积,从而使聚乳酸的抗弯强度下降。由于界面上缺乏相互作用,骨粉微粒粒径越小,在复合材料界面将产生更多的缺陷,导致力学强度变得更低。另外,由于微量残余溶剂的增塑作用, 也会导致材料的抗弯强度降低。由此可知,如何使骨粉和PLLA发生键合作用而改变复合材料界面上的相互作用,以及彻底除去微量残余溶剂从而增加材料的抗弯强度是今后研究的一个方向。
骨粉/PLLA复合材料抗弯断口如图5所示。在低倍SEM形貌中(见图5(a),5(c)和5(e)),骨粉/PLLA复合材料抗弯断口形貌存在明显的区别;骨粉含量小于10%时,材料表面均有韧窝,且边缘较为圆滑,具有韧性断裂的特征;随着骨粉含量增加到10%,骨 粉/PLLA复合材料断口韧窝减少,断口形貌起伏变小而趋向平整,说明随着骨粉含量的增加骨粉/PLLA复合材料发生了从韧性向脆性转化的过程。含15%骨粉的骨粉/PLLA复合材料的断口形貌介于韧性和脆性断裂之间,呈波浪状表现。
在高倍SEM形貌中(见图5(b),5(d)和5(f)),骨粉/PLLA复合材料抗弯断口的SEM形貌也可观察到明显的差异。骨粉含量较低时,骨粉在PLLA基体中分布均匀,团聚现象不明显,粉末与基体之间的结合较紧密,未见粉体游离现象,存在清晰的界面;复合材料断裂时,骨粉微粒未被劈开,因此,在其断面上出现微孔和突出物。随着骨粉含量的增加,骨粉发生部分团聚;同时,骨粉/PLLA复合材料中存在孔隙和裂纹等缺陷,孔隙容易造成应力集中,在外力作用下,沿孔隙尖端所引起的应力集中会引起微裂纹,而这种微裂纹一旦产生,应力集中将更加加剧,促使裂纹迅速扩展,导致材料断裂,因而,降低了材料的抗弯强度,其原因主要有:
a. 在PLLA提纯和骨粉/PLLA复合材料的制备过程中使用了有机溶剂,由于微量残余溶剂的增塑作 用[21],使得复合材料在成型过程中出现缺陷,导致材料的抗弯强度降低。因此,必须彻底除去复合材料中的残留溶剂,提高材料的力学性能及其应用。
b. 由于骨粉与聚乳酸高分子之间没有发生化学键合作用,因此,在骨粉和PLLA的界面存在缺陷,界面处的孔隙为裂纹的迅速扩展提供了通道。这一结果与复合材料的抗弯强度结果相一致。因此,需要对骨粉或高分子材料进行表面修饰,增强其键合能力,减少复合材料中无机相和有机相界面的缺陷。
c. 聚乳酸纤维的变形量较小,若熔融不充分,保温时间不够,则聚乳酸不足以消除粉末之间的孔隙及粉末和纤维之间的孔隙;同时,由于聚乳酸纤维的表观粘度较低,骨粉和聚乳酸之间的距离远大于范德华力的作用范围,从而导致其抗弯强度下降。
(a) 抗弯强度; (b) 弹性模量
图4 骨粉/PLLA复合材料力学性能与骨粉含量的关系
Fig.4 Relationship between mechanical properties of bone meals/PLLA composites and mass fractions of bone meals

w(骨粉)/%:(a), (b) 5; (c), (d) 10; (e), (f) 15
图5 骨粉/PLLA复合材料断口的SEM形貌
Fig.5 SEM images of bone meals/PLLA composites with different mass fractions of bone meals
由于骨粉的加入可显著提高聚乳酸高分子材料的抗弯模量,因此,可以参照人体骨骼的模量在聚乳酸高分子材料中加入适量的骨粉,解决聚乳酸高分子材料与人体骨骼模量不匹配的问题,有利于新生骨组织的生长,还可以解决聚乳酸高分子材料对X射线不显影的问题;其次,聚乳酸高分子材料降解过程中产生大量的乳酸,使得组织局部区域酸度过大,导致无菌性炎症;骨粉的存在可以中和聚乳酸高分子材料降解过程中产生的酸性环境以及提供钙源。所以,用皮质骨粉与PLLA复合制备具有生物活性的骨粉/PLLA复合材料试骨科内固定器件中的理想材料。
3 结 论
a. 采用开环聚合的方法制备相对分子质量较高的PLLA,通过与皮质骨粉复合制得生物活性复合材料。
b. 测试了骨粉/PLLA复合材料的力学性能、微观结构与骨粉含量的关系。通过加入不同含量的骨粉调节复合材料的弹性模量使之与人体骨骼的弹性模量相匹配,有利于新生骨组织的生长。
c. 制备的骨粉/PLLA复合材料是一种较理想的新型内固定器件材料,在骨科内固定器件中有广阔的应用前景。
参考文献:
[1] ZHANG Hai-po, RUAN Jian-ming, ZHOU Zhong-cheng, et al. Preparation of monomer of degradable biomaterial poly(L-lactide)[J]. Journal of Central South University of Technology, 2005, 12(3): 246-250.
[2] Cung A N, Eric A, Grégoire S, et al. Synthesis of a novel fluorescent poly(D,L-lactide) end-capped with 1-pyrenebutanol used for the preparation of nanoparticles[J]. European Journal of Pharmaceutical Sciences, 2003, 20(2): 217-222.
[3] 徐海星, 闫玉华, 万 涛, 等. 壳聚糖-L-乳酸复合不对称膜的制备与表征[J]. 中南大学学报: 自然科学版, 2007, 38(3): 433-437.
XU Hai-xing, YAN Yu-hua, WAN Tao, et al. Preparation and characterization of chitosan-L-lactic acid composite asymmetric membrane[J]. Journal of Central South University: Science and Technology, 2007, 38(3): 433-437.
[4] Hyung W K, Chung W C, Young B K, et al. Preparation and hydrolytic degradation of semi-interpenetrating networks of poly(3-hydroxyundecenoate) and poly(lactide-co-glycolide)[J]. International Journal of Biological Macromolecules, 2005, 37(5): 221-226.
[5] XIAO Yu-mei, LI Dong-xiao, FAN Hong-song, et al. Preparation of nano-HA/PLA composite by modified-PLA for controlling the growth of HA crystals[J]. Materials Letters, 2007, 61(1): 59-62.
[6] 李亚军, 阮建明. 聚乳酸/羟基磷灰石复合型多孔状可降解生物材料[J]. 中南工业大学学报: 自然科学版, 2002, 33(3): 261-265.
LI Ya-jun, RUAN Jian-ming. Study on the biodegradation of poly (d,l-lactide) /hydroxyapatite porous composite[J]. Journal of Central South University of Technology: Natural Science, 2007, 38(3): 433-437.
[7] ZHOU Zhi-hua, RUAN Jian-ming, ZOU Jian-peng, et al. Synthesis and structural characterization of macroporous bioactive glass[J]. Journal of Central South University of Technology, 2007, 14(3): 301-304.
[8] 樊 新, 陈 剑, 阮建明, 等. 聚乳酸类生物可降解材料研究进展[J]. 粉末冶金材料科学与工程, 2008, 13(4): 187-194.
FAN Xin, CHEN Jian, RUAN Jian-ming, et al. Research and progress on polylactide biodegradable materials[J]. Materials Science and Engineering of Powder Metallurgy, 2008, 13(4): 187-194.
[9] 王华林, 戴 静, 翟林峰, 等. 可降解聚乳酸/骨粉杂化材料的制备与降解性能[J]. 高分子材料科学与工程, 2007, 23(3): 167-170.
WANG Hua-lin, DAI Jing, ZHAI Lin-feng, et al. Preparation and degradation of poly lactic acid/bone dust hybrid material[J]. Polymer Materials Science & Engineering, 2007, 23(3): 167-170.
[10] Shim W S, Kim J H, Park H, et al. Biodegradability and biocompatibility of a pH- and thermo-sensitive hydrogel formed from a sulfonamide-modified poly(ε-caprolactone-co-lactide)- poly(ethylene glycol)–poly(ε-caprolactone-co-lactide) block copolymer[J]. Biomaterials, 2006, 27(30): 5178-5185.
[11] ZHOU Zhi-hua, RUAN Jian-ming, ZHOU Zhong-cheng, et al. Bioactivity of bioresorbable composite based on bioactive glass and poly-L-lactide[J]. Transactions of Nonferrous Metals Society of China, 2007, 17(2): 394-399.
[12] LI Xiao-ming, FENG Qing-ling, CUI Fu-zhai, et al. In vitro degradation of porous nano-hydroxyapatite/collagen/PLLA scaffold reinforced by chitin fibres[J]. Materials Science and Engineering: C, 2006, 26(4): 716-720.
[13] 廖素三, 崔福斋, 张 伟. 组织工程中胶原基纳米骨复合材料的研制[J]. 中国医学科学院学报, 2003, 25(1): 36-38.
LIAO Su-san, CUI Fu-zhai, ZHANG Wei. Mineralized collagen based composite for bone tissue engineering[J]. Acta Aademiae Medicine Sinicae, 2003, 25(1): 36-38.
[14] Yasuda T, Tchetina E, Ohsawa K, et al. Peptides of type Ⅱ collagen can induce the cleavage of type Ⅱ collagen and aggrecan in articular cartilage[J]. Matrix Biology, 2006, 25(7): 419-429.
[15] 侯宇川, 王春喜, 李 娜, 等. 生物降解材料己内酯/环氧乙烷共聚物的生物相容性及体内外降解[J]. 吉林大学学报: 医学版, 2004, 30(3): 362-365.
HOU Yu-chuan, WANG Chun-xi, LI Na, et al. Biocompatibility and biodegradation of poly (caprolactone-b-ethylene oxide) in vivo and in vitro[J]. Journal of Jilin University: Medicine Edition, 2004, 30(3): 362-365.
[16] CHEN Yun, Mak A F T, WANG Min, et al. PLLA scaffolds with biomimetic apatite coating and biomimetic apatite/collagen composite coating to enhance osteoblast-like cells attachment and activity[J]. Surface and Coatings Technology, 2006, 201(3/4): 575-580.
[17] CHEN Cheng, DONG Li-song, Cheung M K. Preparation and characterization of biodegradable poly (l-lactide)/chitosan blends[J]. European Polymer Journal, 2005, 41(5): 958-966.
[18] Roudet F, Desplanques Y, Degallaix S, et al. Fatigue of glass/epoxy composite in three-point-bending with predominant shearing[J]. International Journal of Fatigue, 2002, 24(2/4): 327-337.
[19] Breitbart A S, Grande D A, Kessler R, et al. Tissue engineering bone repair of calvarial defect s using cultured periosteal cell[J]. Plastic and Reconstructive Surgery, 1998, 101(3): 567-578.
[20] 任 杰, 宋金星. 聚乳酸及其共聚物在缓释药物中的研究及应用[J]. 同济大学学报, 2003, 31(9): 1054-1058.
REN Jie, SONG Jin-xing. Research and applications on polylactide and its copolymers in drug delayed release system[J]. Journal of Tongji University, 2003, 31(9): 1054-1058.
[21] Rokkanen P U, Bostman O, Hirvensalo E, et al. Bioabsorbable fixation in orthopaedic surgery and traumatology[J]. Biomaterials, 2000, 21(24): 2607-2613.
收稿日期:2008-02-09;修回日期:2008-04-19
基金项目:国家自然科学基金资助项目(50774096;50604017)
通信作者:阮建明(1956-),男,河北霸州人,教授,博士生导师,从事生物医用高分子材料研究;电话:0731-8876644;E-mail: jianming@mail.csu.edu.cn


