紫外线诱变皮状丝孢酵母选育高产油脂菌株
李新社,陆步诗,邓孟桥,殷桃,胡墩柱
(邵阳学院 生物与化学工程系,湖南 邵阳,422000)
摘要:以皮状丝孢酵母GIM 2.68为出发菌株,利用紫外线(UV)进行诱变,以筛选高产油脂突变菌株。通过测定吸光度和致死率绘制出发菌株的生长曲线与致死曲线,根据形态学和生理生化特征观察对菌种进行初筛,根据生物量和油脂产量检测对菌种进行复筛。研究结果表明:出发菌株生长周期为36 h,培养12 h后进入对数生长期;利用25 W紫外灯,在照射距离为36 cm条件下,照射时间为50 s,可以筛选出生物量为1.047 g/(100 mL)、油脂产量为0.374 8 g/(100 mL)的突变菌株Tc3,油脂得率为35.8%,与出发菌株相比,生物量提高38.81%,油脂产量提高86.10%,油脂得率提高34.09%。
关键词:
中图分类号:Q939.97 文献标志码:A 文章编号:1672-7207(2011)03-0617-06
Breeding of high-yield oil strains of Trichosporon cutaneum with mutagenesis of UV
LI Xin-she, LU Bu-shi, DENG Meng-qiao,YIN Tao, HU Dun-zhu
(Department of Biology and Chemistry Engineering, Shaoyang University, Shaoyang 422000, China)
Abstract: The UV was applied as mutagenesis to screen mutant from Trichosporon cutaneum GIM2.68. The growth curve and death curve of the original strain were drawn by measuring the absorbance and death rate. The high-yield oil mutant was identified based on the morphological and physiological characteristics, and its contents of biomass and oil were measured to rescreen. The results indicate that the growth cycle of the original strain is 36 h and the log-phase occurs after being cultured for 12 h. The mutant Tc3 is screened out when the UV lamp is 25 W, the irradiation distance is 36 cm, and the irradiation time is 50 s. The contents of biomass and oil of the mutant reach 1.047 g/(100 mL) and 0.374 8 g/(100 mL), respectively, and the oil yield reaches 35.8%. Compared with the original strain, the contents of biomass and oil increase by 38.81% and 86.10%, respectively, and the oil yield increases by 34.09%.
Key words: Trichosporon cutaneum; mutagenesis of UV; mutant; microbial oil
能源是经济社会发展的重要动力。面对全球社会经济的迅速发展,人类对能源的需求日益增长,仅中国能源消耗每年就以超过10%的速度增长[1]。随着能源需求的日益增长,石油储量的日益减少、资源逐渐枯竭,全世界正面临着能源短缺的危机,开发替代燃料及可再生能源——生物柴油已迫在眉睫。所谓生物柴油是指以植物油、动物脂肪等可再生资源生产的可用于压燃式发动机的清洁替代燃油[2],其突出的环保性和可再生性,引起了世界各国尤其是资源贫乏国家的高度重视。目前,生物柴油多是利用动、植物脂肪及餐饮废油为原料制成,受原料成本及收集、运输的影响,经济可行性差。微生物油脂又称单细胞油脂(SCO),是酵母、霉菌、细菌和藻类等微生物在一定条件下以碳水化合物、碳氢化合物和普通油脂作为碳源,在菌体内产生的大量油脂,可以转化成生物柴油。开发微生物油脂具有发酵周期短,不受场地、季节和气候影响的特点。据文献[3]报道,微生物油脂发酵是生物柴油产业和生物经济的重要研究方向。对于微生物油脂发酵生产研究起步较早,国外主要集中在获取附加值较高的功能性油脂上[4-7],国内在20世纪60年代就有生产微生物油脂的报道。高产油脂突变菌株的选育起始于20世纪90年代,目前,研究和应用较多的主要是深黄被孢霉、斯达氏酵母、红酵母以及假丝酵母等[8-13]。利用皮状丝孢酵母生产微生物油脂的研究很少。为此,本文作者以皮状丝孢酵母(Trichosporon cutaneum)GIM 2.68为出发菌株,利用紫外线诱变,以筛选出高产油脂突变菌株,以便为发酵生产微生物油脂提供新的生产菌株。
1 材料与方法
1.1 材料、仪器与试剂
材料为:皮状丝孢酵母(Trichosporon cutaneum,GIM2.68)菌种,由广东微生物研究所菌种保藏中心提供;麦芽,由湖南省邵阳市百惠啤酒厂提供。
仪器为:紫外线分光光度计、恒温培养箱、冰箱、超净工作台、立式高压蒸汽灭菌锅、振荡式精密恒温水浴槽、离心机、显微镜、电子分析天平、紫外灯、磁力搅拌器、血球计数板等。
试剂为:蔗糖、琼脂、苏丹黑、二甲苯、沙黄,为市售化学纯商品;盐酸、氯仿、甲醇等,为市售分析纯商品。
1.2 试验方法
1.2.1 培养基配制
(1) 麦芽汁培养基(菌种活化与培养用)配制:取 1 kg大麦芽,加55~60 ℃温水4 kg左右,在55~60 ℃水浴锅中保温糖化3~4 h,至液体中加碘无淀粉反应为止。先用纱布过滤,煮沸20 min后分别用定性和定量滤纸各过滤1次,调节糖度至10?Be′(含糖量约 18 g/(100 mL)),固体培养基的琼脂添加量为1.5%~ 2.0%,分装后加棉塞并包扎好,于121 ℃高压蒸汽灭菌20 min[14]。
(2) 麸皮斜面培养基(菌种保藏用)配制:麸皮 30 g,加300 mL水,煮沸30 min,过滤,滤液加入 3 g蔗糖及适量无机盐混合液,加入2%琼脂,熔化定容至300 mL,于121 ℃高压蒸汽灭菌20 min。
1.2.2 菌种的活化和扩大培养
在无菌条件下取少量菌种接种至麦芽汁斜面培养基中,于28 ℃恒温培养2 d,获得活化菌种。将菌种活化2~3次。将已活化的斜面培养基上的菌种刮落到定量无菌水中,充分摇匀后移取一定量菌液至新鲜的麦芽汁液体培养基中,在28 ℃下恒温振荡扩大培养 2 d。
1.2.3 生长曲线的绘制
取25支20 mL试管,分别装等量(10.0 mL)同种麦芽汁液体培养基灭菌备用。用移液管向每只试管中移取经过充分摇匀的皮状丝孢酵母扩大培养液0.5 mL,放入摇床发酵培养箱中于28 ℃恒温培养。每2 h从培养箱中取出1支试管并且编号放入冰箱冷藏。待所有试管全部拿出时,在波长600 nm下用紫外分光光度计进行检测并记录吸光度。
1.2.4 生物量的检测
将定量培养液置于离心管中在转速4 500 r/min下离心10 min,除去上清液,收集下面固形物于三角瓶中干燥(干燥温度为80 ℃)至质量恒定,用电子分析天平称取干菌体质量,计算生物量。每个样品做平行试验3次。
1.2.5 油脂质量的检测
将培养液用冻融法(在-30 ℃与37 ℃反复冻融3次,再进行超声破碎) 使细胞破裂,在转速4 000 r/min下离心15 min取上清液,分别添加适量(约40 mL)盐酸水解,于室温下静置20 min,用沸水浴加热10 min,加入适量(约50 mL)氯仿与甲醇(体积比为1?1)的混合液,振荡30 min,置于1 000 mL分液漏斗中分液,取氯仿层,真空干燥除去氯仿即得油脂,称取油脂质 量[15],并计算油脂得率η。每个样品做平行试验3次。
η=[m(粗油脂)/m(干菌体)]×100%
1.2.6 紫外线诱变
将皮状丝孢酵母活化种移入麦芽汁液体培养基中扩大培养,取对数生长期的细胞,用玻璃珠振荡10~15 min,使细胞充分分散,用无菌生理盐水调节菌液浓度为108个/mL。打开紫外灯(25 W)预热20 min,在直径为6 cm的无菌平皿中注入10 mL菌液,在磁力搅拌器作用下于紫外灯下(功率25 W,照射距离36 cm) 分别照射10,20,30,40,50,60,70,80,90,100,110和120 s,暗箱保藏2~3 h,在红灯下分别稀释10倍和100倍后各取0.10 mL菌液进行平板涂布,在28 ℃恒温培养2 d,统计平板上菌落个数。以未经照射的菌液为对照,计算致死率并绘制紫外线致死曲线[16]。
1.2.7 突变菌株的初筛
吸取在最佳诱变条件下的诱变菌液进行10倍稀释(10-1,10-2,10-3)后涂布平板,在28 ℃下恒温培养2 d,观察平板上菌落的形态特征。取菌涂片,用苏丹黑染色15 min,二甲苯冲洗,至无色时再用沙黄复染,水洗,吸干后镜检。在显微镜下菌丝呈红色,菌体内的脂肪颗粒呈蓝黑色[17]。选取显微镜下观察颜色较深的菌落进行复筛。
1.2.8 突变菌株的复筛
分别选取初筛含脂量较出发菌株高(颜色较深)的突变菌落适量,用无菌生理盐水调节至相同菌液浓度,分别取2 mL接种至100 mL液体培养基上,在28 ℃下摇床恒温培养2 d后,检测生物量与油脂产量。
1.2.9 菌种的保藏
选取生物量与油脂得率高的菌株移接至麦芽汁斜面培养基上,经过多次连续传代,选育性能稳定的菌株保藏于麸皮斜面培养基上。
2 结果与分析
2.1 皮状丝孢酵母生长曲线
将皮状丝孢酵母接种活化后,接种在麦芽汁中,于28 ℃恒温培养,每2 h取样,在600 nm波长下用紫外分光光度计进行紫外检测并记录吸光度。皮状丝孢酵母的生长曲线见图1。

图1 皮状丝孢酵母生长曲线
Fig.1 Growth curve of Trichosporon cutaneum
由图1可以看出:皮状丝孢酵母的1个生长周期为36 h,其中从开始培养至12 h为适应期,12~20 h为对数生长期,20~28 h为稳定生长期。稳定期后,由于细胞繁殖越来越慢,菌体自溶,死亡数越来越多,细胞进入衰亡期;培养12 h后进入对数生长期,表明该菌对环境适应性较强;衰亡期曲线较平稳,表明菌体自溶微弱,在培养过程中菌体形态较为单一。由于对数生长期的细胞为生理活性一致的活细胞,突变率高,重现性好,因此,选取培养14 h后的皮状丝孢酵母作为诱变出发菌株。
2.2 皮状丝孢酵母紫外线致死曲线
将对数生长期的出发菌株在UV下照射不同时间,通过平板活菌计数法得出照射后活细胞含量,计算致死率。皮状丝孢酵母的紫外线致死曲线见图2。
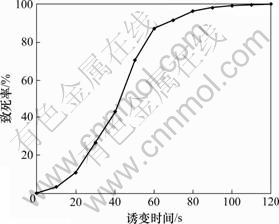
图2 皮状丝孢酵母的紫外线致死曲线
Fig.2 UV death curve of Trichosporon cutaneum
由图2可以看出:照射时间在20 s以内时,紫外线诱变对皮状丝孢酵母影响不大;而大于60 s时,菌体死亡率为90%以上。由于正突变多发生在致死率为70%~80%,因此,选用紫外线照射50 s后,菌体的死亡率为70%,作为最佳处理剂量进行诱变。
2.3 突变菌株的筛选
2.3.1 突变菌株的初筛
将紫外线照射50 s后的皮状丝孢酵母菌液在麦芽汁平板上进行涂布,在28 ℃下恒温培养2 d,观察平板上菌落的形态特征并对平板上长出的所有菌落取菌涂片,用苏丹黑染色后在显微镜下进行镜检,将苏丹黑染色较深的10个涂片分别用Tc1,Tc2,Tc3,…,Tc10标记,其显微镜检像见图3。
由图3可以看出:选出的10个菌株苏丹黑染色颜色明显较出发菌株的深,表明这10个菌株细胞的脂肪含量高于出发菌株含量。在10个苏丹黑染色颜色较深的菌株中,相对较深的是Tc1,Tc3,Tc5,Tc6和Tc10菌株,因此,选取这5个菌株进行复筛。
2.3.2 突变菌株的复筛
将初筛获得的5个油脂含量较高的菌株接种于麦
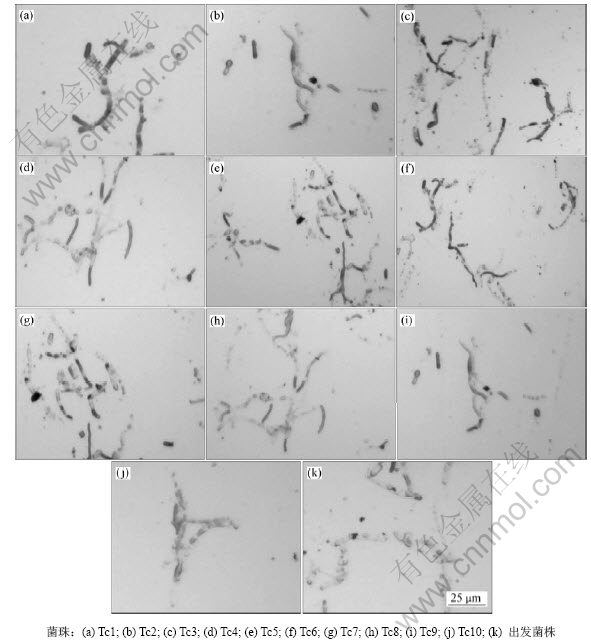
图3 苏丹黑染色镜检像
Fig.3 Microscope images with Sudan black staining
芽汁培养基中,在28 ℃下恒温摇床培养18 h后,离心洗涤3次。将菌细胞用无菌生理盐水调节至相同菌浓度(约1×108~2×108个细胞/mL)的菌悬液,取2 mL接种至100 mL麦芽汁液体培养基中,在28 ℃下恒温摇床培养2 d后,测定生物量、油脂产量,计算油脂得率,结果见表1。
由表1可知:Tc3菌株油脂的产量最高,为0.374 8 g/(100 mL);Tc1菌株油脂的产量次之,为0.261 9 g/(100 mL);Tc3菌株的生物量为1.047 0 g/(100 mL),
表1 突变菌株生物量与油脂产量检测结果
Table 1 Test results of mutant biomass and oil production

Tc1菌株的生物量为0.854 1 g/(100 mL);Tc3菌株油脂得率为35.8%,Tc1菌株油脂得率为30.6%。研究结果显示:生物量、油脂产量与油脂得率之间呈现一定的正相关性,表明细胞内油脂是在菌细胞生长过程中积累的。细胞生长速度越快,单位时间内细胞数量越多,生物量越大,则积累油脂越多。对于发酵生产,细胞生长速度越快,生产周期越短,越有利于提高生产效率,降低产品成本。因此,确定Tc3菌株为高产油脂突变菌株。
2.4 Tc3菌株与出发菌株比较
将Tc3菌株与出发菌株以相同的接种量接种到麦芽汁培养基中,在28 ℃下恒温摇床培养2 d后,检测生物量与油脂产量,结果见表2。
表2 Tc3菌株和出发菌株的生物量与油脂产量检测结果
Table 2 Test results of biomass and oil production of Tc3 strain and original strain

由表2可知:与出发菌株相比,Tc3菌株生物量提高38.81%,油脂产量提高86.10%,油脂得率提高34.09%。
2.5 Tc3菌株的传代与保藏
2.5.1 Tc3菌株的传代
将筛选到的Tc3菌株接种到麦芽汁斜面培养基上,于28 ℃下恒温培养2 d(共活化3次),移接至麦芽汁液体培养基中(三角瓶),于28 ℃下恒温振荡培养2 d后测试生物量与产脂性能,结果见表3。
表3 Tc3菌株生物量与油脂产量检测结果
Table 3 Test results of biomass and oil production of Tc3 strain

由表3可知:经多次传代后,Tc3菌株的生物量为1.046 9 g/(100 mL),油脂产量为0.372 5 g/(100 mL),油脂得率为35.6%,与传代前相比,生物量与产脂性能基本稳定。结果表明:利用诱变获得的高产油脂突变菌株作为油脂发酵生产用菌株,具有一定的应用性。如果对该突变株的培养基配方进行研究并进一步在发酵罐水平上对油脂的发酵条件进行优化,研究最适发酵动力学条件(温度、时间、pH、溶氧量、搅拌速度、接种量、培养基),油脂产量有望进一步提高。
2.5.2 突变菌株的保藏
将经过多次传代后生物量与产脂性能稳定的突变菌株移接到麸皮斜面培养基上,在28 ℃下恒温培养 2 d后,置于温度为4 ℃的冰箱中保藏。
3 结论
(1) 皮状丝孢酵母的生长周期为36 h,从开始培养至12 h为适应期,培养12~20 h为对数生长期,培养20~28 h为稳定生长期。
(2) 利用25 W紫外灯,在照射距离为36 cm条件下,照射50 s,可以筛选到生物量为1.047 g/(100 mL),油脂产量为0.374 8 g/(100 mL),油脂得率为35.8%的突变菌株Tc3。与出发菌株相比,生物量提高了38.81%,油脂产量提高了86.10%,油脂得率提高了34.09%。结果表明:诱变筛选方法是有效的,利用突变菌株生产微生物油脂具有一定的可行性。
参考文献:
[1] 王风芹, 王艳颖, 谢慧, 等. 我国生物柴油原料来源的多样性探讨[J]. 氨基酸和生物资源, 2008, 30(1): 4-9.
WANG Feng-qin, WANG Yan-ying, XIE Hui, et al. Discussion on raw material diversity of biodiesel oil production in China[J]. Amino Acids & Biotic Resources, 2008, 30(1): 4-9.
[2] 田树新. 生物柴油的研究进展与发展现状[J]. 中国林副特产, 2007, 86(1): 84-86.
TIAN Shu-xin. Current situation and development trend of the research of biodiesel[J]. Forest By-Product and Speciality in China, 2007, 86(1): 84-86.
[3] 周良虹, 黄亚晶. 国外生物柴油产业与应用状况[J]. 可再生能源, 2005, 122(4): 62-67.
ZHOU Liang-hong, HUANG Ya-jing. Status of industry and utilization in overseas countries[J]. Renewable Energy, 2005, 122(4): 62-67.
[4] 薛飞燕, 张栩, 谭天伟. 微生物油脂的研究进展及展望[J]. 生物加工过程, 2005, 3(1): 23-27.
XUE Fei-yan, ZHANG Xu, TAN Tian-wei. Research advance and prospect in microbial oils[J]. Chinese Journal of Bioprocess Engineering, 2005, 3(1): 23-27.
[5] 薛照辉, 吴谋成. 微生物油脂进展[J]. 山西食品工业, 2002(2): 10-11.
XUE Zhao-hui, WU Mou-cheng. Research advance in microbial oils[J]. Shanxi Food Industry, 2002(2): 10-11.
[6] 郑建仙, 耿立萍. 功能性食品基料-γ-亚麻酸[J]. 食品与发酵工业, 1996(1): 49-54.
ZHENG Jian-xian, GENG Li-ping. A functional food material- γ-linolenic acid[J]. Food and Fermentation Industries, 1996(1): 49-54.
[7] 墨玉欣, 刘宏娟, 张建安, 等. 微生物发酵制备生物柴油油脂原料工艺条件的研究[J]. 现代化工, 2006, 26(增刊2): 279-282.
MO Yu-xin, LIU Hong-juan, ZHANG Jian-an, et al. Study on operation conditions in production of lipid by fermentation as raw material for biodiesel[J]. Modern Chemical Industry, 2006, 26(S2): 279-282.
[8] 张峻, 刑来君, 王红梅. γ-亚麻酸高产菌株的选育及发酵产物的分离提取[J]. 微生物学通报, 1993, 20(3): 140-143.
ZHANG Jun, XING Lai-jun, WANG Hong-mei. Breeding of a high-γ-linolenic acid yield producing strain and the extraction of fermentation product[J]. Microbiology, 1993, 20(3): 140-143.
[9] 黄建忠, 施巧琴, 周晓兰, 等. 深黄被孢霉高产脂变异株的选育及其发酵的研究[J]. 微生物学通报, 1998, 25(4): 187-189.
HUANG Jian-zhong, SHI Qiao-qin, ZHOU Xiao-lan, et al. Studies on the breeding of mortierella isabellina mutant high producing lipid and its fermentation condition[J]. Microbiology, 1998, 25(4): 187-189.
[10] 曲威, 刘波, 吕建州, 等. 高产油脂斯达氏酵母菌株的选育及摇瓶发酵条件的初步研究[J]. 辽宁师范大学学报: 自然科学版, 2006, 29(1): 88-92.
QU Wei, LIU Bo, LU Jian-zhou, et al. Study on the culture and fermentation conditions of the high lipid lipomyces starkeyi[J]. Journal of Liaoning Normal University: Natural Science Edition, 2006, 29(1): 88-92.
[11] 刘玲, 金雨. 红酵母产油脂诱变育种及发酵条件的研究[J]. 粮食与食品工业, 2005, 12(6): 17-21.
LIU Ling, JIN Yu. Study on breeding rhodotorula grutinis by mutagenesis to produce lipid and its fermentation condition[J]. Cereal and Food Industry, 2005, 12(6): 17-21.
[12] 陈睿. 油脂酵母的选育及发酵产物的研究[D]. 桂林: 广西师范大学生命科学学院, 2007: 31.
CHEN Rui. Breeding of lipid yeast and study on fermentation products[D]. Guiling: Guangxi Normal University. College of Life Science, 2007: 31.
[13] 于长青, 李丽娜. 紫外线诱变深黄被孢霉选育花生四烯酸高产菌株[J]. 微生物学通报, 2009, 36(6): 853-857.
YU Chang-qing, LI Li-na. Breeding of arachidonic acid producting strain with mortierella sabellina by ultraviolet mutation[J]. Microbiology, 2009, 36(6): 853-857.
[14] 黄秀梨, 夏立秋. 微生物学实验指导[M]. 北京: 高等教育出版社, 1996: 36-39.
HUANG Xiu-li, XIA Li-qiu. Microbiology experimental guide[M]. Beijing: Higher Education Press, 1996: 36-39.
[15] 冯冲. 高纯度生物柴油原料的微生物转化技术研究[D]. 郑州: 河南农业大学生命科学学院, 2007: 14.
FENG Chong. Studies micro-technich transform technology the raw material high-purity biodiesel oil[D]. Zhengzhou: Henan Agricultural University. College of Life Science, 2007: 14.
[16] 赵丰丽, 黄翠, 陈睿. 复合诱变对酵母产脂的影响及检测方法的研究[J]. 中国油脂, 2007, 32(7): 34-37.
ZHAO Feng-li, HUANG Cui, CHEN Rui. Effect of compound mutation on the oil production by yeast and its detection[J]. China Oils and Fats, 2007, 32(7): 34-37.
[17] 方心芳. 应用微生物学实验法[M]. 北京: 中国轻工业出版社, 1993: 22-23.
FANG Xin-fang. Experiment method applied microbiology[M]. Beijing: China Light Industry Press, 1993: 22-23.
收稿日期:2010-12-19;修回日期:2011-01-10
基金项目:湖南省教育厅重点资助科研项目(10A110);湖南省科技厅资助科研项目(2010JT4055)
通信作者:李新社(1965-),女,湖南邵阳人,副教授,从事应用微生物研究;电话:0739-5432796;E-mail: lixin651002@sohu.com


