乳浊液和均匀沉淀结合法制备球形纳米ZrO2(Y2O3)粉末
常 鹰, 李溪滨, 孟振强, 赵福安
(中南大学 粉末冶金国家重点实验室, 长沙 410083)
摘 要:
采用二甲苯为油相, span-80为表面活性剂, Zr(NO3)4(3Y)的水溶液为水相的W/O 乳浊液和草酸二甲酯均匀沉淀结合法制备四方相ZrO2(3Y)纳米粉。 用热重-差热法、 X射线衍射仪、 透射电镜、 比表面积分析等手段对粉末及其前驱体进行分析和表征。 结果表明: 采用乳浊液与均匀沉淀结合法所制得的ZrO2纳米粉具有产率高、 球形和分散性好等特点。 在制备过程中, 锆盐溶液的浓度、 水浴反应温度和草酸二甲酯的含量对产物的平均粒径具有规律性的影响。
关键词: 纳米氧化锆; 乳浊液; 均匀沉淀法; 球形 中图分类号: TQ174.1
文献标识码: A
Preparation of ZrO2(Y2O3) spherical nanometer powders via coupling route of water-oil emulsion with homogenous precipitation
CHANG Ying, LI Xi-bin, MENG Zhen-qiang, ZHAO Fu-an
(State Key Laboratory of Powder Metallurgy, Central South University,Changsha 410083, China)
Abstract: Tetragonal phase ZrO2 nano-powders containing 3%Y2O3 was prepared via the coupling route of water-oil emulsion with methyl oxalate homogenous precipitation, in which xylol was used as the oil phase, span-80 as the surfactant, and an aqueous solution containing zirconium as the water phase. The ZrO2 powders and the precursor powders were analyzed and characterized by TGA-DTA, XRD, TEM, BET. The experimental results indicate that ZrO2 nano-powders prepared via the coupling route of W/O emulsion with homogenous precipitation possess some characteristics, such as larger productivity, spherical shape and excellent dispersing. It is found that the concentration of zirconium, the reaction temperature and the content of methyl oxalate have regular effect on the average size of products.
Key words: nanostructured zirconia; emulsion; homogenous precipitation method; spherical
因为ZrO2拥有许多特殊的性能, 例如低的热导率、 高的机械强度、 高的破碎强度以及相对高的热膨胀系数, 它广泛应用于许多具有先进结构的陶瓷, 耐高温陶瓷及电子器件中。 众所周知, 粉末性能对最终陶瓷产品的制作及性能具有很大的影响。 要获得低的烧结温度、 高致密性和一致的微观结构, 形成陶瓷的粉末必须由球形和窄的颗粒尺寸分布的微小颗粒组成, 而纳米颗粒能进一步增强陶瓷的低温烧结性能并使陶瓷具有更小的残余孔隙和颗粒尺寸。 因此, 许多学者将制备ZrO2纳米颗粒作为研究重点。 近年来, 由于乳液特殊的结构, 可将金属盐溶解在被油相包围的带表面活性剂的水核中, 从而在水核中发生化学反应所产生的微粒呈球形、 粒径小, 且大小均匀, 这刚好满足制备陶瓷原料的要求, 故目前有不少关于从微乳液中制备ZrO2纳米粉末的报道[1-4]。 然而, 在已报道的路线中, 大部分需要将含有待沉淀离子的微乳液与含有沉淀剂的另一种微乳液, 或一般溶液、 固体甚至气体进行混合。 混合过程难免产生一定的浓度梯度, 使微乳液的水核处于不同的微观环境中, 造成水核的大小、 水核本身及产物粒子的稳定性等发生不同程度的变化, 致使微乳液不同区域沉淀反应进程的不同步, 从而使合成的纳米粒子粒径分布变宽。 同时, 微乳液中作为反应产物而存在的水相含量往往相对较少, 且使用的有机溶剂价格偏高, 这样使得纳米粉末的生产成本过高。 然而, 作为合成纳米粉末的另一种方法——均匀沉淀法[5-8], 它是利用某一化学反应使溶液中的构晶离子由溶液中缓慢地、 均匀地释放出来, 所加入的沉淀剂并不直接与被沉淀组分发生反应, 而是通过化学反应让沉淀剂在整个溶液中均匀地、 缓慢地析出, 让沉淀物均匀生成[9]。 由于均匀沉淀法在反应过程中“就地”均匀的生成沉淀剂, 有效降低了反应物的浓度梯度, 对纳米粒子粒径分布有所控制, 故目前也有不少关于用均匀沉淀法制备纳米粉末的报道[10-14]。 但均匀沉淀法的整个沉淀反应发生在水溶液中, 难以控制颗粒的长大和团聚, 且颗粒的形状也不易控制。
为了克服以上两种制备方法的劣势并形成优势互补, 进而达到降低成本的目的, 本研究采用价格低廉的二甲苯为油相, 主要成分为山梨醇的部分酯化化合物span-80为表面活性剂, 水相含量较高的乳浊液系统, 将草酸二甲酯、 Zr(NO3)4和Y(NO3)3溶入水相中, 采用乳浊液和均匀沉淀结合法制备了具备良好分散性和较窄粒度分布的纳米ZrO2(Y2O3)粉末。
1 实验
1.1 实验步骤
将纯度大于99%的Zr(NO3)4和Y(NO3)3结晶体溶解于去离子水中, 配成0.1~1.0mol/L浓度的溶液, 按Y2O3含量为3%(摩尔分数)的配比分别量取两种溶液并配成混合溶液, 将该混合溶液分别加入不同量的草酸二甲酯, 将这种含草酸二甲酯的混合液分别逐渐加入到含表面活性剂的二甲苯溶液中, 在添加过程中, 用磁力搅拌机不停搅拌, 并经超声处理形成乳浊液。 将该乳浊液在50℃的水浴中反应3h后形成白色的凝胶, 随后将凝胶放入蒸馏烧瓶中进行共沸蒸馏处理, 经共沸蒸馏处理后的凝胶进行过滤的同时加入无水酒精清洗, 以尽可能的滤去剩余的二甲苯及表面活性剂。 滤干后的凝胶于真空中80℃干燥, 再在600℃下锻烧2h形成白色的ZrO2(Y2O3)粉末。 作为对比, 将由乳浊液所得的凝胶经真空干燥后分别在400、 450、 500、 550、 600、 650、 700和800℃下锻烧1h形成不同的ZrO2(Y2O3)粉末。
1.2 产物的测试和表征
用TGD-7000RH型热分析仪分析了洗涤干燥后的ZrO2前驱体的TG-DTA曲线, 加热温度范围为室温到750℃, 加热速率为10℃/min, 以确定前驱体的锻烧温度。 用Max2500VB+型X射线衍射仪测定烧结后粉末的相结构, 其实验测试条件为: 采用Cu靶Kα辐射, 波长为0.154056nm, 工作电流300mA, 工作电压40kV, 扫描范围为10°~90°, 扫描速度为4(°)/min。 用monosorb仪采用N2吸附单点法测定粉末的比表面积, 其误差约为2%, 并计算当量球径。 利用TecnaiG220型TEM观测粉末的形貌和尺寸。
2 结果与讨论
2.1 乳浊液与均匀沉淀结合的原理
用均匀沉淀法合成草酸锆时, 需要先将草酸二甲酯和硝酸锆在室温下溶解于水, 制成混合水溶液。 由于草酸二甲酯水解的诱导期在室温下较长, 生成的草酸浓度很低, 因此可以使草酸二甲酯和硝酸锆充分混合, 而不致有草酸锆沉淀产生。 当水溶液被加热到50℃时, 草酸二甲酯水解的诱导期大为缩短, 草酸以及草酸电离产生的草酸根离子在溶液中均匀地生成, 从根本上消除了作为沉淀剂的草酸根离子的浓度梯度。 当溶液的过饱和度达到一定程度时, 草酸锆晶粒就开始同步均匀地沉淀出来, 因此可望控制草酸锆粒子的粒径分布。 但均匀沉淀法由于难以限制晶粒的生长程度和团聚作用, 所以该方法不易获得粒径较小的草酸锆。
通过在反应液中加入span-80和二甲苯, 使体系首先转变为油包水型乳浊液, 该乳浊液的水核将作为草酸二甲酯和硝酸锆均匀沉淀的微反应器。 在乳浊液水核内, 虽然生成的草酸锆晶粒也有生长和团聚过程, 但当草酸锆颗粒长大到水核界面时, 表面活性剂就包裹在其表面起稳定作用, 阻止其进一步长大, 从而使得粒子粒径受到一定的控制; 另一方面, 各个水核处于相似的微观环境中, 包含着同样的溶液, 草酸二甲酯的水解及草酸锆的沉淀反应也同步进行, 因此水核的尺寸, 水核本身以及其中粒子的稳定性等变化较小, 使得最终合成的粒子粒径分布较窄。 由此可见, 乳浊液与均匀沉淀结合法可以合成出具有较小粒径和较窄粒径分布的粒子。 应该指出的是, 在实际操作中, 反应液相会存在温度梯度, 影响水核中水解和沉淀反应的同步性, 在一定程度上会使粒径分布变宽。
2.2 干凝胶前驱体及锻烧后的特征分析
图1所示为ZrO2前驱体的DTA和TGA曲线。 从DTA曲线可以看出, 它主要由3个峰组成: 第一个是吸热峰, 后两个是放热峰。 吸热峰出现于120℃附近, 它对应于残余水的消除, 在这个阶段, TGA曲线表现出显著的质量损失也说明了结合水在相对较低的温度(80℃)干燥时并没有被除去。 两个放热峰分别出现在350℃和520℃附近, 前者对应于残余有机物的氧化分解放热, 后者对应于ZrO2前驱体从最初的无定形向晶态转变的放热过程[15], 这可以由图2中500℃时的衍射谱开始出现衍射峰证明。 同时, TGA曲线在600℃左右趋于水平, 这表明在600℃时ZrO2前驱体质量损失过程
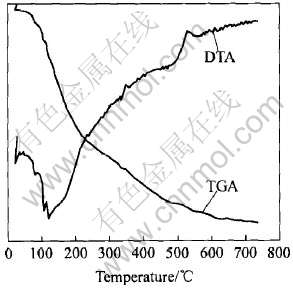
图1 大气中加热速率为10℃/min时ZrO2前驱体的DTA/TGA曲线
Fig.1 DTA/TGA curves of ZrO2 precursor in static air atmosphere under heating rate of 10℃/min

图2 不同烧结温度下粉末的X射线衍射谱
Fig.2 XRD patterns of powders under different calcination temperatures
进行完毕, 此时所得的粉末是完全的ZrO2粉末。 另外, 从图2也可以看出, 在400℃时X射线衍射谱中没有衍射峰出现, 此时粉末还是无定形态, 而在500℃时有一些小的衍射峰出现, 表明一些晶体相开始形成, 在600℃时, 尖锐衍射峰的形成表明氧化物前驱体的晶化过程已经完成且获得了完全的四方相, 从而根据该曲线确定前驱体的锻烧温度为600℃是合理的。 随着锻烧温度的上升, 衍射峰变得更窄, 但晶相仍保持不变, 这表明粉末颗粒在逐渐的长大。
3 反应条件对样品粒度的影响
3.1 锆盐溶液浓度对粉体粒度的影响
图3所示为保持反应温度为50℃, 草酸二甲酯与硝酸锆摩尔比为2∶1的条件下反应3h, 在实验考察的浓度范围内, ZrO2粉末粒径随反应物Zr(NO3)4浓度的变化。 其粒径的大小是根据BET法测试的结果, 分别为: 23.95、 23.1、 22.83、 21.82、 21.11、 20.45、 20.24、 20.04、 19.64、 19.30m2/g, 利用公式As=3/rρ(式中 As为比表面积; r为理想球形晶粒的半径; ρ为晶粒的理论密度, 取6.111g/cm2[16])计算出的粉末的平均晶粒。 从图中可以看出, 随Zr(NO3)4浓度的降低, 产物的粒径逐渐减小。 其原因可能是: 在反应物浓度较小的溶液中形成晶核之后, 晶核生长的速率较慢, 在同样时间内形成的晶粒就比较小,

图3 不同Zr(NO3)4浓度下的颗粒尺寸
Fig.3 Particle sizes under various concentrations of Zr(NO3)4
随着溶液浓度的增加, 晶核生长的速率较快, 凝胶粒子间生成团聚体的可能性增大, 凝胶的均匀性变差, 最终得到产物的粒径较大。 但由于本制备方法引入二甲苯为油相, 并加入了表面活性剂span-80, 从而阻碍了凝胶粒子间的团聚, 这样使得锆盐溶液浓度对粉体粒度的影响并不明显。
3.2 水浴反应温度对粉体粒径的影响
实验过程中, 控制Zr(NO3)4浓度为0.4mol/L, 保持草酸二甲酯与硝酸锆摩尔比为2∶1的条件下反应3h, 反应分别在25~70℃进行, 图4所示为产品的粒径(粒径的大小是根据BET法测试的结果计算得出, 分别为: 17.53、 18.35、 18.88、 20.24、 20.89、 21.82、 20.45、 19.83、 19.25、 18.52m2/g)随反应温度的变化。 结果表明, 在实验考察的温度范围内, 随反应温度的升高, 产物粒径先减小后增大。 其可能的原因是: 温度较高的条件下, 可加速沉降—溶解这一动态平衡, 使Zr(C2O4)2粒子分散得更加均匀。 另外, 随反应温度的升高, 生成晶核的速度也加快, 产生晶核的数目较多, 形成的晶粒粒径较小, 但是反应温度过高时, 会因反应速度过快, 产物的均匀性难以控制, 并且使乳浊液不稳定, 从而造成产物的粒径较大。 可见, 反应温度选择50℃较适宜。

图4 不同反应温度下的颗粒尺寸
Fig.4 Particle sizes at various reaction temperatures
3.3 草酸二甲酯含量对产物粒径的影响
正交实验表明, 当Zr(NO3)4 浓度为0.4mol/L时, 草酸二甲酯与Zr(NO3)4的摩尔比越大, 形成的沉淀粒径越小。 理论上, 反应体系中草酸二甲酯与硝酸锆的摩尔比为1∶1 时, 反应正好完全, 但考虑到草酸二甲酯的水解反应不可能完全, 草酸二甲酯需过量。 图5所示为控制Zr(NO3)4浓度为0.4mol/L、 保持反应温度为50℃反应3h的情况下, 草酸二甲酯与硝酸锆的摩尔比分别为1∶1~2.5∶1 所得氧化锆粉末的TEM像的对比。 从图5 可以看出, 草酸二甲酯与硝酸锆的摩尔比值越大, 产物的粒径越小。 这是因为草酸二甲酯的量增大, 相应溶液中C2O2-4的浓度就增大, 过饱和度增加, 有利于形成粒径小的沉淀。 其涉及到的主要反应机理如下:

另外, 从图中可以看出, 粉末呈球形, 且分散性很好, 颗粒大小在40~80nm之间, 这说明采用乳浊液与均匀沉淀结合法制备纳米粉末能很好地控制粉末的形态, 该法与共沸蒸馏工艺相结合能有效地阻止粉末的团聚。 同时, 对这4种氧化锆粉末采用BET法分别进行了测试, 按图5(a)~(d)的顺序分别为: 24.36、 21.82、 16.36、 13.64m2/g, 其对应的颗粒粒径分别为: 40.30、 45、 60、 72nm, 与TEM像中的颗粒大小对应得较好, 这也说明了式(1)计算粒度的正确性。

图5 不同C2O4(CH3)2与Zr(NO3)4摩尔比条件下氧化锆粉末的TEM像
Fig.5 TEM micrographs of zirconia powders prepared under different ratios of C2O4(CH3)2 to Zr(NO3)4
4 结论
1) 采用以二甲苯为油相, span-80为表面活性剂, Zr(NO3)4(3Y)的水溶液为水相的W/O乳浊液和草酸二甲酯通过均匀沉淀结合法制备了四方相ZrO2(3Y)纳米粉。 该方法具有产率高, 产物呈球形和分散性好等特点。
2) 在制备过程中, 锆盐溶液的浓度、 水浴反应温度和草酸二甲酯的含量对产物的平均粒径具有一定的影响。 其中, 锆盐溶液的浓度对粉体粒度的影响不大; 水浴反应温度对粉体粒径的影响随反应温度的升高, 产物粒径先减小后增大; 草酸二甲酯的含量对产物粒径的影响是随草酸二甲酯的量增大, 产物粒径慢慢减小。
REFERENCES
[1]Lee M H, Tai C Y, Lu C H. Synthesis of spherical zirconia by precipitation between two water/ oil emulsions[J]. Journal of the European Ceramic Society, 1999, 19: 2593-2603.
[2]Tai C Y, Lee M H, Wu Y C. Control of zirconia particle size by using two-emulsion precipitation technique[J]. Chemical Engineering Science, 2001, 56: 2389-2398.
[3]Joo J, Yu T, Kim Y Y, et al. Multigran scale synthesis and characterization of monodisperse tetragonal zirconia noancrystal[J]. Chem Soc, 2003, 125: 6553-6557.
[4]Blandin A F, Mangin D, Rivoire A, et al. Agglomeration in suspension of salicylic acid fine particles: influence of some process parameters on kinetics and agglomerate final size[J]. Powder Technology, 2003, 130: 316- 323.
[5]Ocana M, Morales M P, Serna C J. Homogeneous precipitation of uniform α-Fe2O3 particles from iron solutions in the presence of urea[J]. Journal of Colloid and Interface Sciece, 1999, 212: 317-323.
[6]Kato S, Unuma H, Ota T. Homogeneous precipitation of hydrous tin oxide powders at room temperature using enzymatically inducted gluconic acid as a precipitant[J]. J Am Cream Soc, 2000, 83(4): 986-988.
[7]Rodney M, Andrew E. Nanocrytallization and phase transformation in monodispersed ultrafine zirconia particles from various homogeneous precipitation methods[J]. J Am Cream Soc, 1999, 82(9): 2313-2320.
[8]Emre E, Taspinar E. Preparation of lead zirconate by homogeneous precipitation and calcinations[J]. J Am Cream Soc, 1996, 82(10): 2714-2716.
[9]Bailar J C. Comprehensive Inorganic Chemistry[M]. Oxford: Pergamon Press, 1973. 607-618.
[10]Brune A, Lajavardi M, Fisler D, et al. The electrical conductivity of yttria-stabilized zirconia prepared by precipitation from inorganic aqueous solutions[J]. Solid State Ionics, 1998, 106: 89-101.
[11]Song K C, Kang Y. Preparation of high surface area tin oxide powders by a homogeneous precipitation method[J]. Materials Letters, 2000, 42: 283-289.
[12]Satoshi S, Contreras C, Juarez H, et al. Homogeneous precipitation and thermal phase transformation of mullite ceramic precursor[J]. International Journal of Inorganic Materials, 2001, 3: 625-632.
[13]Kima Y, Kima D, Leeb C S. Synthesis and characterization of CoFe2O4 magnetic nanoparticles prepared by temperature-controlled co-precipitation method[J]. Physic B, 2003, 337: 42-51.
[14]LI Guo-ran, LI Wei, ZHANG Ming-hui. Characterization and catalytic application of homogeneous nano-composite oxides ZrO2-Al2O3[J]. Catalysis Today, 2004, 93-95: 595-601.
[15]Torralvo M J, Alario M A. Crystallization behavior of zirconium oxide gels[J]. Catal, 1984, 86: 473-476.
[16]QIU Hai-bo, GAO Lian, Qiao H C, et al. Nanocrystalline zirconia powder processing through innovative wet-chemical methods[J]. Nanostructured Materials, 1995, 6: 373-376.
收稿日期: 2005-05-12; 修订日期: 2005-08-15
作者简介: 常 鹰(1976-), 男, 博士研究生
通讯作者: 常 鹰, 电话: 0731-2656761; E-mail: wlcy@mail.csu.edu.cn


