DOI: 10.11817/j.issn.1672-7207.2015.12.003
银氨体系抗坏血酸还原制备超细球形银粉
田庆华,邓多,焦翠燕,郭学益
(中南大学 冶金与环境学院,湖南 长沙,410083)
摘 要:
抗坏血酸为还原剂制备超细球形银粉。考察加料速度、溶液初始pH、反应温度、AgNO3溶液浓度等工艺参数对银粉形貌、粒径的影响,对银粉进行扫描电镜、X线衍射和ζ电位分析等表征,研究银粉的分散和生长机理。研究结果表明:采用快速加料法,在硝酸银溶液浓度不大于0.5 mol/L,反应温度低于60 ℃,银氨溶液初始pH为12.0,不使用分散剂的条件下,可制备出分散性好,形貌规则的球形银粉。银粒子在该体系中具有自分散作用,银粉的生长符合二段生长模型。
关键词:
中图分类号:TF123.7+2 文献标志码:A 文章编号:1672-7207(2015)12-4404-07
Preparation of ultra-fine spherical silver powder with reduction of tollens reagent by ascorbic acid
TIAN Qinhua, DENG Duo, JIAO Cuiyan, GUO Xueyi
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: The dispersive ultra-fine spherical silver powder was prepared by chemical reduction with tollens reagent as feed solution and ascorbic acid as reductant. The effects of feeding speed, initial pH value, reaction temperature and concentration of AgNO3 on the morphology and particle size of silver powder were investigated. The scanning electron microscope, the X-ray diffraction and the ζ potential analyzer were used for the characterization of the product. Besides, the dispersion and growth mechanism of silver powder was discussed. The results show that the optimal dispersive spherical silver powder is prepared under the condition that the concentration of AgNO3 solution is no more than 0.5 mol/L, the reaction temperature is lower than 60 ℃, and the initial pH value is 12.0 by the rapid addition of ascorbic acid without using any dispersant. The silver particles have self-dispersive function, while the growth of silver powder follows the two-stage growth model.
Key words: ultra-fine spherical silver powder; feeding speed; dispersion mechanism; growth mechanism
银粉由于其优异的导电、导热性和化学稳定性而在电子工业中得到了广泛的应用。超细银粉作为电子浆料的重要功能相,其需求与日俱增。电子浆料用银粉要求为微米级、分散性好的球形银粉,而分散性差一直是银粉生产过程中存在的重要问题。目前制备银粉的方法很多,包括喷雾热分解法[1]、等离子体蒸发冷凝法[2]、激光法[3]、沉淀转换法[4]、水热法[5]、微乳液法[6]、电化学法[7]、光诱导法[8]等,但这些方法需要特殊气氛环境或专业的设备,或能耗高,难以实现大规模生产。液相还原法[9-12]因其设备简单、操作方便、成本低、节能等优点成为目前银粉制备的主要方法。目前大部分的研究多针对纳米银粉的制备[13-16],对电子工业用微米或亚微米级的银粉研究较少,并且研究者一般通过大量使用分散剂来解决银粉制备过程中的团聚问题,但分散剂的使用不仅会增加生产成本,还会造成银粉清洗困难。本文作者以银氨为原料,以抗坏血酸为还原剂,通过选择合适的加料速度和调节银氨溶液的物化参数,在不使用分散剂的条件下制备高品质超细银粉,研究加料速度、溶液初始pH、反应温度和硝酸银溶液浓度等因素对银粉形貌和粒径的影响,确定了优化的工艺条件,并对反应体系中银粒子的生长和分散机理进行了研究。
1 实验
1.1 原料与设备
实验试剂为硝酸银(株洲冶炼集团有限责任公司)、抗坏血酸(西陇化工股份有限公司)、浓氨水(西陇化工股份有限公司)、无水乙醇(天津市恒兴化学试剂制造有限公司)、浓硝酸(长沙市岳麓精良高纯试剂厂)和去离子水(自制,电阻率为16.25 MΩ·cm)。
实验设备为DF-101S型集热式恒温加热磁力搅拌器、DZ-2BC II型真空干燥箱、Starter 3C型pH计、TDL-40B型低速台式离心机和JY3002型电子天平。
1.2 超细银粉的制备
称取适量的硝酸银,配制成一定浓度的溶液,量取50 mL溶液,用浓氨水将其配制成一定pH的银氨溶液;称取硝酸银质量0.8倍的抗坏血酸,配制成 0.23 mol/L的抗坏血酸溶液;在一定温度下,将抗坏血酸溶液加入到银氨底液中,并以120 r/min的转速恒速电动搅拌10 min,使反应充分进行。反应完全后,离心分离,用去离子水和无水乙醇分别洗涤3次,然后放入真空干燥箱恒温50 ℃干燥5~8 h得到超细银粉。
1.3 分析与测试
采用JSM-6360LV型扫描电镜(SEM)来观察超细银粉的表面形貌;对SEM图片中银粉的粒径进行统计,得到产物平均粒径、粒径分布和分布标准差;使用Rigaku-TTR Ⅲ型X线衍射仪来检测银粉的物相(Cu-Kα靶,管电压40 kV,管电流250 mA);使用马尔文Zetasizer Nano ZS型分析仪对银粉表面的ζ电位进行测试。
2 结果与讨论
2.1 加料速度的选择
在AgNO3浓度为0.3 mol/L,银氨溶液初始pH为11.0,反应温度为20 ℃的条件下,分别采用滴加 (0.42 mL/s)和快速加入(50.0 mL/s) 2种加料速度,考察加料速度对银粉制备的影响。采用不同加料速度制备所得银粉的微观形貌如图1所示。

图1 使用不同加料速度时制得银粉的SEM照片
Fig. 1 SEM images of silver powder prepared with different feeding speeds
从图1可以看出:采用滴加法制备所得银粉团聚较严重,形貌不规则;而采用快速加入法制备所得银粉分散性较好,形貌较为规则。因此,适宜采用快速加入法加料。
对快速加料制备的银粉进行XRD分析,所得结果如图2所示。从图2可以看出:制备所得银粉在38.12°,44.30°,64.44°,77.40°和81.54°处有明显的吸收峰,与标准卡片65-2871完全符合,说明所得样品为单质银。
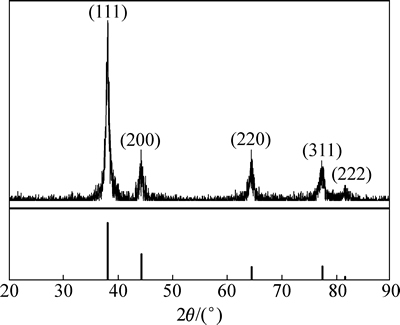
图2 快速加入法制备所得银粉XRD图谱
Fig. 2 XRD patterns of silver powder prepared by rapid addition
2.2 银氨溶液初始pH的选择
在硝酸银浓度为0.3 mol/L,反应温度为20 ℃的条件下,考察银氨溶液初始pH对银粉形貌粒径的影响。银粉平均粒径与银氨溶液初始pH的关系以及银粉的ζ电位测试结果如图3所示。从图3可以看出:随着pH的增加,银粉的粒径先减小后增大。
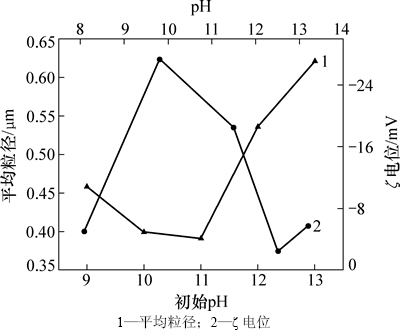
图3 银粉平均粒径和ζ电位变化
Fig. 3 Viriation of mean particle and zeta potential of silver powder
抗坏血酸还原银离子的反应为
C6H8O6+2Ag+=C6H6O6+2Ag+2H+ (1)
抗坏血酸的电极反应式为
C6H6O6+2H++2e=C6H8O6 (2)
其中,C6H6O6/C6H8O6的标准电极电势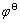 =0.08 V,根据能斯特方程可知:C6H6O6/C6H8O6电极电势与pH关系为
=0.08 V,根据能斯特方程可知:C6H6O6/C6H8O6电极电势与pH关系为
 (3)
(3)
其中:c(C6H8O6)和c(C6H6O6)为C6H8O6和C6H6O6的浓度;n=2。
当c(C6H6O6)=c(C6H8O6)=1,有
φ=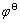 -0.059 1pH (4)
-0.059 1pH (4)
随着体系pH的升高,抗坏血酸的电极电势降低,还原性增强,反应速率上升,成核阶段生成了更多银原子,银原子过饱和度增大,加快了其成核速率。同时,氨水又可以中和抗坏血酸还原过程中生成的H+,从而促进反应(1)向右移动,因此,随着银氨溶液初始pH的升高,反应能在较短时间内生成更多晶核,银粉的粒径也就随之减小;但当银氨溶液pH继续升高,反应体系中的过量氨水会使银氨离子更加稳定,溶液中游离的银离子浓度更低,从而抑制反应(1)向右进行,使得反应速率下降,银的成核速率也下降,银粉的粒径又会随着pH的继续升高而增大。因此,银粉的粒径随着银氨溶液初始pH的升高先减小后增大。
图4所示为不同pH下制备所得银粉的SEM图,从图4可以看出:当pH为12.0时,制备的银粉分散性较好,形貌为球形。
在不同pH的0.001 mol/L 的KCl溶液中,对反应制备的银粉进行ζ电位测试,所得结果见图3。从图3可以看出:在碱性pH范围内,银粉的ζ电位在pH为9.5~10.0时达到最大负值,表明在该pH范围内银粒子间的排斥力较大,不易发生团聚。表1所示为不同初始pH银氨溶液制备银粉后的溶液终点pH。对比表1和图3可知:当银氨溶液初始pH为12.0时,反应终点pH为9.89,银粉的ζ电位达到最大负值。由此也可推断出,该pH条件下制备出的银粉分散性更好。
表1 体系终点pH变化
Table 1 Variation of terminal pH values of system

2.3 反应温度的影响
在银氨溶液初始pH为12.0的条件下考察反应温度对银粉形貌和粒径的影响。不同反应温度下制备的银粉微观形貌如图5所示。
从图5可以看出:不同反应温度下,均制备出了形貌较为规则的球形银粉。只是当反应温度上升到50和60 ℃时,银粉团聚略有加剧,但形貌并没有太大的区别。说明在本实验设计的温度范围内,温度对银粉的形貌影响不大。
图6所示为反应温度对银粉平均粒径的影响。从图6可知:随着反应温度的升高,银粉的粒径增大。说明随着反应温度的提高,银粉的生长速率相对于成核速率增长更快;同时,反应温度的提高导致粒子的布朗运动加剧,粒子间的碰撞更加频繁,使晶核长大的概率增加。因此,随着反应温度的提高,银粉的粒径增大。
2.4 硝酸银浓度的影响
在银氨溶液初始pH为12.0,反应温度为20 ℃的条件下考察AgNO3浓度对银粉形貌和粒径的影响。不同浓度AgNO3溶液所得银粉微观形貌如图7所示。
从图7可以看出:当AgNO3溶液浓度不大于0.5 mol/L时,制备所得银粉分散性较好,形貌较为规则;当硝酸银浓度过大时,银粉团聚变得严重,形貌也变得更不规则。

图4 不同初始pH制得银粉的SEM照片
Fig. 4 SEM images of silver powders prepared with different initial pH values

图5 不同反应温度制得银粉的SEM照片
Fig. 5 SEM images of silver powders with different reaction temperatures
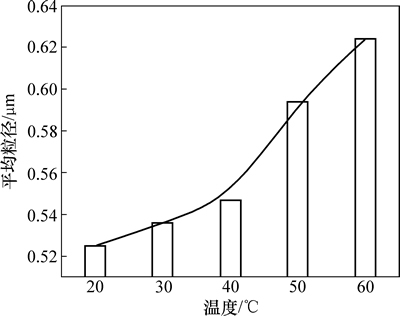
图6 反应温度对银粉平均粒径的影响
Fig. 6 Effect of reaction temperature on silver mean particle size
在银粉分散性较好的硝酸银浓度(0.1~0.5 mol/L)范围内,银粉的粒径分布如图8所示。从图8可以看出:银粉的粒径随着AgNO3浓度的增加而增大。
根据Weimarn法则[17],沉淀时新相的形成包括成核与生长2个过程,这2个过程的相对速率将决定了所得沉淀的粒子粒径,而晶核的成核速率和生长速率均与反应物的浓度有关。当AgNO3溶液浓度低(相应的银氨离子浓度也低),并且生成的银原子过饱和度大于其最低过饱和度时,成核速率大于晶核的生长速率,在单位时间内晶体成核消耗的物质的量多于晶核生长所消耗的物质的量,因此晶核的生长受到抑制;而且稀溶液的离子分散程度较高,因而被还原出来的银原子向晶核表面扩散迁移的距离也大大增加,从而也一定程度上抑制了晶核的生长,导致银粉平均粒径较小。随着AgNO3溶液浓度的增加(相应的银氨离子浓度也增加),晶核的生长速率将大于成核速率,在反应开始生成大量晶核后,随后被还原出来的银原子大部分消耗在银晶核的生长上;加之晶核的填充密度很大,导致晶核之间凝并生长的趋势增加[18],因此,随着硝酸银溶液浓度的升高,银粉的粒径增大。

图7 不同浓度的AgNO3溶液制得银粉的SEM照片
Fig. 7 SEM images of silver powders with different AgNO3 concentrations

图8 AgNO3溶液浓度对银粉粒径分布的影响
Fig. 8 Variation of silver particle size distribution with concentration of AgNO3
2.5 分散及生长机理分析
在本研究体系中,不添加分散剂的情况下,可以制备出分散性较好的超细银粉,这是因为该体系本身具有较好的分散作用。
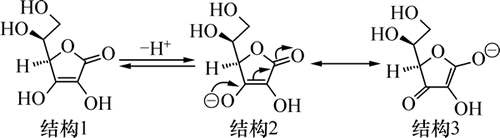
首先,本研究使用抗坏血酸作为还原剂,对抗坏血酸的结构进行研究可知,抗坏血酸具有五元环的结构,该分子处于酮的2种互变异构体(酮-烯醇)的动态平衡中,酮型结构的稳定性比烯醇式结构的差。在水溶液中,其互变异构的动态平衡如下式所示:
 (5)
(5)
抗坏血酸的结构1中,形成2个双键的3个C原子和1个O原子均为sp2杂化,2个双键形成了π,π-共轭结构。结构1电离出1个H+,形成结构2,电离出H+的羟基氧具有1对未共用电子对,该未共用电子位所占据的p轨道与双键π轨道在侧面相互交盖形成p,π-共轭体系,电子可在3个C原子和2个O原子之间迁移,形成结构3。结构2和结构3都具有带负电荷的O原子,该O原子容易受到亲电试剂的进攻,从而发生氧化还原反应。Ag+可作为亲电试剂,分别进攻抗坏血酸结构2和结构3的这2个O原子,从而发生氧化还原反应。抗坏血酸的另一个烯醇式结构的羟基也可电离出氢离子,并与Ag+反应。最终,抗坏血酸被氧化成为脱氢抗坏血酸,银离子被还原为单质银。
脱氢抗坏血酸也具有五元环的结构,五元环以及五元环上连接的碳链,使其具有一定的空间位阻。Ag+与抗坏血酸接触发生反应后,还原出来的银吸附在脱氢抗坏血酸周围,可以在一定程度上减少银粒子团聚的发生。这种抗坏血酸的自分散作用机理如图9所示。
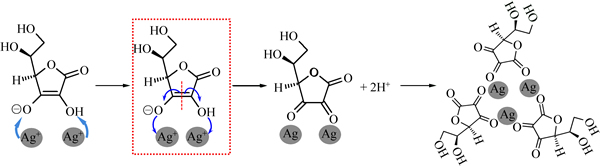
图9 抗坏血酸的自分散作用机理示意图
Fig. 9 Schematic diagram of self-dispersive function mechanism of ascorbic acid
其次,本研究采用快速加入法加入还原剂,在充分搅拌下还原剂与银氨溶液充分混合,可以使反应在整个体系中均匀发生。反应初期,反应物浓度较高,瞬间生成大量银原子,形成较大的过饱和度,从而发生爆发成核。在经历了初期的爆发成核后,反应物的浓度降低。加之体系中银氨离子的存在控制了银离子的释放速度,可以使沉淀反应的各个过程能在整个体系的各个部位同步、均匀地进行[19],因此反应速率减缓,溶质浓度降低,进入不形核、只生长的过程。这样,便实现了Lamer模型[20]的“爆发成核、缓慢生长”,使形核过程和生长过程分离,从而得到粒径均一、分散性较好的颗粒。
最后,通过对反应体系pH的调控,使得反应终点pH处于9.5~10.0之间,在该pH范围内银粉的ζ电位较高(如图3所示),粒子间的排斥力较大,可抑制团聚的发生。
因此,在不使用分散剂的条件下,利用体系的自分散作用,可以制备出分散性较好的超细银粉。
观察实验现象发现,还原剂快速加入后,溶液迅速发生反应,反应液由无色迅速变成黑色,此时体系中发生了爆发成核,生成大量晶核,并进一步生成大量的银一次颗粒;数秒过后,溶液的颜色慢慢变浅,由黑色渐渐变成黄色,说明在此过程中,银粉一次颗粒聚集生长成为较大的二次颗粒,因此溶液颜色变浅,一次颗粒最终生长成为制备所得的超细银粉。对优化条件下制备的银粉进行XRD分析,由Scherrer公式计算得到银粉的晶粒粒径约为14 nm,说明银粉为由粒径约14 nm的一次颗粒聚集生长而成。上述银粉的生长过程如图10所示,这与Park等[21]提出的“爆发成核-聚集生长”二段生长模型相符合。
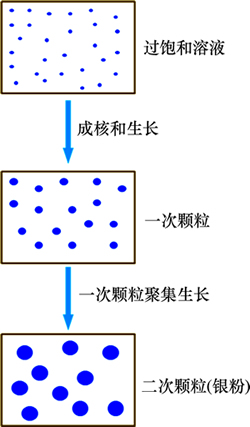
图10 银粉的二段生长过程示意图
Fig. 10 Schematic diagram of two-stage growth process
3 结论
1) 银氨体系抗坏血酸还原剂制备超细球形银粉的优化条件为:采用快速加料,AgNO3浓度不大于0.5 mol/L,反应温度低于60 ℃,银氨溶液初始pH为12.0。
2) 抗坏血酸在体系中具有还原剂和分散剂的双重作用;采用快速加入法,并采用氨水将银离子络合,可以使银粉的生长符合“爆发成核-缓慢生长”的Lamer模型;通过调节体系pH在银粉ζ电位较大的区间,增大粒子间的排斥力,可以有效减小团聚。
参考文献:
[1] 刘志宏, 刘智勇, 李启厚, 等. 喷雾热分解法制备超细银粉及其形貌控制[J]. 中国有色金属学报, 2007, 17(1): 149-155.
LIU Zhihong, LIU Zhiyong, LI Qihou, et al. Morphology control of micro-sized spherical silver powder prepared by spray pyrolysis[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(1): 149-155.
[2] 魏智强, 马军, 冯旺军, 等. 等离子体制备银纳米粉末的研 究[J]. 贵金属, 2004, 25(3): 29-32.
WEI Zhiqiang, MA Jun, FENG Wangjun, et al. The study on preparation of Ag nanopowders by plasma[J]. Precious Metals, 2004, 25(3): 29-32.
[3] Nersisyan H H, Lee J H, Son H T, et al. A new and effective chemical reduction method for preparation of nanosized silver powder and colloid dispersion[J]. Materials Research Bulletin, 2003, 38(6): 949-956.
[4] 蒋伟燕. 配位沉淀-热分解法制备纤维状银粉[D]. 长沙: 中南大学冶金科学与工程学院, 2010: 33-49.
JIANG Weiyan. Preparation of the fiber silver powder by coordination-thermal decomposition[D]. Changsha: Central South University. School of Metallurgical Science and Engineering, 2010: 33-49.
[5] 尹荔松, 阳素玉, 何鑫, 等. 球形纳米银粒子制备新方法及其表征[J]. 纳米技术与精密工程, 2010, 8(4): 295-299.
YIN Lisong, YANG Suyu, HE Xin, et al. New Preparation method and characterization of spheric silver nanoparticles[J]. 2010, 8(4): 295-299.
[6] ZHANG Jianling, HAN Buxing, LIU Minghua, et al. Ultrasonication-induced formation of silver nanofibers in reverse micelles and small-angle X-ray scattering studies[J]. Journal of Physical Chemistry B, 2003, 107(16): 3679-3683.
[7] ZHU Junjie, LIAO Xuehong, ZHAO Xiaoning, et al. Preparation of silver nanorods by electrochemical methods[J]. Materials Letters, 2001, 49(2): 91-101.
[8] Zou K, Zhang X H, Duan X F, et al. Seed-mediated synthesis of silver nanostructures and polymer/silver nanocables by UV irradiation[J]. Journal of Crystal Growth, 2004, 273(1): 285-291.
[9] LIU Zhao, QI Xueliang, Wang Hui. Synthesis and characterization of spherical and mono-disperse micro-silver powder used for silicon solar cell electronic paste[J]. Advanced Powder Technology, 2012, 23(2): 250-255.
[10] GU Sasa, WANG Wei, WANG Hui, et al. Effect of aqueous ammonia addition on the morphology and size of silver particles reduced by ascorbic acid[J]. Powder Technology, 2013, 233(2): 91-95.
[11] Li C C, Chang S J, Su F J, et al. Effects of capping agents on the dispersion of silver nanoparticles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 419: 209-215.
[12] 刘素琴, 樊新, 黄健涵, 等. 规则球形纳米银粉的制备及表 征[J]. 中南大学学报(自然科学版), 2007, 38(3): 497-501.
LIU Suqin, FAN Xin, HUANG Jianhan, et al. Preparation and characterization of uniform spherical nanometer silver powder[J]. Journals of Central South University (Science and Technology), 2007, 38(3): 497-501.
[13] Meng X K, Tang S C, Vongehr S. A review on diverse silver nanostructures[J]. Materials Science, 2010, 26(6): 487-522.
[14] Sharma P, Baek I H, Cho T, et al. Enhancement of thermal conductivity of ethylene glycol based silver nanofluids[J]. Powder Technology, 2011, 208(1): 7-19.
[15] Vidyapati V, Kheiripour Langroudi M, Sun J, et al. Experimental and computational studies of dense granular flow: Transition from quasi-static to intermediate regime in a couette shear device[J]. Powder Technology, 2012, 220(1): 7-14.
[16] Zaheer Z, Rafiuddin. Crystal growth of different morphologies (nanospheres, nanoribbons and nanoplates) of silver nanoparticles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2012, 393(1): 1-5.
[17] 黄凯, 郭学益, 张多默, 等. 超细粉末湿法制备过程中粒子粒度和形貌控制的基础理论[J]. 粉末冶金材料科学与工程, 2005, 10(6): 319-324.
HUANG Kai, GUO Xueyi, ZHANG Duomo, et al. Fundamental theories of particle size and morphology controlling for ultrafine powders in wet chemical precipitation process[J]. Materials Science and Engineering of Powder Metallurgy, 2005, 10(6): 319-324.
[18] 秦智, 张为军, 匡加才, 等. 高分散性球形银粉的制备研究[J]. 电工材料, 2010(3): 12-15.
QIN Zhi, ZHANG Weijun, KUANG Jiacai, et al. Research on finely dispersed spherical silver powder[J]. Electronic Material, 2010(3): 12-15.
[19] 黄凯, 郭学益, 张多默. 超细粉末湿法制备工艺的粒子粒度和形貌控制[J]. 粉末冶金材料科学与工程, 2005, 10(5): 268-276.
HUANG Kai, GUO Xueyi, ZHANG Duomo. Particle size and morphology control of ultrafine powders prepared by wet chemical precipitation[J]. Materials Science and Engineering of Powder Metallurgy, 2005, 10(5): 268-276.
[20] Sugimoto T. Monodispersed particles[M]. Amsterdam: Elsevier Science B V, 2001: 40-59.
[21] Park J, Privman V,  E. Model of formation of monodispersed colloids[J]. The Journal of Physical Chemistry B, 2001, 105(47): 11630-11635.
E. Model of formation of monodispersed colloids[J]. The Journal of Physical Chemistry B, 2001, 105(47): 11630-11635.
(编辑 赵俊)
收稿日期:2014-12-14;修回日期:2015-03-10
基金项目(Foundation item):国家国际科技合作专项项目(2014DFA90520);广东省产学研项目(2013A100003)(Project (2014DFA90520) supported by International S&T Cooperation Program of China; Project(2013A100003) supported by Produce-Learn-Research Program of Guangdong Province)
通信作者:郭学益,博士,教授,从事材料冶金研究;E-mail:xyguo@csu.edu.cn
摘要:以银氨为原料,抗坏血酸为还原剂制备超细球形银粉。考察加料速度、溶液初始pH、反应温度、AgNO3溶液浓度等工艺参数对银粉形貌、粒径的影响,对银粉进行扫描电镜、X线衍射和ζ电位分析等表征,研究银粉的分散和生长机理。研究结果表明:采用快速加料法,在硝酸银溶液浓度不大于0.5 mol/L,反应温度低于60 ℃,银氨溶液初始pH为12.0,不使用分散剂的条件下,可制备出分散性好,形貌规则的球形银粉。银粒子在该体系中具有自分散作用,银粉的生长符合二段生长模型。
[1] 刘志宏, 刘智勇, 李启厚, 等. 喷雾热分解法制备超细银粉及其形貌控制[J]. 中国有色金属学报, 2007, 17(1): 149-155.
[2] 魏智强, 马军, 冯旺军, 等. 等离子体制备银纳米粉末的研 究[J]. 贵金属, 2004, 25(3): 29-32.
[4] 蒋伟燕. 配位沉淀-热分解法制备纤维状银粉[D]. 长沙: 中南大学冶金科学与工程学院, 2010: 33-49.
[5] 尹荔松, 阳素玉, 何鑫, 等. 球形纳米银粒子制备新方法及其表征[J]. 纳米技术与精密工程, 2010, 8(4): 295-299.
[12] 刘素琴, 樊新, 黄健涵, 等. 规则球形纳米银粉的制备及表 征[J]. 中南大学学报(自然科学版), 2007, 38(3): 497-501.
[17] 黄凯, 郭学益, 张多默, 等. 超细粉末湿法制备过程中粒子粒度和形貌控制的基础理论[J]. 粉末冶金材料科学与工程, 2005, 10(6): 319-324.
[18] 秦智, 张为军, 匡加才, 等. 高分散性球形银粉的制备研究[J]. 电工材料, 2010(3): 12-15.
[19] 黄凯, 郭学益, 张多默. 超细粉末湿法制备工艺的粒子粒度和形貌控制[J]. 粉末冶金材料科学与工程, 2005, 10(5): 268-276.
[20] Sugimoto T. Monodispersed particles[M]. Amsterdam: Elsevier Science B V, 2001: 40-59.


