二茂铁-肽Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的
合成和电化学性质
王芳斌,谭月敏,刘又年,曾冬铭,向 娟
(中南大学 化学化工学院,湖南 长沙,410083)
摘 要:
摘 要:以二茂铁二甲酸、甘氨酸、酪氨酸和精氨酸为原料,通过多步反应,合成新的二茂铁-肽衍生物Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe(7)(Fca 代表二茂铁氨基酸)和Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH(8),对寡聚肽的合成进行研究;对合成产物进行红外光谱和氢核磁共振谱表征,并运用循环伏安(CV)方法对产物的电化学性能进行研究。研究结果表明:产物(7)和(8)的产率分别为83.5%和80.2%;Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的循环伏安扫描结果是氧化峰和还原峰电位分别为0.385 V和0.346 V,峰电位之差?Ep为41 mV,峰电流密度之比Jpa/Jpc为1.055;对于Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH,其氧化峰和还原峰电位分别为0.532 V和0.453 V,峰电位之差?Ep为79 mV,峰电流密度之比Jpa/Jpc为0.928。
关键词:
二茂铁-肽;Gly-Gly-Tyr-Arg;合成;电化学特性;
中图分类号:O062; O065 文献标识码:A 文章编号:1672-7207(2007)06-1121-08
Synthesis and electrochemical properties of ferrocene-peptides Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe
WANG Fang-bin, TAN Yue-min, LIU You-nian, ZENG Dong-ming, XIANG Juan
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract: A novel kind of peptide-derived ferrocene compound Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe (7) (Fca is ferrocene amino acid) and Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH(8) were synthesized from ferrocene, glycine, tyrosine and arginine through several steps. The synthetic methods of the oligopeptides were emphasized. The compounds were characterized by IR and 1H-NMR. Furthermore, cyclic voltammetry (CV) was used to investigate the electrochemical properties of the compounds. The results show that the yields of compounds (7) and (8) are 83.5% and 80.2%, respectively. The oxidation potential (Ea) and reduction potential (Ec) of Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe(7) are observed at 0.385 V and 0.346 V, respectively. The ratio of Jpa and Jpc is 1.055. For Boc-HN-Fca-Gly-Gly-Tyr- Arg-OH(8), the oxidation potential (Ea) and reduction potential (Ec) are observed at 0.532 V and 0.453 V, respectively. The ratio of Jpa and Jpc for compound (8) is 0.928.
Key words: ferrocene peptides; Gly-Gly-Tyr-Arg; synthesis; electrochemical properties
二茂铁具有夹心结构和高度富电子特性,且易受环境影响的可逆氧化还原特点。许多多肽分子能与蛋白质和DNA分子相互作用,它们之间的这种特异性相互作用,可用于生物分子的识别、疾病的诊断、靶向药物等方面。将电化学活性[1-5]的二茂铁与氨基酸[6]或肽[6-9]结合形成的共扼化合物,可作为电子转移中间体[10-13],应用于特定序列DNA片断、蛋白质的识别、检测以及DNA的损伤与保护等[14-15]的研究。因此,近年来有关二茂铁与氨基酸、多肽及DNA的共扼化合物的研究成为生物电化学研究领域的热点之一。
四肽Gly-Gly-Tyr-Arg可通过氢键与蛋白质作用(如木瓜蛋白酶)结合,可用于一些蛋白质的检测,Kraatz等[11]通过模拟Gly-Gly-Tyr-Arg的氢键性质完成了对PAP的电化学检测。由于生物电化学方法具有快速、灵敏、简单的特点,但Gly-Gly-Tyr-Arg不具有电化学活性,合成二茂铁与Gly-Gly-Tyr-Arg的化合物,可将其作为电化学探针,用于蛋白质的检测。
多肽合成主要有固相和液相两大合成方法,其中固相合成多用于合成氨基酸个数比较多的肽序列,而液相则用于寡肽的合成。液相合成肽的方法中,主要有DCC(或EDC)-HOBt缩合法、HBTU方法和EDC-NHS方法等,其中以EDC-HOBt缩合法较多使用。
本文作者采用HBTU的方法合成Gly-Gly-Tyr- Arg,以及它与二茂铁的化合物Boc-HN-Fca-Gly-Gly- Tyr-Arg-OMe和Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH,并测试其电化学性能行为。
1 实 验
1.1 主要仪器与试剂
主要仪器为:红外光谱仪(AVATAR360,美国Nicolet),核磁共振仪(Varian INOVA400),电化学工作站(CHI-440,上海辰华仪器有限公司)。
主要试剂为:无水三氯化铝(AR);氯化乙酰(AR);叔丁醇(AR);叠氮化钠(AR);氯甲酸乙酯(AR);O-苯并三唑-N, N, N′, N′-四甲基脲六氟膦酸酯HBTU(AR);柱层析硅胶(20~50 μm);甘氨酸、酪氨酸、精氨酸(AR)等。
1.2 Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的合成路线
Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的合成路线如图1所示。
1.3 化合物的表征方法
1.3.1 红外光谱
运用AVATAR360(美国Nicolet)红外光谱仪器;实验中采用KBr压片,扫描均在(23±2) ℃进行。
1.3.2 核磁共振谱
运用Varian INOVA400核磁共振仪器;实验中采用CDCl3溶剂,以TMS为内标物,扫描均在(23±2) ℃进行。
1.3.3 电化学的实验条件
以金电极为工作电极,Ag/AgCl电极为参比电极,铂丝(Pt)电极为对电极,支持电解质为0.1 mol/L的高氯酸钠乙醇溶液,测定前电解池通入10 min氮气除氧,扫描速度为10~100 mV/s,扫描范围为100~ 700 mV。循环伏安均在(23±2) ℃进行。
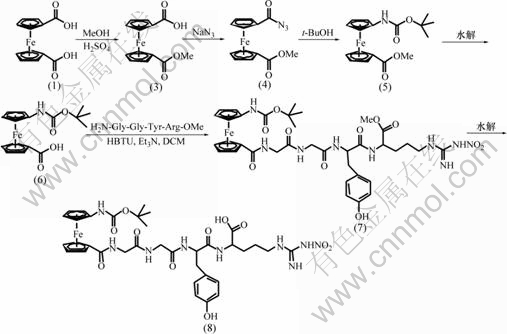
图1 Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的合成路线
Fig. 1 Synthesis of Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe
1.4 叔丁基氧-1’-甲酸-1-氨基二茂铁(6)的合成
1.4.1 1,1’-二茂铁二甲酸甲酯(2)的合成
量取90 mL CH3OH于三口烧瓶中,滴入5~6滴浓硫酸作为催化剂,在70 ℃搅拌,回流。称取5.7 g 1, 1’-二茂铁二甲酸,加入反应体系,维持回流温度反应24~48 h,用TLC监测反应过程。反应完毕后,将混合溶液抽滤,滤去残渣,将滤液蒸干。加入30 mL CH2Cl2和水萃取 2~3次,取油相,加入无水Na2SO4干燥,抽滤,蒸干,用MeOH重结晶,抽滤,将所得滤饼于空气中自然干燥。将产品溶于EtOH中,以体积比为2?1的hexane和EtOAc的混合溶剂为淋洗液过层析柱。分离后蒸干,得橘红色晶体(2) 4.5 g,产率为72.0%。
1.4.2 1’-甲酸甲酯-1-二茂铁甲酸(3)的合成
量取40 mL甲醇于三口烧瓶中,加入3 g 1,1’-二茂铁二甲酸甲酯,用恒压滴液漏斗滴加1 mol/L的NaOH溶液10 mL,维持80 ℃回流温度反应24 h,用TLC监视反应的进程。反应完毕后,滤去残渣,取液相,蒸干后加入蒸馏水溶解,并同时加入30 mL CH2Cl2充分震荡后分液,取水相,油相再用蒸馏水洗2~3次。将所得水溶液转移至烧杯中,搅拌下滴加1 mol/ L的HCl溶液调pH值至1~2,有橘红色沉淀生成,抽滤,将滤饼在空气中自然干燥,得橘红色固体。干燥后得产品(3) 2.3 g,产率为81.0%。
1.4.3 1’-甲酸甲酯-1-叠氮羰基二茂铁(4)的合成
称取1.49 g 1’-甲酸甲酯-1-甲酸二茂铁,溶于5 mL水和28 mL丙酮的混合溶液中,冷却至0 ℃后滴加由2.9 mL Et3N和30 mL丙酮所组成的溶液,维持此温度,滴入由2.2 mL氯甲酸乙酯(ClCOOC2H5)和12 mL丙酮组成的混合溶液。搅拌30 min后,将新配的 1.66 g NaN3与9 mL H2O 的混合溶液滴入反应体系,在0 ℃搅拌1 h。用TLC监视反应的进程。反应结束后将溶液倒入过量的冰水中,并加入20 mL CH2Cl2萃取2~3次,有机相再分别用5% NaHCO3和饱和NaCl溶液洗涤,分液,在有机相中加入无水Na2SO4以除去残留水分,抽滤。将滤液在常温下蒸干,在空气中干燥后得到红褐色晶体。将红褐色晶体溶解于CH2Cl2中,以体积比为3?1的hexane和EtOAc的混合溶剂为淋洗液过层析柱。分离后蒸干得红褐色晶体(4)1.1 g,产率为67.5%。
1.4.4 叔丁基氧-1’-甲酸甲酯-1-氨基二茂铁(5)的合成
量取50 mL叔丁醇于圆底烧瓶中,搅拌,加热至80 ℃,加入973 mg 1’ -甲酸甲酯-1-叠氮羰基二茂铁,在回流温度下反应1.5 h。反应完毕后取出溶液,蒸干,得红棕色固体。用体积比为8?1?5的CH2Cl2,EtOAc和hexane的混合溶剂为淋洗液过层析柱;旋蒸干燥,得橘红色固体(5) 730 mg,产率为73.4%。
1.4.5 叔丁基氧-1’-甲酸-1-氨基二茂铁(6)的合成
量取70 mL甲醇于三口烧瓶中,于70 ℃搅拌并回流,称取723 mg叔丁基氧-1’-甲酸甲酯-1-氨基二茂铁并加入反应器,滴加5.8 mL浓度为1 mol/ L NaOH溶液,维持回流温度反应24 h,TLC监视反应进程。反应完毕后,滤去残渣,取液相,蒸干后加入水溶解,同时加入20 mL CH2Cl2充分震荡后分液,取水相,油相再用蒸馏水洗2~3次。将所得水溶液转移至烧杯中,维持0 ℃,搅拌下慢慢滴加11 mol/L HCl溶液调pH值至1~2,有橘红色沉淀生成,抽滤,将滤饼在空气中自然干燥即得棕色固体(6) 575 mg,产率为83.0%。
1.5 H2N-Gly-Gly-Tyr-Arg-OMe的合成
1.5.1 Gly,Tyr和Arg羧基的保护
称取3.134 g Gly于圆底烧瓶中,加入9 mL CH3OH(无水),在-10 ℃缓慢加入SOCl2,然后移入20 ℃下反应2 h(搅拌体系),再放置3 h,减压蒸去CH3OH等物就可得到产品,产率为90.42%。Tyr和Arg羧基的酯化保护方法同上,产率分别为87.2%和84.7%。
1.5.2 Gly氨基的Boc保护
参照文献[16]的方法,取16.8 g NaHCO3于圆底烧瓶中,在5 ℃下用大约120 mL蒸馏水溶解,另外称取32.4 g (BOC)2O,将其溶解于大约120 mL二氧六环中,将上述2种溶液混合;然后称取7.6 g (0.1 mol)Gly分批少量多次加入以上混合液。反应过夜后,用乙酸乙酯洗2~3次;取水相用乙酸乙酯洗2次;用饱和NaHCO3洗油相2次。然后混合所有的水相用10%盐酸调节水相的pH=1~2,再用乙酸乙酯洗水相2次。集中以上油相用无水硫酸钠干燥,过滤,蒸干即可得到产物。产率为72.7%。
1.5.3 Boc-HN-Gly-Gly-OMe二肽的合成
称取3.54 g (0.02 mol) Boc-HN-Gly于干燥的圆底烧瓶中,用无水CH2Cl2溶解。在0 ℃下加入Et3N (三乙胺)6.2 mL(4.4 g,0.044 mol),之后加入Gly-OMe 1.78 g(0.02 mol),再加入HBTU 8.36 g(0.022 mol)。反应2 h(0 ℃)而后移入室温反应,反应过夜后处理,先用饱和NaHCO3洗,分液,水相用0.51 mol /L的盐酸洗,再用饱和NaHCO3洗,最后用蒸馏水洗油相,而后用无水硫酸钠干燥,过滤,蒸干即可得到产物。产率为97.6%。
1.5.4 Boc-HN-Gly-Gly-OMe二肽的水解
在圆底烧瓶里将1.2 g Boc-HN-Gly-Gly-OMe溶于55 mL THF中,用2.3 mL蒸馏水溶解0.194 g的NaOH的溶液加入以上混合液。于0 ℃反应30 min,而后在室温下反应12 h。将反应物蒸干,加水50 mL,然后用乙酸乙酯洗(3次,每次20 mL),之后再将水相冷却至0 ℃,用0.1 mol / L HCl调pH值至1~2,再用乙酸乙酯洗(3次,每次20 mL),油相用无水硫酸钠干燥,抽滤后蒸干的产品,产率为89.6%。
1.5.5 Boc-HN-Gly-Gly-Tyr-OMe三肽的合成
合成方法与1.5.3节中的相同,产率为95.3%。
1.5.6 Boc-HN-Gly-Gly-Tyr-OMe三肽的水解
合成方法与1.5.4节中的相同,产率为86.8%。
1.5.7 Arg(精氨酸)胍基保护
参照文献[17]方法,在0 ℃将8 mL发烟硝酸加入装有5 mL(含30%SO3)发烟浓硫酸的烧瓶中,在搅拌下,加入6 g Arg。反应1 h后倒入冰水中分解,而后用饱和氨水调节pH值至8~9;再用冰醋酸调节pH=6,将溶液移入冰箱中放置4 h。蒸干即得到产品,产率为70.5%。
1.5.8 Boc-HN-Gly-Gly-Tyr-Arg-OMe的合成
合成方法与1.5.3节中的相同,产率为96.4%。
1.5.9 Boc-HN-Gly-Gly-Tyr-Arg-OMe的Boc的去除
将10 mmol四肽溶于乙酸乙酯中,在0 ℃通入HCl气体1 h,然后搅拌0.5 h,而后移入室温搅拌1 h。所得溶液减压除溶剂干燥,用甲醇-乙醚重结晶,产率为75.5%。
1.6 Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe(OH)的合成
1.6.1 合 成
将0.931 g H2N-Gly-Gly-Tyr-Arg-OMe溶解于干燥的乙酸乙酯中,在0 ℃加入1.55 mL Et3N和0.337 g叔丁基氧-1’-甲酸-1-氨基二茂铁,之后加入0.537 g HBTU。反应在0 ℃进行2 h,而后移入室温几天,TLC跟踪反应进程。最后蒸干即得到产品,产率为83.5%。
1.6.2 Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的水解
在圆底烧瓶里将0.032 g Boc-HN-Fca-Gly-Gly- Tyr-Arg-OMe溶于2 mL THF中,用1.0 mL蒸馏水溶解2.0 mg的NaOH的溶液加入以上混合液。在0 ℃反应30 min,而后在室温下反应12 h。将反应物蒸干,加水50 mL,然后用乙酸乙酯洗(3次,每次10 mL),之后再将水相冷却至0 ℃,用0.1 mol/L HCl调pH值至1~2,再用乙酸乙酯洗(3次,每次10 mL),油相用无水硫酸钠干燥,抽滤后蒸干的产品,产率为80.2%。
1.7 电化学实验
将配好的0.1 mmol/L的Boc-NH-Fc-Gly-Gly- Tyr-Arg-OMe溶液中抽取3 mL加入15 mL的培养皿中,再用注射器加入3 mL配好的0.1 mol/L的高氯酸钠溶液作为支持电解质,轻微晃动至均匀,静置15 min后进行CV测试。金电极为工作电极,Ag/AgCl电极为参比电极,铂丝(Pt)电极为对电极,支持电解质为0.1 mol/L的高氯酸钠溶液,测定前电解池通入10 min氮气除氧,扫描速度为50 mV/s,扫描范围为100~700 mV。测试温度为(22±3) ℃。
2 结果与讨论
2.1 化合物的表征
2.1.1 1, 1’-二茂铁二甲酸甲酯(2)
IR(cm-1):3 107、1 146、824 (νFc);1 701 (νC=O,酯基);1 285,1 146 (νC—O—C);1 380 (νC—H,烷基), 1 470 (δC—H,烷基)。2 564 cm-1和1 398 cm-1处O—H吸收峰消失,1 380 cm-1 (烷基C—H伸缩振动)和1 470 cm-1 (烷基C—H弯曲振动)处峰出现。1 285 cm-1和 1 146 cm-1处出现C—O—C的不对称和对称伸缩振动。1H NMR(CDCl3,化学位移):3.99(s, 6H, COOCH3),3.27(s, 2H, H-3’, H-4’, Fc),4.28(s, 2H, H-3, H-4, Fc),4.58(s, 2H, H-2’, H-5’, Fc),4.78(s, 2H, H-2, H-5, Fc)。
2.1.2 1’-甲酸甲酯-1-二茂铁甲酸(3)
IR(cm-1):3 113、1 160、820 (νFc);1 679,1 708 (νC=O, 羧基,酯基);1 280,1 160 (νC—O—C);1 385 (νC—H,烷基),1 476 (δC—H,烷基);1 391 (δOH)。1 679 cm-1,1 708 cm-1并存羧基与酯基中的羰基吸收峰;1 291 cm-1出现O—H弯曲振动。1H NMR(CDCl3,化学位移):8.67(s, 1H, COOH),3.87(s, 3H, COOCH3),3.97(s, 2H, H-3’, H-4’, Fc),4.42(s, 2H, H-3, H-4, Fc),4.58(s, 2H, H-2’, H-5’, Fc),4.70(s, 2H, H-2, H-5, Fc)。
2.1.3 1’-甲酸甲酯-1-叠氮羰基二茂铁(4)
IR(cm-1):3 101、1 143、824 (νFc);2 142 (νN3); 1 715 (νC=O, 酯基);1 676 (νC=O,CON3);1 282, 1 181 (νC—O—C);1 389 (νC—H,烷基),1 471 (δC—H,烷基)。1 391 cm-1 处O—H弯曲振动消失,1 676 cm-1,2 142 cm-1处CON3中羰基和N3特征吸收峰出现。 1H NMR(CDCl3,化学位移):3.83(s, 3H, COOCH3),4.45(s, 2H, H-3’, H-4’, Fc),4.54(s, 2H, H-3, H-4, Fc),4.87(s, 2H, H-2’, H-5’, Fc),4.85(s, 2H, H-2, H-5, Fc)。
2.1.4 叔丁基氧-1’-甲酸甲酯-1-氨基二茂铁(5)
IR(cm-1):3 116、1 164、824 (νFc);3 377 (νN—H),1 544 (νN—H );1 705 (νC=O, 酯基);1 712,1 247, 1 150 (νC=O, C—C, C—H, Boc);1 285 (νC—N);1 388 (νC—H,烷基),1 467 (δC—H,烷基)。2 142,1 476 cm-1 CON3吸收峰消失,Boc基团特征吸收峰在1 712,1 247, 1 150 cm-1处出现。1 285 cm-1处C—N伸缩振动出现。1H NMR(CDCl3,化学位移):5.91(s, 1H, Cp-NH),3.81(s, 3H, COOCH3),3.99(s, 2H, H-3’, H-4’, Fc),4.39(s, 2H, H-3, H-4, Fc),4.51(s, 2H, H-2’, H-5’, Fc),4.81(s, 2H, H-2, H-5, Fc),1.50(s, 9H, C(CH3)3)。
2.1.5 叔丁基氧-1’-甲酸-1-氨基二茂铁(6)
IR(cm-1):3 150、1 164、811 (νFc);3 251 (νN—H),1 541 (δN—H );1 671 (νC=O, 羧基);1 701,1 261,1 164 (νC=O, C—C, C—H, Boc);1 289 (νC—N);1 394 (νC—H,烷基),1 488 (δC—H,烷基)。显著的变化在于1 705 cm-1处酯羰基消失,羧基中羰基峰(1 671 cm-1)出现。此外在 2 555 cm-1处出现O—H伸缩振动峰。1H NMR(CDCl3,化学位移):8.67(s, 1H, Cp-NH),8.77(s, 1H, COOH),3.99(s, 2H, H-3’, H-4’, Fc),4.42(s, 2H, H-3, H-4, Fc),4.60(s, 2H, H-2’, H-5’, Fc),4.96(s, 2H, H-2, H-5, Fc),1.59(s, 9H, C(CH3)3)。
2.1.6 Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe(7)
如图2所示,IR(cm-1):3 107 cm-1,1 146 cm-1,824 cm-1 (νFc);1 701 cm-1 (νC=O, 酯基);1 546 cm-1 (N—H的面内变形振动);3 402 cm-1 (νN—H );1 240 cm-1 (叔丁基C—C单键伸缩振动谱);1 300 cm-1 (C—N伸缩振动谱);1 036 cm-1 (C—O—C的不对称伸缩振动谱带);1 637 cm-1 (羰基的吸收峰),3 200~2 500 cm-1 (ν OH高低不平的宽峰)。如图3所示,1H-NMR (CDCl3,化学位移):1.260(溶剂 乙酸乙酯),1.346(s, 9H, Boc);1.882(s, 2H, Arg);3.89(s, 2H, H-3’, H-4’, Fc);4.29(s, 2H, H-3, H-4, Fc);4.39(s, 2H, H-2’, H-5’, Fc);4.60(s, 2H,H-2, H-5, Fc);4.694(s, 4H, Tyr上的苯环);6.227(s,H-N,Tyr);7.268(s,1H,CDCl3);7.690(s,2H,Gly);8.094(s,1H,HN-Fc)。

图2 Boc-NH-Fc-Gly-Gly-Tyr-Arg-OMe的红外光谱
Fig. 2 IR spectrum of Boc-NH-Fc-Gly-Gly-Tyr-Arg-OMe

图3 Boc-NH-Fc-CO- Gly-Gly-Tyr-Arg-NO2的1H NMR谱
Fig.3 1H-NMR spectrum of Boc-NH-Fc-Gly-Gly-Tyr-Arg-OMe
2.2 合成条件分析
以HBTU为缩合剂,采用液相合成的方法合成了四肽及其二茂铁的化合物。肽的产率较高,在80%以上,反应时间均在24 h 左右。二茂铁与Boc-HN-Gly-Gly-Tyr-Arg-OMe 的合成中,其产率达到83.5%。说明HBTU可以作为二茂铁与氨基酸或多肽反应的缩合剂,且反应效果较好。另外,精氨酸中胍基的保护,是合成中的一个难点,实验中选用硝化方法保护胍基。
2.2.1 合成中主要产物叔丁基氧-1’-甲酸甲酯-1-氨基二茂铁(5)的合成条件分析
叔丁氧羰基(Boc)是目前多肽合成中广为采用是氨基保护基,叔丁氧羰基具有以下优点:a. Boc-氨基酸容易得到晶体;b. 易于酸解除去,但又具有一定的稳定性,Boc-氨基酸能较长期的保存而不分解;c. 酸解时产生的是叔丁基阳离子再分解为叔丁烯,它不会带来副反应;d. 对碱水解和肼水解都稳定;e. 叔丁氧羰基对催化氢解稳定。
在叔丁基氧-1’-甲酸甲酯-1-氨基二茂铁的合成中和下一步的酸化过程中,为防止氨基和酸发生反应,采取叔丁氧羰基(Boc)作为氨基的保护基团。
这步反应中有一种容易生成的副产物二茂铁脲,并且随着反应时间的增加,副产物的量逐步增多,产品(5)的产率随反应时间的变化如图4所示。
由图4可以看出,当反应时间约为1.5 h时反应产率达到最高(73.4%),继续延长反应时间,产率下降。
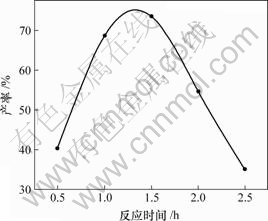
图4 反应时间对产物(5)产率的影响
Fig.4 Influence of time on yield of compound (5)
2.2.2 产物(7)的合成条件分析
产物(7)是本实验中合成部分的最终产物, 也是后期电化学测试以及表面化学重要原料。
肽的合成是把氨基连接到羧基上,而游离的羧基与氨基反应的活性并不高,这就需要一种试剂先与羧基反应使之活化,再与游离羧基进行结合,从而形成肽键。
从理论上说,Fc-OBt与氨基酸的物质的量比应为1?1进行缩合,但在本实验中,二者以1?1进行缩合时的产率相当低,经实验,适当提高氨基酸的物质的量的比例对缩合反应起到促进作用。产率与二者物质的量比的关系如图5所示,其中,Fc-OBt表示产物(5)与HBTU反应后的产物。
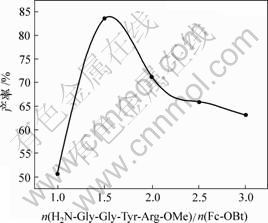
图5 H2N-Gly-Gly-Tyr-Arg-Ome与Fc-OBt的物质的量比对产物(7)产率的影响
Fig.5 Influence of molar ratio of H2N-Gly-Gly-Tyr-Arg-OMe to Fc-OBt on yield of compound (7)
图5所示为Fc-OBt与H2N-Gly-Gly-Tyr- Arg-OMe的物质的量比对产物(7)产率的影响,当二者比例约为1?1.5时,产物(7)的产率最高,为83.5%,随着H2N-Gly-Gly-Tyr-Arg-OMe的继续加入,产物(7)的产率开始下降并趋于平缓,这可能是过量的H2N-Gly-Gly-Tyr-Arg-OMe自身作用的结果。
2.3 电化学性质
通过循环伏安方法对合成的产物Boc-HN-Fca- Gly-Gly-Tyr-Arg-OMe和Boc-HN-Fca-Gly-Gly-Tyr- Arg-OH的电化学性能进行测试,结果如图6和图7 所示。
由图6可知,CV扫描结果(扫描速率为50 mV/s),在100~700 mV范围内出现了一对可逆性较好的氧化还原峰,氧化峰和还原峰电位分别为0.385 V和0.346 V,CV中主要考察的参数峰电位之差?Ep=41 mV,峰电流密度之比Jpa/Jpc =1.055,表明产物(7)在溶液中的

图6 产物(7) 的循环伏安图
Fig.6 Cyclic voltammetry of compound (7)
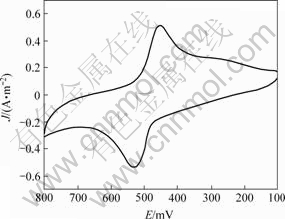
图7 产物(8)的循环伏安图
Fig.7 Cyclic voltammetry of compound (8)
良好的电子传递能力,这种电化学特性是由于二茂铁中的铁离子在二价和三价之间变化时对应一个氧化还原过程。
产物Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe在溶液中多次扫描,其峰电流密度随扫描速率的增加而增加,且峰电流密度的平方根和扫描速率成线性关系,说明此为扩散控制。
通过形成二硫键的方式,采用自组装单分子膜(SAM)的方法将Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH通过EDC-NHS固定在金电极表面,形成自组装单分子膜,之后在0.1 mol/L的高氯酸钠电解质溶液中进行扫描。由图7可知,CV扫描结果(扫描速率为50 mV/s),在100~800 mV范围内出现一对可逆性较好的氧化还原峰,氧化峰和还原峰电位分别为0.532 V和0.453 V,CV中主要考察的参数峰电位之差?Ep=79 mV, 峰电流密度之Jpa/Jpc =0.928。经多次扫描,无脱落现象,氧化还原峰始终较好,说明键合比较稳定。
二茂铁未被修饰前,CV扫描结果表明,在400~500 mV范围内出现了一对可逆性较好的氧化还原峰,CV中峰电位之差?Ep较小,峰电流较大。修饰后,电活性中心离电极更远,路径更长,电子转移时所受的阻力更大,所以其峰电流变小,电位差变大。
利用线性扫描方程,可导出准可逆单步骤单电子过程的J—E曲线[18]。这种情况下的波形,?Ep是v和k0的函数,这时候曲线是无量纲参数α和φ的函数,其中φ定义为

25 ℃时,?Ep与φ的关系可由文献[19]查得,本实验工作中所测得?Ep分别为41 mV和79 mV, 故根据文献[19]中φ数据,代入式(1),求得k0。
根据Matsuda和Ayabe提出的可逆性区分标 志[18],准可逆情况下的2×10-5 v1/2≤k0≤0.3v1/2,根据本实验中扫描速度v为50 mV/s, 即2.828×10-4≤k0≤4.242。而计算所得的k0正是处于此区间范围内,结合图形所表现出来的较为理想的对称氧化还原峰,从而可以确定本实验中的产物Boc-HN-Fca-Gly-Gly- Tyr-Arg-OMe和Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH在溶液中的电化学反应是一个准可逆过程。
3 结 论
a. 合成了一种新的化合物Boc-HN-Fca-Gly- Gly-Tyr-Arg-OMe。对这种化合物进行了IR 和 1H-NMR表征。
b. 研究了Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe和Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH在溶液中的电化学性能。Boc-HN-Fca-Gly-Gly-Tyr-Arg-OMe的CV扫描结果中,氧化峰和还原峰电位分别为0.385 V和0.346 V,峰电位之差?Ep为41 mV,峰电流密度之比Jpa/Jpc为1.055;Boc-HN-Fca-Gly-Gly-Tyr-Arg-OH的CV扫描结果中,氧化峰和还原峰电位分别为0.532 V和0.453 V,峰电位之差?Ep为79 mV, 峰电流密度之比Jpa/Jpc为0.928。
参考文献:
[1] Liu B, Bard A J, Li C Z, Kraatz H B. Scanning electrochemical microscopy. 51. studies of self-assembled monolayers of DNA in the absence and presence of metal ions[J]. J Phys Chem B, 2005, 109(11): 5193-5198.
[2] 徐 春, 蔡 宏, 何品刚. 二茂铁标记DNA 电化学探针的研制及性质研究[J]. 高等学校化学学报, 2001, 22(9): 1492-1495.
XU Chun, CAI Hong, HE Pin-gang. Studies on the synthesis and characters of ferrocene labeled DNA probe[J]. Chemical Journal of Chinese University, 2001, 22(9): 1492-1495.
[3] Long Y T, Li C Z, Sutherland T C, et al. A comparison of electron-transfer rates of ferrocenoyl-linked DNA[J]. J Am Chem Soc, 2003, 125(29): 8724-8725.
[4] Beer P D, Davis J J, Drillsma-Milgrom D A. Anion recognition and redox sensing amplification by self-assembled monolayers of 1,1’-bis(alkyl-N-amido)ferrocene[J]. Chem Commun, 2002, 16: 1716-1717.
[5] Liu Y N, Orlowski G, Schatte G. 3-Ferrocenoylamido-5- methylpyrazole: synthesis and metal coordination[J]. Inorg Chim Acta, 2005, 358(44): 1151-1161.
[6] Barisic L, Rapic V, Kovac V. Ferrocene compounds. XXIX. efficient syntheses of 1’-aminoferrocene-1-carboxylic acid derivatives[J]. Croatica Chem Acta, 2002, 75(1): 199-210.
[7] Kraatz H B. Ferrocene-conjugates of amino acids, peptides and nucleic acids[J]. J Inorg Organometallic Polym Mater, 2005, 15(1): 83-106.
[8] Sevirin K, Bergs R, Beck W. Bioorganometallic chemistry: transition metal complexes with α-amino acids and peptides[J]. Angew Chem Int Ed, 1998, 37(12): 1634-1654.
[9] Huang H, Mu L, Cheng J P. Ferrocenyl-bearing cyclopseudopeptides as redox-switchable cation receptors[J]. J Org Chem, 2003, 68(20): 7605-7611.
[10] Calleja G, Cerveau G. Electrochemistry: A tool for characterization of hybrid materials obtained by non-hydrolytic sol-gel route and containing ferrocene derivatives[J]. J Sol-Gel Sci and Tech, 2003, 26: 307-310.
[11] Plumb K, Kraatz H B. Interaction of a ferrocenoyl-modified peptide with papain: Toward protein-sensitive electrochemical probes[J]. Bioconjugate Chem, 2003, 14(3): 601-606.
[12] Barauskas J, Razumas V, Talaikyt Z. Towards redox active liquid crystalline phases of lipids: a monoolein/water system with entrapped derivatives of ferrocene[J]. Chem Phys Lipids, 2003, 123(1): 87-97.
[13] Wang S F, Du D. Differential pulse voltammetry determination of ascorbic acid with ferrocene-L-cysteine self-assembled supramolecular film modified electrode[J]. Sensors Actuators B: Chem, 2004, 97: 373-378.
[14] Anne A, Bouchardon A, Moiroux J. Ferrocene-labeled oligonucleotide chainsend-tethered to gold electrode surfaces: novel model systems for exploring flexibility of short DNA using cyclic voltammetry[J]. J Am Chem Soc, 2003, 125(5): 1112-111.
[15] Petka W A, Harden J L, McGrath K P, et al. Reversible hydrogels from self-assembling artificial proteins[J]. Science, 1998, 281(17): 389-392.
[16] Shendage D M, Froehlich R, Haufe G. Highly efficient stereoconservative amidation and deamidation of α-amino acids[J]. Org Lett, 2004, 6(21): 3675-3678.
[17] Hofmann K, Peckham W D, Rheiner A. Studies on polypeptides. VII. The synthesis of peptides containing arginine[J]. Biochem, 1955, 78(5): 238-242.
[18] Bard A J, Faulker L R. Electrochemical methods: Fundamentals and applications[M]. 2nd ed. Hoboken: John Wiley & Sons Inc, 2001: 236-240.
[19] Nicholson R S. Theory and application of cyclic voltammetry for measurement of electrode reaction kinetics[J]. Anal Chem, 1965, 37(16): 1351-1355.
收稿日期:2007-02-18;修回日期:2007-04-30
基金项目:国家自然科学基金资助项目(20676153)
作者简介:王芳斌(1965-),男,湖南衡阳人,博士研究生,从事生物传感的研究
通信作者:刘又年,男,教授;电话:0731-8836964;E-mail: liuyoun@mail.csu.edu.cn


