文章编号:1004-0609(2012)07-1956-07
共沉淀法制备LiNi0.8Co0.1Mn0.1O2过程中加料速度对其性能的影响
陈 巍,李新海,王志兴,郭华军,岳 鹏,李灵均
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
采用共沉淀法制备Ni0.8Co0.1Mn0.1(OH)2前驱体,与LiOH·H2O混合后在氧气气氛中焙烧得到LiNi0.8Co0.1Mn0.1O2正极材料,探讨共沉淀反应过程中快速加料和慢速加料制度对前驱体形貌和LiNi0.8Co0.1Mn0.1O2正极材料性能的影响。通过X射线衍射(XRD)、扫描电镜(SEM)和电化学测试对样品进行表征。结果表明:慢速加料法减小了材料的粒径,合成了平均粒径在0.5 μm左右的球形Ni0.8Co0.1Mn0.1(OH)2前驱体,且粒径分布比较集中;所合成LiNi0.8Co0.1- Mn0.1O2正极材料具有良好的层状结构,且无杂相存在;缓慢加料法得到的样品的电化学性能有很大提高,在0.1 C、0.5 C和1 C下首次放电比容量分别达到223.5、194.3和190.7 mA·h/g,循环30次后,容量保持率为80.09%、80.80%和85.84%。
关键词:
锂离子电池;正极材料;LiNi0.8Co0.1Mn0.1O2;共沉淀;
中图分类号:TM912.9 文献标志码:A
Influence of feeding rate on performance of LiNi0.8Co0.1Mn0.1O2 cathode materials prepared by co-precipitation
CHEN Wei, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, YUE Peng, LI Ling-jun
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The mixture of Ni0.8Co0.1Mn0.1(OH)2 precursors were synthesized by co-precipitation, and calcined with LiOH·H2O to produce LiNi0.8Co0.1Mn0.1O2 cathode material in oxygen atmosphere. The influence of the fast feeding rate and slow feeding rate during the process of co-precipitation on the morphology of the precursors and the performance of cathode materials LiNi0.8Co0.1Mn0.1O2 were discussed. The samples were analyzed by X-ray diffractometry (XRD), scanning electron microscopy (SEM) and electrochemical test. The results show that with the slow feeding method, a narrow size-distribution spherical Ni0.8Co0.1Mn0.1(OH)2 precursors are prepared, and the average size is about 0.5 μm. The synthesized cathode materials have good layered structure and no impurity present, the electrochemical performance of the samples obtained by the slow feeding mathod is greatly improved. The first discharge capacities are 223.5, 194.3 and 190.7 mA·h/g at 0.1 C, 0.5 C and 1 C, respectively, and after 30 cycles, the retention rates of capacity at 0.1 C, 0.5 C and 1 C are 80.09%, 80.80% and 85.84%, respectively.
Key words: lithium-ion battery; cathode material; LiNi0.8Co0.1Mn0.1O2; co-precipitation
锂离子电池作为新一代绿色可充电电池,具有十分广阔的发展前景。随着各种便携式电子设备的飞速发展,人们对锂离子电池也提出了更高的要求。目前,在商业领域应用最广泛的锂离子电池正极材料是LiCoO2,其具有优良的综合性能,但钴的毒性、昂贵的价格以及LiCoO2正极材料较低的实际可逆容量等缺点限制了这种材料的应用[1]。因此,近十几年来,人们一直在寻找新的锂离子正极材料以替换LiCoO2。
LiNiO2与LiCoO2性质相近[2],凭借着较高的实际可逆容量及低廉的价格等吸引了人们的关注。然而,由于制备困难,循环过程中结构稳定性差以及存在较严重的锂镍阳离子混排等缺点使其难以实现商业化[3]。人们对LiNiO2进行掺杂研究的过程中发现[4-9],Co能够稳定材料的结构,提高材料电导率[10-11],且Co的掺杂对LiNiO2层状结构影响非常小;Mn能够大大稳定了主体材料的结构[12-14]。实验证明,同时掺杂Co和Mn以后,LiNi1-x-yCoxMnyO2材料的性能得到很大的提 升[15]。在众多三元材料中,LiNi0.8Co0.1Mn0.1O2材料凭借其较高的比容量等无疑成为最具发展潜力的锂离子电池正极材料。
三元正极材料前驱体的制备方法除溶胶-凝胶法之外,目前研究较多的是共沉淀法。LI等[16]采用共沉淀法制备出LiNi0.8Co0.1Mn0.1O2材料,在18 mA/g的电流密度下首次放电容量最高达到192.4 mA·h/g。KIM等[17]用共沉淀法合成的LiNi0.8Co0.1Mn0.1O2正极材料,在0.1 C,3.0~4.3 V条件下首次放电比容量达到198 mA·h/g。胡国荣等[18]通过共沉淀法合成的正极材料LiNi0.8Co0.2O2,在0.2 C、3.0~4.3 V条件下,首次放电比容量达到195.4 mA·h/g。普通工艺制备的正极材料二次颗粒粒度都比较大,达到微米级别,这不利于充放电过程中锂离子的嵌入与脱出,从而降低正极材料的充放电比容量与倍率性能。由于共沉淀法制备前驱体的过程中,反应物料的加入速率将直接影响反应体系内反应产物的过饱和度,从而对前驱体的形貌,特别是粒度产生很大影响。
本文作者采用共沉淀与高温固相相结合的方法制备LiNi0.8Co0.1Mn0.1O2材料正极材料,在前驱体制备阶段,通过蠕动泵控制物料流量。探讨共沉淀法制备前驱体的过程中,快速加料制度和慢速加料制度对Ni0.8Co0.1Mn0.1(OH)2前驱体形貌和LiNi0.8Co0.1Mn0.1O2正极材料性能的影响。
1 实验
1.1 LiNi0.8Co0.1Mn0.1O2的合成
采用2.5 mol/L的氯化镍、氯化钴、氯化锰的混合溶液(Ni、Co、Mn的摩尔比为0.8:0.1:0.1),以2.5 mol/L的NaOH作为沉淀剂,以浓氨水为络合缓冲剂,反应在隔绝空气的氩气气氛下进行。缓慢加料法是在反应开始前,先往反应器中加入足量的去离子水,再加入适量的氨水(体积分数,28%),控制pH在11.0。反应开始后,反应体系的温度控制在50 ℃,搅拌强度为 700 r/min,混合溶液与沉淀剂分别以0.25和0.5 mL/min的流量通过蠕动泵并流加入反应器中,反应1 h后,陈化12 h,过滤得到前驱体Ni0.8Co0.1Mn0.1(OH)2。快速加料法是在反应前,在反应器内加入适量氨水(28%)后,快速地将全部混合料液和沉淀剂并流加入反应器,之后的操作与缓慢加料法相同。
共沉淀法得到的Ni0.8Co0.1Mn0.1(OH)2前驱体经洗涤、过滤后在鼓风干燥器中于120 ℃下干燥12 h,以除去吸附水。干燥后的前驱体经研磨后,与相对于化学计量比过量5%(摩尔分数)的LiOH·H2O(x(Li)/x(Ni+ Co+Mn)=1.05)混合研磨。得到的混合物在480 ℃下预焙烧5 h,再升温至750 ℃焙烧15 h,之后随炉冷却,得到产物LiNi0.8Co0.1Mn0.1O2。
1.2 材料的表征
利用扫描电镜(SEM、JEOL、JSM-5600LV)对样品的形貌进行分析;采用日本Rint-2000型X射线衍射仪分析样品的物相组成(Cu Kα辐射,扫描速率5 (°)/min,管电压40 kV,管电流250 mA,扫描范围2θ= 10°~85°)。
1.3 电池的组装与测试
将正极活性物质、乙炔黑和聚偏氟乙烯(PVDF)按质量比8:1:1混合,加入溶剂N-甲基-2-吡咯烷酮(NMP),研磨均匀,均匀刮涂于铝箔上,置于120 ℃烘箱中干燥后,制成直径为14 mm的正极片,将正极片与负极片(Li,直径为14 mm)、电解液(1 mol/L的LiPF6/DMC+EMC+EC(体积比为1:1:1))和隔膜(Celgard 2300 PP/PE/PP)在充满氩气的手套箱内组装成2025型扣式电池,电池静置12 h后用深圳新威BTS-5V/1mA电池测试仪进行恒电流充放电测试,充放电电压范围为2.8~4.3 V;采用美国CHI660电化学工作站进行循环伏安测试,扫描范围为2.5~4.5 V,扫描速率为0.1 mV/s;采用美国CHI660电化学工作站进行交流阻抗测试,测试频率为0.01 Hz~100 kHz,正弦振幅为5 mV。
2 结果与讨论
2.1 XRD分析
快速加料方法与缓慢加料方法得到的前驱体Ni0.8Co0.1Mn0.1(OH)2和成品LiNi0.8Co0.1Mn0.1O2的XRD图谱如图1所示。图1(a)显示通过两种方法制备的前驱体Ni0.8Co0.1Mn0.1(OH)2均为β-Ni0.8Co0.1Mn0.1(OH)2[17]。而图1(b)则表明,两种方法得到的LiNi0.8Co0.1Mn0.1O2都是层状的α-NaFeO2结构,属R-3m空间群,并且从谱图上观察不到任何杂相峰存在。同时,(006)/(102)与(108)/(110)两对峰分峰都十分清楚,这表面两种方法合成的LiNi0.8Co0.1Mn0.1O2都具有良好的层状结构。有研究表明,(003)与(104)峰强的比值是表征材料锂镍混排程度的重要参数,(003)/(104)值越大,表明材料锂镍混排的程度越小;而(006)峰与(102)峰强度之和同(101)峰的比值越大,材料的六方晶型有序程度就越 好[3]。由图1(b)可知,快速加料法得到的LiNi0.8Co0.1- Mn0.1O2的(003)/(104)值为1.76,[(006)+(102)]/(101)的值为0.46;而缓慢加料法得到的(003)/(104)值为1.40,[(006)+(102)]/(101)的值为0.42,表明两种方法所得样品的阳离子混排程度很小,并且其六方晶型的有序程度都比较好。
2.2 前驱体及其烧结产品的形貌
图2所示为通过两种方法制备的前驱体的SEM像。由快速加料法得到的前驱体,其一次晶粒粒径非常小,从图2(a)和(b)可以看出,前驱体呈絮状,并且这种一次晶粒分散性很差,团聚严重,使得一部分二次颗粒粒径很大,而另一部分二次颗粒粒径却又很小。从图2(c)和(d)可以看出,缓慢加料法得到的前驱体的一次颗粒呈针状,其粒径要大于快速加料法得到的前驱体颗粒的一次晶粒粒径,这种针状一次颗粒分散性很好,团聚不严重,形成的二次颗粒粒径很小,约0.5 μm,并且粒径分布非常集中。这表明通过缓慢加料法得到的前驱体具有更好的形貌,二次颗粒粒径达到了亚微米级。造成一次颗粒粒径不同的原因主要是由于快速加料法制备前驱体过程中,反应物料的加入速度非常快,因此反应形成的产物的过饱和度非常高,过饱和度越高,虽有利于晶体生长,但成核速率更快,溶液中将形成更多的结晶核心,于是在反应过程中形成大量晶核,在反应结束后便得到大量粒径非常小的一次颗粒;而缓慢加料法则相反,其反应过程中反应物的加入速度很慢,反应形成的产物Ni0.8Co0.1Mn0.1- (OH)2的过饱和度较低,不利于晶粒的生长,但更加不利于晶核的形成,因此整个反应过程中形成的晶核数量较少,从而得到粒径较大的针状一次颗粒[19]。同时,由于比表面积大的小粒径粒子在降低表面能的热力学驱动力作用下发生团聚的趋势大于比表面积较小的大粒径粒子,因此通过快速加料制度制备的前驱体,其一次颗粒的团聚也就更加严重[20]。

图1 两种方法得到的Ni0.8Co0.1Mn0.1(OH)2和LiNi0.8Co0.1Mn0.1O2的XRD谱
Fig. 1 XRD patterns of Ni0.8Co0.1Mn0.1(OH)2 (a) and LiNi0.8Co0.1Mn0.1O2 (b) prepared by different feeding methods

图2 两种方法得到的Ni0.8Co0.1Mn0.1(OH)2的SEM像
Fig. 2 SEM images of Ni0.8Co0.1Mn0.1(OH)2 prepared by different feeding rates: (a), (b) Rapid feeding method; (c), (d) Slow feeding method
前驱体经过热处理后得到的LiNi0.8Co0.1Mn0.1O2材料的SEM像如图3所示。由于快速加料法制备的前驱体一次颗粒的团聚很严重,因此,如图3(a)和(b)所示,其烧结得到的LiNi0.8Co0.1Mn0.1O2正极材料团聚也比较严重,颗粒粒径分布很广。而缓慢加料法因其前驱体一次颗粒分散性良好,由一次颗粒得到的二次颗粒粒径分布也很集中,因此如图3(c)和(d)所示,其烧结得到的正极材料的颗粒分散得更好,二次颗粒粒径更细小也更加均匀。这样由缓慢加料法制备的二次颗粒粒径为亚微米级的前驱体烧结而成的LiNi0.8Co0.1- Mn0.1O2正极材料相对于由快速加料法得到的材料,同电解液的接触将更加充分,同时其较小的粒径也将大大缩短充放电过程中锂离子在正极材料中的扩散距离,这都将有利于材料电化学性能的提高[21]。
2.3 电化学性能测试
对通过两种方法得到的LiNi0.8Co0.1Mn0.1O2材料进行电化学性能测试。在0.1 C倍率下,首次充放电曲线如图4所示。由缓慢加料法得到的LiNi0.8Co0.1Mn0.1O2其首次放电容量达到了223.5 mA·h/g,高于由快速加料法得到的LiNi0.8Co0.1Mn0.1O2的192.5 mA·h·/g,这主要是由于缓慢加料法制备的正极材料的颗粒粒径更小,达到了亚微米级,因此,更加有利于锂离子的脱嵌,从而能够获得更高的充放电比容量[3]。从图4还可以看出,由缓慢加料法得到的LiNi0.8Co0.1Mn0.1O2的充电电位要低于快速加料法得到的LiNi0.8Co0.1- Mn0.1O2的充电电位,而前者的放电电位要略高于后者的。这说明由缓慢加料法得到的正极材料在充放电过程中的过电位更小,具有更小的极化[11]。因此,降低加料速度确实能够制备出二次颗粒粒度更小的前驱体,进而得到电化学性能更好的正极材料。

图3 两种方法得到的LiNi0.8Co0.1Mn0.1O2的SEM像
Fig. 3 SEM images of LiNi0.8Co0.1Mn0.1O2 prepared by different feeding methods: (a), (b) Rapid feeding method; (c), (d) Slow feeding method
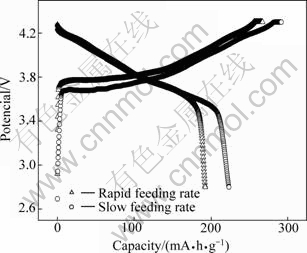
图4 两种方法得到的LiNi0.8Co0.1Mn0.1O2首次充放电曲线
Fig. 4 First charging-discharging curves of LiNi0.8Co0.1Mn0.1- O2 prepared by different feeding methods
两种方法得到的样品的循环性能如图5所示。循环性能测试表明,缓慢加料法得到的正极材料与快速加料法得到的正极材料相比,循环性能有显著的提高,其0.5 C和1 C倍率下首次放电比容量分别达到194.3和190.7 mA·h/g;在0.1 C、0.5 C和1C下30次循环后,其容量保持率分别有80.09%、80.80%和85.84%。而快速加料法得到的材料在0.5 C和1 C倍率下首次放电比容量分别只有149.3和151.9 mA·h/g;在0.1 C、0.5 C和1 C下循环30次后,其容量保持率分别有78.50%、 67.78%和57.87%。由缓慢加料法制备的二次颗粒粒度为亚微米级的前驱体烧结而成的LiNi0.8Co0.1Mn0.1O2正极材料循环性能得到较大提高,特别是大倍率下,循环性能的提高更加明显,这是由于其颗粒分散得更好,二次颗粒粒径更小也更加均匀,活性物质同电解液的接触将更加的充分,而较小的粒径也将大大缩短锂离子在正极材料中的扩散距离,从而有利于充放电过程中锂离子的脱出与嵌入[21]。
图6所示为两种方法得到的样品的循环伏安曲线,曲线上的氧化还原峰主要对应Ni2+/Ni3+、Ni3+/Ni4+以及Co3+/Co4+ 3个氧化还原电对,而LEVIA等[22]认为,4.3 V附近的峰还对应了LiNi0.8Co0.1Mn0.1O2中H1相向H2相的相转变。从图6可见,首次充电的主氧化峰对应的电位总是高于随后的循环中主氧化峰所对应的电位。LEVIA等[22]提出这是由于在动力学上,首次脱锂之后的脱锂过程相对于首次脱锂更加的容易。而OHZUKU等[23]则作出了更具体的解释,认为首次循环之后锂层中阳离子的排布将变得有序,从而更加有利于锂离子的脱出。从图6可以看出,与快速加料法相比,缓慢加料法得到的样品的循环伏安曲线更平滑,2~4次的循环伏安曲线重合度更高,说明由缓慢加料法制备的正极材料的循环性能要优于由快速加料法所制备的正极材料的。

图5 两种方法得到的LiNi0.8Co0.1Mn0.1O2的循环性能
Fig. 5 Cycle performance of LiNi0.8Co0.1Mn0.1O2 prepared by different feeding methods: (a) Rapid feeding method; (b) Slow feeding method
两种方法得到的样品充电至4.4 V时的交流阻抗谱如图7所示。其中,高频区的半圆与充电时形成的固体电解质膜造成的阻抗Rsl有关;中频区的半圆与电荷通过界面时产生的阻抗Rct有关,这个界面可能包括SEI膜-电解质界面以及活性物质颗粒-SEI膜界面; 低频区的斜线则与锂离子在活性物质中的扩散有关[24-25]。从图7可以看出,通过缓慢加料法得到的样品,高频区半圆的半径更大,说明其Rsl要更大,这表明降低反应物加料速度确实能够降低前驱体的二次颗粒粒径,得到二次颗粒粒径为亚微米级。因为颗粒更小的样品,比表面积更大,而更大的比表面积将使活性物质在循环过程中更多的与电解质接触,发生反应,从而生成更多的固体电解质膜,而固体电解质膜虽然对活性物质起到保护作用,但它也对电荷的传递造成阻碍,从而使Rsl增大[21]。
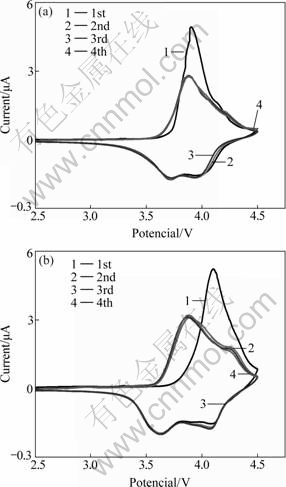
图6 两种方法得到的LiNi0.8Co0.1Mn0.1O2的循环伏安图
Fig. 6 Cyclic voltammograms of LiNi0.8Co0.1Mn0.1O2 prepared by different feeding methods: (a) Rapid feeding method; (b) Slow feeding method
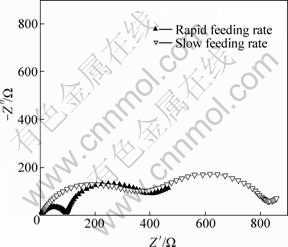
图7 两种方法得到的LiNi0.8Co0.1Mn0.1O2的交流阻抗谱
Fig. 7 EIS images LiNi0.8Co0.1Mn0.1O2 prepared by different feeding methods
3 结论
1) 缓慢加料法成功制备出二次颗粒粒径为亚微米级的Ni0.8Co0.1Mn0.1(OH)2前驱体,并由此得到性能更好的LiNi0.8Co0.1Mn0.1O2正极材料。
2) 所合成的LiNi0.8Co0.1Mn0.1O2正极材料属于六方晶型(空间群为R-3m),具有良好的层状结构,且无杂相存在。
3) 缓慢加料法可降低材料的粒径,得到二次颗粒粒径为0.5 μm左右的球形Ni0.8Co0.1Mn0.1(OH)2前驱体。
4) 由缓慢加料法得到的样品制备的正极材料电化学性能得到了很大的提高,在0.1 C、0.5 C和1 C下首次放电比容量分别达到223.5、194.3和190.7 mA·h/g,循环30次后,容量保持率为80.09%、80.80%和85.84%。
REFERENCES
[1] SHIN H S, SHIN D W, SUN Y K. Synthesis and electro- chemical properties of Li[Ni0.4Co0.2Mn(0.4-x)Mgx]O2-yFy via a carbonate co-precipitation [J]. Current Applied Physics, 2006, 6(S1): e12-e16.
[2] 郭炳焜, 徐 徽, 王先友, 肖立新. 锂离子电池[M]. 长沙: 中南大学出版社, 2005: 60.
GUO Bing-kun, XU Hui, WANG Xian-you, XIAO Li-xin. Lithium-ion battery [M]. Changsha: Central South University Press, 2005: 60.
[3] CHERALATHAN K K, KANG N Y, PARK H S, LEE Y J, CHOI W C, KO Y S, PARK Y K. Preparation of spherical LiNi0.80Co0.15Mn0.05O2 lithium-ion cathode material by continuous co-precipitation [J]. Journal of Power Sources, 2010, 195: 1486- 1494.
[4] SATHIYAMOORTHI R, SHAKKTHIVEL P, RAMALAKSHMI S, SHUL Y G. Influence of Mg doping on the performance of LiNiO2 matrix ceramic nanoparticles in high-voltage lithium-ion cells [J]. Journal of Power Sources, 2007, 171: 922-927.
[5] KIM J, KIM B H, BAIK Y H, CHANG P K, PARK H S, AMINE K. Effect of (Al, Mg) substitution in LiNiO2 electrode for lithium batteries [J]. Journal of Power Sources, 2006, 158: 641-645.
[6] MA X L, WANG C W, CHENG J G, SUN J T. Effects of Sn doping on the structural and electrochemical properties of LiNi0.8Co0.2O2 cathode materials [J]. Solid State Ionics, 2007, 178: 125-129.
[7] SHIN H S, SHIN D W, SUN Y K. Improvement of electrochemical properties of Li[Ni0.4Co0.2Mn(0.4-x)Mgx]O2-yFy cathode materials at high voltage region [J]. Electrochimica Acta, 2006, 52: 1477-1482.
[8] OKADA M, TAKAHASHI K, MOURI T. Synthesis and electrochemical characteristics of Li(Ni. M)O2 (M=Co, Mn) cathode for rechargeable lithium batteries [J]. Journal of Power Sources, 1997, 68: 545-548.
[9] PARK S H, OH S W, SUN Y K. Synthesis and structural characterization of layered Li[Ni1/3+xCo1/3Mn1/3-2xMox]O2 cathode materials by ultrasonic spray pyrolysis [J]. Journal of Power Sources, 2005, 146: 622-625.
[10] KANGA Y J, KIMA J H, LEE S W, SUN Y K. The effect of Al(OH)3 coating on the Li[Li0.2Ni0.2Mn0.6]O2 cathode material for lithium secondary battery [J]. Electrochimica Acta, 2005, 50: 4784-4791.
[11] LI D H, SASAKI Y, KOBAYAKAWA K, SATO Y. Morphological, structural, and electrochemical characteristics of LiNi0.5Mn0.4M0.1O2 (M=Li, Mg, Co, Al) [J]. Journal of Power Sources, 2006, 157: 488-493.
[12] HOLLMARK H M, DUDA L C, DAHBI M, SAADOUNE I, GUSTAFSSON T, EDSTR?M K. Resonant soft X-ray emission spectroscopy and X-ray absorption spectroscopy on the cathode material LiNi0.65Co0.25Mn0.1O2[J]. Journal of The Electrochemical Society A, 2010, 157(8): 962-A966.
[13] Koyama Y, Tanaka I, Adachi H, Makimura Y, Ohzuku T. Crystal and electronic structures of superstructural Li1-x[Co1/3Ni1/3Mn1/3]O2 (0≤x≤1)[J]. Journal of Power Sources, 2003, 119/121: 644-648.
[14] Kim J M, Chung H T. Role of transition metals in layered Li[Ni, Co, Mn]O2 under electrochemical operation [J]. Electro- chimica Acta, 2004, 49: 3573-3580.
[15] Hwang B J, Tsai Y W, Chen C H, Santhanam R. Influence of Mn content on the morphology and electrochemical performance of LiNi1-x-yCoxMnyO2 cathode materials [J]. Journal of Materials Chemistry, 2003, 13: 1962-1968.
[16] LI L J, LI X H, WANG Z X, GUO H J, YUE P, CHEN W, WU L. A simple and effective method to synthesize layered LiNi0.8Co0.1Mn0.1O2 cathode materials for lithium ion battery [J]. Powder Technology, 2011, 206: 353-357.
[17] KIM M H, SHIN H S, SHIN D W, SUN Y K. Synthesis and electrochemical properties of Li[Ni0.8Co0.1Mn0.1]O2 and Li[Ni0.8Co0.2]O2 via co-precipitation [J]. Journal of Power Sources, 2006, 159: 1328-1333.
[18] 胡国荣, 刘艳君, 彭忠东, 杜 柯, 高旭光. 控制结晶法合成球形正极材料LiNi0.8Co0.2O2及其电化学性能[J]. 中国有色金属学报, 2007, 17(1): 59-67.
HU Guo-rong, LIU Yan-jun, PENG Zhong-dong, DU Ke, GAO Xu-guang. Synthesize and properties of spherical cathode materials LiNi0.8Co0.2O2 by controlled crystallization method [J]. The Chinese Journal of Nonferrous Metals, 2007, 17(1): 59-67.
[19] 李洪桂. 冶金原理[M]. 北京: 科学出版社, 2007: 329.
LI Hong-gui. Metallurgical theory [M]. Beijing: Science Press, 2007: 329.
[20] 刘智敏. 锂离子电池正极材料层状LiNixCo1-2xMnxO2的合成与改性研究[D]. 长沙: 中南大学, 2009: 95-96.
LIU Zhi-min. The synthesis and modification of layered LiNixCo1-2xMnxO2 for lithium ion batteries [D]. Changsha: Central South University, 2009: 95-96.
[21] Santhanam R, Rambabu B. High rate cycling performance of Li1.05Ni1/3Co1/3Mn1/3O2 materials prepared by sol-gel and co-precipitation methods for lithium-ion batteries [J]. Journal of Power Sources, 2010, 195: 4313-4317.
[22] Levi E, Levi M D, Salitra G, Aurbach D, Oesten R, Heider U, Heider L. Electrochemical and in-situ XRD characterization of LiNiO2 and LiCo0.2Ni0.8O2 electrodes for rechargeable lithium cells [J]. Solid State Ionics, 1999, 126: 97-108.
[23] Ohzuku T, Ueda A, Nagayama M. Electrochemistry and structural chemistry of LiNi02 (R-3m) for 4 volt Secondary lithium cells [J]. Journal of The Electrochemical Society, 1993, 140(7): 1862-1870.
[24] Amalraj F, Kovacheva D, Talianker M, Zeiri L, Grinblat J, Leifer N, Goobes G, Markovsky B, Aurbach D. Synthesis of integrated cathode materials xLi2MnO3·(1-x)LiMn1/3Ni1/3Co1/3O2 (x=0.3, 0.5, 0.7) and studies of their electrochemical behavior [J]. Journal of The Electro- chemical Society A, 2010, 157(10): 1121-1130.
[25] M D Levi, K Gamolsky, D Aurbach, U Heider, R Oesten. On electrochemical impedance measurements of LixCo0.2Ni0.8O2 and LixNiO2 intercalation electrodes [J]. Electro- chimica Acta, 2000, 45: 1781-1789.
(编辑 何学锋)
基金项目:国家重点基础研究发展计划资助项目(2007CB613607)
收稿日期:2011-06-24;修订日期:2011-11-01
通信作者:王志兴,教授,博士;电话:0731-88836633;E-mail: 573905843@qq.com
摘 要:采用共沉淀法制备Ni0.8Co0.1Mn0.1(OH)2前驱体,与LiOH·H2O混合后在氧气气氛中焙烧得到LiNi0.8Co0.1Mn0.1O2正极材料,探讨共沉淀反应过程中快速加料和慢速加料制度对前驱体形貌和LiNi0.8Co0.1Mn0.1O2正极材料性能的影响。通过X射线衍射(XRD)、扫描电镜(SEM)和电化学测试对样品进行表征。结果表明:慢速加料法减小了材料的粒径,合成了平均粒径在0.5 μm左右的球形Ni0.8Co0.1Mn0.1(OH)2前驱体,且粒径分布比较集中;所合成LiNi0.8Co0.1- Mn0.1O2正极材料具有良好的层状结构,且无杂相存在;缓慢加料法得到的样品的电化学性能有很大提高,在0.1 C、0.5 C和1 C下首次放电比容量分别达到223.5、194.3和190.7 mA·h/g,循环30次后,容量保持率为80.09%、80.80%和85.84%。


