闪锌矿-MnO2同时发电浸出过程的动力学
肖 利1,柳建设2,夏乐先2,方 正1,邱冠周2
(1. 中南大学 化学化工学院,湖南 长沙,410083;
2. 中南大学 资源加工与生物工程学院,湖南 长沙,410083)
摘 要:
摘 要:将发电浸出技术用于闪锌矿-MnO2的同时浸出,建立了生物发电浸出的原电池体系,分别研究不同粒度、不同温度时,有菌和无菌条件对闪锌矿发电浸出的影响。采用未反应核模型来研究有菌和无菌发电浸出过程中化学反应和扩散现象、采用SEM研究同时发电浸出中A. f菌对闪锌矿表面的作用,结果表明:有菌时,闪锌矿粒度为16.6 μm时,12 h Zn2+浸出率达到32.01%,而达到同样的浸出率采用常规生物浸出时需要10 d;发电浸出过程的控制步骤是扩散;在阳极液中有菌时,发电浸出体系的活化能为11.97 kJ/mol,而无菌时的活化能为14.39 kJ/mol,这表明A. f菌能降低发电浸出反应的活化能。发电浸出进行24 h后,A. f菌能氧化发电浸出产生的硫。
关键词:
中图分类号:TF811 文献标识码:A 文章编号:1672-7207(2007)02-0291-06
Dynamics in simultaneous electrogenerative-leaching for
sphalerite-MnO2
XIAO Li1, LIU Jian-she2, XIA Le-xian2, FANG Zheng1, QIU Guan-zhou2
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. School of Resources Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract:The principle for the electro-generative leaching was applied to simultaneous leaching of sphalerite-MnO2. A galvanic system for the bio-electro-generative leaching was set up. The effects of grain size and temperature on rate of zinc extraction from sphalerite in the of presence and absence of A. ferrooxidans were studied, respectively. The unreacted shrinking core model was used for describing the reaction-relative and diffusion-relative phenomena presented in the process of the electro-generative leaching with and without bacteria, which is considered to be diffusion control. SEM was used to study the effect of A. ferrooxidans on the ores in the electro-generative simultaneous leaching. The results show that with bacteria, the maximum extraction of zinc from the ores with grain size of 16.6 μm can reach 32.01% for 12 h, while to obtain the same extraction ratio in the traditional bio-leaching route (i.e. not electro-generative one) takes ten days to ore granules with the same size. The activation energies of the anodic reaction for leaching system in the presence and in the absence of bacteria are calculated to be 11.97 and 14.39 kJ/mol, respectively, indicating that they can be decreased by A. ferrooxidans. The produced sulfur on the surface of the sulfides can be oxidized by A. ferrooxidans after bio-electro-generative leaching for 24 h.
Key words: sphalerite; electro-generative leaching; bio-oxidation; activation energy
闪锌矿是自然界中常见的金属硫化矿,许多研究者采用湿法浸出闪锌矿,并对其动力学进行了研究。例如:Crundwell[1]指出在闪锌矿的Fe3+浸出工艺中,闪锌矿的离解速率与铁离子的浓度成正比;Rodriguez等[2]认为,在闪锌矿的生物浸出过程中,闪锌矿的表面形成了一层硫膜,因此,该矿物浸出的控制步骤是扩散步骤。闪锌矿的浸出过程实质上是硫化物与氧化剂之间的放热氧化还原反应,矿物离解的能量大部分以热的形式释放,除小部分使反应体系温度升高而使反应速率有所提高外,大部分能量散发到环境中被浪费。采用发电浸出技术[3],硫化矿离解的Gibss自由能转变为可供利用的电功[4],同时获得浸出产物。在这种技术中,浸出反应被设计成原电池,电解槽的阴、阳两极区由阴离子膜连接[5-6],阴离子膜能够使阴阳两极区的阳离子分开,而阴离子却能自由迁移;阳极区由阳极电解液和硫化矿粉末电极组成,阴极区由强酸和MnO2粉末电极组成。采用这种技术可以简化浸出的有价金属离子净化处理,硫化物氧化生成的硫以单质形式存在,而不产生污染环境的气体H2S [7]和SO2[8] 。王少芬等[3]已将这一技术用于铜精矿-MnO2的同时发电浸出。但结果表明,阳极浸出产物单质硫会覆盖在反应物硫化矿的表面,阻碍阳极反应进一步进行。因此,要保证同时发电浸出反应彻底进行,要解决的关键问题是采用一种新技术来清除硫化物表面沉积的单质硫。作为生物氧化硫和亚铁离子的主要微生物,氧化亚铁硫杆菌(简称A. f菌)能利用溶液中的亚铁离子作为能源物质[9],也可以直接氧化固态硫[10],获得生长所需的能量。如果将A. f菌加到发电浸出电解槽的阳极区电解质中,使之氧化闪锌矿发电浸出过程中产生的硫,闪锌矿发电浸出的阻碍将会降低。本文作者将A. f菌加到发电浸出电解槽的阳极区电解质中,把利用微生物氧化发电浸出产生的单质硫的同时发电浸出过程,称为生物发电浸出过程(简称BEGL)。
本文作者研究了没有加入A.f菌的同时发电浸出过程(简称EGL)和生物发电浸出过程(BEGL)中Zn2+浸出过程动力学,并通过比较有A.f菌和无A.f菌时,闪锌矿的浸出动力学方程和活化能的变化,结合SEM的变化来分析A.f菌对闪锌矿的作用。同时发电浸出原电池体系的另一极MnO2,在浸出过程中被还原为Mn2+,但因为电极隔膜使A.f菌并不与MnO2直接作用,因此,本文对其不进行研究。
1 闪锌矿-MnO2同时发电浸出过程的电化学反应
将闪锌矿-MnO2同时发电浸出体系设计成原电池,发电浸出体系的总反应式如下:

当阳极液中加入A. f菌时,生物发电浸出体系的总反应式如下:

在研究采用的闪锌矿,为铁闪锌矿。因此,该闪锌矿浸出过程中会离解出亚铁离子,亚铁离子被A. f菌氧化后可生成具有氧化作用的3价铁离子,也可能加速闪锌矿的浸出[11]。亚铁离子作为微生物生长的能源物质按照下式反应[12-13]:
![]()
在生物发电浸出过程中,3价铁离子氧化闪锌矿被还原为2价,而2价铁离子由于A.f菌的作用,又可以变为3价,因此,该体系内能够形成铁离子的循环。
2 实 验
2.1 实验材料
实验所用的闪锌矿选自水口山,采用化学分析法得到主要元素质量分数如表1所示。矿物物相由日本理学D/max2550X射线衍射仪分析(分析条件为:Cu Kα辐射,40 kV,300 mA,扫描速度8(?)/min),结果表明该矿中含ZnS 和FeS。将矿物分级破碎,用英国Malvern激光粒度仪测得粒度分别为33.9,26.1,16.6和10.4 μm。采用KYKY2800扫描电镜分析发电浸出前后矿物的形貌,电压为25 kV,放大倍数为2 000倍。
表1 闪锌矿的化学成分(质量分数,%)
Table 1 Chemical compositions of sphalerite (mass fraction, %)

2. 2 发电浸出实验装置
本研究采用的实验装置是置于恒温水浴中的PVC电解槽,阴离子选择性膜将其分为阴极区和阳极区,体积各为200 mL,如图1所示。
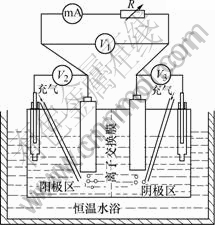
图1 实验装置图
Fig.1 Schematic diagram of experimental apparatus
阴、阳极分别采用MnO2和闪锌矿粉做成电极,阴、阳极电极结构如图2所示。为了增加粉末电极的导电性,MnO2(2.0 g)和闪锌矿(2.0 g)粉末先分别与乙炔黑(0.2 g)混合,然后分别装入孔径为45 μm的耐酸尼龙滤网布,压紧并与直径2.48 cm的炭棒相连做成电极以收集电流。该结构有利于有价金属离子离开矿物表面,也有利于生物氧化发电浸出当中A.f菌与硫化矿接触。在发电浸出过程中,阳极过电势V2缓慢上升,电池电势V1缓慢下降,阴极过电势V3也略有降低。

图2 阴、阳极电极结构
Fig.2 Sketch of anode and cathode structure
将2个充气搅拌器分别伸入阴、阳极电解液中,进行搅拌并为参与生物氧化发电浸出的A.f菌提供氧气。该实验所测pH值,发电浸出电池的输出电势V1,电极电势(vs. SCE)V2和V3,都用PHS-3C酸度计测定;输出电流用安培表测定,氧气浓度用Degussa氧气表测定。所有仪器在使用之前都经过校准。
2. 3 电解质溶液和A.f菌
为了比较研究生物发电浸出与发电浸出的阳极过程,发电浸出过程的阳极液采用适应A.f菌生长的培养基((NH4)2SO4 3.0 g/L, KCl 0.1 g/L, K2HPO4 0.5 g/L, MgSO4?7H2SO4 0.5 g/L, Ca(NO3)2 0.01 g/L),pH=1.8;同样的培养基连同进入指数生长期的A.f菌作为生物发电浸出过程的阳极液。
本实验采用的细菌采自中国云南,为纯化后的A. f菌yunnan 3 (PQ321745),并进行了闪锌矿的适应性培养。A.f菌进行发电浸出之前,在硫培养基中,((NH4)2SO4 3.0 g/L, KCl 0.1 g/L, K2HPO4 0.5 g/L, MgSO4?7H2SO4 0.5 g/L, Ca(NO3)2 0.01 g/L, S 10 g/L)生长,培养温度303 K。为了防止A.f菌生长过程中代谢产物对浸出反应的影响,每次生物发电浸出之前,将A. f菌离心收集,并使之在阳极电解液中浓度达到108个/mL。
因为阴离子可以在两极间自由通过,而A.f菌不能耐受Cl-离子,所以阴极电解液采用1 mol/L H2SO4而不是HCl。
实验所用试剂均为分析纯,水为蒸馏水。浸出溶液体系中溶解氧浓度为5.9 mg/L。
3 结果与讨论
3.1 闪锌矿粒度对发电浸出中锌离子的浸出率的影响
为了研究矿物粒度对锌离子提取率的影响,生物氧化发电浸出和发电浸出实验装置中阳极闪锌矿矿粉分别采用4种不同的粒度,保持实验温度为303 K。根据法拉第定律,一定时间内电池输出电流与电解液中离解出的离子成正比。为了保证锌离子较快离解,此时原电池装置的外电路采用较低的外电阻8 Ω。
经过12 h后,无菌和有菌时不同粒度下每组实验的输出电压和电流都显著下降,但有菌时每组实验的电流下降不及无菌时大。每隔30 min左右取阳极电解液分析Zn2+的浓度,以得到锌离子转化率与反应时间的动力学模型。
图3和4所示为Zn2+的转化率与时间的关系,从图中数据可得xB=kBt,这与未反应核收缩模型的一个特征方程相符合[14-15]。未反应核模型的特征方程以及相应的控制步骤如表2所示,表中xB为产物B的转化率,t为浸出时间,kB为速率常数,单位为min-1。
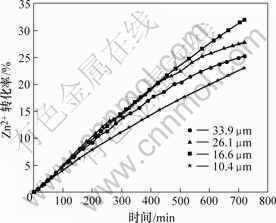
图3 有A.f菌时Zn2+转化率与反应时间的关系
Fig.3 Relationship between conversion ratio of Zn2+and timewith A. ferrooxidans
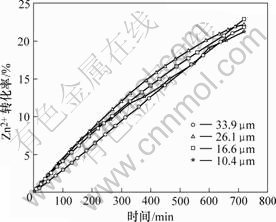
图4 无A.f菌时Zn2+转化率与反应时间的关系
Fig.4 Relationship between conversion ratio of Zn2+ and timewith A. ferrooxidans
表2 速率控制步骤与转化率—时间特征方程的关系
Table 2 Correspondence between rate-determining step and equation of conversion vs. time

因为生物发电浸出和无菌发电浸出的转化率与时间的关系都符合未反应核收缩模型特征方程xB=kBt,所以它们的速率控制步骤都是扩散控制,即阳极电解液扩散到硫化矿表面和产物硫离开外层向阳极液中扩散速度决定了该反应的总速度。
由图3和4可知,有菌体系中Zn2+的转化率随粒度变化比无菌体系的明显,这表明生物发电浸出受粒度影响较大。而且,矿物粒度和反应温度相同的条件下,有菌体系中Zn2+的转化率比无菌体系中要高,说明A.f菌能够氧化发电浸出产生的部分硫,促进发电浸出反应进行。
由图3可见,生物发电浸出12 h后,粒度为16.6 μm 时Zn2+最大转化率达到32.01%,表明粒度为16.6 μm是适合T.f菌吞噬生物发电浸出产生的硫的粒度。粒度从33.9~16.6 μm,随着粒度减小浸出率增大,表明硫产物层随粒度减小更容易被A.f菌氧化。但是,粒度为10.4 μm时,A.f菌对浸出影响较小,这可能是因为粒度太小,反应一段时间后电极容易板结,A.f菌难以与矿粒表面充分接触,从而使A.f菌吞噬硫的作用减弱。为了对比,用同样的A.f菌,氧化16.6 μm的闪锌矿,采用生物浸出方法,10 d左右才达到12 h生物发电浸出同样的转化率,这表明生物发电浸出是一种高效的浸出技术。
3.2 温度对闪锌矿发电浸出过程的影响以及发电浸出过程的表观活化能
为了研究温度对锌离子提取率的影响,生物氧化发电浸出和发电浸出分别选取A. f菌最适生长温度303 K左右的5个温度点:299,301,303,305和307 K。实验所用矿粒都是16.6 μm,原电池装置外电路采用外电阻8 Ω,浸出12 h。不同温度下速率常数分别由式(7)算得,如表3所示。
表3 生物发电浸出和发电浸出12 h后速率常数kB与Zn2+转化率的关系
Table 3 Rate Constant kB and Zinc Extraction Ratio for 12 h in BEGL and EGL
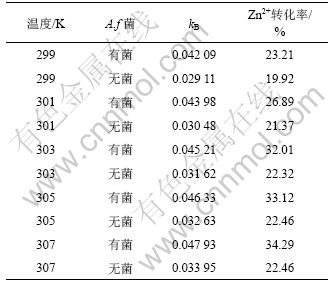
当温度从299 K 增加至 307 K时,生物发电浸出当中锌离子的提取率由23.21%增加到34.29%,而无菌的发电浸出中锌离子的提取率随温度增加不及生物发电浸出显著。这表明在A.f菌生长最适温度范围内,升高温度有利于生物发电浸出反应,也表明无菌条件下温度对闪锌矿发电浸出影响较小。这是因为无菌发电浸出12 h左右,矿物表面堆积的硫使反应难以进行,即使提高温度,浸出率改变也不明显;而生物发电浸出反应进行12 h左右,还能够继续进行,而且温度升高有利于矿物与微生物间的作用。
根据Arrhenius 方程:

分别用1/T对生物发电浸出反应和常规发电浸出反应的lgkB作图,得到如图5所示的2条直线,斜率均为(-Ea/2.303R)。根据图5计算生物发电浸出反应的活化能和无菌时发电浸出反应的活化能分别为11.97 和 14.39 kJ/mol。两者活化能的差别表明,A.f菌在矿物表面的作用降低了发电浸出反应的活化能。文献[11]中闪锌矿在FeCl3浸出体系中的活化能为46.9 kJ/mol。本实验所得活化能比文献中所报道的数值低,除了A.f菌的影响,还因为乙炔黑能够显著降低发电浸出反应的表观活化能[16]。
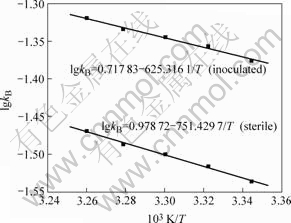
图5 有A.f菌和无A.f菌时lgkB—1/T曲线
Fig.5 lgkB—1/T curve with and without A.ferrooxidans
一般来说,当活化能低于20 kJ/mol时,该反应是由扩散控制[17]。这也从另一个角度证实了无论是有菌还是无菌,发电浸出过程都是阳极电解液扩散到硫化矿表面和固体S产物离开外层向阳极液中扩散来控制。因此,在12 h内,A.f菌并没有将硫彻底氧化。
3.3 发电浸出前后闪锌矿的SEM分析
为了观察发电浸出前后闪锌矿表面的变化,分别观察发电浸出前、发电浸出12和24 h后,以及生物发电浸出12和24 h后闪锌矿的形貌,SEM照片如图6所示。

(a) 发电浸出前; (b) 发电浸出12 h; (c) 发电浸出24 h; (d) 生物发电浸出12 h; (e) 生物发电浸出24 h
图6 闪锌矿发电浸出前后SEM照片
Fig.6 SEM images of sphalerite before and after leaching
从图6可以看出,发电浸出前,矿物表面比较平整。发电浸出后,闪锌矿表面发生了明显的变化。生物发电浸出24 h后,矿物表面已经变得比较光滑,而无菌发电浸出24 h后,大量的絮状S聚集在矿的表面。发电浸出12h后,有菌和无菌情况下矿物表面都有硫存在。
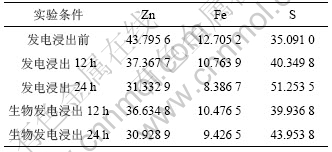
表4所示为电子能谱分析Zn,Fe和S 3种元素的原子比。无菌发电浸出24 h后样品中硫的摩尔分数比生物发电浸出后样品中硫的比例高,而发电浸出 12 h后两者相差不大。这表明A.f菌对矿物表面的硫的氧化随着时间的增加而增多。这一结论刚好与SEM的结果相符合。
表4 闪锌矿浸出前后主要元素的含量(摩尔分数,%)
Table 4 Atom percentage of main element for sphalerite before and after leaching (mole fraction, %)
4 结 论
a. 当有菌且闪锌矿粒度为16.6 μm时,采用生物发电浸出技术浸出12 h时Zn2+浸出率达32.1%,而要达到同样的Zn2+浸出率,采用传统的生物浸出技术需要10 d。
b. 无论是生物发电浸出还是常规发电浸出,浸出过程产生的单质硫阻碍了反应进一步进行。
c. 生物发电浸出24 h后,浸出产生的单质硫几乎可以被A.f菌完全氧化。生物发电浸出和发电浸出的活化能分别为11.97和14.39 kJ/mol。
d. 由于A.f菌降低了发电浸出反应的活化能,而且乙炔黑增加了电极的导电性,起电催化作用,因此,采用生物发电浸出技术能够清除硫化矿表面聚集的单质硫,有利于闪锌矿的浸出。
参考文献:
[1] Crundwell F K. Kinetics and mechanisms of the oxidative dissolution of a zinc sulphide concentrate in ferric sulphate solutions [J]. Hydrometallurgy, 1987, 19(1): 227-242.
[2] Rodriguez Y, Ballester A, Blazquez M L. New information on the sphalerite bioleaching mechanism at low and high temperature [J]. Hydrometallurgy, 2003, 71(1): 57-66.
[3] WANG S F, FANG Z. Simultaneous electrogenerative leaching of chalcopyrite concentrate and MnO2 [J]. J Cent South Univ Technol, 2006, 13(1): 49-52.
[4] Langer S H, Yurchak S. Electrochemical reduction of the benzene ring by electrogenerative hydrogenation [J]. Journal of the Electrochemical Society, 1969, 116(5): 1228-1230.
[5] Fang Z, Zhang Q R. Thermoelectrochemistry and its application to metallurgical research [J]. J Mater Sci Technol, 2001, 17(1): 20-24.
[6] Wang S F, Fang Z. Electrogenerative leaching of galena with ferric chloride [J]. Minerals Engineering, 2003, 16(3): 869-872.
[7] Ramachandra R S, Hepler L G. Equilibrium constants and thermodynamics of ionization of aqueous hydrogen sulfide [J]. Hydrometallurgy, 1977, 2(2): 293-299.
[8] Dalewski F. Removing arsenic from copper smelter gases [J]. JOM, 1999, 51(1): 24-26.
[9] Fowler T A, Crundwell F K. Leaching of zinc sulfide by Thiobacillus ferrooxidans: experiments with a ontrolled redox potential indicate no direct bacterial mechanism [J]. Appl Environ Microbiol, 1998, 64(12): 3570-3575.
[10] Hansford G S, Vargas T. Chemical and electrochemical basis of bioleaching process [J]. Hydrometallurgy, 2001, 59(1): 135-145.
[11] Bobeck G E, Su H. Kinetics of dissolution of sphalerite in ferric chloride solution [J]. Metallurgical Transactions B, 1985, 16(3): 413-424.
[12] Choi W K, Torma A E, Ohline R W. Electrochemical aspects of zinc sulphide leaching by Thiobacillus ferrooxidans [J]. Hydrometallurgy, 1993, 33(1): 137-152.
[13] GABRIEL D S. Relative importance of diffusion and reaction control during the bacterial and ferric sulphate leaching of zinc sulphide [J]. Hydrometally, 2004, 73(2): 313-324.
[14] Lizamza H M, Fairweather M J, Dai Z, Allegretto T D. How does bioleaching start [J]. Hydrometallurgy, 2003, 69(1-3): 109-116.
[15] Gudyanga F P, Mahlangu T. Reductive-Oxidative pretreatment of a stibnite flotation concentrate: Thermodynamic and kinetic considerations [J]. Minerals Engineering, 1998, 11(3): 563-580.
[16] WANG Shao-fen, FANG Zheng, WANG Yun-yan. Application of carbon paste electrode on the electro-generative leaching process of sulfide minerals [J]. Electrochemistry, 2005, 11(1): 77-82
[17] Fowler T A, Holmes P R, Crundwedd F K. On the kinetics and mechanism of the dissolution of pyrite in the presence of Thiobacillus ferrooxidans [J]. Hydrometally, 2001, 59(2): 257-270.
收稿日期:2006-10-09
基金项目:国家重点基础研究发展计划资助项目(2004CB619204);创新研究群体科学基金资助项目(50321402);国家自然科学基金资助项目(50374077)
作者简介:肖 利(1973-),女,湖南省湘潭市人,博士研究生,讲师,从事冶金物理化学的研究
通讯作者:肖 利,女,博士;电话:0731-8660356;E-mail: xiaoli_csu@163.com
leaching of galena with ferric chloride [J]. Minerals Engineering, 2003, 16(3): 869-872." target="blank">[6] Wang S F, Fang Z. Electrogenerative leaching of galena with ferric chloride [J]. Minerals Engineering, 2003, 16(3): 869-872.
[8] Dalewski F. Removing arsenic from copper smelter gases [J]. JOM, 1999, 51(1): 24-26.
" target="blank">[17] Fowler T A, Holmes P R, Crundwedd F K. On the kinetics and mechanism of the dissolution of pyrite in the presence of Thiobacillus ferrooxidans [J]. Hydrometally, 2001, 59(2): 257-270.


