乙醇结晶法提取硼铁矿酸浸液中的硫酸镁
张丽清1, 2,袁本福1, 2,周华锋1, 2,刘志国1, 2
(1. 沈阳化工大学 应用化学学院,辽宁 沈阳,110142;
2. 辽宁省高校硼资源生态化综合利用技术与硼材料重点实验室,辽宁 沈阳,110006)
摘 要:
醇结晶提取硼铁矿酸浸液中硫酸镁的新方法,并计算硫酸镁分别在水溶剂和水-乙醇混合溶剂中的溶剂化能以及溶解过程的焓变(△HS)和吉布斯自由能变(△GS),从理论上验证该方法的可行性。考察溶液pH、乙醇加入量、结晶温度和初始硫酸镁浓度对硫酸镁在水-乙醇相中结晶析出的影响。研究结果表明硫酸镁在水-乙醇混合溶液中结晶析出的最佳条件为:溶液pH在1.5~2.0之间,乙醇加入体积为溶液体积的1.5倍,结晶温度为常温(10~30 ℃) ,硫酸镁的初始浓度在1.5 mol/L以上。在此条件下,硫酸镁的析出率达到97.73%,通过XRD和TG测试分析验证结晶析出产品为七水硫酸镁,测定其纯度为99.10%,达到七水硫酸镁的国家化工行业标准HG/T 2680—2009中的Ⅰ类一等品的要求。
关键词:
中图分类号:TD 98;TQ 132.2 文献标志码:A 文章编号:1672-7207(2013)07-2681-07
Extracting magnesium sulfate from acid-leaching solution of ludwigite by ethanol crystallization
ZHANG Liqing1, 2, YUAN Benfu1, 2, ZHOU Huafeng1, 2, LIU Zhiguo1, 2
(1. College of Applied Chemistry, Shenyang University of Chemical Technology, Shenyang 110142, China;
2. Liaoning Provincial College Key Lab Boron Resource Ecologically Comprehensive Utilization of Boron Resource and Materials, Shenyang 110006, China)
Abstract: A new method that magnesium sulfate crystal extracted from acid-leaching solution of ludwigite using ethanol was proposed, and the feasibility of this method was discussed by calculating the enthalpy change (△HS) and Gibbs free energy change (△GS) of dissolving process and the solvation energy of magnesium sulfate both in water and water-ethanol. The effects of pH, crystallization temperature, the amount of ethanol and the initial concentration of magnesium sulfate on the crystallization rate of magnesium sulfate in ethanol-water were also discussed. The results show that the optimum processing parameters of magnesium sulfate crystallization in water-ethanol mixture are that the pH of solution is between 1.5 and 2.0, the volume ratio of solution to ethanol is 1:1.5, the crystallization temperature is room temperature and the initial concentration of magnesium sulfate is greater than 1.5 mol/L. Under this condition, the crystallization rate of magnesium sulfate can reach 97.73%. The product is determined as magnesium sulfate heptahydrate by XRD and TG, and the purity of it is 99.10%, which fits the first grade of classⅠindustrial products under the chemical industrial standard of China (HG/T 2680—2009) for magnesium sulfate heptahydrate.
Key words: ludwigite; water-ethanol; solvation; solvation energy; magnesium sulfate heptahydrate
我国的硼资源丰富,但是,可供开发利用的高品位硼矿石匮乏,57%的硼储量存在于硼品位较低(以B2O3计质量分数小于10%)的硼铁矿中[1-2]。硼铁矿矿石中镁、铁质量分数较高,主要有用矿物为硼镁石和磁铁矿,脉石矿物为蛇纹石和斜硅镁石,微量矿物为晶质铀矿和硼镁矿。主要矿物共生关系十分密切,连晶复杂,开发难度大,加工工艺复杂。目前,尚未开发出十分有效的从硼铁矿中提取分离硼、镁和铁的有效方法。现有对硼铁矿的综合利用研究报道大多出自国内,国外鲜有报道。在这些研究报道中主要有火法分离工艺和湿法分离工艺[3-8]。火法分离工艺主要是将硼铁矿直接焙烧或添加其他成分一起焙烧,生成硼质量分数较高的富硼渣和含硼铁精矿,再采用高品位硼矿石的方法制取硼化合物;湿法分离工艺主要是采用稀酸溶液直接溶解硼铁矿,使其中的硼和镁铁元素分别以硼酸和盐的形式进入酸浸液,再分别提取硼酸和镁盐、铁盐。但是,无论采用哪种分离方法,硼铁矿提硼过程中都会产生镁盐。因此,开发利用硼铁矿时,镁盐的提取和分离是必不可少的。硫酸镁是一种重要的化工原料,在现代工业中有着广泛的应用[9]。硫酸镁有很多种制备方法[9-11],其中主要的方法是矿石硫酸法,采用含镁矿石与硫酸作用生成硫酸镁,由于硫酸镁在水溶液中溶解度的限制,常温结晶时结晶率低,需采用高温结晶、低温结晶或蒸发溶剂结晶的方法制备硫酸镁固体,这些制备方法能耗较高,硫酸镁的结晶率不高。目前,低品位硼矿中的镁资源大多采用这些方法制备硫酸镁[12-14]。针对现有结晶工艺的不足,本文作者提出一种新的从硼铁矿硫酸酸浸液提取硫酸镁固体的新方法 —— 乙醇结晶法。
1 实验部分
1.1 实验试剂与仪器
实验采用辽宁凤城产的硼铁矿,经粉碎后过125 μm筛,其组成成分如表1所示。浓硫酸(H2SO4,质量分数为98%)为分析纯,北京北化精细化学品有限公司生产;无水乙醇为分析纯,天津市大茂化学试剂厂生产;氧化镁为分析纯,上海国药集团化学试剂有限公司生产;过氧化氢(H2O2,质量分数为30%),上海国药集团化学试剂有限公司生产。
表1 硼铁矿的化学组成(质量分数)
Table 1 Chemical composition of ludwigite %

主要仪器有:DF-101S集热式恒温水浴锅,郑州长城科工贸有限公司制造;增力电动搅拌器,上海标本模型厂制造;DHG-9030 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司制造;PHS-25数显pH计,上海精密科学仪器有限公司制造;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司制造;D8 Advance X线衍射仪,德国布鲁克公司制造;TGA/DSC 1热重分析仪,瑞士Mettler Toledo公司制造。
1.2 实验方法
称取10 g硼铁矿粉放入三口瓶中,用少量的去离子水润湿,加入10 mL 98%的浓H2SO4和40 mL去离子水,于90℃水浴中搅拌酸浸2 h后过滤,硼铁矿中含硼镁铁的矿物成分都与H2SO4反应,使得硼镁铁元素进入酸浸液中。反应方程式如下:
Mg(BO2)(OH)+H2SO4=MgSO4+H3BO3 (1)
Mg9Si4O16(OH)2+9H2SO4=9MgSO4+4SiO2+10H2O (2)
Mg3Si2O5(OH)4+3H2SO4=3MgSO4+2SiO2+5H2O (3)
Fe3O4+4H2SO4=Fe2(SO4)3+FeSO4+4H2O (4)
根据硫酸铁和硫酸亚铁常温下在乙醇中溶解度的差异,先将酸浸液中的亚铁离子氧化为铁离子。向酸浸液中滴加少量的30%的H2O2氧化其中的Fe2+,再利用MgO调节酸浸液的pH,然后加入一定量的无水乙醇,使得其中的镁离子以七水硫酸镁的形式析出,并考察酸浸液浓度、pH等因素对七水硫酸镁析出率的影响,得出乙醇结晶硫酸镁的最佳工艺条件。在最佳条件下制得七水硫酸镁后,再经除铁重结晶和干燥,即可得到预期的七水硫酸镁产品。实验流程图如图1所示。
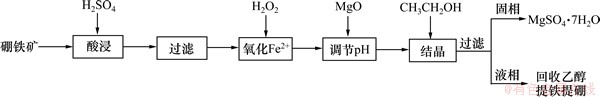
图1 实验流程图
Fig.1 Flow chart of experiment
2 乙醇结晶法提取硫酸镁的理论分析
硫酸镁在水中能很好的溶解,但在加入乙醇后却能析出,这是因为在水-乙醇相中硫酸镁的缔合结晶行为与其在纯水溶剂中的情况迥然不同。在一些关于醇-水混合溶剂中无机盐的结晶行为研究中指出[15-19],与纯水溶剂相比,混合溶剂在极性、黏度等性质上显著不同,造成离子与溶剂分子作用力和溶剂化能不同,从而使得混合溶剂中的正、负离子发生缔合作用而结晶析出。例如,Tung等[20]在水-乙醇混合溶剂中制备磷酸钙中指出,混合溶剂中离子的溶剂化能减弱,结晶时去溶剂化能垒降低,有利于离子晶体的结晶析出。
在溶液中不存在裸露的离子,离子能够以配位键和静电力的作用吸引溶剂分子形成溶剂化层,以溶剂化离子的形式存在。由裸露离子形成溶剂化离子的过程会释放出能量,称为离子的溶剂化能。溶剂化能是离子晶体化合物能够溶于溶剂中形成稳定溶液体系的主要原因之一:当离子的溶剂化能与离子晶体晶格能相当或大于离子晶体晶格能时,离子能很好的溶于溶剂之中;反之,当离子的溶剂化能小于离子晶体晶格能时,离子之间就会发生缔合作用,溶解度很小。这一点可以从溶解过程的热力学角度解释。从溶解过程的热力学Born-Haber循环来看,决定离子晶体的溶解能力的因素主要是离子的溶剂化能、离子晶体晶格能和离子溶剂化熵变[21-22],有以下关系式:
△GS=△HS-T△SS (5)
△HS=US+△G++△G- (6)
其中:△GS为溶解过程的自由能变;△HS为溶解过程的焓变;T为热力学温度;△SS为溶解过程的熵变;U为离子晶体晶格能;△G+为正离子的溶剂化能;△G-为负离子的溶剂化能。
在极性较强的水中,Mg2+和SO42-均能与水分子有效的溶剂化,但当加入乙醇后,乙醇分子会与离子竞争水分子,使得离子溶剂化层中的水分子被乙醇分子夺走。由于Mg2+也能与乙醇分子发生溶剂化,因此,会有乙醇分子进入Mg2+的溶剂化层,使得Mg2+与乙醇发生溶剂化;但是,因为SO42-的半径较大,电荷密度较小,不能与乙醇分子发生溶剂化[23]。
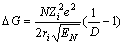 (7)
(7)
式中:N为阿佛加德罗常数;Zi为离子所带电荷;e为电子电量;ri为离子的半径;D为溶剂的介电常数;EN为离子的电负性。Mg2+在乙醇中的溶剂化能可以根据伯恩方程(式(7))计算[24]。根据文献[25-29]可得MgSO4,Mg2+和SO42-的水化能和其他相关热力学参数,可计算出298.15 K时硫酸镁分别在水溶液和乙醇水溶液中溶解过程的焓变、熵变和吉布斯自由能变,结果如表2所示。
表2 硫酸镁的有关热力学参数(kJ/mol, 298.15 K)
Table 2 Thermodynamic data of magnesium sulfate (kJ/mol, 298.15 K)
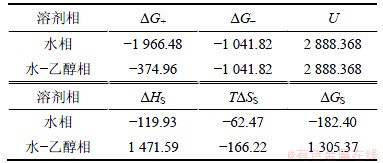
从上述数据可以看出,Mg2+在水-乙醇相中的溶剂化能远小于在水溶液中的,并且硫酸镁在水-乙醇相中的溶解焓变和自由能变都远大于零,说明硫酸镁在乙醇溶液中难以溶解的,这与硫酸镁在乙醇中的溶解度相一致(常温下MgSO4在乙醇中的溶解度为0.025 g)。因此,采用向酸浸液中加入乙醇的方法以结晶提取其中的硫酸镁是可行的。
3 结果与讨论
3.1 pH对七水硫酸镁析出率的影响
溶液的pH对七水硫酸镁在水-乙醇相中的析出影响很大,可能是因为在水-乙醇混合溶剂中硫酸二级电离的pKa比纯水溶剂中的大[30],有较多的HSO4-存在,降低Mg2+与乙醇分子的溶剂化作用,使得Mg2+与SO42-的缔合受阻。在实验过程中发现:在硫酸镁水溶液的pH很小(pH<0 )时,加入乙醇后几乎没有七水硫酸镁析出。取一系列不同pH、浓度为1.5 mol/L的硫酸镁溶液,在室温下加入相同量的无水乙醇,得到pH与七水硫酸镁的析出率的关系如图2所示。
从图2可见:随着pH增大,七水硫酸镁在水-乙醇相中的析出率增大;当pH增大到1.5时,七水硫酸镁的析出率达96%以上;再增大pH,对七水硫酸镁析出率影响不大,并且当pH过大(pH>2)时,溶液中Fe3+就会开始沉淀出来,使得析出的七水硫酸镁中含有较多铁杂质,不仅影响产品的品质,而且会造成一些铁的不必要的浪费。所以,综合考虑,pH选择1.5~2.0较为适宜。
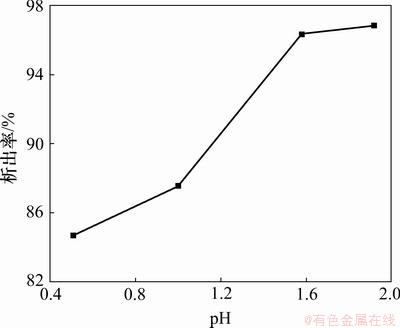
图2 pH对七水硫酸镁析出率的影响
Fig.2 Effect of pH on crystallization rate of magnesium sulfate
3.2 乙醇加入量对七水硫酸镁析出率的影响
由于乙醇和水可以以任意比例混溶,所以在硫酸镁水溶液中可以加入任意量的乙醇,加入的乙醇的越多,混合溶剂的介电常数越小,化学性质越与纯乙醇相近,则Mg2+与乙醇分子的溶剂化作用越强,就越利于七水硫酸镁的析出。取一系列浓度为1.5 mol/L,pH为1.7的硫酸镁水溶液,在室温下分别加入不同比例的无水乙醇,得到乙醇加入量与七水硫酸镁的析出率的关系如图3所示。从图3可见:随着乙醇加入量的增加,七水硫酸镁在混合溶液中的析出率逐渐变大;在加入的乙醇的体积与原溶液的体积比达到1.5:1时,七水硫酸镁的析出率达到96.85%;再继续加入乙醇对七水硫酸镁的析出率无多大影响。从生产成本上考虑,加入的乙醇量越多,设备体积要求增大,成本投入增加,而且同时增加后期蒸馏回收乙醇的成本。因此,选择乙醇的加入体积为原溶液的体积的1.5倍为宜。
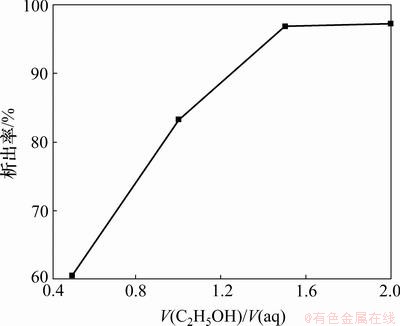
图3 乙醇加入量对七水硫酸镁析出率的影响
Fig.3 Effect of quantity of adding ethanol on crystallization rate of magnesium sulfate
3.3 温度对七水硫酸镁析出率的影响
取一系列浓度为1.5 mol/L,pH为1.7的硫酸镁溶液,加入相同量的无水乙醇,分别置于不同的温度环境下,观察七水硫酸镁的析出率与温度之间的关系,结果如图4所示。
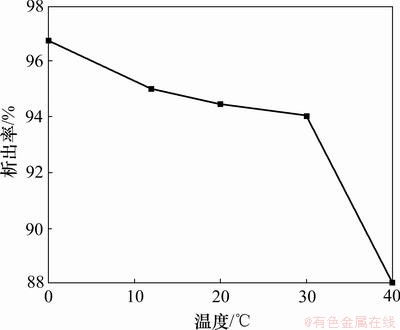
图4 温度对七水硫酸镁析出率的影响
Fig.4 Effect of temperature on crystallization rate of magnesium sulfate
从图4可见:在常温(0~30 ℃)下,七水硫酸镁在水-乙醇混合溶液中能很容易析出,并且析出率达到94%以上,温度较高时反而不利于七水硫酸镁的析出。
温度是影响晶体成长速率的最重要参数之一。在其他条件相同的情况下,生长速率随温度的提高而加快。但是,实际上,温度提高并不一定产生这种结果,原因在于:不仅粒子的扩散速度和相界面上的过程速度与温度有关,而且许多其他参数和特征也与温度有关,如溶液的黏度、相临界面上的比能等。此外,物质的溶解度与温度也有很大关系,大多数物质的溶解度随着温度的升高而增大。在水-乙醇混合溶剂中,在一定的温度范围内,温度越高,体相内部的溶剂分子的热运动速率越快,分子间的碰撞越激烈,就越不利于Mg2+和SO42-的缔合,因此,七水硫酸镁的析出率就会变小。所以,使用乙醇结晶的方法析出七水硫酸镁选择在常温(0~30 ℃)下进行为宜,并且这样的温度条件最容易实现,这与传统的高温结晶和低温结晶相比,操作更容易实现,条件温和,能耗较低。
3.4 初始浓度对七水硫酸镁析出率的影响
在常温(0~30 ℃)下,硫酸镁水溶液的饱和浓度为1.83~3.23 mol/L,在低于此浓度下,硫酸镁不会从溶液中自动析出,但是,加入乙醇后就能析出,并且根据浓度的不同析出率不同。在20℃下,取一系列不同浓度、pH为1.7的硫酸镁溶液,加入相同量的无水乙醇,观察七水硫酸镁的析出率与硫酸镁浓度之间的关系,结果如图5所示。
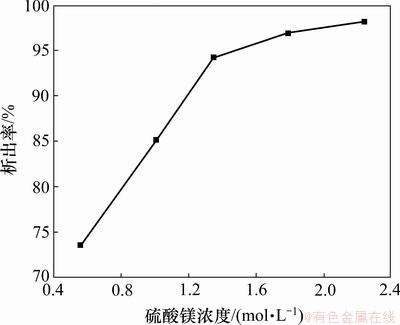
图5 硫酸镁浓度对七水硫酸镁析出率的影响
Fig.5 Effect of concentration on crystallization rate of magnesium sulfate
从图5可见:当硫酸镁初始浓度较低时,加入乙醇后七水硫酸镁的析出率也较低;随着硫酸镁初始浓度的增大,七水硫酸镁在水-乙醇混合溶液中的析出率也变大;当硫酸镁初始浓度达到1.5 mol/L时,七水硫酸镁的析出率达到95%以上。这是因为硫酸镁的浓度越大,单位体积内Mg2+的数量越多,Mg2+与乙醇分子的溶剂化率就越高,Mg2+和SO42-的缔合作用就越强,所以,七水硫酸镁的析出率就越大。因此,采用乙醇结晶法提取硼铁矿酸浸液中的硫酸镁时,原溶液中硫酸镁的初始浓度越大越好,一般要求大于1.5 mol/L。
3.5 产品的处理及分析测试
由乙醇结晶法提取的产品经重结晶除铁后,其表面附着的主要是乙醇,容易挥发,降低干燥所需要的条件。将重结晶除铁后得到的固体在35 ℃下干燥1.5 h,对产品进行XRD和TG测试分析,结果分别如图6和图7所示。
从图6中可见:产品在2θ为14.91°,16.69°,19.86°,21.16°,23.55°,25.86°,30.51°,31.08°,32.63°,33.71°和40.94°处出现明显的特征衍射峰,与数据库中七水硫酸镁衍射峰的标准卡片JCPDS 72-0696对应的一致,证明产品主要物相为七水硫酸镁。从图7可见:产品在48~90,90~130,130~160,160~200和200~300 ℃内质量分别损失5.78%,23.34%,7.28%,7.22%和7.44%,对应七水硫酸镁失去1个分子、3个分子、1个分子、1个分子和1个分子结晶水,并且在每个温度区间分别对应出现1个吸热峰,最后转变为无水硫酸镁。取适量产品在35 ℃下干燥至恒质量,采用化学方法测定其纯度为99.10%,达到七水硫酸镁国家化工行业标准HG/T 2680—2009中的Ⅰ类一等品的要求。
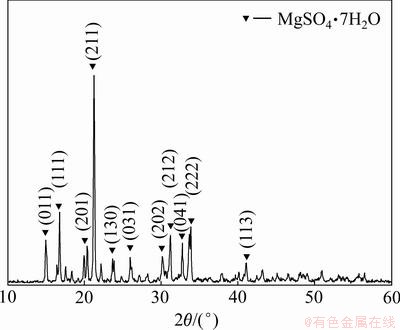
图6 产品的XRD谱图
Fig.6 XRD pattern of product
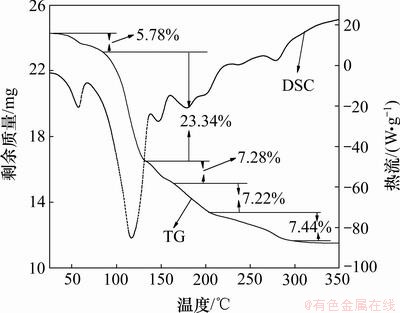
图7 产品的TG-DSC曲线(β=10 K/min)
Fig.7 TG-DSC curves of product (β=10 K/min)
4 结论
(1) 提出采用乙醇结晶的方法提取硼铁矿酸浸液中的硫酸镁的新工艺,并通过计算硫酸镁分别在水溶液和水乙醇混合溶液中的溶剂化能以及溶解过程中的焓变和吉布斯自由能变从理论上解释了该工艺的可行性。
(2) 确定乙醇结晶硫酸镁的最佳工艺为:在室温下,调节初始浓度为1.5 mol/L以上的硫酸镁溶液的pH在1.5~2之间,加入体积为溶液体积1.5倍的乙醇进行结晶。在此条件下,硫酸镁的结晶析出率达到97.73%,经重结晶除铁并干燥后对产品进行XRD和TG测试,验证产品主要物相为七水硫酸镁。
(3) 利用乙醇结晶法提取硼铁矿酸浸液中的硫酸镁,操作简单,条件温和,而且提取率较高,提取的七水硫酸镁的纯度达到99.10%,达到七水硫酸镁国家化工行业标准HG/T 2680—2009中的Ⅰ类一等品的要求。此外,提取滤液中的乙醇还可蒸馏回收循环利用。
参考文献:
[1] 刘然, 薛向欣, 刘欣, 等. 我国硼资源加工工艺和硼材料应用进展[J]. 硅酸盐通报, 2006, 25(6): 102-107.
LIU Ran, XUE Xiangxin, LIU Xin, et al. Progress on China’s boron resource and the current situation of boron-bearing materials[J]. Bulletin of the China Ceramic Society, 2006, 25(6): 102-107.
[2] PENG Qiming, Palmer M R. The paleoproterozoic Mg and Mg-Fe borate deposits of Liaoning and Jilin provinces, Northeast China[J]. Economic Geology, 2002, 97(1): 93-108.
[3] 张显鹏, 郎建峰, 崔传孟, 等. 低品位硼铁矿在高炉冶炼过程中的综合利用[J]. 钢铁, 1995, 30(12): 9-11.
ZHANG Xianpeng, LANG Jianfeng, CUI Chuanmeng, et al. Comprehensive utilization of low grade ludwigite ore with blast furnace smelting[J]. Iron and Steel, 1995, 30(12): 9-11.
[4] 安静, 薛向欣, 姜涛. 硼铁矿火法分离工艺生态压力研究[J]. 东北大学学报: 自然科学版, 2010, 31(4): 542-545.
AN Jing, XUE Xiangxin, JIANG Tao. Ecological pressure analysis of thermometallurgical separation process of paigeite ore[J]. Journal of Northeastern University: Natural Science, 2010, 31(4): 542-545.
[5] 张建良, 蔡海涛. 低品位硼铁矿中硼的富集[J]. 北京科技大学学报, 2009, 31(1): 36-40.
ZHANG Jianliang, CAI Haitao. Enrichment of boron in low-geade paigeite[J]. Journal of University of Science and Technology Beijing, 2009, 31(1): 36-40.
[6] 叶平亚, 吕秉玲. 翁泉沟硼镁铁矿的硫酸法加工[J]. 化工学报, 1996, 47(4): 447-453.
YE Pingya, L Bingling. Processing of ascharite-magnetite syngenetic mineral by sulfuric acid[J]. Journal of Chemical Industry and Engineering (China), 1996, 47(4): 447-453.
Bingling. Processing of ascharite-magnetite syngenetic mineral by sulfuric acid[J]. Journal of Chemical Industry and Engineering (China), 1996, 47(4): 447-453.
[7] LIU Sulan, CUI Chuanmeng, ZHANG Xianpeng. Pyrometallurgical separation of boron from iron in luduigite ore[J]. ISIJ International, 1998, 38(10): 1077-1079.
[8] 王小欢, 张丽清, 侯明艳, 等. 硼铁矿碳热氯化反应[J]. 过程工程学报, 2007, 7(4): 702-705.
WANG Xiaohuan, ZHANG Liqing, HOU Mingyan, et al. Carbonchlorination reaction of ludwigite[J]. The Chinese Journal of Process Engineering, 2007, 7(4): 702-705.
[9] 胡庆福. 镁化合物生产与应用[M]. 北京: 化学工业出版社, 2004: 357-385.
HU Qingfu. The production and application of magnesium compounds[M]. Beijing: Chemical Industry Press, 2004: 357-385.
[10] Grevel K D, Majzlan J. Internally consistent thermodynamic data for magnesium sulfate hydrates[J]. Geochimica et Cosmochimica Acta, 2009, 73(13): 6805-6815.
[11] Kilic  , Kilic A M. Recovery of salt co-products during the salt production from brine[J]. Desalination, 2006, 186(1/2/3): 11-19.
, Kilic A M. Recovery of salt co-products during the salt production from brine[J]. Desalination, 2006, 186(1/2/3): 11-19.
[12] 曹吉林, 赵蓓, 刘淑琴, 等. 翁泉沟硼镁铁矿的硫酸法加工[J]. 化工学报, 1996, 47(4): 454-460.
CAO Jinlin, ZHAO Bei, LIU Shuqin, et al. Processing of ascharite-magnetite syngenetic mineral by sulfuric acid[J]. Journal of Chemical Industry and Engineering (China), 1996, 47(4): 454-460.
[13] 李杰, 刘艳丽, 刘素兰, 等. 低品位硼镁矿制备硼酸及回收硫酸镁的研究[J]. 矿产综合利用, 2009(1): 3-6.
LI Jie, LIU Yanli, LIU Sulan, et al. Preparation of boric acid from low-grade ascharite and recovery of magnesium sulfate[J]. Multipurpose Utilization of Mineral Resource, 2009(1): 3-6.
[14] 张丽清, 刘素兰, 朱建新, 等. MgSO4-H3BO3-H2O体系水热条件下结晶动力学[J]. 物理化学学报, 2000, 16(5): 468-471.
ZHANG Liqing, LIU Sulan, ZHU Jianxin, et al. Crystallization dynamics of MgSO4-H3BO3-H2O under hydrothermal condition[J]. Acta Physico-Chimca Sinica, 2000, 16(5): 468-471.
[15] Manoli F, Dalas E. Spontaneous precipitation of calcium carbonate in the presence of ethanol, isopropanol and diethylene glycol[J]. Journal of Crystal Growth, 2000, 218(2/3/4): 359-364.
[16] Falini G, Gazzano M, Ripamonti A. Magnesium calcite crystallization from water-alcohol mixtures[J]. Chem Commun, 1996, 12(9): 1037-1038.
[17] Dickison S R, McGrath K M. Switching between kinetic and thermodynamic control: calcium carbonate growth in the presence of a simple alcohol[J]. Journal of Materials Chemistry, 2003, 13(3/4): 928-933.
[18] Lerner E, Azoury R, Sarig S. Rapid precipitation of apatite from ethanol-water solution[J]. Journal of Crystal Growth, 1989, 97(3): 725-730.
[19] CHEN Shaofeng, YU Shuhong, YU Bo, et al. Solvent effect on mineral modification: selective synthesis of cerium compounds by a facile solution Route[J]. Chemistry–A European Journal, 2004, 10(12): 3050-3058.
[20] Tung M S, O’Farrel T J. Effect of ethanol on the formation of calcium phosphates[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1996, 110(2): 191-198.
[21] 殷中意, 胥江河. 关于物质溶解过程本质的探讨[J]. 渝州大学学报: 自然科学版, 1996, 13(1): 56-62.
YIN Zhongyi, XU Jianghe. Probing into the nature of dissolving processes of matter[J]. Journal of Yuzhou University: Nat Scien Edit, 1996, 13(1): 56-62.
[22] 张雅明, 沃洛布耶夫 A F, 索洛玛季娜 N A, 等. 溴化钠在正丙醇-水混合溶剂中溶解热和溶剂化热[J]. 物理化学学报, 1994, 10(10): 904-908.
ZHANG Yaming, Woloubief A F, Suolamatina N A, et al. Enthalpies of solution and solvation of NaBr in aqueous mixtures of n-propanol[J]. Acta Physico-Chemica Sinica, 1994, 10(10): 904-908.
[23] 岳林海, 贾志刚, 金达莱, 等. 镁离子存在下乙醇-水混合溶液中碳酸钙结晶行为的研究[J]. 化学学报, 2006, 64(7): 623-628.
YUE Linhai, JIA Zhigang, JIN Dalai, et al. Study on the crystallization behavior of calcium carbonate in ethanol-water mixed solution in the presence of Mg2+[J]. Acta Chem Sin, 2006, 64(7): 623-628.
[24] Qureshi P M, Varshney R K. A very simple empirical modification of the bore equation[J]. Journal of Chemical Education, 1989, 66(8): 641.
[25] 天津大学物理化学教研室. 物理化学[M]. 4版. 北京: 高等教育出版社, 2001: 311-317.
Department of Physical Chemistry of Tianjin University. Physical Chemistry[M]. 4th ed. Beijing: Higher Education Press, 2001: 311-317.
[26] 张有民, 赵新生. 单原子离子溶剂化的研究[J]. 物理化学学报, 1986, 2(2): 110-118.
ZHANG Youmin, ZHAO Xinsheng. Study of solvation of monatomic ions[J]. Acta Physico-Chemica Sinica, 1986, 2(2): 110-118.
[27] 印永嘉. 物理化学简明手册[M]. 北京: 高等教育出版社, 1988: 120.
YIN Yongjia. Concise handbook of physical chemistry[M]. Beijing: Higher Education Press, 1988: 120.
[28] J A 迪安. 兰氏化学手册[M]. 2版. 北京: 科学出版社, 2003: 5.133-5.135.
Dean J A. Lange’s chemistry handbook[M]. 2nd ed. Beijing: Science Press, 2003: 5.133-5.135.
[29] David R L. CRC Handbook of chemistry and physics[M]. 90th ed. Florida USA: CRC Press LLC Headquarters, 2009-2010: 12.21-12.34, 12.29-12.30.
[30] 王洁, 杨家振, 张汝波, 等. 在i-PrOH-H2O混合溶剂中硫酸镁离子对缔合热力学研究[J]. 高等学校化学学报, 2001, 22(4): 651-653.
WANG Jie, YANG Jiazhen, ZHANG Rubo, et al. Thermodynamics of ionpair of [MgSO4]0 in i-PrOH water mixed solvent[J]. Chemical Journal of Chinese Universities, 2001, 22(4): 651-653.
(编辑 邓履翔)
收稿日期:2012-07-18;修回日期:2012-10-15
基金项目:辽宁省教育厅科学研究计划基金资助项目(05L336);辽宁省高校硼资源生态化综合利用与硼材料重点实验室资助项目(200602)
通信作者:张丽清(1963-),女,吉林长春人,博士,教授,从事矿物分离研究;电话:024-89383298;E-mail: zlqsyuct@163.com
摘要:提出一种通过乙醇结晶提取硼铁矿酸浸液中硫酸镁的新方法,并计算硫酸镁分别在水溶剂和水-乙醇混合溶剂中的溶剂化能以及溶解过程的焓变(△HS)和吉布斯自由能变(△GS),从理论上验证该方法的可行性。考察溶液pH、乙醇加入量、结晶温度和初始硫酸镁浓度对硫酸镁在水-乙醇相中结晶析出的影响。研究结果表明硫酸镁在水-乙醇混合溶液中结晶析出的最佳条件为:溶液pH在1.5~2.0之间,乙醇加入体积为溶液体积的1.5倍,结晶温度为常温(10~30 ℃) ,硫酸镁的初始浓度在1.5 mol/L以上。在此条件下,硫酸镁的析出率达到97.73%,通过XRD和TG测试分析验证结晶析出产品为七水硫酸镁,测定其纯度为99.10%,达到七水硫酸镁的国家化工行业标准HG/T 2680—2009中的Ⅰ类一等品的要求。
[1] 刘然, 薛向欣, 刘欣, 等. 我国硼资源加工工艺和硼材料应用进展[J]. 硅酸盐通报, 2006, 25(6): 102-107.
[3] 张显鹏, 郎建峰, 崔传孟, 等. 低品位硼铁矿在高炉冶炼过程中的综合利用[J]. 钢铁, 1995, 30(12): 9-11.
[4] 安静, 薛向欣, 姜涛. 硼铁矿火法分离工艺生态压力研究[J]. 东北大学学报: 自然科学版, 2010, 31(4): 542-545.
[5] 张建良, 蔡海涛. 低品位硼铁矿中硼的富集[J]. 北京科技大学学报, 2009, 31(1): 36-40.
[6] 叶平亚, 吕秉玲. 翁泉沟硼镁铁矿的硫酸法加工[J]. 化工学报, 1996, 47(4): 447-453.
[8] 王小欢, 张丽清, 侯明艳, 等. 硼铁矿碳热氯化反应[J]. 过程工程学报, 2007, 7(4): 702-705.
[9] 胡庆福. 镁化合物生产与应用[M]. 北京: 化学工业出版社, 2004: 357-385.
[12] 曹吉林, 赵蓓, 刘淑琴, 等. 翁泉沟硼镁铁矿的硫酸法加工[J]. 化工学报, 1996, 47(4): 454-460.
[13] 李杰, 刘艳丽, 刘素兰, 等. 低品位硼镁矿制备硼酸及回收硫酸镁的研究[J]. 矿产综合利用, 2009(1): 3-6.
[14] 张丽清, 刘素兰, 朱建新, 等. MgSO4-H3BO3-H2O体系水热条件下结晶动力学[J]. 物理化学学报, 2000, 16(5): 468-471.
[21] 殷中意, 胥江河. 关于物质溶解过程本质的探讨[J]. 渝州大学学报: 自然科学版, 1996, 13(1): 56-62.
[22] 张雅明, 沃洛布耶夫 A F, 索洛玛季娜 N A, 等. 溴化钠在正丙醇-水混合溶剂中溶解热和溶剂化热[J]. 物理化学学报, 1994, 10(10): 904-908.
[23] 岳林海, 贾志刚, 金达莱, 等. 镁离子存在下乙醇-水混合溶液中碳酸钙结晶行为的研究[J]. 化学学报, 2006, 64(7): 623-628.
[25] 天津大学物理化学教研室. 物理化学[M]. 4版. 北京: 高等教育出版社, 2001: 311-317.
[26] 张有民, 赵新生. 单原子离子溶剂化的研究[J]. 物理化学学报, 1986, 2(2): 110-118.
[27] 印永嘉. 物理化学简明手册[M]. 北京: 高等教育出版社, 1988: 120.
[28] J A 迪安. 兰氏化学手册[M]. 2版. 北京: 科学出版社, 2003: 5.133-5.135.
[30] 王洁, 杨家振, 张汝波, 等. 在i-PrOH-H2O混合溶剂中硫酸镁离子对缔合热力学研究[J]. 高等学校化学学报, 2001, 22(4): 651-653.


