SO42-/TiO2-MoO3催化合成丁醛乙二醇缩醛的研究
湖北师范学院化学与环境工程系,湖北师范学院化学与环境工程系,湖北师范学院化学与环境工程系 湖北黄石435002 ,湖北黄石435002 ,湖北黄石435002
摘 要:
以固体超强酸SO4 2 - /TiO2 MoO3为催化剂 , 对以丁醛和乙二醇为原料合成丁醛乙二醇缩醛的反应条件进行了研究。实验表明 :SO4 2 - /TiO2 MoO3是合成丁醛乙二醇缩醛的良好催化剂 , 较系统地研究了醛醇摩尔比、催化剂用量、反应时间诸因素对收率的影响。最佳反应条件为 :n (丁醛 ) ∶n (乙二醇 ) =1∶1.3 , 催化剂用量为反应物料总质量的 0 .5 %, 环己烷为带水剂 , 反应时间 45min。上述条件下 , 丁醛乙二醇缩醛的收率可达 68.1%。
关键词:
丁醛乙二醇缩醛;SO42-/TiO2-MoO3;催化;缩醛化;
中图分类号: TQ223
收稿日期:2003-04-01
基金:湖北省教育厅重点科研基金资助项目 ( 2 0 0 2A0 0 0 0 8);
Synthesis of Butyraldehyde Glycol Acetal by Using SO42-/TiO2-MoO3 as Catalyst
Abstract:
Butyraldehyde glycol acetal was synthesized from butyraldehyde and glycol in the presence of SO 4 2- /TiO 2 MoO 3. The factors influencing the yield of product and the optimum reaction conditions were discussed. The optimum conditions are as follows: molar ratio of butyraldehyde to glycol is 1∶1.3, quantity of catalyst is equal to 0.5% feed stock, and the reaction time is 45 min. SO 4 2- /TiO 2 MoO 3 is an excellent catalyst to synthesize butyraldehyde glycol acetal and the yield can be up to 68.1%.
Keyword:
butyraldehyde glycol acetal; SO 4 2- /TiO 2 MoO 3; catalysis; acetalization;
Received: 2003-04-01
缩醛 (酮) 是一类重要化合物, 通常用于保护羰基或作为合成中间体
1 实验部分
1.1 试剂及仪器
丁醛, 乙二醇, 环己烷, TiCl4, 稀H2SO4, 钼酸铵, 浓氨水均为分析纯, 实验用水均为二次蒸馏水; 标准磨口中量有机制备仪; PKW-Ⅲ型电子节能控温仪; Abbe折光计。 粉末衍射分析用岛津XRD-6000型X射线衍射仪, 由石墨单色器滤波, 用铜靶K α1辐射, 在管电压40 kV, 管电流30 mA的条件下测定, 扫描范围2θ 5°~70°; Nicolet 5DX型傅立叶变换红外光谱仪 (KBr压片) ; MERCURY-VX 300 核磁共振波谱仪 (CDCl3为溶剂, TMS为内标) 。
1.2 固体超强酸SO42-/TiO2-MoO3的制备方法
取一定量的TiCl4 (l) 快速用12% NH3·H2O水解至溶液呈碱性, 沉淀完全, 静置24 h后进行抽滤, 并用蒸馏水不断洗涤沉淀至无Cl-离子, 烘干后研磨至小于100目的Ti (OH) 4粉末。 取一定量Ti (OH) 4 粉末用0.5 mol·L-1的稀H2SO4浸泡24 h, 然后抽滤、 烘干, 用计量的钼酸铵溶液浸渍, 小火蒸干后在一定的温度下焙烧3 h, 冷却后研细即制成固体超强酸SO42-/TiO2-MoO3。 制备的催化剂SO42-/TiO2-MoO3用XRD谱及IR光谱检测确证。
1.3 催化合成丁醛乙二醇缩醛的操作方法
在100 ml三颈瓶中按一定计量比加入丁醛, 乙二醇, 带水剂和一定量的催化剂, 装上温度计、 分水器和回流冷凝管, 加热回流, 反应至无水分出为止。 将反应液倾出, 催化剂因不溶于反应液而留在反应瓶中。 倾出后的反应液用水洗至中性, 然后用无水MgSO4干燥, 常压蒸馏收集沸程为130~134 ℃之间的馏分, 即得无色透明具有果香味的液体产品, 测定折光率, 称量计算收率。
2 结果与讨论
2.1 催化剂SO42-/TiO2-MoO3的表征
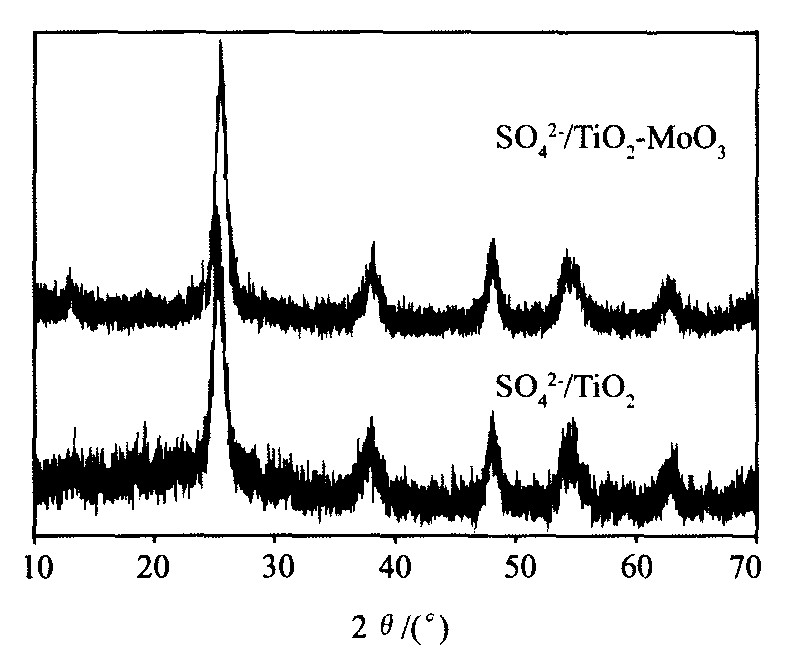
红外光谱检测结果表明, SO42-/TiO2-MoO3催化剂的IR特征吸收峰为1384, 1132, 1043 cm-1, 表明催化剂表面有含硫物种存在, 能诱导产生强酸中心。 图1示出了催化剂SO42-/TiO2-MoO3的XRD谱。 由图1的XRD谱可知, 两种催化剂SO42-/TiO2-MoO3和SO42-/TiO2均表现锐钛矿晶相, 二者XRD衍射峰对应的2θ 值基本一致, 但SO42-/TiO2的衍射峰较宽, 而SO42-/TiO2-MoO3的衍射峰较尖、 较高, 由此可以推测, MoO3的引入有利于表面的晶化, 从而增大催化剂的比表面积, 提高了催化剂的催化活性。 另外, 从SO42-/TiO2-MoO3的XRD谱中观察不到MoO3的衍射峰, 这是由于MoO3的含量存在一阈值, 当MoO3的含量低于该值时, 在XRD衍射峰中观察不到MoO3物相的存在。
2.2 反应条件的优化
2.2.1 醛醇量比对收率的影响
图1 催化剂SO42-/TiO2-MoO3的XRD谱
Fig.1 XRD spectra of SO42-/TiO2-MoO3
从化学平衡的角度考虑, 增大任何一种反应物的量都有利于提高丁醛转化率, 但实验表明丁醛在水中的溶解度较乙二醇小, 洗涤时难以除去, 而且丁醛沸点较产品稍低, 蒸馏时难以分开, 造成后处理困难, 所以实验中采用乙二醇稍过量, 但乙二醇过量太多会造成乙二醇的浪费及加重后处理工序。 本实验固定丁醛为0.2 mol, 催化剂用量为反应物料总质量的0.5%, 加入8 ml环己烷作带水剂, 改变乙二醇的用量, 控制回流温度反应45 min。 考察不同醛醇量比r对产品收率的影响, 结果见表1。
由表1可见, 增加乙二醇的用量有利于提高收率, 当r=1∶1.3时, 收率达到最大, 再增加乙二醇的量, 则收率反而下降。 因此选择最佳r=1∶1.3。
2.2.2 催化剂的用量对收率的影响
催化剂用量是指催化剂质量与反应物总质量的百分比。 由已确定的r=1∶1.3, 加入8 ml环己烷作带水剂, 通过改变催化剂用量, 控制回流温度反应45 min。 考察不同催化剂用量对产品收率的影响, 结果见表2。
由表2可见, 在此反应条件下, 催化剂用量占反应物料总质量的0.5%时, 产品收率最高。 本实验取催化剂的用量为0.5%, 因为再增加催化剂的用量, 产品收率基本不变。
2.2.3 反应时间对收率的影响
在已确定的最佳r=1∶1.3, 最佳催化剂用量条件下, 控制一定的回流温度进行不同反应时间实验, 其结果见表3。
从表3数据及反应分水情况可知, 反应进行到45 min时, 反应基本完成, 再延长反应时间, 产品收率反而减小。 综合考虑能耗与收率, 本实验选择反应时间以45 min为宜。
表1 n (丁醛) ∶n (乙二醇) 量比对收率的影响
Table 1Effect of ratio of butyraldehyde to glycol on yield
醛醇量比 |
1∶1.1 | 1∶1.3 | 1∶1.5 | 1∶1.7 |
收率/% |
65.1 | 68.1 | 59.9 | 53.0 |
表2 催化剂用量对收率的影响
Table 2 Effect of catalyst amount on yield
催化剂用量/% |
0.25 | 0.5 | 1.0 | 1.5 | 2.0 |
收率/% |
63.4 | 68.1 | 66.8 | 66.8 | 61.2 |
表3 反应时间对收率的影响
Table 3 Effect of reaction time on yield
反应时间/min |
30 | 45 | 60 | 90 |
收率/% |
68.0 | 68.1 | 66.5 | 66.4 |
2.3 催化剂的回收与重复利用
反应在最佳条件下进行。 为了考察催化剂的重复使用效果, 待第一次反应结束后, 分离出催化剂, 于500 ℃温度下活化3 h, 再加入同样醛醇物质的量比的反应物, 按上述方法继续反应。 实验结果表明: 催化剂经再生后使用5次, 对收率影响不大, 所以催化剂经再生可重复使用。 使用SO42-/TiO2-MoO3催化合成丁醛乙二醇缩醛不仅具有催化剂用量少, 活性高等特点, 且其重复使用性能较好, 从而克服了其价格高的缺点。 但从收率看, 催化剂活性有所下降, 如何提高恢复催化剂的活性以保证产品收率, 尚需进行深入研究。
2.4 不同催化剂活性比较
表4分别列出了磷钨酸
由表4可知SO42-/TiO2-MoO3催化剂催化合成丁醛乙二醇缩醛所需的反应时间短, 且其催化活性明显高于磷钨酸和 Fe2 (SO4) 3·xH2O。 这是因为SO42-/TiO2-MoO3催化剂表面有含硫物种存在, 能产生酸催化中心, MoO3的引入有利于表面的晶化, 增大催化剂比表面积, 提高了催化剂的催化活性。
2.5 催化机制
根据酸催化羰基亲核加成的反应机制
2.6 产品分析鉴定
按本法制得丁醛乙二醇缩醛产物的主要红外光谱数据ν/cm-1 (IR, KBr) : 1146, 1123, 1057, 1023和946, 与文献
表4 不同催化剂催化活性比较
Table 4Catalytic activities data of H3PW12O40, Fe2 (SO4) 3·xH2O and SO42-/TiO2-MoO3
| 催化剂 | 醛醇量比 | 反应时间/h | 收率/% |
磷钨酸 |
1∶1.5 | 2.0 | 53.3 |
Fe2 (SO4) 3·xH2O |
1∶1.5 | 6.0 | 56.0 |
SO42-/TiO2-MoO3 |
1∶1.3 | 0.75 | 68.1 |
3 结 论
合成丁醛乙二醇缩醛的最佳条件为: n (醛) ∶n (醇) =1∶1.3, 催化剂用量为反应物料总质量的0.5%, 环己烷为带水剂, 反应时间45 min。 上述条件下, 丁醛乙二醇缩醛的收率为68.1%。 缩醛化反应温度低, 反应时间短, 催化剂用量少且可较好地回收循环使用, 无废酸排放, 工艺流程简便, 可降低生产成本。 因此, SO42-/TiO2-MoO3是合成丁醛乙二醇缩醛的优良催化剂, 具有良好的应用前景。
参考文献
[2] BrunsK , ConradJ , SteigelA . Stereochemistryofcycliccom poundsⅠ[J].Tetrahedron, 1979, 35:2523.
[5] 杨水金, 陈露春, 梁永光, 等. TiSiW12O40/TiO2催化合成环己酮1, 2丙二醇缩酮[J].精细化工, 2002, 19 (10) :600.
[6] 杨水金, 陈露春, 梁永光, 等. TiSiW12O40/TiO2催化合成环己酮缩乙二醇[J].化学试剂, 2003, 25 (2) :100.
[7] 毛东森, 卢冠忠, 陈庆龄, 等. 负载型氧化物固体超强酸催化剂的制备及应用[J].化学通报, 2001, (5) :278.
[8] 杨辉荣, 邓鹏飞, 宋晓锐, 等. 固体超强酸SO42-/ZrO2TiO2催化剂的研制及其催化合成草莓酸酯的研究[J].精细化工, 2000, 17 (9) :534.
[9] 赵菊仙, 成占胜, 行春丽. WO3TiO2SO42-固体超强酸合成柠檬酸三丁酯[J].化工科技, 2002, 10 (5) :11.
[10] 马德埒, 黎 源. WO3TiO2SO42-固体超强酸催化剂的制备及应用研究[J].精细化工, 2002, 19 (1) :36.
[11] 张晋芬, 陈 铜, 张德新, 等. 缩醛 (酮) 的杂多酸催化合成[J].香料香精化妆品, 1995, (4) :25.
[12] 李叶芝, 黄化民, 金 辉, 等. 硫酸铁催化环己酮的缩合反应和缩醛 (酮) 反应[J].吉林大学学报, 1989, (2) :113.
[13] [美]莫里森RT , 博伊德RN著. 复旦大学化学系有机化学教研组译.有机化学 (下册) [M].北京科学出版社, 1983.523.
[14] 王存德, 杨新华, 钱文元. 固体超强酸TiO2/SO42-催化合成缩醛 (酮) [J].精细化工, 1992, 9 (1) :4.
[2] BrunsK , ConradJ , SteigelA . Stereochemistryofcycliccom poundsⅠ[J].Tetrahedron, 1979, 35:2523.
[5] 杨水金, 陈露春, 梁永光, 等. TiSiW12O40/TiO2催化合成环己酮1, 2丙二醇缩酮[J].精细化工, 2002, 19 (10) :600.
[6] 杨水金, 陈露春, 梁永光, 等. TiSiW12O40/TiO2催化合成环己酮缩乙二醇[J].化学试剂, 2003, 25 (2) :100.
[7] 毛东森, 卢冠忠, 陈庆龄, 等. 负载型氧化物固体超强酸催化剂的制备及应用[J].化学通报, 2001, (5) :278.
[8] 杨辉荣, 邓鹏飞, 宋晓锐, 等. 固体超强酸SO42-/ZrO2TiO2催化剂的研制及其催化合成草莓酸酯的研究[J].精细化工, 2000, 17 (9) :534.
[9] 赵菊仙, 成占胜, 行春丽. WO3TiO2SO42-固体超强酸合成柠檬酸三丁酯[J].化工科技, 2002, 10 (5) :11.
[10] 马德埒, 黎 源. WO3TiO2SO42-固体超强酸催化剂的制备及应用研究[J].精细化工, 2002, 19 (1) :36.
[11] 张晋芬, 陈 铜, 张德新, 等. 缩醛 (酮) 的杂多酸催化合成[J].香料香精化妆品, 1995, (4) :25.
[12] 李叶芝, 黄化民, 金 辉, 等. 硫酸铁催化环己酮的缩合反应和缩醛 (酮) 反应[J].吉林大学学报, 1989, (2) :113.
[13] [美]莫里森RT , 博伊德RN著. 复旦大学化学系有机化学教研组译.有机化学 (下册) [M].北京科学出版社, 1983.523.
[14] 王存德, 杨新华, 钱文元. 固体超强酸TiO2/SO42-催化合成缩醛 (酮) [J].精细化工, 1992, 9 (1) :4.