Li1+xV3O8的固相法合成及高温电化学特性研究
中南大学粉末冶金国家重点实验室,中南大学粉末冶金国家重点实验室,中南大学粉末冶金国家重点实验室 湖南长沙410083 ,湖南长沙410083 ,湖南长沙410083
摘 要:
以NH4VO3, Li2CO3为原料, 无水乙醇为介质, 采用一种新的固相法合成了Li1+xV3O8。运用TG/DSC, XRD, SEM等手段进行了表征, 测量了Li1+xV3O8的高温电导率, 求出了电导活化能;并研究了Li1+xV3O8的热稳定性。制备的Li1+xV3O8的形状为棒状和条状, 长端约10μm, 短端约5μm。热分析结果表明, 其结构不随温度改变而改变, 直到628℃熔化。在500℃时, 当电流密度为100 mA.cm-2时, Li1+xV3O8的峰值电压为2.77 V, 终止电压为1.8 V时, 比容量为198 mAh.g-1。室温550℃, Li1+xV3O8的电导率和温度的关系式为lnσ=1.5052.141×103/T, 说明在该温度区间Li1+xV3O8具有始终如一的电子跃迁机构, 其电导活化能为0.185 eV。
关键词:
中图分类号: TM911;
收稿日期:2005-08-01
基金:国家自然科学基金资助项目 (50002015);
Solid-State Synthesis and High-Temperature Electrochemical Characteristics of Li1+xV3O8
Abstract:
Li1+xV3O8 was synthesized by means of a novel solid-state method, in which the materials were NH4VO3, Li2CO3 and absolute alcohol.The Li1+xV3O8 powder was characterized by thermogravimetric analysis (TGA) /differential scanning calorimetry (DSC) , X-ray diffraction (XRD) and scanning electron microscopy (SEM) .The high-temperature electrical conductivity, activated energy of electrical conductivity and thermal stability of Li1+xV3O8 were measured.The shape of Li1+xV3O8 is a stick or strip, of which the long end is about (10 μm) and the short end is about (5 μm) .The results of thermal analysis show that the structure does not change with the temperature until it melt at 628 ℃.The peak voltage of Li1+xV3O8 is 2.77 V at 100 mA·cm-2 and 500 ℃ and the specific capacity reaches 198 mAh·g-1 at cut-off voltage of 1.8 V.From room temperature to 550 ℃, the formula of electrical conductivity of Li1+xV3O8 and temperature is lnσ=1.505-2.141×103/T, which shows a consistant electron-transition mechanism for Li1+xV3O8.Activated energy of electrical conductivity of Li1+xV3O8 is 0.185 eV.
Keyword:
Li1+xV3O8;synthesis;electrochemical;high-temperature electrical conductivity;thermal stability;
Received: 2005-08-01
层状化合物Li1+xV3O8最初作为锂蓄电池正极材料
Li1+xV3O8的主要制备方法有: Li2CO3与V2O5高温固相反应
1 实 验
将NH4VO3和Li2CO3按化学式计量n (Li∶V) =1.2∶3配好, 加入无水乙醇进行湿磨混料8 h, 然后在干燥箱中85 ℃将无水乙醇除去。 再将沉渣在真空干燥箱中160~180 ℃干燥5 h, 得黄褐色粉末, 将粉末缓慢升温至600 ℃保温24 h。 随炉冷却至室温, 取出研磨得蓝黑色粉末。 实验所用试剂均为分析纯。
物相和结构分析采用日本Rigaku D/max2550VB+18 kW转靶X射线衍射仪 (40 kV/300 mA, 步长0.02°, Cu靶, λ=0.15406 nm, 10°≤2θ≤80°) ; 前驱体粉末用德国耐弛STA449C型热分析仪分别进行了TG/DSC检测 (空气, 10 ℃·min-1) ; 日本JSM-5600LV型扫描电镜观察产物形貌; x-y函数记录仪测量电压随时间的变化曲线; Li1+xV3O8的热稳定性由美国SDT Q600型热分析仪进行了TG/DSC检测 (N2, 10 ℃·min-1) 。
高温电导率的测量采用实验室自行设计的高温电导率测试仪, 其原理是直流四端电极法
模拟Li-B/LiCl-KCl/Li1+xV3O8片型单电池在500 ℃的放电试验。 含Li 67% (质量分数) 的Li-B合金是Li7B6和Li的两相材料 (自制, 厚度为0.6~0.65 mm) , 电解质隔离片 (0.4 g) 是含30%轻质MgO的LiCl-KCl共熔盐 (质量比为45∶55, 熔点为352 ℃) 的粉末压制片。 将Li1+xV3O8中加入20%的LiCl-KCl, 混合均匀后, 450 ℃保温1 h, 快速冷却后捣碎压片, 作为正极。 极片直径为17.5 mm, 集流片为1 mm厚的钼片 (由于Mo片的导热性好, 273 K时的导热率为1.4 W·cm-1· (°) -1) , 极片的制作及电池的组装均在通入干燥空气的手套箱内 (相对湿度≤2%) 完成, 以防止吸潮。 将模拟电池送入两块500 ℃恒温的金属压块间, 空载1 min后加上负载, 以不同电流密度进行放电试验, 终止电压为1.2 V。
2 结果与讨论
2.1 Li1+xV3O8的合成机制
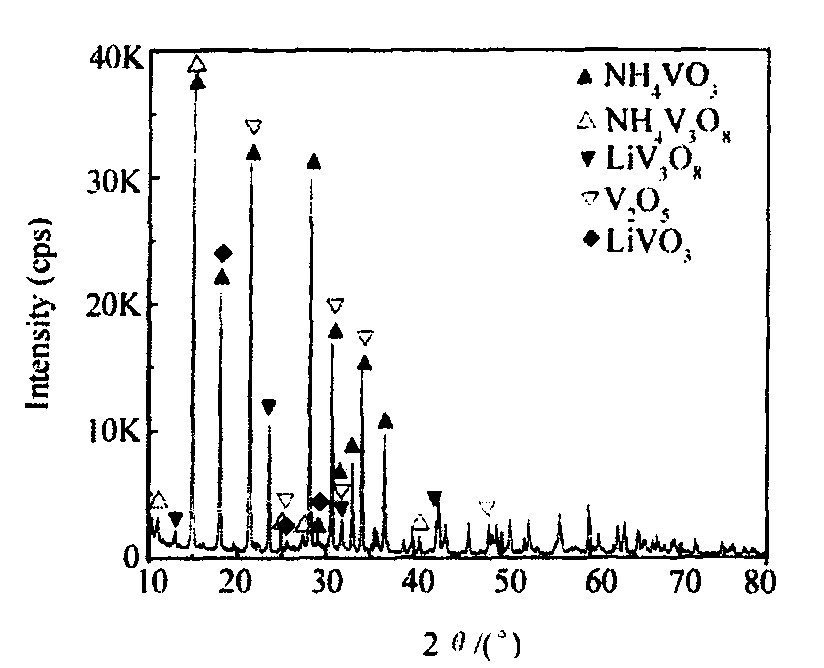
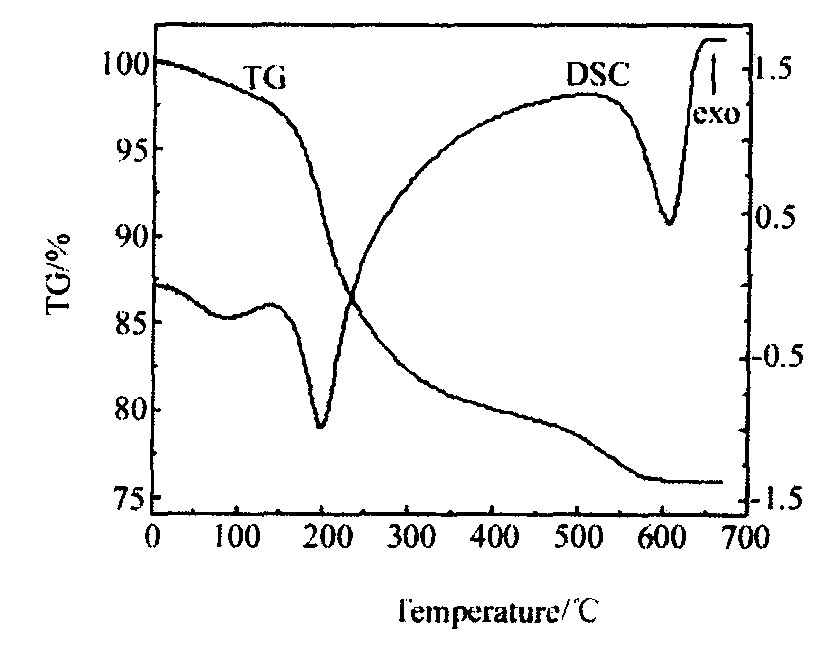
图1和2分别是160~180 ℃真空干燥后所得前驱体粉末的XRD图谱及TG/DSC曲线。 从图1可以看出, 前驱体主要由NH4VO3, NH4V3O8和少量的LiV3O8, V2O5, LiVO3组成。 干燥过程中放出大量刺激性气味的氨气, 这是由于NH4VO3发生分解, 进行下列反应
6NH4VO3→2NH4V3O8+4NH3↑+2H2O (1)
反应 (1) 完全进行时理论失重率达13.16%, 对应图2中200 ℃的强吸热峰。 继续升温, NH4V3O8与Li2CO3, LiVO3与V2O5进行下列反应:
2NH4V3O8+Li2CO3→2LiV3O8+2NH3+CO2+H2O (2)
LiVO3+V2O5→LiV3O8 (3)
反应 (2) 式的理论失重率达12.63%, 对应图2中200~570 ℃之间的转变。 570 ℃时, 重量已无明显变化, Li1+xV3O8合成反应已经完成。 总反应方程式为:
6NH4VO3+Li2CO3→2LiV3O8+6NH3↑+CO2+3H2O (4)
反应 (4) 式的总失重率达25.79%, 与图2的结果相一致, 80~90 ℃的吸热峰, 是由于粉末中少量水分的失去所造成的。 620 ℃时发生Li1+xV3O8的熔化, DSC曲线上出现大的吸热峰。
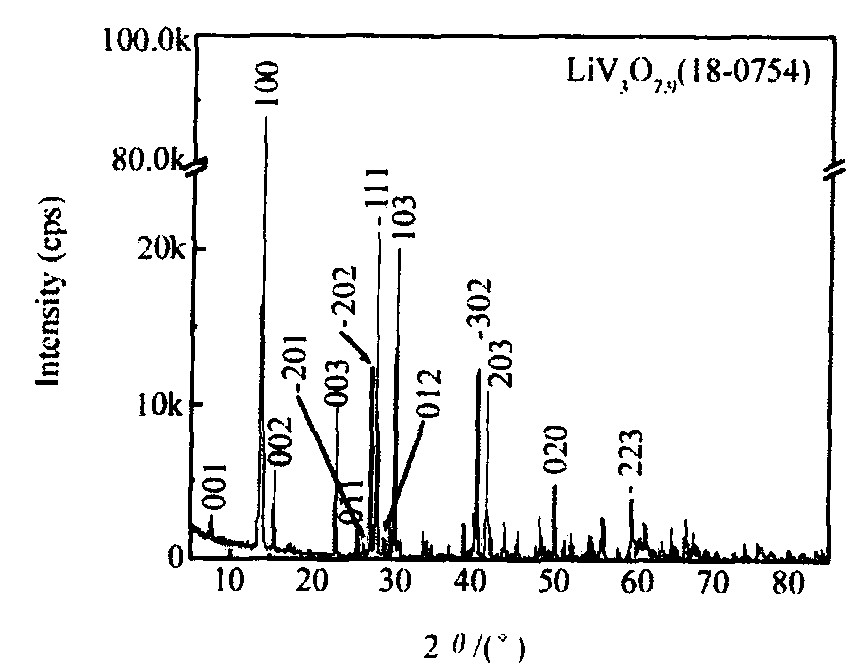
Li1+xV3O8粉末的XRD如图3所示, 与标准卡片 (18-754) 的谱线基本吻合, 在2θ=13.92° 出现最强峰 (100) , 面间距d=0.6356 nm。 根据公式 (5) 可计算出晶体的点阵参数: a=0.667 nm, b=0.360 nm, c=1.200 nm, β=107.7°。
图1 真空干燥后所得前驱体粉末的XRD图谱
Fig.1 XRD patterns of precursor powder after desiccation in vacuum
图2 前驱体粉末的TG和DSC曲线 (空气, 10 ℃·min-1)
Fig.2 TG and DSC of precursor powder (air, 10 ℃·min-1)
图3 合成产物Li1+xV3O8的XRD
Fig.3 XRD patterns of Li1+xV3O8 powder obtained at 600 ℃ for 24 h
图4 前驱体 (a) 与合成的Li1+xV3O8 (b) 粉末的形貌
Fig.4 Morphology of the precursor (a) and synthesized Li1+xV3O8 powder (b)
图4为Li1+xV3O8前驱体粉末 (a) 和Li1+xV3O8 (b) 粉末的扫描电镜照片。 图4 (a) 中颗粒的形状为块状, 颗粒与颗粒之间的结合比较松散, 粒度比较均匀, 而且颗粒表面有孔洞存在。 图4 (b) 中颗粒的形状则主要为棒状和条状, 表面比较光滑, 形状相对规整, 长端约10 μm, 短端约5 μm。 制备的Li1+xV3O8粉末与传统650 ℃高温固相反应制备的Li1+xV3O8在颗粒形貌方面有很大的不同
2.2 Li1+xV3O8的高温电化学特性
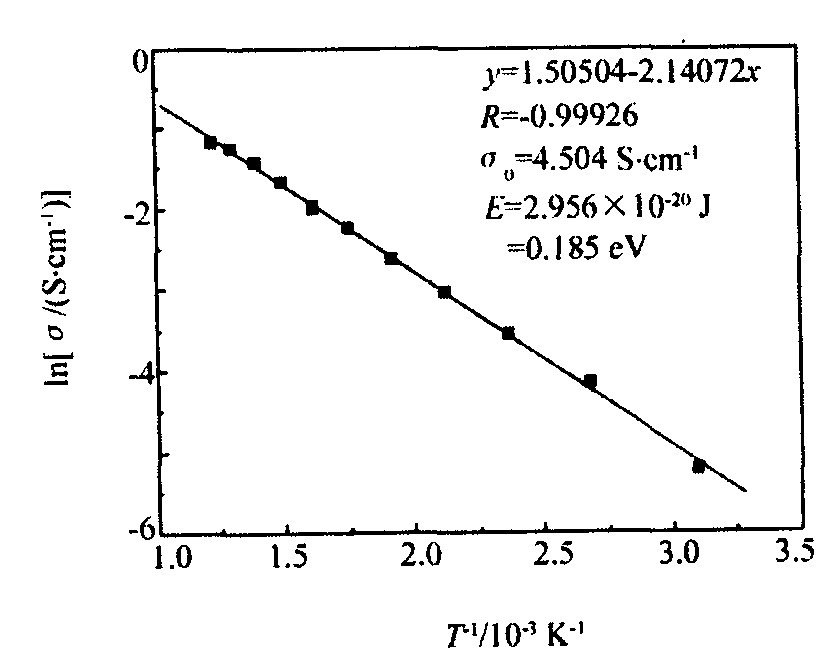
实验测量了室温~550 ℃范围内Li1+xV3O8材料的电导率, 电导率的自然对数与热力学温度倒数的关系如图5所示。 从图中可以看出, Li1+xV3O8试样的lnσ与1/T具有良好的线性特性, 表示在该温度区间具有始终如一的电子跃迁机构
lnσ=1.50504-2140.72/T (6)
置信度为99.926%。 而理论上, 对于高温半导体, 存在着Arrhenius关系:
lnσ=lnσ0-E/kT (7)
式中: σ0是极限状态即温度无穷大时的电导率, 单位为S·cm-1; E是电导活化能, 它包括缺陷形成能和迁移能, 单位为J; k是Boltzmann常数, 值为1.38066×10-23 J·K-1; T表示绝对温度。
对比式 (6) 与式 (7) , 求得σ0=4.504 S·cm-1, E=2.956×10-20 J, 即0.185 eV。 所以Li1+xV3O8的电导率和温度的关系如下式所示:
lnσ=1.505-2.141×103/T (室温~550 ℃) (8)
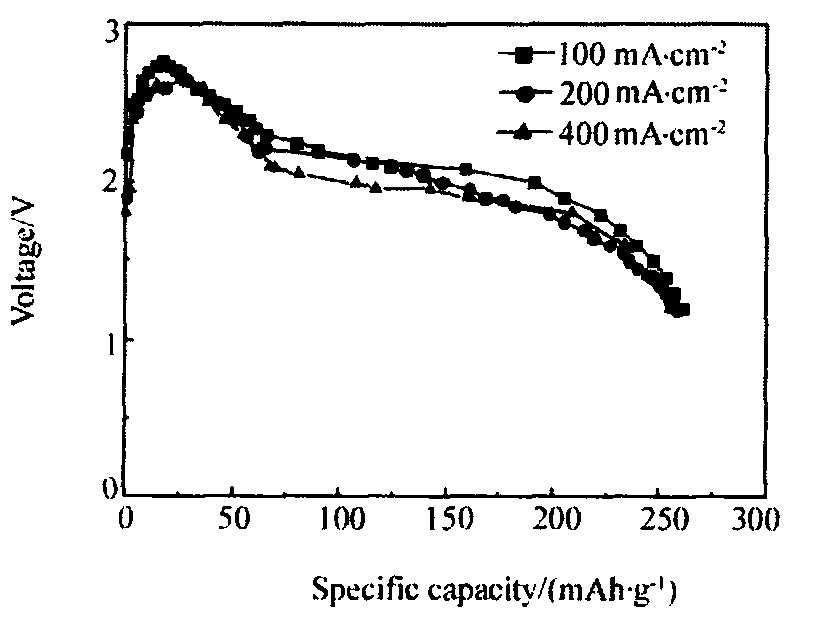
图6为Li1+xV3O8在500 ℃时不同电流密度下的放电曲线 (终止电压为1.2 V) 。 电流密度为100 mA·cm-2时, Li1+xV3O8的最高电压为2.77 V, 终止电压为1.8 V时比容量为198 mAh·g-1, 比FeS2 100 mA·cm-2时的最高电压高出约0.4 V (同一条件测得FeS2的最高电压为2.40 V) ; 终止电压为1.2 V时的比容量为261 mAh·g-1。 从图中还可以看出, 随着电流密度的增大, 电池的工作电压降低。
图5 Li1+xV3O8试样lnσ-T的关系
Fig.5 Relation between lnσ-T of Li1+xV3O8
电压的降低与嵌锂自由能下降有关外, 还受放电动力学因素的影响。 Li1+xV3O8的嵌锂电压主要取决于空位嵌锂能, 嵌锂过程中的组态熵对电压的贡献较小, 已嵌入的锂离子及其邻近阳离子的还原所导致的嵌锂能的变化是影响电压平稳性的关键因素
图6 Li1+xV3O8在500℃时不同电流密度放电曲线 (终止电压1.2 V)
Fig.6 Discharge curves of Li1+xV3O8 at 500 ℃ (cut-off voltage: 1.2 V)
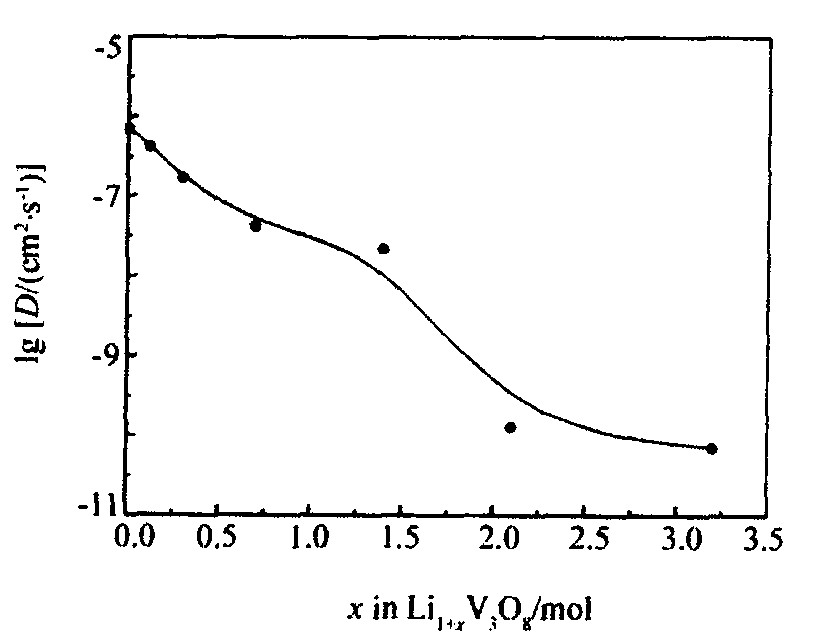
图7 Li1+xV3O8的扩散系数与x的关系
Fig.7 Relation between diffuse coefficient D and x
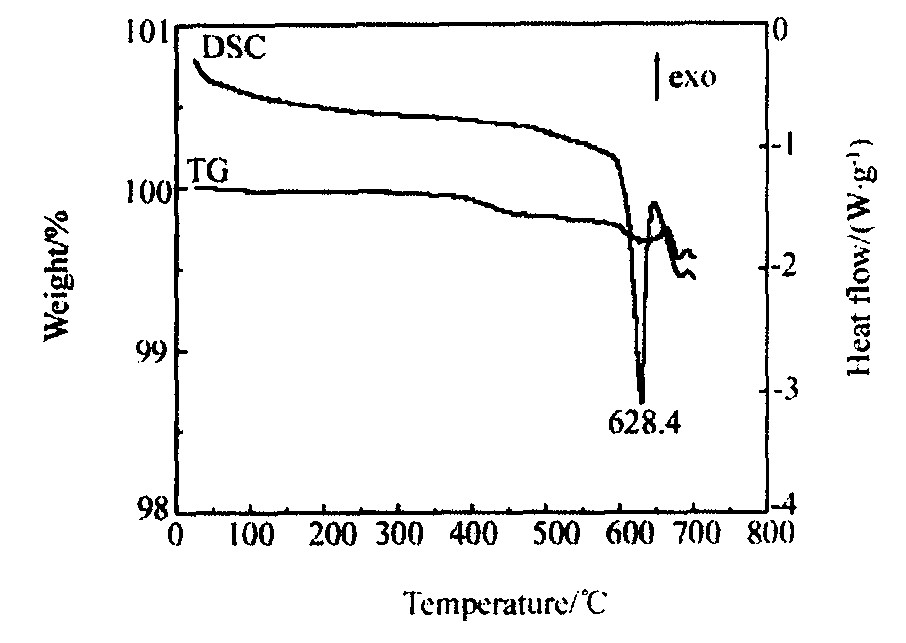
图8 Li1+xV3O8的TG/DSC曲线 (N2, 10 ℃·min-1)
Fig.8 TG/DSC of Li1+xV3O8 (N2, 10 ℃·min-1)
2.3 Li1+xV3O8的热稳定性
热电池材料是在高温下使用, 当Li1+xV3O8的层状结构不致受到热冲击而遭到破坏的情况下, 才能使Li+快速地嵌入, 因此研究了Li1+xV3O8正极材料的结构热稳定性。 图8所示为Li1+xV3O8的TG/DSC曲线, 从图中可以看出, Li1+xV3O8在628 ℃之前的DSC曲线平滑, 表明其结构稳定, 未发生影响结构的相变、 分解等现象; 628 ℃时DSC曲线上出现一较大的吸热峰, 对应图2中Li1+xV3O8的熔化温度; 628 ℃之后重量发生较大变化, 此时Li1+xV3O8有可能发生挥发或蒸发现象。
3 结 论
1. 以NH4VO3, Li2CO3为原料, 无水乙醇为介质, 采用一种新的固相法合成了Li1+xV3O8, 其点阵参数为a=0.667 nm, b=0.360 nm, c=1.200 nm, β=107.7°。
2. Li1+xV3O8的形状为棒状和条状, 表面比较光滑, 形状相对规整, 长端约10 μm, 短端约5 μm。
3. 室温~550 ℃ Li1+xV3O8的电导率和温度的关系为lnσ=1.505~2.141×103/T, 说明在该温度区间Li1+xV3O8具有始终如一的电子跃迁机构; 其电导活化能为0.185 eV。
致谢:感谢粉末冶金研究院刘志坚教授提供了热电池负极材料Li-B合金, 冶金学院赖延清教授、张刚博士在高温电导率测量方面给予的大力帮助。
参考文献
[10] 李志友, 黄伯云, 汤春峰, 等.LiV3O8的溶胶-凝胶法合成及500℃阴极放电性能[J].功能材料, 2001, 32 (2) :181.
[11] 刘国强, 曾潮流, 徐宁, 等.锂蓄电池正极材料LiV3O8的合成和充放电性能[J].中国有色金属学报, 2002, 12 (S1) :70.
[12] 田忠良, 赖延清, 李吉力, 等.NiFe2O4基金属陶瓷的电导率[J].粉末冶金材料科学与工程, 2005, 10 (2) :110.
[13] 申泮文.无机化学丛书 (第八卷) [M].北京:科学出版社, 1998.238.
[14] 关振铎, 张中太, 焦金生.无机材料物理性能[M].北京:清华大学出版社, 2002.241.
[15] 李志友, 张晓泳, 黄伯云, 等.嵌入式化合物嵌锂电压的表达式[J].中国有色金属学报, 2003, 13 (1) :76.
[10] 李志友, 黄伯云, 汤春峰, 等.LiV3O8的溶胶-凝胶法合成及500℃阴极放电性能[J].功能材料, 2001, 32 (2) :181.
[11] 刘国强, 曾潮流, 徐宁, 等.锂蓄电池正极材料LiV3O8的合成和充放电性能[J].中国有色金属学报, 2002, 12 (S1) :70.
[12] 田忠良, 赖延清, 李吉力, 等.NiFe2O4基金属陶瓷的电导率[J].粉末冶金材料科学与工程, 2005, 10 (2) :110.
[13] 申泮文.无机化学丛书 (第八卷) [M].北京:科学出版社, 1998.238.
[14] 关振铎, 张中太, 焦金生.无机材料物理性能[M].北京:清华大学出版社, 2002.241.
[15] 李志友, 张晓泳, 黄伯云, 等.嵌入式化合物嵌锂电压的表达式[J].中国有色金属学报, 2003, 13 (1) :76.