文章编号:1004-0609(2007)08-1342-06
采用中温菌和常温菌浸出含砷金精矿
罗志雄1, 2,张广积1,方兆珩1
(1. 中国科学院 过程工程研究所,北京 100080;
2. 中国科学院 研究生院,北京 100049)
摘 要:
考察了不同矿浆浓度和接种量对细菌浸出含砷金精矿的影响。结果表明:中度嗜热嗜酸铁氧化菌MLY和嗜酸氧化亚铁硫杆菌(Acidthiobacillus ferrooxidans,At.f)的浸矿效果不同。MLY和At.f对含砷金精矿的浸出机理也不同;接种MLY的矿浆中,可能主要是溶液中的细菌将Fe2+氧化为Fe3+,再由Fe3+氧化溶解矿物,即以间接浸出作用为主;而接种At.f可能首先是At.f被吸附到矿物表面,通过细菌与矿物之间的某种界面作用引起矿物溶解,矿物溶解产生的Fe2+被游离菌氧化成为Fe3+,从而溶解矿物,即At.f浸出可能包括直接作用和间接作用的共同效应。
关键词:
砷黄铁矿;中度嗜热嗜酸铁氧化菌;嗜酸氧化亚铁硫杆菌;生物浸出;
中图分类号:TF 18; TF 811 文献标识码:A
Bioleaching arsenic-containing gold concentrates with MLY and At.f
LUO Zhi-xiong1, 2, ZHANG Guang-ji1, FANG Zhao-heng1
(1. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100080, China;
2. Graduate University, Chinese Academy of Sciences, Beijing 100049, China)
Abstract: To comprehend the bioleaching mechanisms of arsenic-containing gold concentrates with moderately thermoacidphilic iron-oxidizing bacterium MLY and Acidthiobacillus ferrooxidans(At.f), bioleaching experiments were carried out, in which different pulp densities and inoculations were performed. It is found that MLY and At.f show different behaviors in the bioleaching process and these results suggest that MLY and At.f have different bioleaching mechanisms. In the MLY leaching, Fe2+ is oxidized to generate Fe3+ by the free bacteria in solution, and then arsenopyrite is dissolved by Fe3+, that is to say, the indirect action is much more significant in MLY leaching. On the other hand, in the At.f leaching, the bacteria is attached to the mineral surface firstly, then the mineral is dissolved and Fe2+ is released into the solution. Fe2+ in the solution is oxidized to produce Fe3+ by free bacteria, and then Fe3+can attack the mineral as well. So the united mechanisms contain direct action and indirect action in the At.f leaching.
Key words: arsenopyrite; moderately thermoacidphilic iron-oxidizing bacteria; Acidthiobacillus ferrooxidans; bioleaching
采用细菌对难处理金矿进行预处理已经成为一项主要的金矿预处理技术,近年来我国也通过引进和自主研发应用这项技术。但目前金矿的生物预处理还存在着一些问题,影响了其使用和推广,最主要的是由于采用的嗜酸氧化亚铁硫杆菌对矿物的浸出速度较慢,要求的停留时间比较长,造成动力消耗过大,从而增加了成本[1?3]。李雅琴等[4?5]采用中度嗜温菌可以将目前的反应温度由35~40 ℃提高到50 ℃以上,能有效地提高反应速度,缩短反应周期,减少工厂的处理成本,但中度嗜温菌在矿浆环境中的生长耐受性和对矿物溶解释放的砷等有害元素的耐受性还需要进一步评价。目前,采用中度嗜温菌浸矿的研究已有报道,石绍渊等[6?8]采用中度嗜温菌浸出硫化锌矿物的反应周期较嗜酸氧化亚铁硫杆菌能缩短2 d左右,但是采用中度嗜温菌浸出含砷金精矿的报道很少,其浸矿机理也未见报道。
本文作者筛选了一株从煤矿废石堆中分离的中度嗜热嗜酸铁氧化菌菌株用于实验研究,李雅琴等[4?5]曾报道过该菌株的生长特性,暂时以MLY命名。本研究将MLY菌株与嗜酸氧化亚铁硫杆菌菌株进行含砷金精矿的浸出比较,考察其浸出效果和细菌对砷毒性的耐受性,了解MLY和嗜酸氧化亚铁硫杆菌浸出含砷金精矿的机理,为工业应用设计提供基础。
1 实验
1.1 矿样
实验中含砷金精矿的主要矿物成分分析结果见表1。通过矿物中各元素含量、XRD和SEM谱等分析,矿物中的主要组分为黄铁矿(约25%),砷黄铁矿(约25%),石英(约20%)和一部分铅锌硫化矿(约20%),黄金品位约为12 g/t。
表1 含砷金精矿的主要矿物成分
Table 1 Main compositions of arsenic-containing gold concentrates(mass fraction, %)

1.2 菌株
实验采用的嗜酸氧化亚铁硫杆菌 (Acidithiobacillus ferrooxidans,At.f)和嗜热嗜酸铁氧化菌MLY由中国科学院微生物研究所提供,并于Leathen培养基中培养,其中MLY生长的最佳条件如下:pH为1.5~2.0,温度为50~54 ℃。Leathen培养基的组成为:(NH4)2SO4 0.15 g/L;K2HPO4 0.05 g/L;KCl 0.05 g/L;MgSO4?7H2O 0.5 g/L;Ca(NO3)2?2H2O 0.05 g/L。本研究采用显微镜直接计数法计数。
1.3 实验方法
1.3.1 矿浆浓度实验
取70 mL Leathen培养基,分别将2、5、10和20 g矿物加入250 mL锥形瓶中配成矿浆,将不含铁的MLY菌液用滤菌膜过滤,各取30 mL含菌培养基接种到已配料的矿浆中,使总体积达100 mL,并向各瓶中添加0.2 g/L酵母粉。接种At.f的菌液实验步骤与之类似,但不添加酵母浸膏粉。使用恒温水浴摇床在温度50 ℃(接种At.f的矿样为35 ℃)、转速为160 r/min下培养,定时测定矿浆中的pH和氧化还原电位φ,矿浆pH维持在1.5(接种At.f的矿样为2.0)。定时取样1 mL,用等量的培养基补充,蒸发的水用蒸馏水补充。
1.3.2 接种量实验
固定矿浆浓度为5%(质量分数),接种量分别选设为1%、5%、10%、30%和50%(体积分数,下同),其余过程与矿浆浓度实验相似。
氧化还原电位φ采用饱和甘汞电极和铂电极测定,本实验采用的氧化还原电位φ均为测定值加上饱和甘汞电极电势(0.241 V)。
1.4 分析方法
矿浆中的总砷浓度采用ICP(Inductively coupled plasma)光谱分析法分析,总铁浓度采用邻菲罗啉法测定[6],原矿物和细菌浸出后的矿物通过X射线粉晶衍射仪(D/Max-rB)分析。
2 结果与讨论
2.1 矿浆浓度的影响
图1所示为不同矿浆浓度下接种MLY和At.f时的氧化区原电位与时间的关系。从图1中可以看出,当矿浆浓度为2%和5%时,接种MLY矿浆的氧化还原电位从浸出开始就迅速提高,其中2%的矿浆氧化还原电位提高速度和幅度更大些,随着时间延长虽然电位有所波动,但与无菌对照实验相比电位都有明显提高,同时发现矿浆中的细菌数量也明显提高,都达到108个/mL以上。伴随着氧化还原电位的提高,矿浆pH值较无菌对照样有较大幅度的提高,同时矿浆中的铁和砷的浓度迅速上升,表明在此浓度下MLY能够顺利生长。矿浆浓度为10%和20%时,氧化还原电位在实验开始后即有所下降,但矿浆浓度为10%的矿浆经历一段时间的滞后期后,氧化还原电位大幅度上升,细菌数量也明显提高;矿浆浓度为20%的氧化还原电位下降到某较低值后,基本保持不变,反应结束时在矿浆中已经很难发现细菌,表明在高矿浆浓度条件下,MLY的生长会受到影响,不能有效浸出矿物。这可能是由于矿浆中的固体物质阻碍O2和CO2传输给菌种,同时也不排除矿物剪切力、溶解砷的毒性等因素对细菌生长的影响,造成细菌生长繁殖困难。铁和砷的浸出率随时间变化关系如图2所示。根据溶液中砷含量的计算,矿浆浓度为2%和5%的样品中砷黄铁矿的浸出率在5 d后已经达到50%以上。
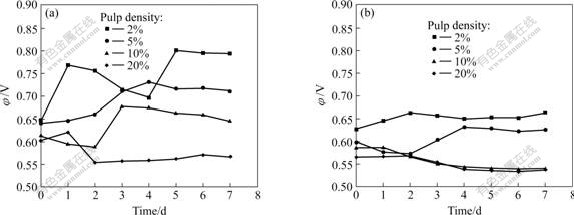
图1 不同矿浆浓度下接种MLY、At.f时的氧化还原电位与时间的关系
Fig.1 Relationship between φ and time of pulp containing MLY or At.f with various concentrations: (a) Bioleaching with inoculated MLY; (b) Bioleaching with inoculated At.f
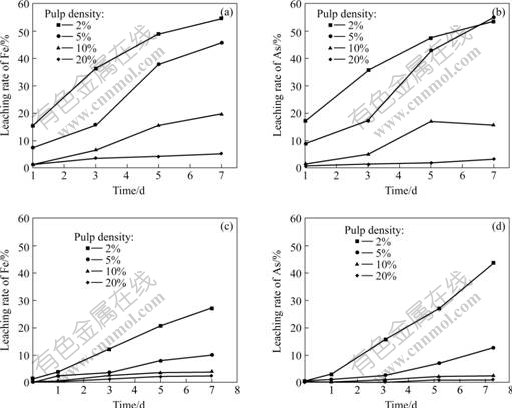
图2 不同矿浆浓度下接种MLY和At.f时铁、砷的浸出率与时间的关系
Fig.2 Relationship between iron or arsenic concentrations and time of pulp containing MLY and At.f with various pulp concentrations: (a), (b) Bioleaching with inoculated MLY; (c), (d) Bioleaching with inoculated At.f
对于接种At.f的实验,在矿浆浓度为2%和5%时矿浆的氧化还原电位有所提高,细菌数量也不断增加,铁、砷的浸出率上升较快,证明细菌可以生长并对矿物进行浸出,但与同一浓度的MLY菌浸出实验相比,矿浆氧化还原电位的升高速度要慢些,铁和砷的浸出率也低得多,其中矿浆浓度为5%时铁和砷的浸出率不到接种MLY的1/3(图2)。出现这种现象的原因可能是MLY浸出时温度较高而pH值较低,在矿物开始浸出时有比较多的Fe2+被酸浸出,被细菌氧化为Fe3+,Fe3+的氧化作用加快矿物的浸出速度;而在At.f的浸出实验中由于浸出温度较低,pH值较高,在开始阶段溶液中含铁量较低,造成细菌生长繁殖缓慢,使得初始阶段矿物浸出速度慢,矿浆氧化还原电位较低。在矿浆浓度为10%和20%的实验中,At.f基本不生长,氧化还原电位和pH值除开始阶段有变化外,以后基本保持不变,证明At.f在高矿浆浓度条件下难以生长。由图2可知,在高矿浆浓度下,溶液中的砷含量并不是很高,这是由于细菌生长状况不好,使得仅有少量的砷被浸出到溶液中。根据以上研究可以初步判断,砷的毒性不是高矿浆浓度下细菌不能正常生长的主要原因。
2.2 接种量的影响
图3所示为不同接种量下接种MLY和At.f矿浆的氧化还原电位与时间的关系。固定矿浆浓度为5%,其中接种量为1%的矿浆初始细菌数量约为106/mL。从图3可以看出,MLY的接种量在1%~50%时,除了接种量为1%外,其它接种量的氧化还原电位都迅速上升,并且浸矿过程中其氧化还原电位和细菌数量相差不大;接种MLY菌种的矿浆中铁、砷浓度随时间的进行迅速上升,接种量为5%~50%的铁、砷的浸出率从一开始就很相近(见图4),这种现象暗示中温菌MLY对含砷金精矿的浸出可能主要是在溶液中的细菌通过氧化Fe2+为Fe3+,再由Fe3+氧化溶解矿物,即以间接浸出作用为主。对于接种量为1%的矿浆,开始时细菌数量较少,使得Fe2+被氧化为Fe3+的量较其他接种量的要少,从而因为Fe3+间接作用溶解的矿物量也少,导致溶液中铁、砷浓度较其他接种量的要少;但到第2 d时接种量为1%的矿浆氧化还原电位也迅速上升到与其它接种量相近,并且细菌数量也繁殖较快,达到108/mL以上,在随后的几天,氧化还原电位和其他接种量变化一致。可见,接种量达到一定数量以上时,接种量对细菌浸出效果影响不大,同时这也说明在矿浆浓度为5%时,矿物的剪切摩擦和砷毒性对中度嗜温菌MLY浸矿影响不大。
从接种At.f的接种量实验来看,因开始时矿物中碱性物质较多,致使矿浆的pH值上升较快,需要不断调节pH,才能维持细菌浸矿生长。如果不能及时的调节pH值,当pH上升到一定的值时,细菌生长缓慢或停滞生长,这时只有矿物对细菌的剪切摩擦损伤影响,从而造成细菌数量的减少[9]。从图3可以发现,接种量为5%~50%时,细菌都能浸矿生长,但是有所差别,接种量为30%和50%的矿浆氧化还原电位从一开始就较高,细菌数较多,在合适的pH环境下,细菌能很快地生长繁殖;而对于接种量为5%和10%的矿浆,因开始时细菌数较接种量为30%、50%的矿浆要少,经历了两天滞后期后矿浆的氧化还原电位才上升,但仍较接种量为30%和50%的矿浆要低,且细菌数也要少得多。接种量大的矿浆中铁和砷的浸出率也相对高一些。在浸出后期,对于接种量为30%和50%的矿浆中都有一定程度的铁沉淀(图4)。这种现象说明在矿浆中由于At.f对硫化矿物有着强烈的吸附作 用[10],At.f很可能首先要吸附到矿物表面,通过细菌与矿物之间的某种界面作用引起矿物的溶解,初始接种量大,吸附细菌数量也大,有利于矿物的浸出。矿物溶解产生的Fe2+可以被游离细菌利用,氧化成为Fe3+也可以溶解矿物,但速度较中温菌要慢,即常温菌浸出可能包括直接作用和间接作用的共同效应。接种量为1%的矿浆,氧化还原电位不断降低,第3 d后很难在矿浆中发现有细菌的存在。可见,矿物对细菌的剪切力、砷毒性对At.f浸矿有一定的影响[11?15]。
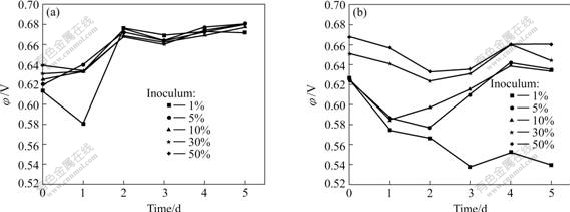
图3 不同接种量下接种MLY、At.f矿浆的氧化还原电位与时间的关系
Fig.3 Relationship between φ and time of pulp containing MLY or At.f with various inoculations: (a) Bioleaching with inoculated MLY; (b) Bioleaching with inoculated At.f
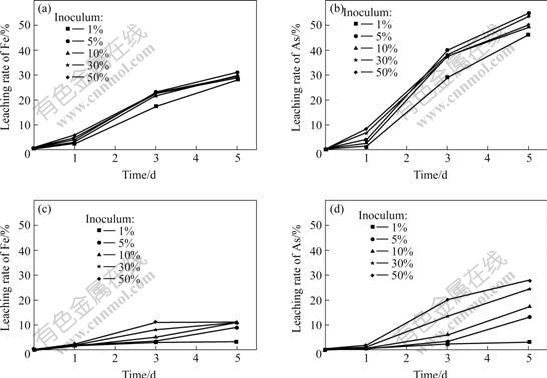
图4 不同接种量下接种MLY、At.f时铁和砷的浸出率与时间的关系
Fig.4 Relationship between iron or arsenic concentrations and time of pulp containing MLY or At.f with various inoculations: (a), (b) Bioleaching with inoculated MLY; (c), (d) Bioleaching with inoculated At.f
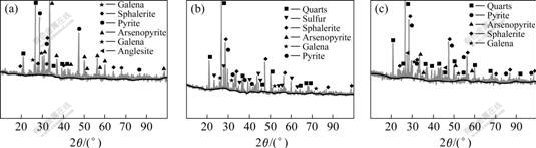
图5 原矿物及接种MLY、At.f浸出后浸出渣的XRD谱
Fig.5 XRD patterns of mineral sample and leached residues with MLY or At.f: (a) Mineral sample; (b) Residues by MLY bioleaching; (c) Residues by At.f bioleaching
2.3 细菌浸出前后矿物的XRD分析
从图5中可以看出,在细菌浸出实验中所使用含砷金精矿主要含有砷黄铁矿、黄铁矿、石英、闪锌矿和方铅矿等矿物。在MLY浸出5 d后发现砷黄铁矿的峰基本消失,黄铁矿的峰也明显变小,石英、方铅矿的峰有所上升。这证明在浸出过程中主要被浸出的是砷黄铁矿,黄铁矿也可以被浸出,但浸出速率要低于砷黄铁矿,石英、方铅矿基本不溶解。在MLY浸出后的矿渣中还发现有元素硫的存在,由于溶解过程中产生的元素硫不能很快被细菌氧化产生硫酸,因此浸出过程中是耗酸的,这成为导致浸出过程中pH值不断上升的重要原因[16?18]。
At.f浸出后的矿渣成分与MLY很相似,但也存在一些差别:1) 从XRD谱上可以看到,仍然有比较明显的砷黄铁矿峰和元素硫的峰存在,黄铁矿峰比较高,证明At.f对含砷金精矿的浸出速度比MLY要慢[19?20];2) 在XRD谱上没有发现有元素硫的峰存在。这可能是在MLY浸出过程中,砷黄铁矿溶解的速度较快,浸出过程中产生的元素硫较多,不能很快被细菌氧化为硫酸,沉积在浸渣中;而在At.f浸出过程中,砷黄铁矿被溶解的速度相对MLY较慢,产生的硫较少,因此浸渣中没有发现元素硫的峰。
无论是中温菌MLY还是常温菌At.f浸出后的XRD谱图中都没有发现砷酸铁的峰,表明没有或很少的As3+被Fe3+氧化为As5+,砷黄铁矿溶解后释放出的砷主要都以As3+的形式存在于溶液中。这一方面说明我们所用细菌确实对毒性较高的As3+有比较好的耐受性,另一方面也提醒我们溶液中的溶解形态的砷需要适当的处理以避免污染。
3 结论
1) 在含砷金精矿的细菌浸出过程中,接种MLY浸出主要是因为间接作用溶解矿物;接种At.f浸出因为细菌吸附于矿物表面,使得直接作用溶解矿物占了很大比例。
2) 考察矿浆浓度和接种量实验情况,也显示了中温菌MLY对矿浆浓度和砷毒性有比较强的耐受性。
3) XRD谱表明,MLY菌种浸矿效果较At.f要好,表现在有更高的铁、砷浸出率,更快的浸出速率。
[1] Ehrlich H. Past, present and future of biohydrometallurgy[J]. Hydrometallurgy, 2001, 59: 127?134.
[2] Bosecker K. Bioleaching: metal solubilization by microorganisms[J]. FEMS Microbiology Review, 1997, 20: 591?604.
[3] 方兆珩. 硫化矿细菌氧化浸出机理[J]. 黄金科学技术, 2002, 10(5): 26?31.
FANG Zhao-heng. Mechanism of bacterial leaching sulfides[J]. Gold Science and Technology, 2002, 10(5): 26?31.
[4] 李雅琴, 何正国. 一株中度嗜热嗜酸铁氧化菌特性研究[J]. 微生物学报, 2001, 86(2): 45?47.
LI Ya-qin, HE Zheng-guo. Studies on the characteristics of a moderately thermoacidophilic iron-oxidizing bacterium[J]. Microbiology, 2001, 86(2): 45?47.
[5] 李雅琴, 何正国. 中度嗜热嗜酸铁氧化菌对Fe2+的氧化[J]. 有色金属, 2003, 55(1): 37?38.
LI Ya-qin, HE Zheng-guo. Ferrous iron ion oxidation with moderately thermoacidophilic iron-oxidizing bacterium[J]. Nonferrous Metals, 2003, 55(1): 37?38.
[6] 石绍渊. 铁闪锌矿浮选精矿生物浸出基础研究[D]. 北京: 中国科学院过程工程研究所, 2004.
SHI Shao-yuan. Fundamental studies on bioleaching marmatite flotation concentrates[D]. Beijing: Institute of Process Engineering, Chinese Academy of Science, 2004.
[7] SHI Shao-yuan, FANG Zhao-heng. Bioleaching of marmatite flotation concentrate by acidithiobacillus ferrooxidans and leptospirillum ferrooxidans[J]. Trans Nonferrous Met Soc China, 2004, 14(3): 569?575.
[8] SHI Shao-yuan, FANG Zhao-heng. Marmatite bioleaching with moderately thermoacidophilic bacterial strain and mineral analyses of solid residues[J]. Trans Nonferrous Met Soc China, 2005, 15(5): 1150?1155.
[9] KE Jia-jun, LI Hong-mei. Bacterial leaching of nickel-bearing pyrrhotite[J]. Hydrometallurgy, 2006, 82: 172?175.
[10] Goutam K, Natarajan K A, Modak J M. Estimation of mineral-adhered biomass of thiobacillus ferrooxidans by protein assay-some problems and remedies[J]. Hydrometallurgy, 1996, 42: 169?175.
[11] ZHANG Guang-ji, FANG Zhao-heng. The contribution of direct and indirect actions in bioleaching of pentlandite[J]. Hydrometallurgy, 2005, 80: 59?66.
[12] Tributsch H. Direct versus indirect bioleaching[J]. Hydrometallurgy, 2001, 59: 177?185.
[13] Sand W, Gehrke T, Jozsa P, Schippers A. Biochemistry of bacterial leaching direct vs indirect bioleaching[J]. Hydrometallurgy, 2001, 59: 159?175.
[14] Cruz R, La′zaro I, Gonza′lez I, Ehrlich H L. Acid dissolution influence bacterial attachment and oxidation of arsenopyrite[J]. Minerals Engineering, 2005, 18: 1024?1031.
[15] Wiertz J V, Mateo M, Escobar B. Mechanism of pyrite catalysis of As(Ⅲ) oxidation in bioleaching solution at 30 ℃ and 70 ℃ [J]. Hydrometallurgy, 2006, 83: 35?39.
[16] Breed A W, Glatz A, Hansford G S, Harrison S T L. The effect of As(Ⅲ) and As(Ⅴ) on the batch bioleaching of a pyrite-arsenopyrite concentrate[J]. Minerals Engineering, 1996, 9(12): 1135?1152.
[17] Ndlovu S, Monhemius A J. The influence of crystal orientation on the bacterial dissolution of pyrite[J]. Hydrometallurgy, 2005, 78: 187?197.
[18] Schippers A, Sand W. Bacterial leaching of metal sulfides proceeds by two indirect mechanisms via thiosulfate or via polysulfides and sulfur[J]. Applied and Environmental Microbiology, 1999: 319?321.
[19] Clark D A, Norris P R. Oxidation of mineral sulphides by thermophilic microorganisms[J]. Minerals Engineering, 1996, 9(11): 1119?1125.
[20] Deneci H, Akcil A, Alp I. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron [J]. Hydrometallurgy, 2004, 73: 293?303.
基金项目:国家自然科学基金资助项目(50404009, 20236050);国家重点基础研究发展规划资助项目(2004CB619203)
收稿日期:2006-11-27;修订日期:2007-04-16
通讯作者:张广积,博士,副研究员;电话:010-62554558; E-mail: gjzhang@home.ipe.ac.cn
摘 要:考察了不同矿浆浓度和接种量对细菌浸出含砷金精矿的影响。结果表明:中度嗜热嗜酸铁氧化菌MLY和嗜酸氧化亚铁硫杆菌(Acidthiobacillus ferrooxidans,At.f)的浸矿效果不同。MLY和At.f对含砷金精矿的浸出机理也不同;接种MLY的矿浆中,可能主要是溶液中的细菌将Fe2+氧化为Fe3+,再由Fe3+氧化溶解矿物,即以间接浸出作用为主;而接种At.f可能首先是At.f被吸附到矿物表面,通过细菌与矿物之间的某种界面作用引起矿物溶解,矿物溶解产生的Fe2+被游离菌氧化成为Fe3+,从而溶解矿物,即At.f浸出可能包括直接作用和间接作用的共同效应。


