文章编号:1004-0609(2007)08-1286-05
甘氨酸络合制备正极材料Li1+xV3O8及其性能
鲁道荣,李枝贤
(合肥工业大学 化工学院,合肥 230009)
摘 要:
以甘氨酸为络合剂制备锂离子电池正极材料Li1+xV3O8。采用XRD﹑SEM﹑DSC和TG-DTA测试了Li1+xV3O8的结构、形貌和性质。结果表明:在420 ℃下焙烧20 h,可以得到正极材料Li1+xV3O8 ,该材料具有良好的结晶度和热稳定性。电化学测试表明:此方法合成的Li1+xV3O8在室温下以10 mA/g的电流放电时,首次放电容量高达360 mA?h/g, 循环30次后容量衰减约9.7%,循环性能良好;当放电电流从10 mA/g增大到25 mA/g时,其容量损失约50.5%。
关键词:
中图分类号:TM 912.9; O 614.21 文献标识码:A
Synthesis of Li1+xV3O8 as cathode material by complexing of glycin and its properties
LU Dao-rong, LI Zhi-xian
(College of Chemical Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract: C2H5NO2 was used to synthesize the cathode material Li1+xV3O8. The structure, morphology and characteristics of Li1+xV3O8 were investigated by XRD, SEM, DSC and TG-DTA. The results show that the material Li1+xV3O8 with good crystallization degree and good thermal stability is obtained at 420 ℃. The electrochemistry test of Li1+xV3O8 indicates that the material obtained has a discharge capacity of 360 mA?h/g at room temperature with a current of 10 mA/g, and the capacity is only decreased by 9.7% after 30 cycles, which indicates the material has a good cycle performance. The capacity is decreased by about 50.5% when the discharge current increases from 10 mA/g to 25 mA/g.
Key words: cathode material; Li1+xV3O8; glycin; specific capacity; cycle performance
具有层状结构的锂离子电池正极材料Li1+xV3O8,因其比容量大、循环寿命长,具有优良的嵌锂能力,且能克服二硫族化合物不能承受的深度放电和易受潮等缺点,因而成为人们关注的电池正极材料之一[1?9]。Li1+xV3O8是由八面体和三角双锥组成,位于八面体位置的Li+与邻近层紧紧连接[10], 在Li1+xV3O8层间有3个以上的锂离子可以进行可逆的嵌入与脱嵌,且八面体位置上的Li+从一个四面体位置跃迁到其它四面体时不受阻碍[11]。为了改善其化学性能,人们对此做了大量的研究工作,如:高效研磨﹑水热技术﹑快速冷却﹑超声处理和掺杂无机物小分子[12]等。
目前有关用溶胶凝胶法制备正极材料Li1+xV3O8的报道,大多数是以柠檬酸作为络合剂,从反应开始到形成凝胶、干燥、以及焙烧等过程,需要较长时间。本文作者以甘氨酸为络合剂,采用一种简单的合成方法制备正极材料Li1+xV3O8,此方法至今尚未见报道。与传统的溶胶凝胶法用柠檬酸为络合剂[13]相比,此方法不但缩短了反应时间,简化了反应流程,而且所制备的粉体Li1+xV3O8可以提高电池的比容量和循环性能。
1 实验
1.1 材料制备
按n(Li)?n(V) =1.05?3.0,n(V)?n(C2H5NO2)=1.0?1.5准确称取一定量的LiOH、NH4VO3和C2H5NO2,将其混合后溶于去离子水中,在磁力搅拌器上加热搅拌适当时间,待形成均一体系后,将该混合溶液倒入干净的瓷坩埚内,在万用电热炉上控温加热,待水蒸干后,得到前驱体。将前驱体研磨后置于箱式电阻炉内,分别以320﹑420和520 ℃的温度焙烧20 h,自然冷却后即可得到具有手感细腻和流动性良好的粉体。
1.2 材料表征
采用日本理学公司D/Max?rB型X射线衍射仪测试样品Li1+xV3O8的结构,采用Cu Kα,λ=0.154 1 nm,管压40.0 kV,管电流0.100 A,扫描速率6(?)/min,扫描范围10?~80?;采用DSC821e(METTLER TOLEDO, Germany)测试材料形成过程中的焓变,采用DTG?60H (Shimadzu, Japan)测试材料的热稳定性;采用荷兰XT30 ESEM?TMP扫描电镜测试材料的形貌;在5 V、5 mA的充放电仪(深圳新威尔电子有限公司制造)上测试材料的电化学性能。
1.3 正极制备与电池组装
按质量比80?15?5分别称取Li1+xV3O8样品、乙炔黑、聚偏氟乙烯于小烧杯中,搅拌均匀,滴入一定量的N-甲基吡咯烷酮,调匀后涂在铝箔上,80 ℃真空干燥3 h后,再用压片机压制成型作为正极,锂片为负极,隔膜采用Celguard2300,电解液为1 mol/dm3 LiPF6/EC+DMC(体积比为1?1)溶液,在充满氩气的干燥手套箱内组装成纽扣电池。电池的性能测试采用恒电流充放电法,充放电电压范围为2.00 ~ 4.20 V。
2 结果与讨论
2.1 DSC测试
图1所示为前驱体的DSC曲线。从图中可以看出,当温度升高到90 ℃左右时有一较强的吸热峰,这是因为凝胶前驱体中残留的水分失去;当继续升温至315 ℃左右时,DSC曲线上又出现另外一个吸热峰,其原因可能是在该温度下前驱体形成晶相;在315 ℃以后,DSC曲线中没有出现其它峰,表明正极材料Li1+xV3O8的晶相生成逐渐完成,没有出现其他晶相。
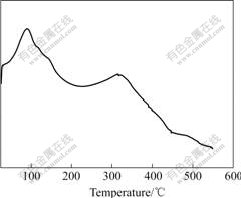
图1 前驱体的DSC曲线
Fig.1 DSC curve of precursor
2.2 XRD测试
根据前驱体的DSC测试,选定焙烧温度分别为320、420和520℃,考察温度对正极材料Li1+xV3O8的晶体结构的影响,测试结果如图2所示。由图可知,在420 ℃与520 ℃时,位于13.86?的(100)晶面的衍射峰强度明显高于28.53?处的( )晶面,表明较高温有利于(100)晶面的生长,而(a)中(100)晶面的衍射峰强度却低于(
)晶面,表明较高温有利于(100)晶面的生长,而(a)中(100)晶面的衍射峰强度却低于( )晶面的,可能是(100)晶面在较低温度时的生长没有(
)晶面的,可能是(100)晶面在较低温度时的生长没有( )晶面有利。由(b)和(c)还可以看出,随着温度的升高,晶面择优取向(100)的衍射峰强度增加,当衍射峰强度越高时,样品的结晶度越高,这使得晶体中提供的Li+嵌入与脱嵌的通道变长,而Li+的嵌入是一个扩散过程,对于长的扩散通道,会增加Li+离子的嵌入时间,反而导致容量降低[14];而结晶度过低时,扩散通道会大量减少,不利于Li+的嵌入。因此,前驱体的较适宜焙烧温度为420 ℃。
)晶面有利。由(b)和(c)还可以看出,随着温度的升高,晶面择优取向(100)的衍射峰强度增加,当衍射峰强度越高时,样品的结晶度越高,这使得晶体中提供的Li+嵌入与脱嵌的通道变长,而Li+的嵌入是一个扩散过程,对于长的扩散通道,会增加Li+离子的嵌入时间,反而导致容量降低[14];而结晶度过低时,扩散通道会大量减少,不利于Li+的嵌入。因此,前驱体的较适宜焙烧温度为420 ℃。

图2 不同焙烧温度Li1+xV3O8的XRD谱
Fig.2 XRD patterns of Li1+xV3O8 obtained at different calcinating temperatures
2.3 热稳定性分析
在进行电化学嵌入时,嵌入反应体系必须具备一定的特殊结构,即主体晶格的结构骨架应当稳定,在嵌入与脱嵌反应过程中基本不发生变化。由于锂离子电池在充放电过程中会产生一定的热量,可能会对其结构产生一定的影响,使得Li+的嵌入受阻,因而将420 ℃焙烧后的Li1+xV3O8样品进行TG?DTA测试,考察材料的热稳定性,结果如图3所示。从图中可以看出,TG曲线变化很小,从开始到温度升高至600 ℃,样品质量损失仅2.4%,说明该材料具有良好的热稳定性。DTA曲线上对应于600 ℃时有一个吸热峰,这可能是因为在600 ℃时Li1+xV3O8样品有少部分开始熔化。
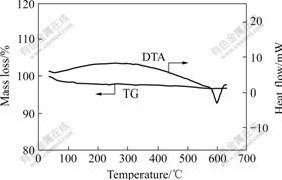
图3 经420 ℃焙烧后Li1+xV3O8的TG?DTA曲线
Fig.3 TG?DTA curves of Li1+xV3O8 obtained at 420 ℃
2.4 SEM测试
图4所示为由不同焙烧温度制备的正极材料Li1+xV3O8的SEM像。由图4(a)可以发现在320 ℃时,样品颗粒中有部分小孔,可能是低温时材料没有很好地结晶成形所致,这与XRD的测试结果相同。从图4(b)和4(c)可以看出,随着温度的升高,样品结晶越来越完善,但样品的粒径也随着温度的升高而增大,不利于Li+的扩散,这是因为样品的粒径较小时,样品的表面积较大,且扩散通道较短,因而有利于更多的Li+进行扩散。因此理想的温度应控制为420 ℃。

图4 不同焙烧温度下制备的Li1+xV3O8的SEM像
Fig.4 SEM images of Li1+xV3O8 obtained at different calcinating temperatures: (a): 320 ℃; (b): 420 ℃; (c): 520 ℃
2.5 Li1+x V3O8材料的电化学性能测试
图5所示为不同焙烧温度下制备的正极材料Li1+xV3O8在室温下以10 mA/g的电流放电的首次放电曲线。放电时Li+首先从液相扩散至电极表面,接着在固/液界面处转移进入固相,最后在固相中进行扩散。当有电流通过时,将产生极化, 随着正极电极电势的负移,来自外电路的电子进入嵌入化合物Li1+xV3O8中未充满的导带,导致部分金属离子的化合价降低,并引起周围阴离子负电荷过剩,电解质中的Li+遂迁入主体晶格中阴离子附近的空位[15]。从图中可以看出,放电曲线出现2个电压平台,一个电压平台在2.8 V左右,一个电压平台在2.5 V左右。经420 ℃焙烧的正极材料Li1+xV3O8的2个放电电压平台较长,因而其比容量较大,约为360 mA?h/g。经过320 ℃焙烧的Li1+xV3O8的2个放电电压平台长度较420 ℃的短,其比容量次之,约为340 mA?h/g。而在520 ℃焙烧的Li1+xV3O8的2个放电电压平台长度最短,其比容量最小,约为300 mA?h/g。这可能是由于520 ℃焙烧的样品的结晶度较高,具有较长的扩散通道,增加了Li+的嵌入时间,不利于Li+的扩散,因而比容量相对较 低[16]。在320 ℃焙烧后的样品a, 由于其晶相不很完善,因而比容量不如420 ℃的样品b。

图5 焙烧温度对Li1+xV3O8首次放电容量的影响
Fig.5 Effect of calcinating temperatures on first discharge capacity of Li1+xV3O8
图6所示为焙烧温度为420 ℃的正极材料Li1+xV3O8组装成电池,在不同电流密度下的放电曲线。可以看出,随着放电电流密度的增加,容量逐渐减少。这是因为当放电倍率增大时,电池产生浓差极化和电化学极化,导致放电困难,因此容量降低。当放电电流从10 mA/g增加到25 mA/g时,比容量从360 mA?h/g减少至178 mA?h/g,容量损失率约为50.5%。

图6 不同放电倍率对Li1+xV3O8首次放电容量的影响
Fig.6 Effect of rate on first discharge capacity of Li1+xV3O8
将不同焙烧温度得到的正极材料Li1+xV3O8组装成电池进行循环性能测试(见图7)。由图7可知,当以10 mA/g的恒电流放电时,420 ℃焙烧得到的正极材料首次容量为360 mA?h/g,经30次循环后电池的容量衰减约9.7%,低于320 ℃和520 ℃焙烧得到的正极材料的容量衰减率(分别为12.3%和13.1%),说明以甘氨酸为络合剂在420 ℃焙烧后制备的Li1+xV3O8具有较好的循环性能。Jin等[5]认为造成循环容量衰减的原因可能是在放电过程中产生新相Li4V3O8,降低了Li+的嵌入速率,减缓了相转变,在Li4V3O8相和LiV3O8相间的不完全可逆相变将导致容量减少。

图7 不同焙烧温度制备的正极材料Li1+xV3O8的循环性能
Fig.7 Cycle performance of Li1+xV3O8 prepared at different calcinating temperatures
3 结论
1) 以甘氨酸为络合剂,制备正极材料Li1+xV3O8,与传统的溶胶凝胶法中以柠檬酸为络合剂相比,该法简化了反应流程,缩短了反应时间,所得产物粉体细腻,热稳定性高,具有良好的循环性能,且提高了电池的比容量。
2) 420 ℃为最佳焙烧温度,该温度下焙烧的正极材料Li1+xV3O8结晶度适中,容量较大,以10 mA/g电流放电时,初始容量为360 mA?h/g;30次循环后容量衰减为9.7%。
3) 该方法投资较少,有利于工业化生产。
[1] Jouanneau S, Verbaere A, Guyomard D. A combined X-ray and neutron rietveld study of the chemically lithiated electrode materials Li2.7V3O8 and Li4.8V3O8[J]. Journal of Solid State Chemistry, 2005(178): 22?27.
[2] GAO Jian, JIANG Chang-yin, WAN Chun-rong. Preparation and characterization of spherical Li1+xV3O8 cathode material for lithium secondary batteries[J]. Journal of Power Sources, 2004(125): 90?94.
[3] Kawakita J, Mori H, Miura T, Kishi T. Formation process and structural characteristics of layered hydrogen vanadium[J]. Solid State Ionics, 2000(131): 229?235.
[4] LIU En-hui, LI Xin-hai, HOU Zhao-hui, HE Ze-qiang, DENG Ling-feng. Chemical diffusion behaviors of lithium-ion in the LiV3O8 prepared by wet method reaction[J]. Wuli Huaxue Xuebao, 2004, 20(4): 377?381.
[5] Jin K, Takashi M, Tomiya K. Lithium insertion and extraction kinetics of Li1+xV3O8[J]. J Power Sources, 1999, 83: 79?83.
[6] 刘国强, 曾潮流, 徐 宁, 高 虹, 杨 柯. 锂蓄电池正极材料LiV3O8的合成和充放电性能[J]. 中国有色金属学报, 2002, 12(1): 70?73.
LIU Guo-qiang, ZENG Chao-liu, XU Ning, GAO Hong, YANG Ke. Synthesis and electrochemical properties of LiV3O8 as cathode material for rechargeable lithium batteries[J]. The Chinese Journal of Nonferrous Metals, 2002, 12(1): 70?73.
[7] 刘素琴, 黄可龙. 锂离子二次电池正极材料Li1+xV3O8热处理[J]. 矿冶工程, 1999, 19(3): 61?65.
LIU Su-qin, HUANG Ke-long. Heat treatment of Li1+xV3O8 as a cathode material for secondary lithium ion batteries[J]. Mining and Metallurgical Engineering, 1999, 19(3): 61?65.
[8] LIU Ping, ZHANG Ji-guang, John A. Turner, potassium manganese-vanadium oxide cathodes prepared by hydrothermal synthesis[J]. Journal of Power Sources, 2001(92): 204?211.
[9] Benedek R, Thackeray M M, Yang L H. First-principles calculation of atomic structure and electrochemical potential of Li1+xV3O8[J]. Journal of Power Sources, 1999(81/82): 487?490.
[10] Wadsley A D. Crystal chemistry of nonstoichiometric quinquevalent vanadium oxide: crystal structure of Li1+xV3O8[J]. Acta Crystallogr, 1957, 10: 261?267.
[11] Pistoia G, Panero S, Tocci M, Moshtev R V, Manev V. Solid solutions Li1+xV3O8 as cathodes for high rate secondary Li batteries[J]. Solid State Ionics, 1984, 13(4): 311?318.
[12] 刘恩辉, 李新海, 何则强, 侯朝辉, 邓凌峰. Ag+掺杂锂钒氧化物的合成及其电化学性能[J]. 中国有色金属学报, 2004, 14(5): 809?814.
LIU En-hui, LI Xin-hai, HE Ze-qiang, HOU Zhao-hui, DENG Ling-feng. Synthesis and electrochemical performance of Ag+ doped lithium vanadium oxide[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(5): 809?814.
[13] 刘建睿, 王 猛, 尹大川, 黄卫东. 锂离子电池正极材料LiV3O8的低温合成与研究[J]. 无机材料学报, 2002, 17(3): 617?620.
LIU Jian-rui, WANG Meng, YIN Da-chuan, HUANG Wei-dong. Low-temperature synthesis of LiV3O8 as cathode material for rechargeable lithium-ion batteries[J]. Journal of Inorganic Materials, 2002, 17(3): 617?620.
[14] 张华香, 童庆松, 林素英, 陈前火. 锂钒氧化物的合成及电化学性能的表征[J]. 无机盐工业, 2004, 36(3): 26?28.
ZHANG Hua-xiang, TONG Qing-song, LIN Su-ying, CHEN Qian-huo. Synthesis and electrochemical performance of Li1+xV3O8[J]. Inorganic Chemicals Industry, 2004, 36(3): 26?28.
[15] 查全性. 电极过程动力学导论[M]. 北京: 科学出版社, 2002: 402?410.
CHA Quan-xing. Introduction to kinetics of electrode process[M]. Beijing: Science Press, 2002: 402?410.
[16] LIU Guo-qiang, ZENG Chao-liu, YANG Ke. Study on the synthesis and properties of Li1+xV3O8 rechargeable lithium batteries cathode[J]. Electrochemica Acta, 2002(47): 3239?3243.
基金项目:安徽省教育厅自然科学基金研究资助项目(050601D2); 合肥工业大学创新基金资助项目(XS0635)
收稿日期:2006-09-20;修订日期:2007-06-15
通讯作者:鲁道荣,教授;电话:0551-2901451; E-mail:ldr897@sohu.com
摘 要:以甘氨酸为络合剂制备锂离子电池正极材料Li1+xV3O8。采用XRD﹑SEM﹑DSC和TG-DTA测试了Li1+xV3O8的结构、形貌和性质。结果表明:在420 ℃下焙烧20 h,可以得到正极材料Li1+xV3O8 ,该材料具有良好的结晶度和热稳定性。电化学测试表明:此方法合成的Li1+xV3O8在室温下以10 mA/g的电流放电时,首次放电容量高达360 mA?h/g, 循环30次后容量衰减约9.7%,循环性能良好;当放电电流从10 mA/g增大到25 mA/g时,其容量损失约50.5%。


