活化焙烧强化盐酸浸出红土矿的镍
李金辉1, 2,李新海1,胡启阳1,王志兴1,周友元1,郑俊超1,伍凌1
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;
2. 江西理工大学 材料与化学工程学院,江西 赣州,341000)
摘 要:
摘 要:通过X线衍射、红外光谱、差热、扫描电镜和液氮吸附等方法考察活化焙烧对红土矿矿相结构变化和有价金属浸出的影响。研究结果表明:该矿在277 ℃左右发生了针铁矿脱水转变为赤铁矿,在610 ℃发生蛇纹石去羟基化作用,该结果与通过XRD表征的在不同温度下进行焙烧的矿石中主要矿相的晶型转变结果一致;矿物在300 ℃焙烧时,比表面积为21.04 m2/g,在610 ℃焙烧时,比表面积为26.45 m2/g,比原矿的比表面积16.03 m2/g有较大提高,有助于后续的浸出过程;在300 ℃焙烧后,矿样浸出可以获得最大的镍浸出率,达93%,而铁的浸出减少,进一步升高焙烧温度不利于有价金属镍的浸出。
关键词:
中图分类号:TF815 文献标志码:A 文章编号:1672-7207(2010)05-1691-07
Enhancement of nickel extraction from laterite in hydrochloride acid through activated roasting
LI Jin-hui1, 2, LI Xin-hai1, HU Qi-yang1, WANG Zhi-xing1, ZHOU You-yuan1, ZHENG Jun-chao1, WU Ling1
(1. School of Metallurgy Science and Engineering, Central South University, Changsha 410083, China;
2. School of Materials and Chemical Engineering , Jiangxi University of Science and Technology,
Ganzhou 341000, China)
Abstract: Enhancement of nickel extraction via activated roasting treatment of laterite and subsequent acid leaching was investigated by X-ray diffraction (XRD), Fourier transform infrared (FTIR) spectroscopy, difference temperature analysis (DTA), scanning electron microscopy (SEM) and N2 adsorption techniques. The results show that there are two main phase transformation processes including goethite to hematite at roasting temperature 277 ℃ and lizardite dehydroxylation at roasting temperature 610 ℃, which accord with phase transformation of laterite minerals roasted at different temperatures investigated through X-ray powder diffraction (XRD). The specific surface area of roasted ore are 21.04 m2/g with 300 ℃ and 26.45 m2/g with 610 ℃ contrast with that of raw ore of 16.03 m2/g, which is greatly favorable to the subsequent leaching. Through leaching experiments of different roasted ores comparing with raw ore, increasing the temperature up to 300 ℃ for laterite, the optimum nickel recovery of 93% is obtained and the leaching of iron decreases, and further heating is not helpful to the nickel recovery.
Key words: laterite; nickel; activated roasting; leaching; hydrochloride acid; mineral reconstruction
镍在地球上是储量较丰富的一种金属,世界陆地镍储量约为4.7亿t。世界上可供开采的镍资源有2类:一类是硫化镍矿,占陆地镍资源的40%,另一类为红土镍矿,占60%。而世界上55%的镍产品都是从硫化矿中提取的,从红土镍矿中提取的镍产品低于世界镍产量的45%[1]。但随着开采的不断进行,硫化镍矿资源越来越少,品位逐渐下降,开采成本逐渐提高。红土镍矿被认为是将来开发的主要镍资源[2]。据估 计,到2010年从氧化镍矿中生产镍的产量会超过从硫化镍矿生产的镍产量[3]。然而,一个限制红土矿开发的主要因素是其生产成本是硫化镍矿生产成本的2~3倍[4]。目前,研究较多并得到工业应用的主要是高压酸浸(HPAL, PAL)[5]和还原焙烧氨浸[6]2种工艺,但该2种工艺也均存在着操作成本高、有价金属回收率低且不能适用于处理所有种类的红土矿等问题。对于主要存在于针铁矿颗粒中的镍的浸出常常需要对针铁矿颗粒进行完全破坏[7],而这通常需要较为苛刻的工艺条件,同时,导致铁的大量浸出和生产成本上升。活化焙烧是一种可以改变矿物结构的方法,广泛地应用于矿物的前处理过程。通过焙烧可以使红土矿中的羟基硅酸镁和蛇纹石发生晶型转变而形成无定形态的硅酸镁[8],同时,由于矿相中原有的自由水和键合水被分解,以及部分矿相的晶型改变导致矿物原有结构崩塌,使得比表面积和孔隙增加[9],有利于后续的浸出过程。云南沅江地区拥有丰富的红土镍矿,对于该地区红土矿国内已有多人展开研究[5, 10],但通过活化焙烧盐酸浸出尚无报道。在此,本文作者通过活化焙烧来强化浸出红土矿中的镍,并就不同焙烧温度对矿石中晶型的改变、对镍等有价金属浸出的影响及机理进行研究和讨论。
1 实验
1.1 原料
实验所用红土矿原料来自于云南,矿石经过磨碎后,用150 μm筛选取筛下矿粉在105 ℃下烘干。矿石成分(质量分数)如表1所示。图1所示为红土矿矿相XRD谱。由图1可知:该矿石中主要矿相为利蛇
表1 矿石化学成分
Table 1 Chemical composition of raw ore %

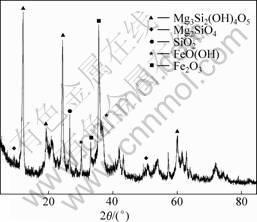
图1 红土矿矿相XRD图
Fig.1 X-ray diffraction pattern of raw laterite
纹石(Mg3Si2(OH)4O5)、针铁矿(FeO(OH))、赤铁矿(Fe2O3)和石英(SiO2)等。工艺矿物学研究表明矿石中的镍主要赋存于含铁矿物中,约占镍总量的81.15%,硅酸盐中的镍占18.85%。
1.2 实验方法
焙烧实验在管式炉中进行,如图2所示。焙烧温度通过连接在管式炉上的温度控制器进行调节控制。焙烧时,将装有物料的烧舟放置在管式炉的焙烧区,通入保护气氩气并以10 ℃/min的速度开始升温,至预定温度后计时,焙烧1 h后冷却至室温。将原矿料和不同温度下的焙烧料冷却后投入到如图3所示的浸出装置中进行浸出实验研究。浸出工艺条件如下:固液比为1?6,初始酸浓度为4 mol/L,浸出温度为50 ℃,浸出时间为1 h。
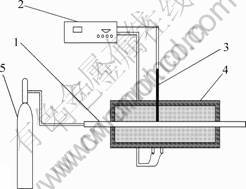
1—玻璃管; 2—温度控制器; 3—热电偶; 4—加热炉; 5—氩气瓶
图2 焙烧实验装置
Fig.2 Roasting equipment sketch
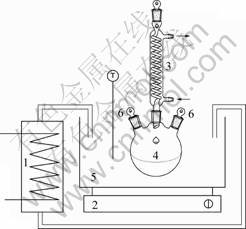
1—温度加热系统; 2—磁力搅拌装置; 3—冷凝装置; 4—三孔圆底烧瓶; 5—水浴槽; 6—加料孔
图3 浸出实验装置
Fig.3 Leaching equipment sketch
1.3 分析方法
溶液中金属离子浓度采用化学分析滴定的方法测定,低浓度采用原子吸收的方法测定,物相分析采用X线衍射仪(Rint-2000, Rigaku)进行分析测定(以Cu Kαɑ 为靶材,λ=1.540 56×10-10 m,扫描速度为2 (°)/min))。采用JEOLr JSM-5612LV型扫描电镜观察产物形貌,采用Nicolet NEXUS 670型红外光谱仪检测红外光谱。采用北京汇海宏纳米科技有限公司生产的3H-2000全自动氮吸附比表面积测试仪测定比表面积。
2 结果与讨论
2.1 矿物学分析
红土矿的热重曲线、在不同焙烧温度下矿相组成和红外光谱分别如图4~6所示。从图4可知:在277 ℃ 和607 ℃有2个吸热峰,分别为针铁矿和利蛇纹石的去羟基化作用[11]。从图5中曲线(a)和(b)可知:针铁矿相在X线衍射图中30.1°和37.4°的特征峰在300 ℃焙烧下消失,说明其内部结构羟基开始大量脱失,晶体结构被破坏,发生脱水反应[11],如反应式(1)所示,其质量损失4.341%。从图6中曲线(a)和(b)可以看出:在3 410和1 630 cm-1处针铁矿的特征吸收谱带在300 ℃焙烧后变宽和减弱,表明针铁矿向赤铁矿发生了转变。同时,该谱带表明由针铁矿脱水生成的赤铁矿有可能含带部分羟基,其可表述为Fe2-x/3(OH)xO3-x[12]。当焙烧温度上升至610 ℃时,利蛇纹石(Mg3Si2(OH)4O5)开始分解形成无定型的硅酸镁。从图5中曲线(e)可以看出:在12.1°,20.2°和60.1°,利蛇纹石的特征峰逐渐变宽并消失。该分解反应如方程式(2)所示,其质量损失7.618%。比较图6中曲线(a)与曲线(c)和(d)可以看出:波数为3 686和3 550 cm-1时的吸收峰是利蛇纹石八面体结构中的外羟基(结构水)和内羟基(层间水)伸缩振动峰[10],这些特征谱带在300 ℃焙烧下仍然存在,只是强度有所减弱,说明利蛇纹石的晶型仍然较为完整而没有被破坏。但当焙烧温度为610 ℃和800 ℃时,这几处特征峰完全消失或合并
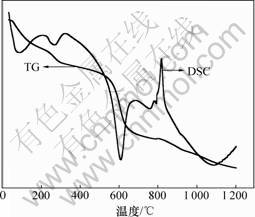
图4 红土矿热重曲线
Fig.4 TG-DSC curves of laterite
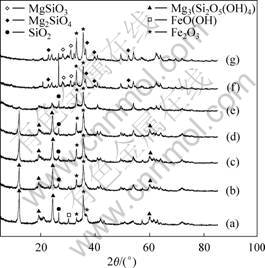
(a) 原矿; (b) 300 ℃; (c) 400 ℃; (d) 500 ℃; (e) 610 ℃; (f) 700 ℃; (g) 800 ℃
图5 不同焙烧温度下红土矿XRD图
Fig.5 X-ray diffraction pattern of laterite minerals roasted at different temperatures
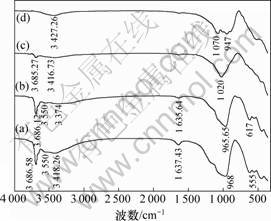
(a) 原矿; (b) 300 ℃; (c) 610 ℃; (d) 800 ℃
图6 不同焙烧温度下的FTIR图
Fig.6 FTIR spectrum of laterite roasted at different temperatures
成一处更宽的吸收带,表明已脱出羟基,晶体结构被破坏,产生相变。当焙烧温度超过610 ℃达到700 ℃和800 ℃时,由图5中曲线(e)和(d)可见:无定型硅酸镁重新结晶形成镁橄榄石(Mg2SiO4)和顽辉石(MgSiO3)。从图6中曲线(d)可以看出:在1 020 cm-1处分裂为1 070和947 cm-1 2个吸收峰,此特征峰表明有硅酸盐橄榄石生成[13]。同时,由图5中曲线(f)可以发现:在27.2°处,SiO2特征峰强度有所增加。这可能是利蛇纹石结构水进一步脱除导致无定形SiO2生成并结晶,样品中SiO2含量增加所致[13]。DSC-TGA分析显示由于镁橄榄石晶型发生改变而导致在 807 ℃出现了1个放热峰[10]。
2FeO?OH→Fe2O3+H2O↑ (1)
Mg3Si2(OH4)O5→Mg2SiO4+MgSiO3+2H2O↑ (2)
2.2 浸出结果分析
2.2.1 镍的浸出
图7所示为焙烧温度对浸出结果的影响。从图7可以看出:在300 ℃进行活化焙烧可以显著地增加镍的浸出,并达到最大浸出率93.1%。这可能是因为镍主要赋存于针铁矿相中[14-16],而其中的镍要想完全溶解必须完全破坏掉针铁矿相[17]。从图4和图5中曲线(b)可以看出:在300 ℃焙烧下,由于矿物中的针铁矿脱水转变成赤铁矿而导致原有矿的结构被破坏,使得其中的镍被释放出来。不同焙烧温度下矿物比表面积如图8所示。从图8可以看出:300 ℃时的焙烧料比表面积为21.04 m2/g。同时,通过对比图9(a)和(b)可以看出:在300 ℃时焙烧料的矿物表面相对于原矿矿物表面有更多的细孔和碎片;随着焙烧的温度升至400 ℃和500 ℃,由于部分小颗粒的重新团聚导致比表面积略微下降(见图7),因而镍的浸出率也有所 下降。
不同焙烧温度下矿物扫描电镜图如图9所示。当焙烧温度为610 ℃时,利蛇纹石(Mg3Si2(OH)4O5)开始分解并导致原矿结构被更大程度地破坏。从图9(c)可以看出:其矿物表面相对于其他焙烧温度矿物表面有更多的细孔和碎片,其比表面积达到了最大值26.45 m2/g。但是,由图7可知:在610 ℃时镍的浸出率下降至77%。这是因为在610 ℃下焙烧产生了无定型体硅酸盐,随着其不断被浸出,大量具有较大表面积的硅酸盐颗粒分布在浸出液中,其表面有高能量的活性
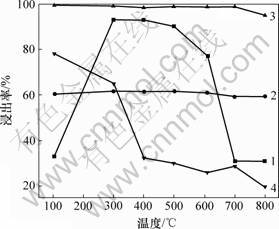
1—Ni; 2—Co; 3—Mn; 4—Fe
图7 焙烧温度对浸出结果的影响
Fig.7 Effect of roasting temperature on leaching results
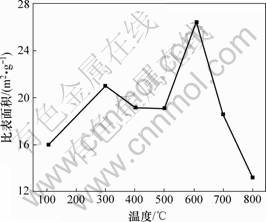
图8 不同焙烧温度下矿物的比表面积
Fig.8 Specific surface area of raw ore and roasting ore at different temperatures

焙烧温度:(a) 原矿; (b) 300 ℃; (c) 610 ℃; (d) 800 ℃
图9 不同焙烧温度下矿物扫描电镜图
Fig.9 SEM image of laterite
基团(Si—O—H),可以吸附气相和液相中的离子或分子[18]。Whittington等[19-20]发现由于红土矿酸浸渣中的无定型硅酸盐具有很强的电负性,可以吸附镍而造成镍的损失。同时,Kosuge等[21-22]认为常压酸浸红土矿过程会导致硅酸盐结构的部分分 解,不会造成大量硅酸的产生。因此,对300,400和500 ℃焙烧料进行浸出镍的损失远小于610 ℃时焙烧料浸出镍的损失。从图8可知:当焙烧温度为700 ℃和800 ℃时,镍比表面积分别降为18.61和13.23 m2/g,相应的镍浸出率降为31.25%和31.1%。这是因为过高的焙烧温度会降低矿物的多孔性和比表面积[23],同时,当去羟基化反应发生之后,镍变得不稳定,易进入硅酸镁盐形成(Mg,Ni)3SiO2并且重结晶形成橄榄石型[24](见图5(f)和5(g))。该矿石结构将镍包覆在里面,阻碍了镍从该相中脱出。
2.2.2 铁的浸出
从图7可以看出:Co和Mn等金属的浸出并未受到焙烧的影响。这可能是由于钴和锰所存在的矿相并未因为焙烧而显著地改变或破坏。但随着焙烧温度的
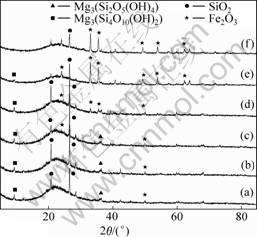
焙烧温度/℃:(a) 300; (b) 400; (c) 500; (d) 610; (e) 700; (f) 800
图10 不同温度下焙烧料浸出渣XRD谱
Fig.10 XRD pattern of leaching residue at different roasting temperatures
上升,铁的浸出却相应的下降。从图5可以看出:赤铁矿在2θ为33°处的特征峰随着焙烧温度的升高越来越强,尤其是当焙烧温度超过610 ℃后,伴随着利蛇纹石的脱水,硅酸镁与铁嵌合重结晶形成橄榄石晶体(Mg, Fe)3SiO2,进一步阻碍了铁的浸出,这种情况与镍类似。
从图10可以看出:不同焙烧温度下浸出渣中的物相有明显不同。在300,400和500 ℃焙烧料浸出渣中,主要有滑石(Mg3Si4O10(OH)2)、利蛇纹石(Mg3Si2(OH)4O5)、脉石(SiO2)和赤铁矿(Fe2O3)等矿相,这说明在浸出过程中利蛇纹石部分转变成为滑石,而由于赤铁矿的部分溶解以及晶体结构一定程度的改变导致其在物相图中特征衍射峰减少,峰强度减弱;当焙烧温度超过610 ℃后,其浸出渣中羟基硅酸盐相开始消失,出现了较为尖锐的三氧化二铁特征峰。这也印证了当焙烧温度达到610 ℃后硅酸镁与铁嵌合形成橄榄石晶型的结论。由于更多的铁被嵌合而延缓了铁的浸出过程,因此,在一定的浸出时间内铁浸出率有所下降。从图10(e)和(f)可以看出:其浸出渣中出现了更多的Fe2O3特征峰,这是由于Fe2O3矿相随着焙烧温度的升高其晶型也更趋于完整,因此,其浸出得到了进一步抑制[25]。
3 结论
(1) 焙烧可以显著地改变红土矿中的矿相结构,对后续的浸出产生重要影响。本实验所用红土矿最佳焙烧温度为300 ℃,镍的浸出率可达到93%左右,继续提高焙烧温度不利于有价金属镍的浸出。
(2) 采用活化焙烧红土矿的处理方法,通过焙烧之后,可以在较短的时间、较低的酸度以及较低的反应温度下达到在其他相对苛刻的浸出条件下相同的镍浸出率,同时,在一定程度下抑制了铁的浸出,有利于后续的净化富集工序。
参考文献:
[1] Moskalyk R R, Alfantazi A M. Nickel laterite processing and electrowinning practice[J]. Minerals Engineering, 2002, 15(8): 593-605.
[2] Pickles C A. Microwave heating behaviour of nickeliferous limonitic laterite ores[J]. Minerals Engineering, 2004, 17(6): 775-784.
[3] 卢生康, 赵万双. 镍工业发展趋势研究[J]. 兰州工业高等专科学校学报, 2004, 11(4): 55-58.
LU Sheng-kang, ZHAO Wan-shuang. Research on the developing tendency of nickel industry in China[J]. Journal of Lanzhou Polytechnic College, 2004, 11(4): 55-58.
[4] Thomas F T. Comparative costs of nickel sulphides and laterites[J]. Resources Policy, 1995, 21(3): 179-187.
[5] McDonald R G, Whittington B I. Atmospheric acid leaching of nickel laterites review, Part I: Sulphuric acid technologies[J]. Hydrometallurgy, 2008, 91(1/2/3/4): 35-55.
[6] 尹飞, 阮书锋, 江培海, 等. 低品位红土镍矿还原焙砂氨浸试验研究[J]. 矿冶, 2007, 16(3): 29-33.
YIN Fei, RUAN Shu-feng, JIANG Pei-hai, et al. Experimental study on roasted ore of poor nickeliferous laterite ore with ammonia leaching technology[J]. Mining & Metallurgy, 2007, 16(3): 29-33.
[7] Senanayake G, Das G K. A comparative study of leaching kinetics of limonitic laterite and synthetic iron oxides in sulfuric acid containing sulfur dioxide[J]. Hydrometallurgy, 2004, 72(1/2): 59-72.
[8] Valix M, Cheung W H. Study of phase transformation of laterite ores at high temperature[J]. Minerals Engineering, 2002, 15(8): 607-612.
[9] 李小斌, 周秋生, 彭志宏, 等. 活化焙烧一水硬铝石矿增浓溶出过程动力学[J]. 中南工业大学学报: 自然科学版, 2000, 31(3): 219-221.
LI Xiao-bin, ZHOU Qiu-sheng, PENG Zhi-hong, et al. Study on the kinetics of digesting roasted dia spore in the sweetening process[J]. Journal of Central South University of Technology: Natural Science, 2000, 31(3): 219-221.
[10] Wei L, Qiming F, Leming O, et al. Fast dissolution of nickel from a lizardite-rich saprolitic laterite by sulphuric acid at atmospheric pressure[J]. Hydrometallurgy, 2009, 96(1/2): 171-175.
[11] Tartaj P, Cerpa A, Garcia-Gonzalez M T, et al. Surface instability of serpentine in aqueous suspensions[J]. J Colloid Interface Sci, 2000, 231(1): 176-181.
[12] Mariana A, Rueda E H, Sileo E E. Structural characterization and chemical reactivity of synthetic Mn-goethites and hematites[J]. Chemical Geology, 2006, 231(4): 288-299.
[13] 郭立鹤, 韩景仪. 红外反射光谱方法的矿物学应用[J]. 岩石矿物学杂志, 2006, 25(3): 250-256.
GUO Li-he, HAN Jing- yi. The mineralogical application of IR reflectance spectrometry[J]. Acta Petrologica et Mineralogica, 2006, 25(3): 250-256.
[14] McDonald R G, Whittington B I. Atmospheric acid leaching of nickel lateritesreview. Part Ⅱ: Chloride and bio-technologies[J]. Hydrometallurgy, 2008b, 91(1/2/3/4): 56-69.
[15] Senanayake G. Review of theory and practice of measuring protein activity and pH inconcentrated chloride solutions and application to oxide leaching[J]. Miner Eng, 2007, 20(7): 634-645.
[16] Whittington B I, Muir D. Pressure acid leaching of nickel laterites: A review[J]. Min Proc Ext Met Rev, 2000, 21(6): 527-600.
[17] Senanayake G, Das G K. A comparative study of leaching kinetics of limonitic laterite and synthetic iron oxides in sulfuric acid containing sulfur dioxide[J]. Hydrometallurgy, 2004, 72(1/2): 59-72.
[18] Reig F B, Adelantado J V G, Moya Moreno M C M. FTIR quantitative analysis of calcium carbonate (calcite) and silica (quartz) mixtures using the constant ratio method: Application to geological samples[J]. Talanta, 2002, 58 (4): 811-821.
[19] Whittington B I, Johnson J A. Pressure acid leaching of arid-region nickel laterite ore. Part Ⅲ: Effect of process water on nickel losses in the residue[J]. Hydrometallurgy, 2005, 78(3/4): 256-263.
[20] Whittington B I, McDonald R G, Johnson J A, et al. Pressure acid leaching of arid-region nickel laterite ore. Part Ⅰ: Effect of water quality[J]. Hydrometallurgy, 2003, 70(1/2/3): 31-46.
[21] Kosuge K, Shimada K, Tsunashima A. Micropore formation by acid treatment of antigorite[J]. Chem Mater, 1995, 7(12): 2241-2246.
[22] Lin F C, Clemency C V. The dissolution kinetics of brucite, antigorite, talc, and phlogopite at room temperature and pressure[J]. Am Mineral, 1981, 66(7/8): 801-806.
[23] Chander S, Sharma V N. Reduction roasting/ammonia leaching of nickeliferous laterites[J]. Hydrometallurgy, 1981, 7(4): 315-327.
[24] Kukura M E, Stevens L G, Auck Y T. Development of UOP process for oxide silicate ores of nickel and cobalt[C]//Evans D J I, Shoemaker R S, Veltman H. International Laterite Symposium. New York: SME-AIME, 1979: 527-552.
[25] O’Connor F, Cheung W H, Valix M. Reduction roasting of limonite ores: Effect of dehydroxylation[J]. Int J Miner Process, 2006, 80(2/3/4): 88-99.
收稿日期:2009-11-03;修回日期:2010-02-01
基金项目:国家重点基础研究发展计划(“973”计划)项目(2007CB613607);国家自然科学基金资助项目(50864004)
通信作者:李新海(1963-),男,湖南邵阳人,博士,教授;从事资源高效提取和电池材料制备研究;电话:0731-88836633;E-mail: bigworld_li@163.com


