锂离子电池正极材料LiMn2O4的改性研究
北京有色金属研究总院矿物资源与冶金材料所,北京有色金属研究总院矿物资源与冶金材料所,北京有色金属研究总院矿物资源与冶金材料所,北京有色金属研究总院矿物资源与冶金材料所 北京100088 ,北京100088 ,北京100088 ,北京100088
摘 要:
为改善尖晶石LiMn2O4的循环性能, 采用高温固相法合成了由Li2CO3改性的尖晶石锂锰氧化物, 研究了Li2CO3添加量对LiMn2O4性能的影响。通过XRD, Rietveld精细XRD分析和模拟电池等方法对产物的结构和电化学性能进行了表征与测试。结果表明, 部分Li进入到尖晶石LiMn2O4的晶格中, 增强了材料充放电循环过程中的结构稳定性。随着Li2CO3量的增加, 产物的循环稳定性增加。当Li2CO3的加入量为0.06摩尔比时, 10次循环后的高温容量衰减由改性前的15%降低到6.8%。
关键词:
中图分类号: TM911;
收稿日期:2005-08-01
基金:国家自然科学基金 (50074012) 资助项目;
Modification of LiMn2O4 for Cathode Materials of Lithium Ion Batteries
Abstract:
In order to improve the cyclic performance of spinel LiMn2O4, the lithium mangnese oxides modified with Li2CO3 were prepared by solid phase reaction at high temperature.The effect of Li2CO3 content on electrochemical characteristics of LiMn2O4 was studied.Structure and electrochemical performance of the material were characterized by means of XRD, Rietveld refine XRD and model battery.The results show that partial Li+ entrancing into the spinel crystal structure may imporve the stability of crystalline structure.Products with high Li2CO3 ratio exhibited best cyclic performance at room temperature and elevated temperature.The best electrochemical performance is shown by a composite containing 0.06 molar ratio of Li2CO3, in this time the capacity loss decreases from 15% for pure LiMn2O4 to 6.8% at 55 ℃ after 10 cycles.
Keyword:
lithium ion batteries;LiMn2O4;modification;electrochemical performance;
Received: 2005-08-01
锂离子电池正极材料尖晶石LiMn2O4具有资源丰富、 价格低廉、 对环境友好且合成相对简单等特点, 成为电池材料领域研究的热点。 但该种材料充放电过程中结构不稳定造成的循环性差、 特别是高温下容量的衰减快等缺点制约了其产业化应用
1 实 验
以Li2CO3, 尖晶石LiMn2O4 (编号为A) 为原料, 按n (Li2CO3) ∶n (LiMn2O4) 分别为0.02∶1, 0.06∶1, 0.10∶1充分混合后在马弗炉中800 ℃保温8 h, 制备出改性的LiMn2O4电极材料, 相应的产物编号为A1, A2, A3。
电化学性能测试: 将活性物质与导电剂、 PVDF按一定比例混合均匀后调浆, 涂在铝箔上制成面积为1 cm×1.5 cm的双面电极, 以金属锂为对电极组装模拟电池。 电解液是1 mol·L-1 LiPF6/EC-DMC (体积比1∶1) 。 采用恒电流充放电法在LAND测试仪上测试材料的电化学性能, 电流密度为0.2 mA·cm-2, 电压范围为3.3~4.35 V。
产物相结构采用Cu靶辐射的X射线衍射分析, 扫描范围10°~90°; 采用扫描电镜 (SEM) 观察产物的形貌。
2 结果与讨论
2.1 晶体结构表征
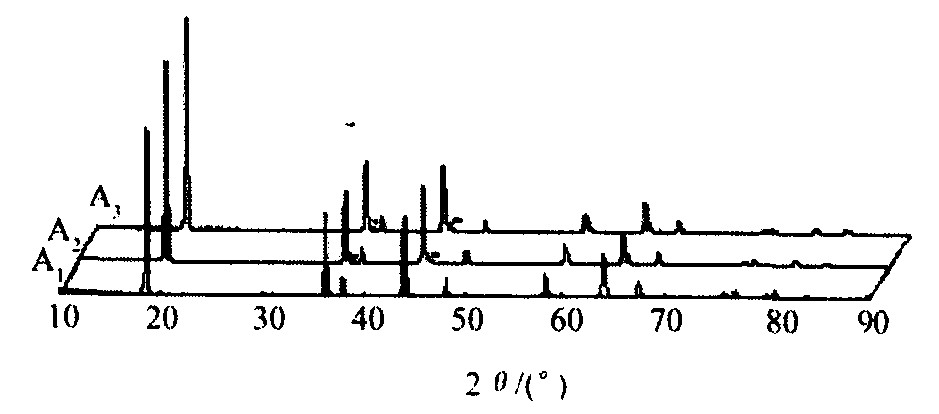
图1是合成改性产物的XRD图谱。 由图可知, 当改性物质Li2CO3的添加量比较小时 (0≤Li2CO3/LiMn2O4≤0.02) , 没有出现异常的衍射峰, 合成产物A1呈完好的正尖晶石结构。 随着改性物质Li2CO3的量增加 (0.06≤Li2CO3/LiMn2O4) , 图中出现了微弱的杂相峰, 并且当反应物中Li2CO3/LiMn2O4摩尔分数为0.1时, 杂相峰的衍射强度有所增大。 这说明此时合成的产物已不是纯的尖晶石结构。 表1为采用科亨最小二乘法计算出的产物的晶胞参数。 计算结果表明A的晶胞参数 (0.8251nm ) 以及A1的晶胞参数 (0.8253 nm) 较化学计量比LiMn2O4晶胞参数 (0.8247 nm)
图1 改性产物的X射线衍射图谱
Fig.1 XRD patterns of modified LiMn2O4
表1产物的晶胞参数
Table 1Crystalline Parameters of products
产物 |
Li2CO3/ LiMn2O4 (摩尔分数) | 晶胞常数/nm |
A |
0 | 0.8251 |
A1 |
0.02 | 0.8253 |
A2 |
0.06 | 0.8237 |
A3 |
0.10 | 0.8189 |
为进一步了解产物的结构, 对产物A1进行了Rietveld精细XRD分析。 图2为A1拟合得到的XRD谱图, 图2 (a) 中黑点表示实际观测的结果, 黑线表示拟合得到的衍射谱, 图2 (b) 中的曲线表示观测值与拟合值之间的差别, 结构参数列于表2。 由表2可以看出, 只有当100%的锂与0.1%的锰处于8a位置, 99.9%的Mn处于16d位置, 100%的O处于32e位置时, 布拉格因子Rb最小, 此时拟合谱与观测结果符合最好。 由此表明, 对于A1, Li2CO3和 LiMn2O4经高温热处理后, 0.1%的锰从16d的位置转而进入8a位置, 晶胞中锰的迁移将导致其晶胞参数较化学计量比的LiMn2O4的晶胞参数偏大, 这与我们的实验结果相吻合。
2.2 充放电特性
表3为合成产物在常温 (25 ℃) 和高温 (55 ℃) 下充放电循环性能。 由表中结果可见, 高温下的容量损失高于常温下的容量损失。 与LiMn2O4相比, Li2CO3加入量的多少对产物的电化学循环稳定性影响较大。 55 ℃时, LiMn2O4的初始可逆容量为122.6 mAh·g-1, 经10周循环后降至104.1 mAh·g-1, 容量损失高达15.0%, 而Li2CO3改性后的产物A1~A3, 随着反应物中Li2CO3的增加, 经10周循环后, 容量损失分别降为9.9%, 6.8%和4.9%, 与常温下的容量损失相当。 可见, 含锂越高的改性产物, 循环性能越好。 究其原因, 这主要是由于Li2CO3中的Li+进入到尖晶石LiMn2O4的晶格之中, Li/Mn增加, 使尖晶石结构中Mn3+含量降低, 这不仅降低了Mn3+的溶解, 而且抑制了放电末期Jahn-Teller效应的发生, 增加了材料结构的稳定性
表2A1的结构参数
Table 2Structure Parameters of A1
| 原子 | 位置 | 占有率 | x | y | z | B/104 pm2 |
Li |
8a | 1.000000 | 0.125000 | 0.125000 | 0.125000 | 0.500000 |
Mn1 |
8a | 0.001000 | 0.125000 | 0.125000 | 0.125000 | 0.500000 |
Mn2 |
16d | 0.999000 | 0.500000 | 0.500000 | 0.500000 | 0.500000 |
O |
32e | 1.000000 | 0.262690 | 0.262690 | 0.262690 | 0.500000 |
Rb=6.749% (Rb:布拉格因子)
图2 A1的XRD的拟合 (a) 与差异谱 (b)
Fig.2 XRD for A1: (a) Observed and calculated; (b) Difference plot
表3不同Li2CO3/LiMn2O4摩尔比的尖晶石产物的循环性能
Table 3Cycling capacity for products with different Li2CO3/LiMn2O4molar ratio
样品 |
LiMn2O4 | A1 | A2 | A3 | ||||
温度/℃ |
25 | 55 | 25 | 55 | 25 | 55 | 25 | 55 |
首次放电容量/ (mAh·g-1) |
118.8 | 122.6 | 118.2 | 119.8 | 112.3 | 115.5 | 105.4 | 106.1 |
第十周放电容量/ (mAh·g-1) |
105 | 104.1 | 106.8 | 105.9 | 104.9 | 107.6 | 100.5 | 101.2 |
容量损失/% |
11.6 | 15.0 | 10.23 | 11.6 | 6.6 | 6.8 | 4.7 | 4.9 |
图3 LiMn2O4, A3的SEM图 (a) LiMn2O4; (b) A3
Fig.3 SEM pattern of LiMn2O4 and A3
2.3 产物的扫描电镜分析
图3是LiMn2O4和改性产物A3的SEM照片。 可见未改性的LiMn2O4表面呈蜂窝状, 颗粒分布比较均匀, 粒度分布较小, 而改性产物A3颗粒之间显得比较松散, 颗粒分布不均匀, 粒度分布相对较大。 由于尖晶石的比表面积对锰的溶解速度影响很大, 为此认为, 改性产物粒度增大, 减少了电极材料和电解液的界面面积, 提高了电极材料的电性能。
3 结 论
1. 适当增加锂在锰酸锂中的比例可有效地抑制Jahn-Teller效应, 补充锂在充放电过程中的损失, 稳定晶体结构。
2. Li2CO3为改性剂, 有效提高了尖晶石LiMn2O4的循环性能。
3. 引入过多的锂会产生杂质相, 影响材料的比容量。
参考文献
[10] 金维华, 卢世刚, 蔡振平.不同铝盐对LiMn2O4改性材料性能的影响[J].稀有金属, 2005, 29 (4) :530.