DOI: 10.11817/j.issn.1672-7207.2016.01.005
磁性固体酸催化剂S2O82-/ZrO2-TiO2-Fe3O4的制备及其催化合成乙酰丙酸
王义刚1,聂小安1, 2
(1. 中国林业科学研究院 林产化学工业研究所 江苏 南京,210042;
2. 中国林业科学研究院 林业新技术研究所,北京,100091)
摘 要:
制备具有磁性功能的固体酸催化剂S2O82-/ZrO2-TiO2-Fe3O4,利用红外、X线衍射、氮气吸附脱附、振动样品磁强计等方法对其结构及性能进行表征,获得孔径为1.74 nm、BET面积为27.3 m2/g及具有四方晶型结构的磁性固体酸催化剂。研究结果表明:该催化剂应用于催化葡萄糖制备乙酰丙酸,在葡萄糖质量浓度为30 g/L,催化剂质量浓度3 g/L,反应温度200 ℃,反应时间2 h的条件下,乙酰丙酸的产率达70.2%,催化剂回收率90%以上。
关键词:
中图分类号:TQ032.4 文献标志码:A 文章编号:1672-7207(2016)01-0026-07
Preparation of magnetic solid acid catalyst S2O82-/ZrO2-TiO2-Fe3O4 and its application to synthesis of levulinic acid
WANG Yigang1, NIE Xiaoan1, 2
(1. Institute of Chemical Industry of Forest Products, CAF, Nanjing 210042, China;
2. Institute of New Technology of Forestry, CAF, Beijing 100091, China)
Abstract: The magnetic solid acid catalyst S2O82-/ZrO2-TiO2-Fe3O4 was prepared by chemical co-precipitation, and the structures and properties of the catalysts were characterized by the methods of IR, XRD, BET and VSM. The catalyst with BET pore diameter of 1.74 nm, BET area of 27.3 m2/g and tetragonal structure was obtained. The results show that using the catalyst for the synthesis of levulinic acid from glucose under the conditions of glucose concentration 30 g/L, reaction temperature 200 ℃ and reaction time 2 h, the levulinic acid yield of 70.2% and catalyst recovery of 90% can be obtained.
Key words: chemical co-precipitation; synthesis; magnetic solid acid catalyst; levulinic acid; characterization
随着全球能源危机及环境污染的日益加重,可再生生物质资源的利用引起了世界的广泛关注,生物质被认为是最重要的可替代化石资源的可再生资源之一。然而,生物质结构的多样性及成分的复杂性,导致其加工产品分级处理困难、成本过高,严重限制了其工业化进程。生物质平台化合物的高效转化技术成为解决生物质资源工业化应用的关键技术。乙酰丙酸是一种由葡萄糖、淀粉、蔗糖和纤维素等生物质原料通过降解反应得到的平台化合物,由于含有高反应活性的羰基和羧基官能团,易于发生酯化、氧化还原、取代和聚合等一系列反应,成为生物质高效应用的重要研究方向[1]。无机液体酸是乙酰丙酸制备最重要的早期催化剂,由于存在设备腐蚀性大、后处理困难、易于造成环境污染等问题而逐渐被更加环保的固体酸所取代[2-5]。固体酸催化剂具有可再生性、环境污染小、设备腐蚀小以及回收成本低等优点[6-9],同时也存在热稳定性差、反应活性低和比表面积小等缺陷。如何提高固体酸催化活性、降低回收损失率是固体酸催化剂研究的关键问题。以ZrO2为活性组分是固体酸催化剂中最具代表性的一类,通过改善ZrO2的微观结构,可以制备许多具有高效催化活性的纳米级固体酸催化剂:1) 在ZrO2微观结构上引入Ti,Si以及Al等金属元素,该方法可以显著提高催化剂表面酸强度[10-12];2) 用硫酸或过硫酸根离子对固体酸催化剂进行浸渍,分别形成较强的 及Lewis 酸中心[13],进一步提高固体酸的酸性[14]。马雪旦等[15]通过对固体酸结构的改性及颗粒的纳米化,固化酸催化剂的催化效率得到极大提高,但纳米级颗粒也给催化剂的回收带来了困难。本文作者以化学共沉淀法,在利用Ti金属对ZrO2微观结构进行改性的同时,将磁性基体引入固体酸催化剂核心结构中,制备具有磁性功能的S2O82-/ ZrO2-TiO2-Fe3O4催化剂,并对该磁性催化剂进行结构表征及应用研究。
及Lewis 酸中心[13],进一步提高固体酸的酸性[14]。马雪旦等[15]通过对固体酸结构的改性及颗粒的纳米化,固化酸催化剂的催化效率得到极大提高,但纳米级颗粒也给催化剂的回收带来了困难。本文作者以化学共沉淀法,在利用Ti金属对ZrO2微观结构进行改性的同时,将磁性基体引入固体酸催化剂核心结构中,制备具有磁性功能的S2O82-/ ZrO2-TiO2-Fe3O4催化剂,并对该磁性催化剂进行结构表征及应用研究。
1 实验部分
1.1 材料
葡萄糖、硫酸亚铁、三氯化铁、硫酸亚钛、氧氯化锆均为分析纯,国药集团化学试剂有限公司生产;氨水、过硫酸铵为分析纯,南京化学试剂有限公司生产。
1.2 磁性固体酸催化剂的制备
1.2.1 磁性基体的制备
将质量为1.4 g硫酸亚铁和2.7 g 三氯化铁溶于带有电动搅拌器、回流冷凝器及N2保护气的四口烧瓶中,通入N2同时开动搅拌并逐渐升温至45 ℃,然后滴加氨水至pH为9~11,继续反应1 h,最后用磁分离技术分离磁性基体,用去离子水反复冲洗至中性。
1.2.2 S2O82-/ZrO2-TiO2-Fe3O4磁性催化剂的制备
向快速搅拌的三口烧瓶中依次加入15 g氧氯化锆、10 mL硫酸亚钛溶液以及全部的磁性基体。搅拌混合均匀后逐渐滴加氨水至pH大于9,继续反应1 h,陈化2 h。将生成的产物用磁分离技术反复洗涤至中性,并用AgNO3检测保证无Cl-。然后在1.5 mol/L的(NH4)2S2O8溶液中浸泡24 h,真空烘干,在600 ℃下焙烧,冷却后得S2O82-/ZrO2-TiO2-Fe3O4磁性催化剂。
1.3 催化剂结构表征
Magna-IR550型红外光谱仪:KBr压片法,分辨率为4 cm-1,波长范围为400~4 000 cm-1,扫描次数为32次/min。
TD型X线衍射仪:辐射源Cu靶,管电压为40 kV,管电流为30 mA,扫描范围2θ为10°~80°,扫描速度为6°/min,采样步宽为0.02°。
3H-2000PS2型全自动比表面及微孔物理吸附分析仪:测试前样品于150℃下脱水预处理6 h,载气为He。
采用BET(Brunauer-Emmett-Teller, BET)方程计算样品比表面积,相对压力范围为0.05~0.22;
采用BJH模型通过等温线吸附分支计算孔容和孔径分布。
LH-3型振动样品磁强计:磁矩量程为0.08 A·m2,磁场量程为2.0 T,磁场范围为-1.59~1.59 MA/m,时间常数为0.1 s,退磁因子为0.322 0。
TP-5080型全自动多用吸附仪:在N2氛围下程序升温至500℃,处理2 h后,降温至120℃吸附NH3直至平衡。N2吹扫20 min,以10℃/min的速率程序升温至1 000 ℃。色谱条件:柱温为60℃,载气为He,流量为30 mL/min。
1.4 乙酰丙酸的制备
将500 mL 30 g/L的葡萄糖水溶液以及1 g磁性固体酸催化剂先后加入到带有搅拌器的高压反应釜中,设定反应温度为190 ℃,反应时间为120 min,转速为800 r/min。反应结束后用冷却水将反应液迅速冷却、冷藏。然后利用外加磁场的作用下回收催化剂。
1.5 乙酰丙酸成分分析
利用高效液相色谱采用外标法对反应液中乙酰丙酸的含量进行检测,色谱柱采用Agilent TC-C18(2),长×宽×高为25 cm×4.6 mm×5 μm,流动相采用V(乙腈):V[磷酸-磷酸二氢钠缓冲溶液(pH=2~3)]=15:85。流速为1 mL/min,波长为265 nm,进样体积为20μL [16]。
2 结果与分析
2.1 催化剂S2O82-/ZrO2-TiO2-Fe3O4结构表征
本文主要通过红外光谱来验证强酸性中心的形成,以XRD图谱来证明高温煅烧提高了催化剂稳定性及酸性,以低温氮气吸附脱附方法来测试催化剂的BET表面积及孔径,以磁滞回线表征磁性的强弱。
2.1.1 催化剂的红外谱
催化剂S2O82-/ZrO2-TiO2-Fe3O4红外光谱见图1。由图1可知:催化剂在3 159.23 cm-1处出现了O—H的伸缩振动峰,在1 630.40 cm-1处出现了表面金属原子吸附水的O—H弯曲振动吸收峰,在565.26 cm-1处出现了Fe—O的伸缩振动峰,在1 062.52 cm-1处出现了O=S=O的伸缩振动峰,结果表明催化剂经过过硫酸根的浸渍及高温煅烧已由离子键变成了稳定的共价键。S=O具有很强的诱导效应,增强了Zr表面的酸性,形成了稳定的酸性中心[17]。波数在890 cm-1处为Zr—O—S的伸缩振动峰,表明S2O82-与ZrO2并非简单的物理附着,而是发生了化学反应。
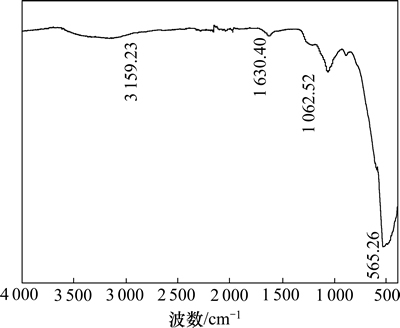
图1 催化剂的红外光谱图
Fig. 1 IR spectra of catalyst
2.1.2 催化剂的XRD分析
催化剂煅烧前后的XRD如图2所示。从图2可知:经过高温煅烧的催化剂为2θ=30°,35°,50°和60°时均出现较强的ZrO2衍射峰,说明高温煅烧促使ZrO2四方晶型的形成并不断趋于完整[18],这有利于提高催化剂的稳定性,增加酸中心的密度和酸性。图2中未能检测到TiO2的晶相衍射峰,可能Ti的引入量较少且以高度分散状态存在,与磁性固体酸催化剂的基体氧化物ZrO2形成了均相混合的复合氧化物[19]。
2.1.3 催化剂的低温氮气吸附脱附分析
催化剂的低温氮气吸附脱附曲线如图3和图 4所示。从图3和图4可知:当相对压力为0.60~0.99时,催化剂出现了明显的吸附-脱附迟滞后环,测得催化剂在煅烧后形成了直径为1.75 nm及BET表面积为27.3 m2/g的介孔,达到了介孔型催化剂标准[20-21]。
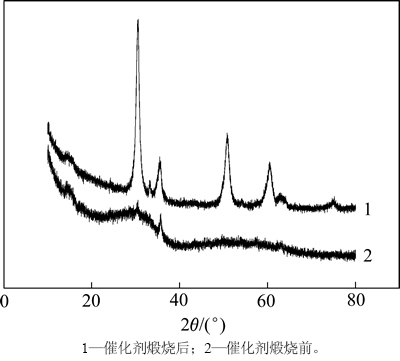
图2 催化剂的XRD图
Fig. 2 XRD of catalyst

图3 催化剂的氮气吸附脱附等温曲线
Fig. 3 Nitrogen adsorption isotherms of catalyst

图4 催化剂的孔径分布图
Fig. 4 Size distribution of catalyst
2.1.4 催化剂的饱和磁强度
当煅烧温度为600 ℃时,催化剂的饱和磁强度磁滞回线如图5所示。由图5可知:催化剂的矫顽力为0 A/m,其剩余磁化强度为2.937 7 mA·m2/g、饱和磁强度为13.426 5 mA·m2/g,表明该催化剂具有较高的磁性,为该催化剂获得较高的回收率奠定基础。通过计算催化剂的矩形比为0.218 8,可能是催化剂在制备过程中产生团聚现象导致磁畴呈各向异性分布[22]。
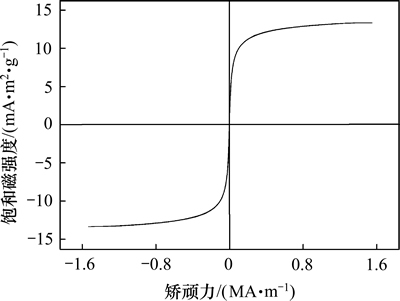
图5 催化剂的磁滞回线
Fig. 5 Hysteresis loop of catalyst
2.1.5 煅烧温度对催化剂的饱和磁强度的影响
不同煅烧温度对催化剂饱和磁强度的影响如表1所示。从表1可知:催化剂煅烧前后均有较强的饱和磁强度,但是随着煅烧温度的增加,催化剂的饱和磁强度逐渐降低,这主要是因为:1) 随着煅烧温度的升高四氧化三铁的颗粒在逐渐长大,当其粒径达到顺磁性的临界尺寸时,样品将会失去顺磁性而表现出亚铁磁性;2) 随着煅烧温度的升高四氧化三铁部分被氧化而降低磁性。3) 随着煅烧温度的升高ZrO2由无定型转变为四方晶型,在一定程度上降低了催化剂的磁力[23]。 因此,为了保持一定的磁强度,催化剂的煅烧温度不宜超过700 ℃。
2.1.6 催化剂 NH3-TPD分析
NH3-TPD工作原理:当NH3被催化剂酸性中心吸附时,可以根据脱附温度的不同判定酸性中心的强 弱,NH3脱附峰温度和脱附峰反映催化剂表面酸强度酸量及其分布。催化剂的NH3-TPD曲线如图6所示。从图6可知:催化剂在250 ℃出现了弱酸峰,545 ℃出现了较弱的中强酸脱附峰,767 ℃出现了强烈的强酸脱附峰。催化剂无论在弱酸中心还是强酸中心,均出现了2个较大面积的脱附峰,这说明本实验所制备的固体酸催化剂具有较高的酸强度和多个酸性活性中心[24-25]。
表1 不同条件下催化剂的饱和磁强度
Table 1 Saturation magnetic intensity of catalyst under different conditions
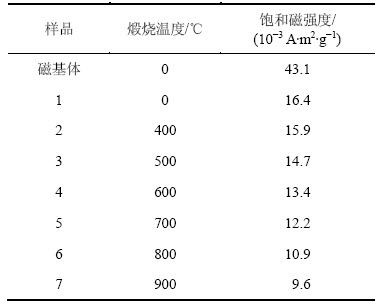
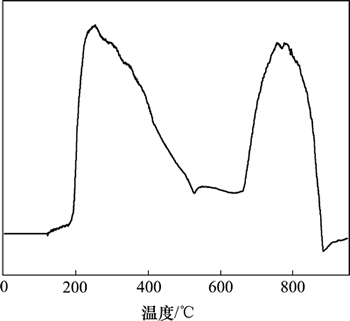
图6 催化剂的NH3-TPD
Fig. 6 NH3-TPD of catalyst
2.1.7 催化剂的酸性测定
磁性固体酸催化剂的酸性测定采用Hammett指示剂法。表2所示为不同煅烧温度下催化剂的酸强度。从表2可知:1) 当温度低于600 ℃时,随着煅烧温度的增加,催化剂的酸强度逐渐增大;2) 当煅烧温度为600 ℃时,催化剂的pKa位于-12.70与-13.16之间,属于固体超强酸[26];3) 当温度高于600 ℃时,随着煅烧温度的升高,催化剂的酸性反而下降,主要原因是高温条件下ZrO2的晶型由四方晶相向单斜晶相转变[23]。从表1可知:当催化剂煅烧温度为600 ℃时,催化剂同时具备相对较高的饱和磁强度和酸强度,是该催化剂较理想的煅烧温度。
表2 不同煅烧温度下催化剂的酸强度
Table 2 pKa of catalyst at different temperatures

2.2 磁性催化剂催化活性的研究
催化剂催化活性主要通过葡萄糖制备乙酰丙酸的乙酰丙酸的产率来体现。在原料葡萄糖质量浓度为30 g/L,催化剂质量浓度为1~5 g/L,反应温度为190~210 ℃,反应时间2 h的反应条件下,不同的反应温度及催化剂质量浓度对乙酰丙酸产率的影响如表3所示。
表3 温度和催化剂浓度对乙酰丙酸产率影响
Table 3 Effect of temperature and catalyst concentration on the yields of LA

从表3可知:1) 在催化剂用量一定的情况下,乙酰丙酸的得率随着反应温度的升高先升后降,这说明适度的高温有利于乙酰丙酸的形成,过度高温将促使反应副产物腐黑物的生成[27-29];2) 在温度一定的情况下,乙酰丙酸的产率随着催化剂质量浓度的增加也呈现先增后减的现象,这主要是因为磁性催化剂在高浓度下易于发生颗粒团聚,降低了催化剂的比表面积[30]。
分析表3可知:在葡萄糖质量浓度为30 g/L,催化剂质量浓度为3 g/L,反应温度为200 ℃,反应时间为2 h的条件下,乙酰丙酸的最高得率为70.2%。
2.3 催化剂回收率及再生
在葡萄糖质量浓度为30 g/L,催化剂质量浓度为3 g/L,反应温度为200℃,反应时间为2 h的条件下,对催化剂进行再生3次回收再利用实验,结果如表4及表5所示。
表4 催化剂的回收率及催化效率
Table 4 Recovery and catalytic efficiency of catalyst
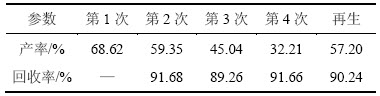
表5 催化剂回收利用过程的酸性变化
Table 5 Change of pKa of catalyst at recovery

从表4及表5可知:经过4次催化反应,催化剂每次回收率均达90%左右,乙酰丙酸得率均维持在30%以上,具有极佳的催化重复使用性及回收率。催化剂在重复使用过程中催化活性呈现逐渐降低现象,主要是因为催化剂使用过程中酸性的流失导致活性的丧失;同时反应过程难溶腐黑物将催化剂的表面覆盖,降低了催化剂的活性。
3 结论
1) 化学共沉淀法制备的磁性固体酸催化剂S2O82-/ZrO2-TiO2-Fe3O4,具有较小的孔径及较大的比表面积;具有较高的磁强度,有效地提高了催化剂的回收率;具有较强的酸性,提高了葡萄糖制备乙酰丙酸的催化效率。
2) 当葡萄糖质量浓度为30 g/L,催化剂质量浓度3 g/L,反应温度200 ℃,反应时间2 h,催化剂煅烧温度600 ℃时,乙酰丙酸的产率为70.2%。
参考文献:
[1] BOZELL J J, MOENS L, ELLIOTT D C, et al. Production of levulinic acid and use as a platform chemical for derived products[J]. Resources, Conservation and Recycling, 2000, 28(3): 227-239.
[2] FELLER A, ZUAZO I, GUZMAN A, et al. Common mechanistic aspects of liquid and solid acid catalyzed alkylation of isobutane with n-butene[J]. Journal of Catalysis, 2003, 216(1): 313-323.
[3] OKUHARA T. Water-tolerant solid acid catalysts[J]. Chemical Reviews, 2002, 102(10): 3641-3666.
[4] DUNN J P, STENGER H G, WACHS I E. Molecular structure– reactivity relationships for the oxidation of sulfur dioxide over supported metal oxide catalysts[J]. Catalysis Today, 1999, 53(4): 543-556.
[5] 彭新文, 吕秀阳. 5-羟甲基糠醛在稀硫酸催化下的降解反应动力学[J]. 化工学报, 2008, 59(5): 1150-1155.
PENG Xinwen, L Xiuyang. Decomposition kinetics of 5-hydroxymethylfurfural catalyzed by dilute sulfuric acid[J]. Journal of Chemical Industry and Engineering, 2008, 59(5): 1150-1155.
Xiuyang. Decomposition kinetics of 5-hydroxymethylfurfural catalyzed by dilute sulfuric acid[J]. Journal of Chemical Industry and Engineering, 2008, 59(5): 1150-1155.
[6] 李俊宏, 徐玉婷, 唐成黎, 等. 磺化交联壳聚糖树脂固体酸催化剂的制备及表征[J]. 化工学报, 2013, 64(5): 1635-1641.
LI Junhong, XU Yutong, TANG Chengli, et al. Preparation and characterization of sulfonated crosslinked chitosan resin as solid acidic catalyst[J]. Journal of Chemical Industry and Engineering, 2013, 64(5): 1635-1641.
[7] 曾珊珊, 林鹿, 刘娣. 固体酸SO42-/TiO2-ZrO2催化制备乙酰丙酸的研究[J]. 现代食品科技, 2012, 28(8): 964-968.
ZENG Shanshan, LIN Lu, LIU Di. Study on synthesis of levulinic acid with solid acid SO42-/TiO2-ZrO2 as catalyst[J]. Modern Food Science and Technology, 2012, 28(8): 964-968.
[8] 刘焘, 李利军, 刘柳, 等. 固体超强酸催化剂S2O82-/ ZrO2-M2O3 (M=Al,Fe)制备5-羟甲基糠醛[J]. 化工进展, 2012, 31(11): 2488-2492.
LIU Tao, LI Lijun, LIU Liu, et al. Solid superacid catalyst S2O82-/ZrO2-M2O3 (M=Al,Fe) for the preparation of 5-hydroxymethyl furfural[J]. Chemical Industry and Engineering Progress, 2012, 31(11): 2488-2492.
[9] CHEN Hongzhang, YU Bin, JIN Shengying. Production of levulinic acid from steam exploded rice straw via solid superacid[J]. Bioresource Technology, 2011, 102(3): 3568-3570.
[10] LI Z L, WNETRZAK R, KWAPINSKI W, et al. Synthesis and characterization of sulfated TiO2 nanorods and ZrO2/TiO2 nanocomposites for the esterification of biobased organic acid[J]. ACS Applied Materials & Interfaces, 2012, 4(9): 4499-4505.
[11] 张杰家, 窦春光, 王佰亮, 等. S2O82-/ZrO2-SiO2固体超强酸催化剂的研制[J]. 当代化工, 2007, 36(4): 393-397.
ZHANG Jiejia, DOU Chunguang, WANG Bailiang, et al. Preparation of S2O82-/ZrO2-SiO2 solid superacid catalysts[J]. Contemporary Chemical Industry, 2007, 36(4): 393-397.
[12] 但悠梦, 米远祝, 田大听. S2O82-/ZrO2-SiO2-Al2O3固体超强酸催化剂的研制与应用[J]. 应用化学, 2001, 18(10): 840-842.
DAN Youming, MI Yuanzhu, TIAN Dating. Preparation and application of S2O82-/ZrO2-SiO2-Al2O3 solid superacid catalysts[J]. Chemical Journal of Applied Chemistry, 2001, 18(10): 840-842.
[13] 夏勇德, 华伟明, 高滋. S2O82-处理的ZrO2固体超强酸上的正丁烷异构化反应[J]. 化学学报, 1999, 57(12): 1325-1331.
XIA Deyong, HUA Weiming, GAO Zi. n-Butane isomerization on solid superacids of ZrO2 modified by persulfate[J]. Acta Chimica Sinica, 1999, 57(12): 1325-1331.
[14] 王君, 范美青, 杨飘萍, 等. 磁性固体超强酸SO42-/ ZrO2-Al2O3-Fe3O4的制备与性能研究[J]. 无机化学学报, 2007, 23(7): 1137-1142.
WANG Jun, FAN Meiqing, YANG Piaoping, et al. Preparation and properties of magnetic solid superacid SO42-/ZrO2- Al2O3-Fe3O4[J]. Chinese Journal of Inorganic Chemistry, 2007, 23(7): 1137-1142.
[15] 马雪旦, 郭岱石, 蒋淇忠, 等. SO42-/TiO2 及 S2O82-/TiO2催化剂的制备及表征[J]. 高校化学工程学报, 2006, 20(2): 239-244.
MA Xuedan, GUO Daishi, JIANG Qizhong, et al. Preparation and characterization of SO42-/TiO2 and S2O82-/TiO2 catalysts[J]. Journal of Chemical Engineering of Chinese Universities, 2006, 20(2): 239-244.
[16] 李利军, 刘焘, 刘柳, 等. 固体超强酸催化剂S2O82-/聚乙二 醇-TiO2-M2O3(M=Al,Cr)制备乙酰丙酸[J]. 工业催化, 2012, 20(5): 64-68.
LI Lijun, LIU Tao, LIU Liu, et al. Preparation of levulinic acid over solid superacid catalyst S2O82-/polyethylene glycol- TiO2-M2O3(M=Al,Cr)[J]. Industrial Catalysis, 2012, 20(5): 64-68.
[17] 潘晖华, 何鸣元, 于中伟, 等. 氧化铝对Pt-固体酸催化剂结构与酸性的影响[J]. 催化学报, 2005, 26(12): 1067-1072.
PAN Huihua, HE Mingyuan, YU Zhongwei, et al. Effect of alumina on structure and acidity of solid acid catalyst Pt- SO42-/ZrO2-Al2O3[J]. Chinese Journal of Catalysis, 2005, 26(12): 1067-1072.
[18] 雷霆, 华伟明, 唐颐, 等. MCM-41负载SO42-/ZrO2超强酸的性能研究[J]. 高等学校化学学报, 2000, 21(8): 1240-1243.
LEI Ting, HUA Weiming, TANG Yi, et al. Studies on MCM-41 supported SO42-/ZrO2 solid superacid catalysts[J]. Chemical Journal of Chinese Universities, 2000, 21(8): 1240-1243.
[19] 李占双, 范美青, 刘岩峰, 等. SO42-/ZrO2/ Fe3O4/TiO2磁性固体酸催化剂的制备与性能[J]. 石油化工, 2009, 38(11):1151-1157.
LI Zhanshuang, FAN Meiqing, LIU Yanfeng, et al. Preparation and properties of nano magnetic solid acid catalyst SO42-/ZrO2/ Fe3O4/TiO2[J]. Petrochemical Technology, 2009, 38(11): 1151-1157.
[20] SHEN Wenzhong, ZHENG Jingtang, QIN Zhangfeng, et al. Preparation of mesoporous activated carbon fiber by steam activation in the presence of cerium oxide and its adsorption of Congo red and Vitamin B12 from solution[J]. Journal of Materials Science, 2004, 39(14): 4693-4696.
[21] SHIBATA H, MUKAI T, AKITA T, et al. Preparation of mesoporous titania particles with photocatalytic activity under visible-light irriation[J]. Chemistry Letters, 2005, 34(12): 1696-1697.
[22] 于冬亮, 都有为. NiFe2O4纳米线阵列的制备与磁性[J]. 物理学报, 2005, 54(2): 930-934.
YU Dongliang, DU Youwei. Fabrication of NiFe2O4 nanowire arrays and its magnetic properties[J]. Acta Physica Sinica, 2005, 54(2): 930-934.
[23] 谢太平, 刘成伦, 徐龙君, 等. 锶磁性固体酸S2O82-/ ZrO2-SrFe12O19催化剂的制备和表征[J]. 复合材料学报, 2012, 29(5): 121-126.
XIE Taiping, LIU Chenglun, XU Longjun, et al. Synthesis and characterization of S2O82-/ZrO2-SrFe12O19 strontium magnetic solid acid catalyst[J]. Acta Materiae Compositae Sinica, 2012, 29(5): 121-126.
[24] YAMAGUCHI T. Recent progress in solid superacid[J]. Applied Catalysis, 1990, 61(1): 1-25.
[25] LIANG H P, ZHANG H M, HU J S, et al. Pt hollow nanospheres: facile synthesis and enhanced electrocatalysts[J]. Angewandte Chemie, 2004, 116(12): 1566-1569.
[26] YANG H, LU R, SHEN L, et al. Preparation, characterization and catalytic activity of sulfated zirconia-silica nanocrystalline catalysts[J]. Materials Letters, 2003, 57(16): 2572-2579.
[27] WEINGARTEN R, CHO J, XING R, et al. Kinetics and reaction engineering of levulinic acid production from aqueous glucose solutions[J]. ChemSusChem, 2012, 5(7): 1280-1290.
[28] RUNGE T, ZHANG C. Two-stage acid-catalyzed conversion of carbohydrates into levulinic acid[J]. Industrial & Engineering Chemistry Research, 2012, 51(8): 3265-3270.
[29] WEINGARTEN R, CONNER W C, HUBER G W. Production of levulinic acid from cellulose by hydrothermal decomposition combined with aqueous phase dehydration with a solid acid catalyst[J]. Energy & Environmental Science, 2012, 5(6): 7559-7574.
[30] RINALDI R, SCH TH F. Design of solid catalysts for the conversion of biomass[J]. Energy & Environmental Science, 2009, 2(6): 610-626.
TH F. Design of solid catalysts for the conversion of biomass[J]. Energy & Environmental Science, 2009, 2(6): 610-626.
(编辑 罗金花)
收稿日期:2015-01-29;修回日期:2015-03-25
基金项目(Foundation item):国家“十二五”科技支撑计划项目(2014BAD02B02) (Project(2014BAD02B02) supported by the National Science and Technology Pillar Program during the 12th “Five-year” Plan Period)
通信作者:聂小安,研究员,博士生导师,从事生物质能源及材料研究;E-mail: niexiaoan@126.com
摘要:以化学共沉淀法制备具有磁性功能的固体酸催化剂S2O82-/ZrO2-TiO2-Fe3O4,利用红外、X线衍射、氮气吸附脱附、振动样品磁强计等方法对其结构及性能进行表征,获得孔径为1.74 nm、BET面积为27.3 m2/g及具有四方晶型结构的磁性固体酸催化剂。研究结果表明:该催化剂应用于催化葡萄糖制备乙酰丙酸,在葡萄糖质量浓度为30 g/L,催化剂质量浓度3 g/L,反应温度200 ℃,反应时间2 h的条件下,乙酰丙酸的产率达70.2%,催化剂回收率90%以上。
[3] OKUHARA T. Water-tolerant solid acid catalysts[J]. Chemical Reviews, 2002, 102(10): 3641-3666.
[5] 彭新文, 吕秀阳. 5-羟甲基糠醛在稀硫酸催化下的降解反应动力学[J]. 化工学报, 2008, 59(5): 1150-1155.
[6] 李俊宏, 徐玉婷, 唐成黎, 等. 磺化交联壳聚糖树脂固体酸催化剂的制备及表征[J]. 化工学报, 2013, 64(5): 1635-1641.
[7] 曾珊珊, 林鹿, 刘娣. 固体酸SO42-/TiO2-ZrO2催化制备乙酰丙酸的研究[J]. 现代食品科技, 2012, 28(8): 964-968.
[8] 刘焘, 李利军, 刘柳, 等. 固体超强酸催化剂S2O82-/ ZrO2-M2O3 (M=Al,Fe)制备5-羟甲基糠醛[J]. 化工进展, 2012, 31(11): 2488-2492.
[11] 张杰家, 窦春光, 王佰亮, 等. S2O82-/ZrO2-SiO2固体超强酸催化剂的研制[J]. 当代化工, 2007, 36(4): 393-397.
[12] 但悠梦, 米远祝, 田大听. S2O82-/ZrO2-SiO2-Al2O3固体超强酸催化剂的研制与应用[J]. 应用化学, 2001, 18(10): 840-842.
[13] 夏勇德, 华伟明, 高滋. S2O82-处理的ZrO2固体超强酸上的正丁烷异构化反应[J]. 化学学报, 1999, 57(12): 1325-1331.
[14] 王君, 范美青, 杨飘萍, 等. 磁性固体超强酸SO42-/ ZrO2-Al2O3-Fe3O4的制备与性能研究[J]. 无机化学学报, 2007, 23(7): 1137-1142.
[15] 马雪旦, 郭岱石, 蒋淇忠, 等. SO42-/TiO2 及 S2O82-/TiO2催化剂的制备及表征[J]. 高校化学工程学报, 2006, 20(2): 239-244.
[16] 李利军, 刘焘, 刘柳, 等. 固体超强酸催化剂S2O82-/聚乙二 醇-TiO2-M2O3(M=Al,Cr)制备乙酰丙酸[J]. 工业催化, 2012, 20(5): 64-68.
[17] 潘晖华, 何鸣元, 于中伟, 等. 氧化铝对Pt-固体酸催化剂结构与酸性的影响[J]. 催化学报, 2005, 26(12): 1067-1072.
[18] 雷霆, 华伟明, 唐颐, 等. MCM-41负载SO42-/ZrO2超强酸的性能研究[J]. 高等学校化学学报, 2000, 21(8): 1240-1243.
[19] 李占双, 范美青, 刘岩峰, 等. SO42-/ZrO2/ Fe3O4/TiO2磁性固体酸催化剂的制备与性能[J]. 石油化工, 2009, 38(11):1151-1157.
[22] 于冬亮, 都有为. NiFe2O4纳米线阵列的制备与磁性[J]. 物理学报, 2005, 54(2): 930-934.
[23] 谢太平, 刘成伦, 徐龙君, 等. 锶磁性固体酸S2O82-/ ZrO2-SrFe12O19催化剂的制备和表征[J]. 复合材料学报, 2012, 29(5): 121-126.
[24] YAMAGUCHI T. Recent progress in solid superacid[J]. Applied Catalysis, 1990, 61(1): 1-25.


