网络首发时间: 2016-05-11 14:03
钴镍萃取过程中萃合物配位结构的研究进展
北京有色金属研究总院生物冶金国家工程实验室
摘 要:
介绍了钴镍冶金的现状和发展方向, 论述了钴镍萃取与分离工艺的特点和优势, 指出了当前在钴镍萃取与分离方面存在的问题, 说明了钴镍萃取反应过程中萃合物空间配位结构研究的必要性;总结了钴镍的物理化学性质、配位数和空间配位结构, 讨论了不同配体对钴镍配合物的空间构型的影响, 并运用配位场理论, 分别从晶体场配位理论和价键理论两个方面分析了不同萃取体系下钴镍配合物的空间构型存在差异的原因;综述了单一萃取体系和协同萃取体系下钴镍的配位数和空间配位结构及其研究方法的国内外最新进展, 并利用配位场理论解释了不同萃取体系下钴镍萃合物的差异;指出了当前在钴镍萃合物的配位结构研究方面存在的不足, 展望了未来钴镍萃合物结构研究的潜在方法和发展方向, 为钴镍萃取工艺实践提供了理论指导。
关键词:
中图分类号: O641.4;O658.2
作者简介:孙启 (1989-) , 男, 甘肃陇南人, 博士研究生, 研究方向:协同萃取;E-mail:sunq08@lzu.edu.cn;;杨丽梅, 教授;电话:010-62241397;E-mail:yanglm@grinm.com;
收稿日期:2015-03-10
基金:国家国际科技合作专项项目 (2014DFA90920) 资助;
Research and Prospect on Coordination Structures of Cobalt and Nickel Extracted Complexes during Solvent Extraction: A Review
Sun Qi Yang Limei Huang Songtao Xu Zheng Li Yan Wang Wei
National Engineering Laboratory of Biohydrometallurgy, General Research Institute for Nonferrous Metals
Abstract:
The development status of cobalt and nickel metallurgy was introduced. The characteristic and advantages of recovery and separation of cobalt and nickel by solvent extraction in recent years were discussed. The extraction problems of cobalt and nickel existed during solvent extraction process were disclosed. It was very necessary to study extracted complex structures of cobalt and nickel. Physicochemical properties, coordination numbers and structures of cobalt and nickel were illustrated and effects of ligands on coordination structures of cobalt and nickel were discussed. The differences of coordination numbers and structures of cobalt and nickel extracted complexes which composed with different extractants were summarized and explained with ligand field theory which included crystal field theory and valence-bond theory. Development researches and methods on coordination structures of cobalt and nickel extracted complexes with single extractant and synergistic system were reviewed. Shortage of research of extracted complex structures was proposed. Potential development direction and research methods that should be further studied were also proposed as well. This review would supply the fundamentals for application of solvent extraction of cobalt and nickel.
Keyword:
solvent extraction of cobalt and nickel; coordination structure; extracted complex structure; synergistic solvent extraction; ligand field theory;
Received: 2015-03-10
钴镍是当前重要的铁磁性金属元素, 其具有较强的硬度、抗拉强度、机械加工性能和优异的电化学性能, 广泛地应用于电池、高性能合金、催化剂等领域[1,2]。随着工业化和电子化的飞速发展, 人们对钴镍的需求量逐年增加, 而全世界钴镍的总储存量却日益减少, 钴镍原料的来源已经从镍红土矿向钴镍渣料、废电池和废电子产品等二次资源转变, 钴镍的成本也相应地升高[3,4]。为了适应当前经济发展模式和环境的要求, 钴镍的处理工艺也由传统的火法造锍、湿法分离相结合转为浸出-萃取-电积的全湿法流程[5]。然而, 钴镍原料的复杂性导致钴镍在提取与分离方面仍存在着较大的困难, 例如钴镍分离以及钴镍与杂质离子锰、钙和镁的分离等[6]。因此, 对于钴镍的萃取过程中萃取机制的研究显得尤为重要, 尤其是萃合物配位方式和结构的研究[7]。本文综述了钴镍与不同萃取体系形成的萃合物配位结构的研究进展, 分析钴镍萃取过程中的差异性原因, 从而更好地指导工艺实践。
1 钴镍萃取简介
钴镍的萃取始于20世纪70年代, 并随着钴镍产量的增加而迅速发展, 成为当今钴镍提取分离的主流方法。相比于其他提取分离方法, 溶剂萃取法设备简单、分离效率高、选择性好和操作连续化等特点而受到了广大学者的研究, 部分工艺已经应用于工业生产[6]。
钴镍萃取分离主要采用的萃取体系有胺类萃取剂、磷 (膦) 酸类萃取剂和螯合类萃取剂, 这些萃取体系对钴镍均具有一定的萃取能力。然而, 这些萃取体系在分离钴镍的过程中, 仍然存在着钴镍分离系数小、钴镍与杂质离子分离性差和酸性萃取剂萃取钴镍的平衡p H过高等问题, 使得钴镍萃取工业的发展受到了一定的限制。随后, 协同萃取的引入又促进了钴镍分离的发展。协同萃取不仅能够增大钴镍的分离系数, 还能促进钴镍与其他杂质金属离子的分离, 显著地提升钴镍的分离效率, 已成为当前萃取发展的主要方向[8]。广泛应用于钴镍分离的协同萃取体系主要有:有机酸/胺类、有机酸/有机酸类、有机酸/烷基吡啶类和有机酸/螯合类, 这些体系适用于不同介质下的钴镍的分离, 得到了较好的分离效果[9]。
此外, 众多学者除了对钴镍萃取工艺进行改进, 还研究了钴镍萃取过程中的萃取机制, 例如萃取反应平衡、萃取反应的热力学性质和萃合物的组成与空间配位结构等方面[10,11], 从本质上解释了钴镍萃取过程中的差异性, 尤其是不同萃取体系在钴镍萃合物空间配位上的差异性, 从而科学地利用萃取规律制定出更加合理的萃取工艺流程, 促进钴镍萃取工业的发展[12]。
2 钴镍配位结构的差异性分析
钴镍为第四周期第VIII族元素, 钴具有3d74s2电子构型, 有一价、二价、三价3种价态, 常见的配位数有4或6, 能够与多种萃取剂形成蓝色的四面体和粉红色的八面体空间配位结构;镍具有3d84s2电子构型, 有一价、二价、三价3种价态, 一般情况下为二价, 常见的配位数有4或6, 能够与多种萃取剂形成四面体、平面四边形和八面体的空间配位结构。例如, 在水溶液中, 镍的存在形式为[Ni (H2O) 6]2+, 当溶液中有CN-时, 镍的配位方式为[Ni (CN) 4]2-, 其配位结构分别为正八面体结构和平面正方形结构[13,14]。
钴镍虽然同为第四周期第VIII族相邻元素, 化学性质相似, 但由于电子构型不同, 与萃取剂基团的空间配位方式也不相同, 这种差异性是钴镍萃取分离的主要原因。本节主要运用配位场理论, 分别从晶体场配位理论和价键理论两个方面对钴镍分离差异进行探讨。
2.1 晶体场配位理论
钴镍同属于过渡金属原子, 钴镍的配位数一般为4或6, 根据晶体场理论, 不同配体参与钴镍配位时, 会使中心离子外层d轨道的能级分裂, dx2, dx2-y2, dxy, dxz, dyz 5个轨道发生简并, 配合物所处的位置不同和空间构型不同, 能级分裂的大小也不同。在能级分裂过程中还要克服成对能P, 不同钴镍配位构型对应能量的大小如表1所示[15]。
由表1可知, Co (II) 的四面体构型能量和八面体构型能量相差较小, 所以Co (II) 的萃合物构型为四面体或八面体, 两种构型之间可以相互转变。例如, 在盐酸介质中, Co (II) 配位结构以[Co Cl4]2-和[Co (H2O) 6]2+两种方式存在, 分别为四面体结构和八面体配位结构, 平衡反应式如式 (1) 所示[16]。
表1 钴镍不同配位时对应的能量Table 1 Energy of cobalt and nickel in different coordina-tion structures 下载原图
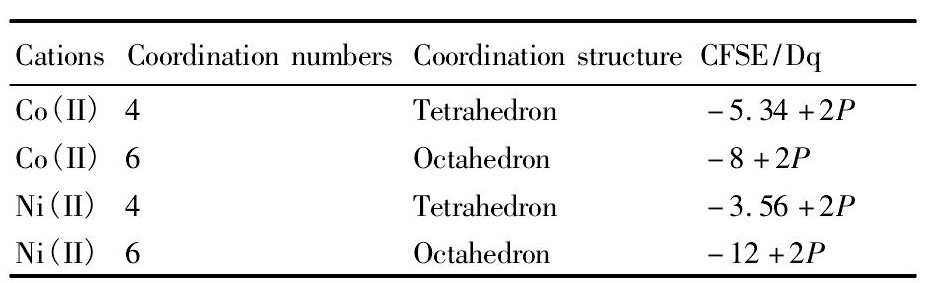
CFSE:Crystal field stable energy;P:Electron twin energy
表1 钴镍不同配位时对应的能量Table 1 Energy of cobalt and nickel in different coordina-tion structures
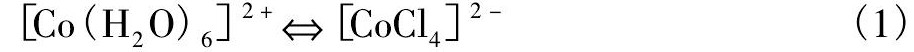
Ni (II) 的四面体构型和八面体构型的能量相差较大, 且八面体构型的能量更低, 因而, Ni (II) 的配合物结构一般为八面体构型。在水溶液中, 镍的存在形式为[Ni (H2O) 6]2+, 当溶液中有NH3时, 镍的配位方式为[Ni (NH3) 6]2+, 其配位结构为正八面体结构, 氨配位的Ni (II) 配合物的结合能低于其络合水的结合能, 稳定性恰好相反, 这种差异也经过了实验证明[17]。
2.2 价键理论
价键理论认为:配合物形成时, 能级相差不远的轨道采取杂化轨道的方式与配体成键, 从而降低分子的能量, 使形成的配合物分子更稳定。Co (II) 的四配位为sp3杂化, 六配位为内轨型d2sp3或者外轨型sp3d2。配位原子的电荷对Co (II) 的配位化合物结构有较大的影响, 一方面, 中心离子与配位原子的电负性相差较大时, 倾向于生成外轨型络离子, 相差较小时, 则倾向于生成内轨型络离子;另一方面, 弱配位场的负离子配体, 如卤离子等特别倾向于与Co (II) 形成四面体配合物[18]。
以水相中的Co (II) 的配位为例, 在纯水中, Co (II) 的存在形式为[Co (H2O) 6]2+。当溶液中有NH3或CN-时, Co (II) 的配位方式为[Co (NH3) 6]2+和[Co (CN) 5H2O]3-, 其具有较强的还原性, 容易被氧化为[Co (NH3) 6]3+和[Co (CN) 5H2O]2-, 为八面体结构。根据价键理论, 参与Co (II) 配位的氧原子的电负性大于氮原子, 所以[Co (H2O) 6]2+以外轨型的sp3d2杂化方式存在, 这种杂化方式的中心Co (II) 的4d轨道有两对成对电子, 其正八面体构型相对稳定;而氮原子参与配位的[Co (NH3) 6]2+和[Co (CN) 5H2O]3-以内轨型的d2sp3杂化方式存在, Co (II) 离子3d轨道中的一个电子被激发到4d轨道, 这种杂化方式的Co (II) 的4d轨道只有一个孤电子, 容易失去, 故[Co (NH3) 6]2+和[Co (CN) 5H2O]3-具有还原性, 两种杂化方式下的钴的电化学性质也不同[16]。例如, 不同配体下Co (III) /Co (II) 的标准电极电势也不相同, 其大小如表2所示[19]。
表2 Co (III) /C (II) 在不同介质中的氧化还原电位Table 2 Redox potentials of Co (III) /Co (II) in different media (e V) 下载原图
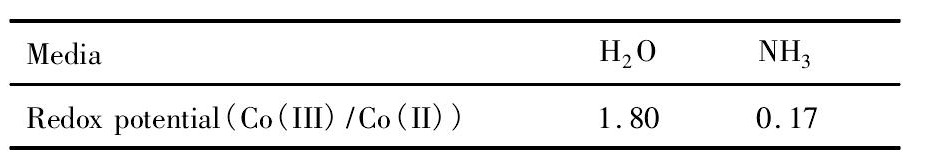
表2 Co (III) /C (II) 在不同介质中的氧化还原电位Table 2 Redox potentials of Co (III) /Co (II) in different media (e V)
3 不同萃取体系下钴的萃合物配位结构
当前, 钴萃取常用的萃取剂主要有磷 (膦) 酸萃取剂、螯合萃取剂和羧酸萃取剂以及他们组成的协同萃取体系。本节主要从单一萃取体系和协同萃取体系两个方面对Co (II) 萃合物的结构进行综述, 讨论不同体系下Co (II) 萃合物的配位方式和空间结构。
3.1 单一萃取体系
目前, 钴镍的单一萃取体系在工业上应用较为广泛, 主要有磷 (膦) 酸萃取体系、螯合萃取体系和胺类萃取体系等。
3.1.1 磷 (膦) 酸萃取体系
磷 (膦) 酸萃取剂是目前萃取钴镍比较常用的萃取剂。在磷 (膦) 酸体系萃取过程中, 以P204 (二 (2-乙基己基) 磷酸) 、P507 (乙基己基磷酸单-2-乙基己酯) 和Cyanex 272 (双 (2, 4, 4-三甲基戊基) 膦酸) 萃取剂为例, Co (II) 的萃合物配位结构为八面体结构或者四面体结构, 这种结构随着萃取条件的变化而变化。随着3种萃取剂酸性减弱, 与Co (II) 的结合能力减弱, 对Co (II) 的萃取能力下降, 但Co (II) 合物的空间配位结构也从八面体向四面体转变, 萃合物稳定性提高, 亲油性增强, 弥补了由于酸性导致萃取能力的降低[15,20]。
例如, 在萃取剂浓度远大于钴离子的浓度时, 钴的萃合物是八面体空间配位结构, 随着钴离子的浓度升高, 钴的萃合物构型向四面体聚合物转变, 萃合物的颜色也由粉红色变为深蓝色[21,22]。Peng等[23]研究了硫酸体系下DDPA (正十二烷基磷酸) 萃取Co (II) 的动力学, 得到了萃合物的分子式为Co A2, 但该萃合物的空间配位结构没有作深入的研究。李次然等[24]研究了P507和Co (II) 形成的萃合物的结构, 利用红外和电子光谱法得出, 该萃合物中Co (II) 和萃取剂的摩尔比为1∶2, 萃合物为四面体配位结构。
3.1.2 螯合萃取体系
羟肟萃取剂是最常见的一类螯合萃取剂, 它是指分子中同时还有羟基-OH和肟基-C=NOH的一类化合物, 根据两种官能团在碳原子上的位置不同, 可分为α-羟肟和β-羟肟, 例如LIX63 (5, 8-二乙基-7-羟基-6-十二烷基肟) 和LIX84 (1- (2-羟基-5-壬苯基) 乙酮肟) 。α-羟肟的肟基连在α碳原子上, 在通常分为顺式和反式, 顺式的羟肟两个羟基在同一侧, 萃取过程中空间位阻较大, 并且分子内形成氢键, 阻碍萃取的进行, 因而只有反式才能与金属离子形成配合物[25]。β-羟肟的肟基连在β碳原子上, 通常分为酮肟和醛肟。
羟肟萃取剂和Co (II) 反应方程式如式 (2) 所示[26]:
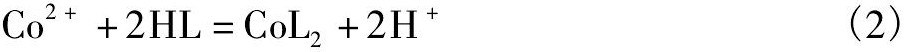
其中HL表示羟肟萃取剂。由反应可知, 萃合物的分子式为Co L2·x H2O, 萃合物中水分子是否参与配位尚未可知。当羟肟萃取剂萃取Co (II) 时, 会出现萃取剂钴中毒的现象[27], 这主要是由于Co (II) 进入有机相以后, 与萃取剂形成配合物, 形成的萃合物在空气中极易氧化为Co (III) , 形成更稳定的配合物, 从而难以将其反萃出来[19,28]。根据价键理论, 八面体空间配位下d2sp3杂化的萃合物具有较强的还原性, 极易被氧化, 推测羟肟萃取剂和Co (II) 形成八面体空间配位结构, 并且有两分子的水参与配位, 萃合物的分子式应该为Co L2·2H2O。
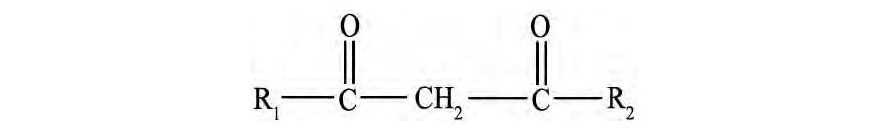
β-双酮又是另一类常见的钴镍萃取剂, 其结构式如图1所示。
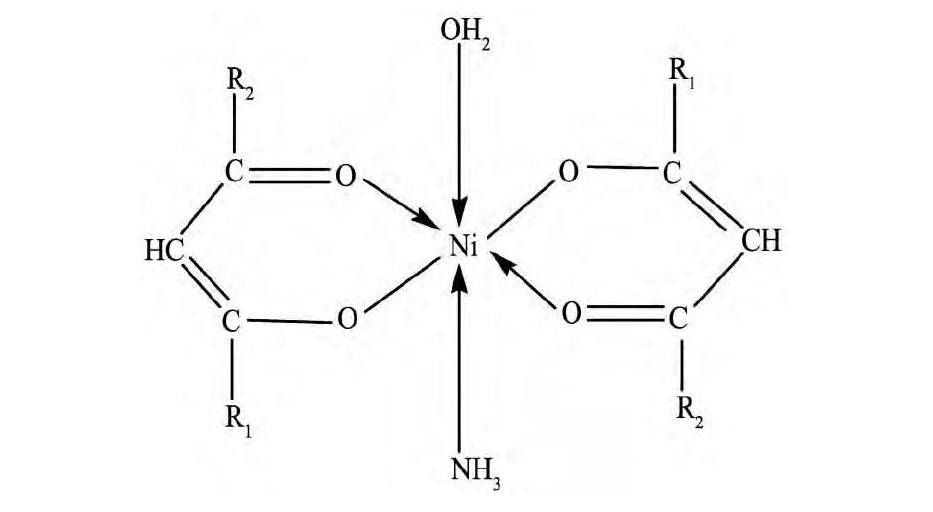
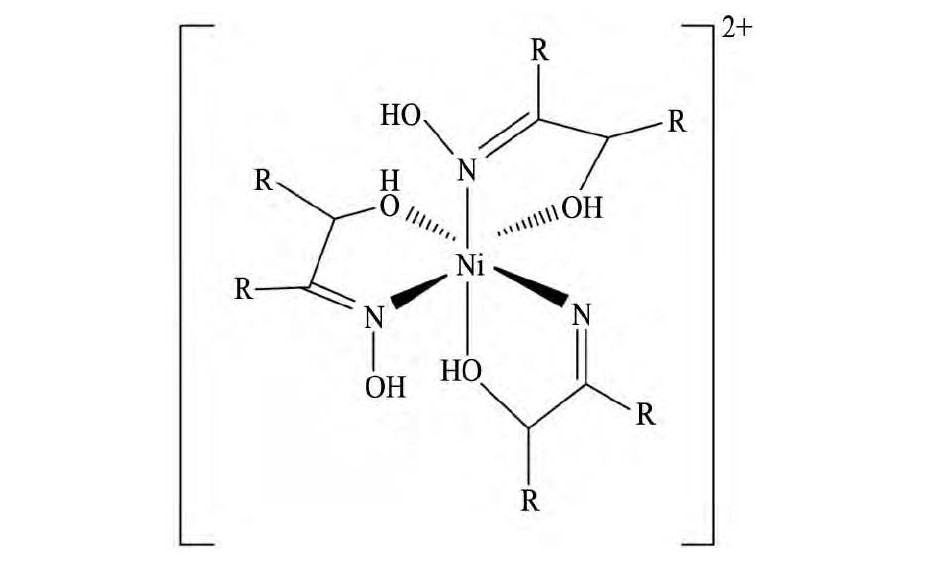
由于两个羰基存在使得亚甲基上的氢原子比较活泼, 可以转移到羰基氧原子上形成烯醇式结构。一般情况下, 烯醇式和双酮共同存在, 其比例受到外界条件影响。Hu等[17,29]利用UV-Vis (紫外可见光谱) 、FT-IR (傅里叶变换红外光谱) 和XAS (X射线吸收光谱) 等结构表征方法研究了氨水体系下β-双酮 (HA) 与镍形成的萃合物的结构。研究结果表明, 液态和结晶态的镍萃合物均为轴向拉长的八面体构型, 其中镍与两分子的双酮形成两个六元环, 而氨分子和水分子则在轴向位置参与配位, 该萃合物的分子式为Ni A2·H2O·NH3, 萃合物可能的空间结构如图2所示。
图1 β-双酮的结构式 (R1, R2为烃类取代基) Fig.1β-diketone structure (R1, R2denoting hydrocarbyl)
3.1.3 胺类萃取体系
胺类萃取剂主要用于盐酸介质中钴的萃取, 其萃取机制有两种:阴离子交换机制和加成反应机制。以叔胺R3N为例, 阴离子交换机制为叔胺在酸性溶液中形成盐R3N·HA, 再与Co Cl42+生成 (R3NH) 2Co Cl4;直接配位机制为 (R3NH) 2Co Cl4由Co2+与Cl-及R3N直接加和而成。萃合物的结构主要以离子盐的形式存在, 钴的配位方式在萃取前后不变, 仍然为四面体结构[20]。总之, 胺类萃取剂应用于钴萃取相对较少, 其萃取机制因萃取剂和介质不同而有较大差异, 需要深入研究。
3.2 协同萃取体系
3.2.1 有机羧酸/螯合类
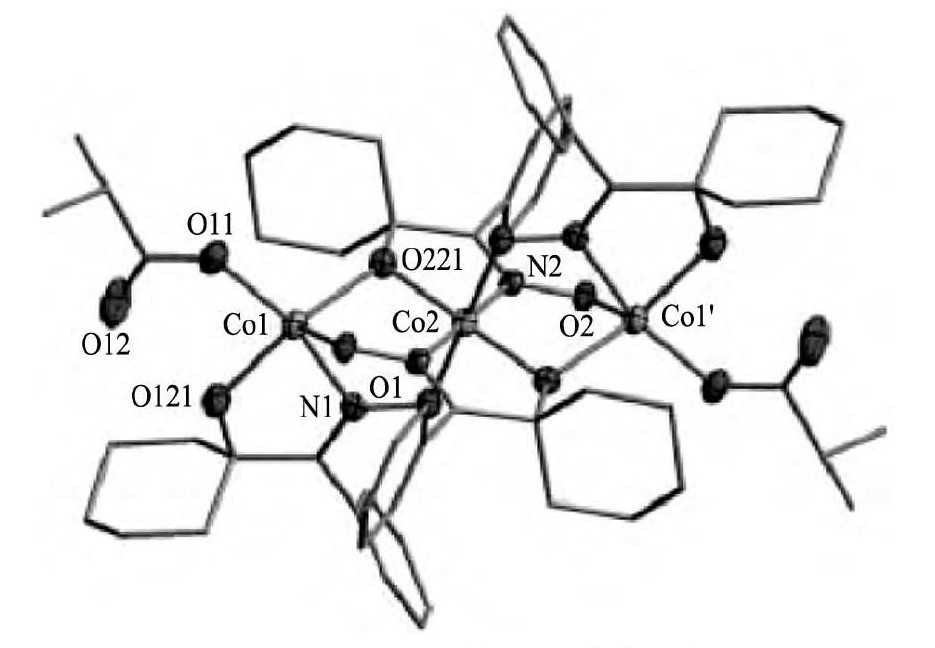
Cheng[30]利用LIX63和Versatic 10 (新癸酸) 萃取体系从镍红土矿浸出液中萃取钴镍, 通过条件实验推测, Ni (II) 与协同萃取体系形成的萃合物中, LIX63作为萃取剂, 而Versatic 10则作为协萃剂。Barnard等[27]提出, 该萃合物中, Ni (II) ∶LIX63∶Versatic 10的化学计量比为1∶3∶2, 但都没有给出相应萃合物的配位结构信息。随后, 其又合成出一种新型的羟肟萃取剂 (1-羟基环己基) -苯基酮肟, 并与Versatic 10组成的协同萃取体系萃取铜、镍、钴, 形成的萃合物的化学计量比为:1∶2∶2, 和LIX63/Versatic 10体系相比, 萃合物少一个LIX63分子。上述的研究仅仅通过最大饱和量计算的得出, 并没有系统地探究萃合物的配位结构[31]。D'Alessio等[32]利用这种新型羟肟与异丁酸萃取钴, 制得的萃合物结晶后, 利用X射线衍射 (XRD) 分析了萃合物的配位结构, 得到较为复杂的萃合物结构, 萃合物的分子式为Co3 (L-H) 4 (O2CC3H7) 2, 其结构式如图3所示。由图3可知, 复杂的萃合物结构中, 中心Co (II) 原子的配位结构为八面体, 配位原子为N2O4, 而其余两个Co (II) 原子配位数位为5, 配位原子为NO4。但是, 由于萃合物的结构非常混乱, 所以无法确定两种萃取剂羟基上质子的去向。这种Co (II) 的五配位方式也是比较常见的[33], 有学者提出了Co (II) 的五配位方式, 其配体为两分子的醛肟和一分子的亚硝酰基, 空间配位为四棱锥形, 其中醛肟上的N2O2共面, 而亚硝酰基则位于平面顶端, 形成四棱锥的空间结构[34,35]。
图2 β-双酮在氨水体系下萃取镍的萃合物结构 (R1, R2分别为烃基) Fig.2 Extracted complex structure of nickel (II) andβ-dike-tone in ammoniacal solution (R1, R2denoting hydro-carbyl)
3.2.2 有机磷 (膦) 酸/螯合类
单一的磷 (膦) 酸萃取剂HR与Co (II) 形成的萃合物的分子式为:Co (HR2) 2, 其结构式为四面体结构。当有螯合剂萃取剂存在时, 螯合萃取剂也参与Co (II) 的配位, 萃合物的分子式转变为八面体配位结构:Co (HR2) 2 (HL) 2, 反应式如式 (3) 所示[36]:
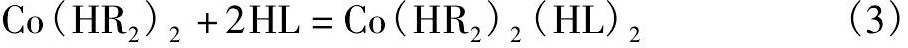
此时, 钴的萃合物和镍的萃合物相似, 磷 (膦) 酸萃取剂作为萃取剂, 而螯合萃取剂作为协萃剂。
图3 羟肟与异丁酸协同萃取Co (II) 的萃合物结构ketone oxime and Fig.3Extracted complex structure of cobalt (II) with (1-hydroxycyclohexyl) -phenyl Versatic 10
Hutton-Ashkenny等[37]研究了Co (II) 对羟肟萃取剂LIX860 (2-羟基-5-壬基苯甲醛肟) 及其混合萃取体系LIX860/P204, LIX860/P507, LIX860/Cyanex 272, LIX860/Versatic10的毒化程度。结果表明, 单一LIX860体系毒化最强, 而LIX860/P204的毒化程度较弱, 这可能由于LIX860和Co (II) 形成八面体的空间配位结构, 当P204加入该萃取体系后, 取代了该萃合物轴向配位的水分子, 形成了更稳定的萃合物, 从而抑制了Co (II) 的氧化, 但对该结构没有进一步的研究。
4 不同萃取体系下镍的萃合物配位结构
镍萃取常用的萃取剂主要有磷 (膦) 酸萃取剂、磺酸萃取剂、螯合萃取剂和羧酸萃取剂以及他们组成的协同萃取体系。本节综述了磷 (膦) 酸与螯合的单一萃取体系和协同萃取体系下镍萃合物的配位方式和空间结构, 并利用配位理论解释配位方式。胺类萃取剂一般用于钴镍分离中钴的萃取, 对镍的萃取能力较弱, 这里不作过多介绍。
4.1 单一萃取体系
4.1.1 磷 (膦) 酸萃取体系
磷 (膦) 酸类萃取剂是分离钴镍最常用的萃取剂之一。在磷 (膦) 酸体系萃取过程中, 镍的萃合物配位结构始终是较为稳定的八面体结构, 它不会随着体系条件的变化而变化。例如, P204, P507和Cyanex 272都能与镍离子形成八面体结构。随着P204, P507和Cyanex 272支链结构增加, 分子量增大, 氢键电子云密度增加, 羟基键稳定性增强, 因而酸性减弱。在形成八面体结构的过程中, 随着萃取剂结构复杂, 配合物紧密度增加, 空间位阻增大, 参与配位的萃取剂配体之间互相排斥而使健角偏离正常位置, 空间位阻增大, 萃取剂配体无法满足金属离子配位饱和, 因而结构简单的水分子则易于萃取剂分子参与配位。由于形成的萃合物分子中含有水而亲油性下降, 导致对镍的萃取能力下降, 此时镍的萃合物结构式为[Ni (R2) HRx (H2O) 4-x][38]。周澄明等[39]利用电子光谱和ESR (电子自旋共振) 波谱研究了镍与不同的酸性磷 (膦) 酸酯形成的萃合物的配位结构, 结果表明, 该萃合物的吸收光谱图和八面体构型的[Ni (H2O) 6]2+, [Ni (en) 3]2+的图谱一致, 是典型的八面体结构, 其中en表示乙二胺。黄可龙等[40]利用P507萃取Ni (II) , 通过元素分析、红外吸收光谱和热分析得出, 结晶态下P507和镍形成的萃合物的空间配位为八面体结构, 磁化率计算出镍的未成对电子数为2, 此时的水分子也参与了配位, 分子式为[NiR2·2 (H2O) ]。
但也有学者认为, 由于磷 (膦) 酸分子磷酰基上的氧原子给电子能力很强, 容易产生分子间氢键, 所以磷 (膦) 酸分子通常是以二聚物的形式出现的, 与镍形成的萃合物应该是以二聚物的形式参与配位, 其分子式为Ni (HR2) 2 (H2R2) n (H2O) [21]2-n。但这种结构也只是计算得出, 详细的空间配位结构还需要进一步研究。
4.1.2 螯合萃取体系
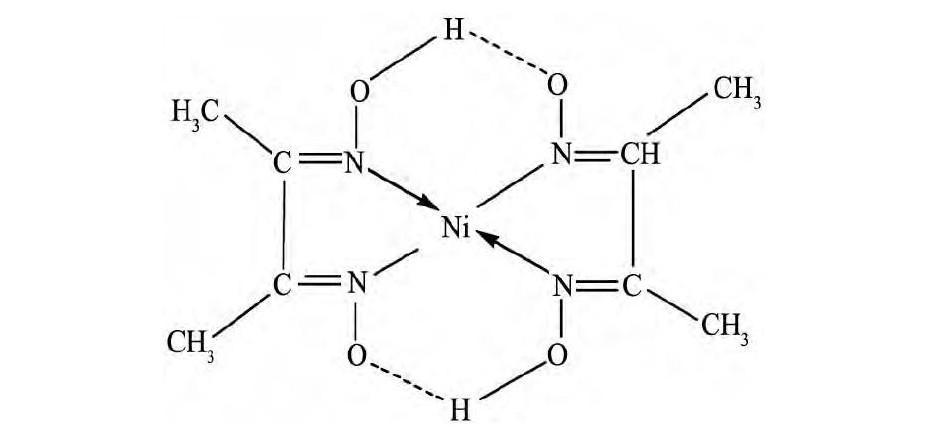
螯合萃取剂与镍形成的萃合物一般为平面四边形构型或八面体构型。肟类萃取剂是比较常见的螯合萃取剂, 它和Ni (II) 形成的萃合物一般为平面四边形结构, 酚羟基上的氧原子与肟基上的氮原子参与配位, 与肟基上的羟基形成氢键, 使萃合物更加稳定[41,42]。例如, 镍与丁二肟易形成平面四边形配合物, 并以dsp2杂化轨道成键, 其结构式如图4所示[16]。
有学者提出了Ni (II) 的八面体配合离子, Barnard等[43]在利用LIX63和Versatic 10萃取Ni (II) 时发现, 在反萃槽中出现了一种蓝色的结晶沉淀, 通过XRD分析发现, 该沉淀为硫酸盐晶体, 其分子式为[Ni (HL) 3]SO4, LIX63以分子的形式参与配位, 形成八面体的空间结构。LIX63和Versatic10与Ni (II) 形成的萃合物的配位情况将在随后的章节讨论。
4.2 协同萃取体系
前面提到, 镍与螯合萃取剂形成的萃合物一般为平面四边形结构, 但是当加入另外一种含受电子基团的萃取剂时, 其配位数由4变为6, 配位结构也从以前的平面四边形转变为八面体配位结构[44]。常见的这种萃取剂主要有磺酸、磷 (膦) 酸和羧酸。
图4 丁二肟与Ni (II) 形成的萃合物的结构Fig.4 Extracted complex structure of nickel (II) and 2, 3-bu-tanedione dioxime
4.2.1 有机磺酸/螯合类
有机磺酸/螯合类协萃体系对镍具有较好的协同效应。Zheng和OsseoAsare[45]研究了DNNSA (二壬基萘磺酸) 和LIX63协同萃取镍 (II) , 通过改变萃取平衡和DNNSA的浓度, 利用斜率法得到萃合物的分子式为Ni (H2L) 3D2, 其中D代表磺酸, Ni∶H2L∶D的化学计量比为1∶3∶2, 推测可能镍与羟肟形成八面体的空间配位结构, 并以阳离子的形式和DNNSA反应, 结构式如图5所示。
4.2.2 有机磷 (膦) 酸/螯合类
之前提到, 磷 (膦) 酸与镍形成的萃合物的分子式为Ni (HR2) 2 (H2R2) n (H2O) 2-n, 由于萃合物中含有水分子, 萃合物的亲油性弱, 当加入螯合萃取剂时, 螯合剂的取代了萃合物中水分子, 从而增强了镍的萃取率, 反应式如式 (4) 所示:

其中, HR为磷 (膦) 酸萃取剂, HL为螯合萃取剂。根据萃取反应能够得出, 该反应中磷 (膦) 酸作为萃取剂, 而螯合萃取剂则作为了协萃剂。
Elizafde等[46]分别利用P204和H[DOP] (邻苯二甲酸二辛酯) 与LIX63组成的协萃体系从性酸介质中萃取镍, 通过构建反应模型计算, 得到萃合物的分子式可能为Ni L2HR和Ni2 (NO3) 2L2 (HR) , 然而, 没有进一步说明萃合物的空间配位情况。Hirokazu等[47]采用X射线吸收光谱法 (XAFS) 方法研究了LIX84萃取Ni2+过程中配合物的结构, 表明Ni (II) 与LIX84分子形成四配位的平面四边形构型;当加入高浓度P204后, 萃合物结构从平面四边形向六配位的八面体结构转变;同时发现少量P204的加入可加速LIX84对Ni (II) 的萃取, 但从XAFS结果中发现这与萃合物构型转变无关。
图5 DNNSA和LIX63萃取体系下Ni (II) 与DNNSA的配位结构Fig.5 Extracted complex structure of nickel (II) and DNNSA in synergistic system containing DNNSA and LIX63
4.2.3 有机羧酸/螯合类
羧酸和螯合体系对镍也有较好的协同效应, 和磷 (膦) 酸相比, 羧酸的羟基氧的电子云密度较大, 羟基的解离能也较大, 因而羧酸的酸性较弱。一般认为, 在有机羧酸/螯合类协同萃取镍的过程中, 镍的萃合物中化学计量比:Ni (II) ∶羟肟∶羧酸为1∶2∶2[48], 分子式为Ni L2 (HA) 2, 萃取反应式如式 (5) 所示[49]:
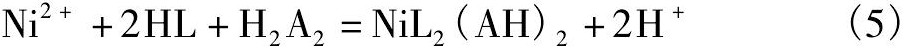
其中, HA为羧酸。
羟肟萃取剂优先失去氢离子, 作为阴离子参与配位, 两个羟肟配体按反式排列为平面四边形结构, 而羧酸作为协萃剂, 位于平面四边形的轴向参与配位, 羧酸的羟基与羟肟配体上的氧原子形成氢键。Cheng[31]得出LIX63和Versatic 10与Ni (II) 形成的萃合物中, LIX63作为萃取剂, 而Versatic 10则作为协萃剂。Castresana等[50]研究了LIX63和不同的羧酸组成的协萃体系萃取镍的性能, 其结构式如图6所示。
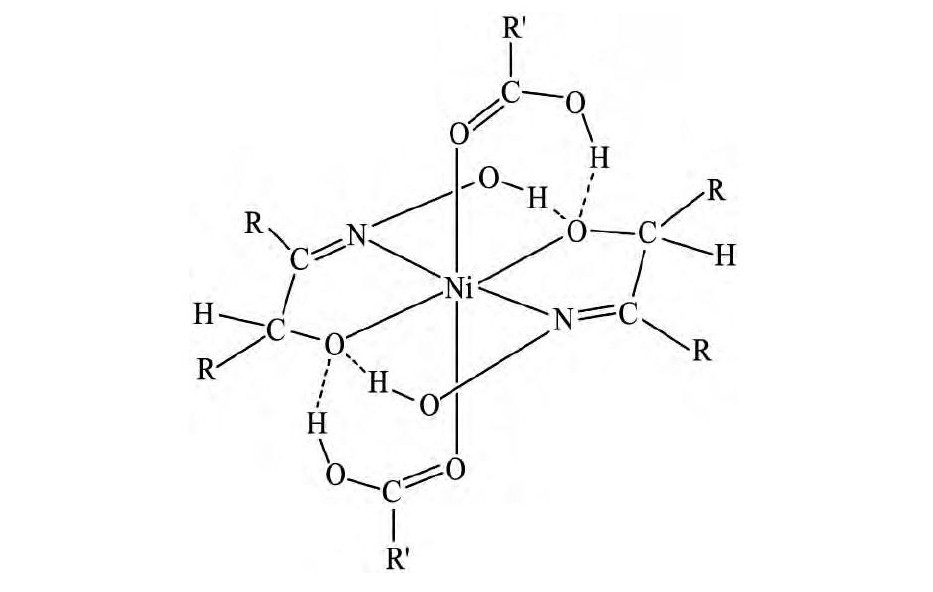
Barnard等[51]研究了丙酸、异丁酸和安息香酸与LIX63组成的协同萃取体系萃取镍的萃合物配位结构, 得到的3种萃合物结晶后, 利用X射线晶体衍射表征萃合物的空间结构。结果发现, 羧酸作为萃取剂, 而α-羟肟作为协萃剂。萃合物羧酸和螯合配体之间形成分子内氢键, 增强了萃合物的稳定性, 萃合物的空间结构如图7所示[45]。然而, 该结构只能说明结晶后的空间配位情况, 液态下的萃合物的结构还需要进一步的研究。
图6 LIX63与羧酸协同萃取Ni (II) 的萃合物结构Fig.6Extracted complex structure of nickel (II) with syner-gistic system containing LIX63 and aliphatic and aro-matic derivatives
图7 LIX63与丙酸、异丁酸、安息香酸协同萃取Ni (II) 的萃合物结构Fig.7Extracted complex structure of nickel (II) and LIX63along with any of benzoate, isobutyrate and propionate
5 结语
钴镍萃取与分离的研究发展迅速, 众多学者提出了大量新型的单一萃取体系和协同萃取体系, 并且做了大量实验工作和工艺研究, 还通过各种方法深入地研究钴镍的萃取机制。然而, 钴镍萃取与分离仍然面临着巨大的困难和挑战, 例如萃取剂的稳定性、镍的动力学、钴镍分离和相分离等问题, 大部分萃取体系难以应用于实际生产。同时, 钴镍萃取理论体系不够完善, 萃取机制尚不明确, 尤其是协同萃取机制及产生协同效应的原因。目前, 萃合物的反应与空间配位方式大都采用理论计算和结晶态的XRD分析, 都具有一定的局限性, 不能准确地表征萃合物的配位方式。
萃合物配位结构的研究比较复杂, 采用理论计算和实验模拟无法准确的得到萃合物的特征, 必须采用分子振动光谱、电子光谱法、核磁共振和X射线吸收光谱法等方法对萃合物进行详细系统地研究, 探究不同萃取体系下钴镍萃合物配位结构的差异性, 利用配位原理解释造成这种差异的原因, 总结萃取规律, 完善萃取理论, 从而为萃取工艺实践作进一步的指导, 促进钴镍萃取与分离的发展。
参考文献
[21] Kislik V S.Solvent Extraction:Classical and Novel Approaches[M].Elsevier, 2011.202.
[41] Szmanowski J.Hydroxyoximes and Copper Hydrometallurgy[M].Florida:CRC Press, Inc., 2003.294.