文章编号: 1004-0609(2005)03-0435-06
超细CeO2粉体的制备及其紫外线吸收性能
朱兆武, 龙志奇, 崔大立, 张顺利, 张国成
(北京有色金属研究总院 有研稀土新材料股份有限公司, 北京 100088)
摘 要:
用碳酸氢铵作沉淀剂通过添加NH4NO3和(NH4)2CO4两种不同的试剂制备了超细CeO2粉体。 采用X射线衍射、 BET和激光散射的方法研究了不同灼烧温度下粉体粒径的变化规律, 并研究了粉体粒径对紫外线吸收的影响。 结果表明: NH4NO3和(NH4)2CO4作为添加剂可以制得一次粒径在10~100nm的纳米粉体, 团聚粒径在200~300nm分散性好的超细CeO2粉体。 X射线衍射和BET测得的一次粒径随灼烧温度升高呈明显增大的趋势, 激光散射测得的团聚粒径随灼烧温度变化不明显。 CeO2粉体分散在去离子水中的吸收光谱研究表明, 粉体一次粒径大小对光的吸收效果有明显影响, 粒径小, 紫外线吸收效果好, 可见光穿透性强, 粒径增大, 粉体将失去紫外线吸收效果, 紫外吸收受粉体的团聚粒径影响不大。
关键词: 超细CeO2粉体; 制备; 紫外吸收 中图分类号: O643
文献标识码: A
Preparation of ultra-fine particle-sized
CeO2 powder and its UV absorbance
ZHU Zhao-wu, LONG Zhi-qi, CUI Da-li,
ZHANG Shun-li, ZHANG Guo-cheng
(Grirem Advanced Materials Co. Ltd,
General Research Institute for Nonferrous Metals, Beijing 100088, China)
Abstract: Ultra-fine CeO2 particle-sized powders were prepared by precipitation method with bicarbonate as precipitant while NH4NO3 and (NH4)2CO4 serve as additives, respectively. The variant regularity of particle size with calcinations temperatures was studied by XRD, BET and Lazer Scattering methods. The results show that nano-particle sized CeO2 with primary particle size of 10-100nm and aggregated particle size of 200-300nm can be obtained while NH4NO3 and (NH4)2CO4 serves as additive. The primary particle size determined by XRD and BET method increases significantly with temperature, however the secondary particle size dose not change appreciably analyzed by laser scattering method. As CeO2 dispersed in de-ionized water, ultra violet(UV)-visible absorbance spectrum was applied to study its absorbance characters. The study finds that it has good UV absorbance and visible light transparency as CeO2 powder with an ultra-fine particle size. UV absorbance is greatly influenced by the primary particle size. With the primary particle size increase, the UV absorbance weakens markedly. The secondary particle size has little influence on its UV absorbance.
Key words: ultra-fine CeO2; preparation; ultra violet absorbance
我国稀土储量居世界之首, 其中铈约占稀土总量的50%, 因此开发铈基功能材料具有重要意义。 超细氧化铈具有强的紫外线吸收性能, 而且对可见光穿透性良好[1-5], 因此, 超细氧化铈作为抗紫外线吸收剂可应用于玻璃、 塑料、 橡胶以及化妆品等领域, 它具有价格低、 无毒害, 而且不改变原料的颜色等优点, 目前引起了人们广泛的兴趣。 Liu等[6]用Kramers Kronig转换模型研究了超细颗粒的氧化铈的紫外线吸收性能。 研究表明, 超细氧化铈在200~480nm之间有一宽的吸收带, 并且在这个宽的吸收带中还有两个窄的吸收带叠加在一起。 宽的吸收带为O的2p和Ce的4f电子跃迁, 而两个窄的吸收带是铈的4f1态的自旋轨道分裂造成的。 Shinryo[4]用Mg2+, Ca2+, Sr2+, Ba2+, Y3+, La3+, Nd3+, Sm3+, Eu3+, Tb3+等离子对CeO2掺杂, 发现20%的Ca2+和Zn2+掺杂后CeO2的粒径明显减小, 紫外线吸收效果好, 而且可见光透过性强。 尽管研究表明CeO2固体颗粒减小, 紫外线吸收效果加强, 但是紫外线吸收性能与CeO2粉末颗粒之间的关系尚不明确。 本文作者采用碳酸氢铵沉淀法添加NH4NO3和(NH4)2CO4分别制备了超细CeO2粉体, 研究了紫外线吸收与颗粒大小之间的关系。
1 实验
1.1 试剂与仪器
主要试剂: Ce2(CO3)3, m(CeO2)/m(REO)>99.9%, 甘肃稀土公司生产; 其他试剂均为分析纯。
主要仪器有: JSM-840 扫描电镜, 日本电子光学公司生产; XPert Pro MPD X 射线衍射仪, 荷兰PaNalytical公司生产; 90Plus 激光粒度仪, 美国BrookHaven仪器公司生产; Lambda19 紫外可见分光光度计, 美国PE公司生产; ST-08比表面仪, 北京科学仪器公司生产。
1.2 样品制备
将市售Ce2(CO3)3粉末用HNO3溶解转化为Ce(NO3)3, 稀释配成0.5mol/L的溶液。
方法1(Method 1): 取100mL 0.5mol/L的Ce(NO3)3溶液加入NH4NO3使其浓度为0.15mol/L, 搅拌均匀后, 室温下(16℃)按13mL/L的加料速度均速加入160mL 1.0mol/L的NH4HCO3。 加料完全后将沉淀体系升温到80℃陈化4h, 冷却后过滤干燥, 在预定温度下灼烧即得超细CeO2粉体。
方法2(Method 2): 取1.54g (NH4)2CO3溶于160mL 1.0mol/L的NH4HCO3中, 然后在室温下(16℃)按13mL/L的加料速度均速加入100mL 0.5mol/L的Ce(NO3)3溶液中。 加料完全后将沉淀体系升温到80℃陈化4h, 冷却后过滤干燥, 在预定温度下灼烧即得超细CeO2粉体。
NH4HCO3在水溶液中发生下列反应:

令[CO2-3]total=[CO2-3]+[HCO-3]+[H2CO3], 那么, 碳酸氢铵溶液中CO2-3的浓度占溶液中总CO2-3浓度(表示为[CO2-3]total)的比例可表示为
![]()
当1.0mol/L的NH4HCO3(pH≈9)加入1.0mol/L的Ce(NO3)3溶液中时, CO2-3与Ce3+瞬间形成的浓度积约为4×10-6, 浓度积远大于CO2-3与Ce3+形成沉淀的浓度积(1.08×10-28)。 因此, 当用NH4HCO3沉淀Ce(NO3)3溶液中的Ce3+时, 瞬间形成较大的过饱和度, 而且形成的Ce2(CO3)3具有很小的溶解度。 根据Weimarn成核与颗粒生长理论:
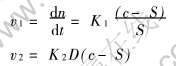
式中 v1、 v2分别为成核速率和生长速率; n为成核数目; t为时间; c、 S分别为过饱和度和溶解度; D为溶质分子扩散系数; K1、 K2为常数。 可以推知, 沉淀反应将有较大的成核速率, 形成的固体具有极细的颗粒。
尽管文献[7-10]曾报道多种制备纳米级超细CeO2粉体的方法, 但沉淀法由于工艺简单, 易于工业化生产, 目前仍是制备CeO2超细粉体的主要方法, 文献[11, 12]已报道用碳酸氢铵沉淀法制备出超细的氧化铈粉体。 沉淀法制备稀土氧化物时, 由于颗粒表面易形成氢键相互交联, 因此团聚现象较严重, 往往得不到分散性好的粉体。 本文作者分别采用NH4NO3和(NH4)2CO4作添加剂, 制备了超细分散性好的CeO2粉体。
1.3 样品分析
1.3.1 粒径分析
1.3.1.1 X射线衍射测得的粒径
由X射线衍射谱(111)面衍射峰半高宽, 根据Scherrer计算公式,
![]()
式中 Dx、 β和θ分别为X射线衍射粒径、 半高峰宽化度以及Bragg衍射角; λ为入射X射线波长, λ=0.1541nm; K为宽化常数, 这里K=0.89。
1.3.1.2 BET测得的粒径
采用BET吸附法测定样品的比表面积, 用Archimede排水法测定样品的密度, 样品粒径DBET计算公式为
![]()
式中 ρ为样品密度; SBET为样品的比表面积。
1.3.1.2 激光散射法测得的粒径
取少量样品用超声波分散在去离子水中, 用激光散射粒度分析仪测定样品的粒度。
1.3.2 样品吸光度分析
取少量样品用超声波分散在去离子水中, 置入1cm石英比色杯中, 以去离子水为参比, 在分光光度计上测定200~600nm区间的吸收光谱。
2 结果与讨论
2.1 样品形貌分析
按实验所述的两种制备方法, 将Ce2(CO3)3溶解在HNO3溶液中制得0.5mol/L的Ce(NO3)3溶液, 碳酸氢铵沉淀晶化后得到的Ce2(CO3)3在700℃下灼烧2h, 形成的氧化铈粉体的SEM形貌如图1所示。 可以看出, 两种合成方法得到的CeO2粉
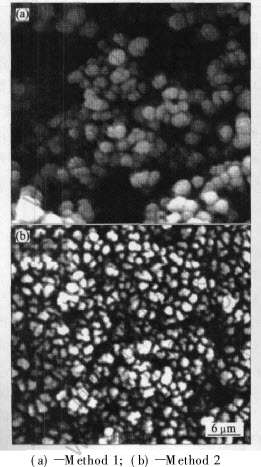
图1 不同方法制得的CeO2粉体的SEM形貌
Fig.1 SEM morphologies of CeO2 powder
体具有不同的形貌。 沉淀前在Ce(NO3)3溶液中加入一定量的NH4NO3得到的CeO2颗粒近似球形, 平均粒径在300nm左右, 而在沉淀剂中加入(NH4)2CO3得到的CeO2球化度较差, 形成的颗粒度较小, 平均粒径在200nm。
2.2 X射线衍射分析
两种合成方法得到的Ce2(CO3)3在不同温度下灼烧2h后, X射线衍射谱见图2。 由图可见, 在两种条件下合成的样品不同温度下灼烧后得到的X射线衍射谱差不多。 400℃下灼烧已得到明显的CeO2面心立方晶型衍射峰, 说明晶粒在400℃以上灼烧后, 晶格基本完善。 400和500℃灼烧后样品的衍射峰明显宽化, 衍射峰强度较弱, 说明CeO2的晶化度低。 按照Scherrer公式和Bravais法则, 由(111)晶面计算的晶粒大小和晶胞参数(a)列于表1。
表1的计算结果表明, 当灼烧温度低于500℃ 时, 晶粒非常小, 两种制备路线均能得到纳米级尺

图2 不同温度灼烧后Ce2(CO3)3的X射线衍射谱
Fig.2 XRD patterns of Ce2(CO3)3 after calcined at different temperatures
表1 由X射线衍射谱计算的晶粒大小和晶胞参数(a)
Table 1 Crystal particle size and parameter(a) calculated from XRD patterns
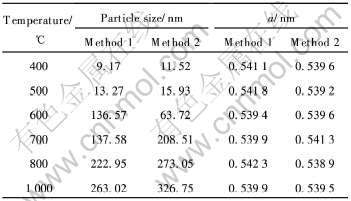
寸的晶粒。 随灼烧温度增大, 晶胞参数a没有发现规律性的变化, 晶胞畸变不明显, 但粒径随之增大, 说明高温下小的晶粒烧结成为较大的晶粒。 当灼烧温度大于600℃时, 衍射峰的宽化不明显, 计算误差较大。 但从衍射峰宽化度的变化可知, 添加NH4NO3制备的CeO2, 当灼烧温度在500~600℃之间, 一次粒径烧结长大较显著, 而添加(NH4)2CO3制备的CeO2, 当灼烧温度在600~700℃之间, 一次粒径烧结长大较显著, 这可能是由于粉体颗粒表面结构不同, 表面张力的差异引起的。
2.3 BET粒径分析
两种合成方法得到的样品在不同温度下灼烧后测得的比表面、 密度以及按球体计算的粒径列于表2。
表2 不同温度灼烧后比表面、 密度以及按球体计算的粒径
Table 2 Specific surface area, density and BET particle sized after calcined at variant temperatures

随着灼烧温度增大, 样品的密度增大, 比表面迅速减小。 由表2可知, BET方法测得粒径与X射线衍射峰计算的粒径极为接近, 这说明形成的颗粒表面较光滑, 颗粒空隙少。
2.4 激光散射法粒径分析
用激光散射方法测定的粒径一般称为粉体的团聚粒径, 因为它反映了颗粒在运动过程中团聚体的大小。 尽管团聚粒径是由一些小的一次粒径组成, 但这些小的颗粒由表面分子键粘连在一起, 在运动过程中表现为一整体, 难以分离。 两种合成路线得到的样品在不同温度下灼烧后测得的团聚粒径以及与BET粒径的比值列于表3。
表3 样品的团聚粒径以及与BET粒径的比值
Table 3 Aggregated particle size(DA) and ratio of them to BET particle size(DBET)
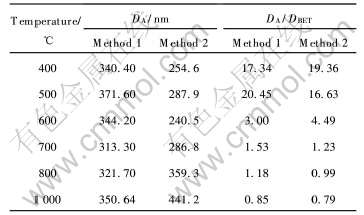
一般用团聚粒径与BET粒径的比表示粉体的团聚性大小, 从表3可以看出, 尽管在较低温度下由XRD和BET测得的一次粒径较小, 但颗粒的团聚性强, 这是由于小的颗粒具有较高的比表面能, 通过表面分子键合形成较大的团聚颗粒使表面能降低, 体系趋于稳定。 当温度较高时, 颗粒具有单分散性。 比值小于1, 这可能是由于颗粒偏离球形造成的。
2.5 UV吸收
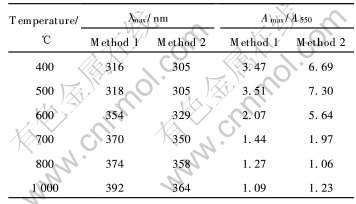
将样品分散在去离子水中, 样品的紫外-可见吸收谱如图3所示。 由图看出, 由于水分子与颗粒表面的结合作用, 吸收谱在紫外区没能表现出吸收的精细结构。 低温(400~600℃)灼烧的样品在紫外区出现一宽的吸收峰, 在200~400nm的紫外区具有较高吸收性能, 而对大于400nm可见光区具有好的透过性。 随灼烧温度升高, 最大吸收峰的波长(见表4)红移。 用最大吸收峰的吸光度与550nm处的吸光度比表示对紫外光的吸收性能, 结果列于表4。 可以看出, 灼烧温度升高, 随CeO2颗粒的烧结, 紫外吸收效果明显变差。 晶体CeO2有一个
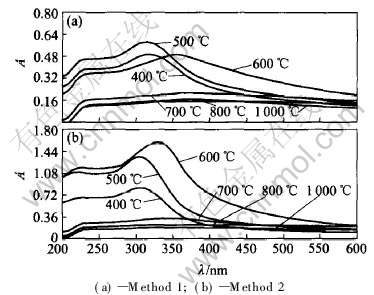
图3 样品的紫外可见吸收光谱
Fig.3 UV and visible absorbance spectrum of prepared samples
表4 不同温度下CeO2粉体的最大吸收波长和最大吸收强度与550nm处吸收强度比
Table 4 Maximum absorption wavelength of CeO2 powder and ratio of its maximum absorbance (Amax) to that in 550nm
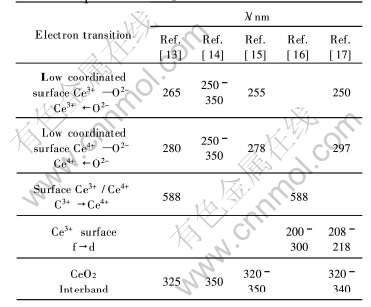
3.1eV的能带间隔, 在此能带区电荷转移在紫外区有很强的吸收, 吸收边界λ=hc/Eg=1240/3.1=400nm(式中λ为吸收波长; h为Plank常数; c为光速; Eg为能带间隔)。 从吸收峰可以看出, 一次粒径在10nm附近, CeO2对波长小于400nm的紫外光具有很强的吸收。 许多文献曾对CeO2的吸收光谱进行指认, 结果列于表5。
尽管表5中的研究结果对吸收峰的指认有所差异, 但是可以看出CeO2的紫外吸收大都与表面电荷迁移相关, 因此它们受粒径影响较大, 粒径越小, 表面积越大, 电荷转移数越多, 紫外吸收越强。 Bwnslem等[13]研究表明, 类似CeO2, ZrO2的半导体材料, 其紫外吸收波长受粒径影响较大, 带间能量增大, 最大紫外吸收波长蓝移, 这从实验结果中(图3)也能明显地看出。 随着晶体颗粒增大,紫外线激发CeO2能带间电荷迁移也会明显减少, 因此导致紫外线吸收明显减弱。
表5 不同文献中指认的CeO2的电荷转移和对紫外—可见光的吸收光谱
Table 5 Charge transition and UV—vis absorption of CeO2 in different references
实验结果表明, CeO2对紫外线的吸收性能受粉体颗粒的影响较复杂, 它既与粉体的一次晶体粒径(XRD粒径或BET粒径)有关, 当一次粒径在10nm左右时, CeO2具有强的紫外吸收效果和可见光穿透性能, 当粉体晶体粒径(XRD测得粒径)在几十或BET测得粒径在100nm以上时, 粉体将失去紫外吸收效果。 另外, 粉体的紫外吸收效果又受粉体团聚粒径的影响, 分散性越好, 紫外吸收效果越强。 但CeO2粉体的紫外吸收主要是由颗粒的一次粒径决定的, 团聚粒径的大小影响较弱。
3 结论
1) 以NH4NO3 和(NH4)2CO3作添加剂, 用碳酸氢铵沉淀法可以制备颗粒细、 分散好的CeO2粉体。
2) 超细CeO2具有很好的紫外线吸收效果, 并对可见光透射性良好。 当粉体一次粒径在10nm左右时, CeO2具有强的紫外吸收效果和可见光穿透性能, 当粉体一次粒径在100nm以上时, 粉体将失去紫外吸收效果。
3) CeO2粉体的紫外吸收强度主要受颗粒一次粒径的影响, 团聚粒径对CeO2粉体也有一定的影响, 随团聚粒径的减小, 紫外线吸收效果增强。
REFERENCES
[1]姜亚昌, 望达健. 纳米CeO2的制备技术及其紫外线吸收应用[A]. 纳米材料和技术应用进展. 全国第三界纳米材料和技术应用会议集(下)[C]. 南京: 中国材料研究学会, 2003. 788-791.
JIANG Ya-chang, WANG Da-jian. Preparation of nanosized CeO2 and its application for UV absorption[A]. Progress of Nanostructured Materials and Technical Applications[C]. Nanjing: Chinese Material Research Academic Association, 2003. 788-791.
[2]高金良. 防紫外线化妆品用氧化铈[J]. 稀土信息, 1997, 8: 11.
GAO Jin-liang. Cerium dioxide applied for anti-ultraviolet radiation in cosmetic[J]. Rare Earth Information, 1997, 8: 11.
[3]Ruixing L, Shinryo Y, Yamashita M, et al. Synthesis and UV-shielding properties of ZnO- and CaO-doped CeO2 via soft solution chemical process[J]. Solid State Ionics, 2002, 151(1-4): 235-241.
[4]Shinryo Y, Yamashita M, Shigeyoshi M, et al. Synthesis and UV-shielding properties of metal oxide doped ceria via soft solution chemical processes[J]. International Journal of Inorganic Materials, 2001, 3(7): 1003-1008.
[5]Shinryo Y, Tsugio S. Cerium oxide for sunscreen cosmetics[J]. Journal of Solid State Chemistry, 2003, 171(1-2): 7-11.
[6]Fangxin L, Chengyun W, Qingde S, et al. Optical properties of nanocrystalline ceria[J]. Applied Optics, 1997, 36(13): 2796-2798.
[7]Purohit R D, Sharma B P. Pillai K T, et al. Ultrafine ceria powders via glycine-nitrate combustion[J]. Materials Research Bulletin, 2001, 36(15): 2711-2721.
[8]张环华, 李秀珍, 潘湛昌, 等. 纳米二氧化铈的制备及应用[J]. 化学工程师, 2002, 89(2): 36-38.
ZHANG Huan-hua, LI Xiu-zhen, PAN Zhan-chang, et al. Application and preparation on liquid phase methods of nanometer CeO2[J]. Chemical Engineer, 2002, 89(2): 36-38.
[9]董相廷, 洪广言. 溶胶-凝胶法合成二氧化铈纳米晶[J]. 长春理工大学学报, 2002, 25(2): 43-46.
DONG Xiang-tiang, HONG Guang-yan. Sythesis of nanocrystalline CeO2 by so-gel method[J]. J Changchun Univ Sci Tech, 2002, 25(2): 43-46.
[10]Jin-Seok L, Sung-Churl C. Crystallization behavior of nano-ceria powders by hydrothermal synthesis using a mixture of H2O2 and NH4OH[J]. Materials Letters, 2004, 58(3-4): 390-393.
[11]李梅, 柳召刚, 刘铃声, 等. 氧化铈超细粉体的制备研究[J]. 中国稀土学报, 2003, 21(4): 265-267.
LI Mei, LIU Shao-gang, LIU Ling-sheng, et al. Study on the preparation of ultra-fine particle sized ceria powder[J]. Journal of the Rare Earth Society, 2003, 21(4): 265-267.
[12]肖楚民, 潘湛昌, 张环华, 等. 碳酸氢铵沉淀法制备二氧化铈超细粉体[J].矿冶工程, 2003, 23(1): 41-43.
XIAO Chu-min, PAN Zhan-chang, ZHANG Huan-hua, et al. Preparation of ultra-fine particle sized ceria powder by precipitation method with ammonium bicarbonate[J]. Mining Engineering, 2003, 23(1): 41-43.
[13]Bensalem A, Muller J C, Bozon-Verduraz F. In-situ diffuse reflectance spectroscopy of supported cerium oxide[J]. J Chem Soc, Faraday Trans 1992, 88: 153-159.
[14]Bensalem A, Bozon-Verduraz F, Delamar M, et al. Preparation and characterization of highly dispersed silica-supported ceria[J]. Appl Catal, 1995, A121: 81-93.
[15]Zaki M I, Hussein G A, Mansour S A, et al. Ceria on silia and alumina catalysts: dispersion and surface acid-base properties as probed by X-ray and in situ IR absorption diffractomettry, UV-vis diffuse reflectance studies[J]. Colloids Surfaces, 1997, A127: 47-56.
[16]Binet C, Bardi A, Lavalley J C. A comparative UV-vis-diffuse reflectance study on the location and interaction of cerium ions in Al- and Zr-pillared montmorillonite clays[J]. J Phys Chem, 1994, 98: 6392-6398.
[17]Ranga R H, Ranjan S H. XRD and UV diffuse reflectance analysis of CeO2-ZrO2 solid solutions synthesized by combustion method[J]. Proc Indian Acad Sci(Chem Sci), 2001, 113(5-6): 651-658.
(编辑陈爱华)
基金项目: 国家发展与改革委员会稀土专项资助项目
收稿日期: 2004-06-30; 修订日期: 2004-12-10
作者简介: 朱兆武(1966-), 男, 副研究员, 博士.
通讯作者: 朱兆武, 副研究员; 电话: 010-82241188; 传真: 010-82241188; E-mail: zwuzh@263.net
[2]高金良. 防紫外线化妆品用氧化铈[J]. 稀土信息, 1997, 8: 11.
[8]张环华, 李秀珍, 潘湛昌, 等. 纳米二氧化铈的制备及应用[J]. 化学工程师, 2002, 89(2): 36-38.
[9]董相廷, 洪广言. 溶胶-凝胶法合成二氧化铈纳米晶[J]. 长春理工大学学报, 2002, 25(2): 43-46.
[11]李梅, 柳召刚, 刘铃声, 等. 氧化铈超细粉体的制备研究[J]. 中国稀土学报, 2003, 21(4): 265-267.
[12]肖楚民, 潘湛昌, 张环华, 等. 碳酸氢铵沉淀法制备二氧化铈超细粉体[J].矿冶工程, 2003, 23(1): 41-43.


