文章编号:1004-0609(2011)12-3202-09
SiCl4氢化转化为SiHCl3过程的热力学
侯彦青1,谢 刚1, 2,陶东平1,俞小花1,李荣兴1,宋东明1, 3
(1. 昆明理工大学 冶金与能源工程学院,昆明 650093;
2. 云南冶金集团总公司 技术中心,昆明650031;
3. 昆明冶研新材料股份有限公司,昆明 650031)
摘 要:
应用有关热力学数据研究了与多晶硅主要生产工艺即西门子法相关的“Si-Cl-H”三元系的复杂化学反应,研究SiCl4氢化转化为SiHCl3过程中可能发生的15个反应,给出15个反应的![]() —T图;并确定5个独立的反应,给出这5个独立反应的
—T图;并确定5个独立的反应,给出这5个独立反应的![]() —T图;高温时主反应(1)的
—T图;高温时主反应(1)的![]() 增长较慢,而反应(2)和(5)的
增长较慢,而反应(2)和(5)的![]() 快速增大,1 373 K时,主反应(1)的
快速增大,1 373 K时,主反应(1)的![]() 较小,为0.157 1。进一步研究温度、压强和进料配比
较小,为0.157 1。进一步研究温度、压强和进料配比![]() 对SiCl4氢化率的影响,并绘制出SiCl4氢化率随这些因素的变化曲线。结果表明:当压强和进料配比一定时,SiCl4的氢化率随温度的升高先增加后降低;增大压强或增加进料配比
对SiCl4氢化率的影响,并绘制出SiCl4氢化率随这些因素的变化曲线。结果表明:当压强和进料配比一定时,SiCl4的氢化率随温度的升高先增加后降低;增大压强或增加进料配比![]() 都会提高SiCl4的氢化率;SiCl4氢化转化为SiHCl3过程的最佳操作条件为温度为1 000 ℃,压强为0.3 MPa,进料配比
都会提高SiCl4的氢化率;SiCl4氢化转化为SiHCl3过程的最佳操作条件为温度为1 000 ℃,压强为0.3 MPa,进料配比![]() 为4,在此条件下,SiCl4的氢化率为25.78%。
为4,在此条件下,SiCl4的氢化率为25.78%。
关键词:
中图分类号:O642.4;O613.72 文献标志码:A
Thermodynamics of transformation process from SiCl4 to SiHCl3
HOU Yan-qing1, XIE Gang1, 2, TAO Dong-ping1, YU Xiao-hua1, LI Rong-xing1, SONG Dong-ming1, 3
(1. Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology,
Kunming 650093, China;
2. Technology Center, Yunnan Metallurgy Group Co., Kunming 650031, China;
3. Kunming Yeyan New-Material Co., Ltd., Kunming 650031, China)
Abstract: Based on the thermodynamic data for the related pure substances, fifteen possible chemical reactions in the SiCl4 hydrogenation system of Siemens process that is one of the main process for the polysilicon production were studied. The ![]() curves of the fifteen chemical reactions in the system versus temperature were fitted by the assistant of computer. The values of
curves of the fifteen chemical reactions in the system versus temperature were fitted by the assistant of computer. The values of ![]() for most reactions are greater than zero at the range of 973K to 1 773 K. That is to say that the value of equilibrium constant is small. Therefore, the small degree of the reactions was carried on. Five independent reactions in the process were decided and the relation between
for most reactions are greater than zero at the range of 973K to 1 773 K. That is to say that the value of equilibrium constant is small. Therefore, the small degree of the reactions was carried on. Five independent reactions in the process were decided and the relation between ![]() and temperature was fitted by the assistance of computer based on the thermodynamic data for the related pure substances. The value of
and temperature was fitted by the assistance of computer based on the thermodynamic data for the related pure substances. The value of ![]() for main reaction (1) increases a little at high temperature, but the value of
for main reaction (1) increases a little at high temperature, but the value of ![]() for side-reactions (2) and (5) increase quickly. Besides, the value of
for side-reactions (2) and (5) increase quickly. Besides, the value of ![]() for main reaction (1) is low at low temperature, for example only 0.157 1 at 1 373 K. Therefore, the transformation ratio of SiCl4 to SiHCl3 being low is a objective fact which can not be changed. Furthermore, the influencing factors, such as the temperature, pressure and feeding mole ratio, on the transformation ratio from SiCl4 to SiHCl3 were studied. The diagrams of η—transformation ratio are presented as function of temperature, pressure and feeding mole ration, respectively. The transformation ratio of SiCl4 to SiHCl3 decreases with increasing the temperature, and the pressure have a positive effect on the transformation ratio. Furthermore, the excess of H2 is necessary in SiCl4 hydrogenation system of the modified Siemens process. From the thermodynamic above, The results show that the optimum operation parameters are at 1 050 ℃, 0.3 MPa and feeding mole ratio
for main reaction (1) is low at low temperature, for example only 0.157 1 at 1 373 K. Therefore, the transformation ratio of SiCl4 to SiHCl3 being low is a objective fact which can not be changed. Furthermore, the influencing factors, such as the temperature, pressure and feeding mole ratio, on the transformation ratio from SiCl4 to SiHCl3 were studied. The diagrams of η—transformation ratio are presented as function of temperature, pressure and feeding mole ration, respectively. The transformation ratio of SiCl4 to SiHCl3 decreases with increasing the temperature, and the pressure have a positive effect on the transformation ratio. Furthermore, the excess of H2 is necessary in SiCl4 hydrogenation system of the modified Siemens process. From the thermodynamic above, The results show that the optimum operation parameters are at 1 050 ℃, 0.3 MPa and feeding mole ratio ![]() of 4. Under this condition, the transformation ratio from SiCl4 to SiHCl3 is 25.78%.
of 4. Under this condition, the transformation ratio from SiCl4 to SiHCl3 is 25.78%.
Key words: SiCl4; SiHCl3; thermodynamics; transformation
随着传统能源的枯竭以及石油价格的不断升高,太阳能受到全世界越来越广泛的关注。目前多晶硅是光伏转化器最好的材料之一[1],其生产方法主要如下:西门子法[2-3]、冶金法[4-8]、硅烷法[9]、锌还原法[10-11]、高纯二氧化硅的碳热还原法[12]等,其中西门子法是目前国际主流厂商生产多晶硅的主要工艺[13-14]。然而西门子法在制备多晶硅的生产过程中,生产1 t多晶硅将产生14 t SiCl4[11],因此需对尾气分离并氢化制备三氯氢硅,从而使得整个生产流程实现完全闭路循环,节约资源,并在一定程度上降低了生产成本。基于该原则,西门子法经过三代的发展,已经实现了完全的闭路生产,称为改良的西门子法。由于国外对改良西门子法中SiCl4氢化技术封锁,国内基本上仍无法掌握该技术。因此,本文作者对西门子法过程中SiCl4氢化系统进行热力学分析,对实际生产起到指导性作用。
大量文献报道了Si-H-Cl三元系方面的研究,在西门子法制备多晶硅方面也有很多出色的研究,但主要都是涉及SiHCl3氢还原制备多晶硅方面的研究,如SIRTL等[15]研究了反应达到平衡时的主要气相物质与硅的平衡,并给出硅产率与温度的关系图以及SiHCl3物质的量的分数对硅沉积速率的影响;DIANA等[16]研究了晶体硅、液态硅、H2、SiCl4、SiHCl3、HCl、SiH2Cl2、Si2C16、SiH3C1、SiH4、Cl2与一些高温物种和自由基SiC12、SiC1、SiC13、SiH、H、C1、气态硅组成的体系达到平衡时,其成分和Si在不同H2/SiHCl3时的还原产率等;苗军舰等[17-18]也对该过程进行了详细研究。
关于西门子法SiCl4氢化系统的工艺论证及实验研究已有许多报道[19-23],但一直以来未见西门子法反应体系中SiCl4氢化制备SiHCl3的热力学研究报道,并且SiCl4是西门子法制备多晶硅过程的主要副产物,产量很大,需对其氢化转化为SiHCl3,从而可得到循环利用。因此,有必要揭示SiCl4氢化制备SiHCl3的反应规律,以便提高该过程的一次转化率,更好地控制反应过程。基于此,本文作者对SiCl4氢化制备SiHCl3的热力学行为进了详细探讨。
1 Si-H-Cl体系热力学
SiCl4氢化制备SiHCl3(TCS)过程中,体系可能会发生如下反应[15, 24-26]:
SiCl4(g)+H2(g)=SiHCl3(g)+HCl(g) (主反应) (1)
SiCl4(g)+H2(g)=SiCl2(g)+2HCl(g) (2)
2SiHCl3(g)=SiCl4(g)+SiH2Cl2(g) (3)
SiH2Cl2(g)+H2(g)=SiH3Cl(g)+HCl(g) (4)
SiHCl3(g)=SiCl2(g)+HCl(g) (5)
SiCl4(g)+2H2(g)=Si(s)+4HCl(g) (6)
4SiHCl3(g)=Si(s)+3SiCl4(g)+2H2(g) (7)
2SiCl2(g)=Si(s)+SiCl4(g) (8)
SiHCl3(g)+2H2(g)=SiH3Cl(g)+2HCl(g) (9)
SiCl2(g)+H2(g)=Si(s)+2HCl(g) (10)
2SiHCl3(g)=Si(s)+2HCl(g)+SiCl4(g) (11)
SiH2Cl2(g)=Si(s)+2HCl(g) (12)
SiHCl3(g)+H2(g)=SiH2Cl2(g)+HCl(g) (13)
SiHCl3(g)+H2(g)=Si(s)+3HCl(g) (14)
SiH3Cl(g)=HCl(g)+Si(s)+H2(g) (15)
对以上15个反应进行热力学计算,可以得到平衡时的组分含量,从而对SiCl4氢化的操作条件有指导性的作用。根据热力学及实际化学分析,该体系中存在H2(g)、SiCl4(g)、HCl(g)、SiHCl3(g)、SiCl2(g)、Si(s)、SiH2Cl2(g)、SiH3Cl(g)、SiH4(g)、SiCl(g)等十几种物种,其中前8种是主要物种,其余物种的含量很少,可以忽略不计[15]。这是因为SiH4在800 ℃以上很容易分解,而活性中间体如SiCl等,很容易与其他气相物质反应。所以他们的含量很少,一般低于10-7数量级,因此,相对于前8中主要物种(一般大于10-3数量级)可忽略不计。根据这些物质的热力学数据(见表1),即可绘出上述15个反应的![]() 与T的关系曲线,如图1所示。
与T的关系曲线,如图1所示。
表1 相关物质在标准条件下(0.1 MPa,298 K)的热力学数据[27]
Table 1 Thermodynamic data for related pure substances at standard condition (0.1 MPa, 298 K)[27]
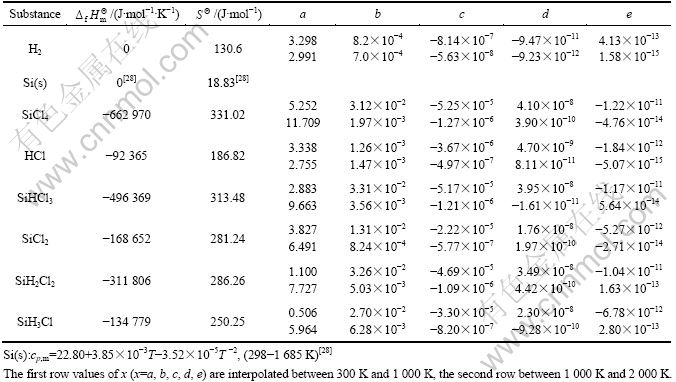
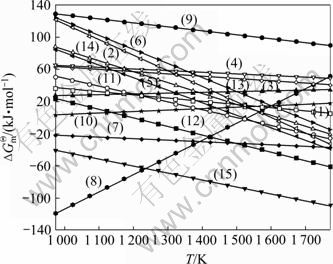
图1 反应(1)~(15)的![]() —T曲线
—T曲线
Fig.1 Diagrams of ![]() —T for reactions (1)-(15)
—T for reactions (1)-(15)
由图1可知,温度在973~1 773 K范围内,大多数反应的![]() 数值都大于0,说明这些反应的平衡常数很小,很难进行。根据Brinklev方法[29]可知:SiCl4氢化过程中的15个反应中存在的物种数(M)为8,独立组元数(N)等于元素数3,即Si、H、Cl这3种元素,则独立反应数为:M-N=8-3=5。所以,SiCl4氢化过程中15个反应中只有5个是独立反应,其余反应均为它们的线性组合。由于在SiCl4氢化过程是气相反应过程,且在实际生产过程中,没有发现固体硅的生成,产物主要有HCl、SiHCl3及SiH2Cl2,且进料为SiCl4和H2[9]。因此,为了计算方便,本文作者选择式(1)~(5)作为1组独立反应。通过上述热力学数据,可绘出这5个独立反应的
数值都大于0,说明这些反应的平衡常数很小,很难进行。根据Brinklev方法[29]可知:SiCl4氢化过程中的15个反应中存在的物种数(M)为8,独立组元数(N)等于元素数3,即Si、H、Cl这3种元素,则独立反应数为:M-N=8-3=5。所以,SiCl4氢化过程中15个反应中只有5个是独立反应,其余反应均为它们的线性组合。由于在SiCl4氢化过程是气相反应过程,且在实际生产过程中,没有发现固体硅的生成,产物主要有HCl、SiHCl3及SiH2Cl2,且进料为SiCl4和H2[9]。因此,为了计算方便,本文作者选择式(1)~(5)作为1组独立反应。通过上述热力学数据,可绘出这5个独立反应的![]() 与T的关系曲线,如图2所示。
与T的关系曲线,如图2所示。
由图2可知:在973~1 350 K范围内,这5个独立反应的![]() 都很小,当温度大于1 350 K时,主反应(1)略有增加,副反应(2)和(5)的
都很小,当温度大于1 350 K时,主反应(1)略有增加,副反应(2)和(5)的![]() 增长的非常快,反应(3)和(4)基本不变。由于反应(5)消耗SiHCl3,因此温度升高,SiCl4的氢化效果不好。但是当温度低时,
增长的非常快,反应(3)和(4)基本不变。由于反应(5)消耗SiHCl3,因此温度升高,SiCl4的氢化效果不好。但是当温度低时,
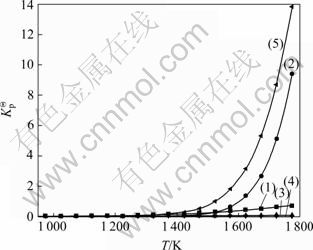
图2 反应(1)~(5)的![]() —T图
—T图
Fig.2 Diagrams of ![]() for reactions (1)-(5) versus temperature
for reactions (1)-(5) versus temperature
反应(1)的平衡常数又很低,在1 373 K时,仅为0.157 1,因此SiCl4的氢化率低是无法改变的客观事实。
2 计算结果与讨论
SiCl4的氢化率可以由下式求出:
![]() (16)
(16)
其中:![]() 为SiCl4的氢化率;
为SiCl4的氢化率;![]() 为平衡时SiHCl3的物质的量,mol;
为平衡时SiHCl3的物质的量,mol;![]() 为SiCl4的进料量,mol。
为SiCl4的进料量,mol。
2.1 温度对SiCl4氢化率的影响
在压强和进料配比不变的条件下,分析温度对SiCl4氢化率的影响。计算了压强(0.1、0.3和0.5 MPa)和进料配比(![]() 为1:2、1:3和1:4)条件下,温度在700~1 500 ℃范围内的SiCl4氢化率的变化情况,分别见图3和4。
为1:2、1:3和1:4)条件下,温度在700~1 500 ℃范围内的SiCl4氢化率的变化情况,分别见图3和4。
由图3和4可知,在压强和进料配比一定的条件下,SiCl4氢化率明显有个峰值,即随着温度的升高,SiCl4氢化率先增加后逐渐降低。当p=0.1 MPa,![]() =2,温度由700 ℃到1 500 ℃时,SiCl4的氢化率由9.6%升高到16.5%,再降低到3.0%;在温度为972 ℃时,SiCl4的氢化率达到最高值,为16.5%。由此可知,在实际生产中,温度控制在最优的温度范围内,对SiCl4的氢化过程非常重要。在0.1 MPa下,最佳温度为980 ℃左右;0.3 MPa时,最佳温度为1 000 ℃;0.5 MPa时,最佳温度则为1 050 ℃。由此可见,SiCl4氢化的最佳温度随着压强的增大而增大。
=2,温度由700 ℃到1 500 ℃时,SiCl4的氢化率由9.6%升高到16.5%,再降低到3.0%;在温度为972 ℃时,SiCl4的氢化率达到最高值,为16.5%。由此可知,在实际生产中,温度控制在最优的温度范围内,对SiCl4的氢化过程非常重要。在0.1 MPa下,最佳温度为980 ℃左右;0.3 MPa时,最佳温度为1 000 ℃;0.5 MPa时,最佳温度则为1 050 ℃。由此可见,SiCl4氢化的最佳温度随着压强的增大而增大。
由图3可知,在同一压力条件下,温度较高时,SiCl4的氢化率很低,且进料配比(![]() )对SiCl4氢化率几乎没有影响,表明反应温度高于一定数值时,增大
)对SiCl4氢化率几乎没有影响,表明反应温度高于一定数值时,增大![]() ,对SiCl4的氢化率没有明显的提高,即增大
,对SiCl4的氢化率没有明显的提高,即增大![]() 没有意义。但是当温度控制在最佳温度附近时,进料配比(
没有意义。但是当温度控制在最佳温度附近时,进料配比(![]() )对SiCl4氢化率的影响就变得更为显著。通过计算发现,产生这种现象的原因主要是由于:温度对副反应(2)和(5)的反应进度影响很大,而对主反应(1)的反应进度影响很小,如图2所示。
)对SiCl4氢化率的影响就变得更为显著。通过计算发现,产生这种现象的原因主要是由于:温度对副反应(2)和(5)的反应进度影响很大,而对主反应(1)的反应进度影响很小,如图2所示。
由图4可知,在同一进料配比条件下,温度较低时,SiCl4的氢化率也很低,且压强对SiCl4氢化率也几乎没有影响。这表明反应温度低于一定数值时,增大压强对SiCl4氢化率没有意义。但是当温度控制在最佳温度附近时,压强对SiCl4氢化率的影响就变得较为显著。产生这种现象的原因如下:在温度较低时主反应以及副反应的平衡常数都很小,如图2所示。
因此,温度对SiCl4氢化转化为SiHCl3过程非常重要,只有把温度控制在适当的范围,才能通过改变压强或进料配比来提高SiCl4的氢化率。通过以上分析可以得到:温度控制在980~1 050 ℃范围内最为合适,当压强为0.1 MPa时,最佳温度为980 ℃;当压强为0.3 MPa时,最佳温度为1 000 ℃;当压强为0.5 MPa时,最佳温度为1 050 ℃。
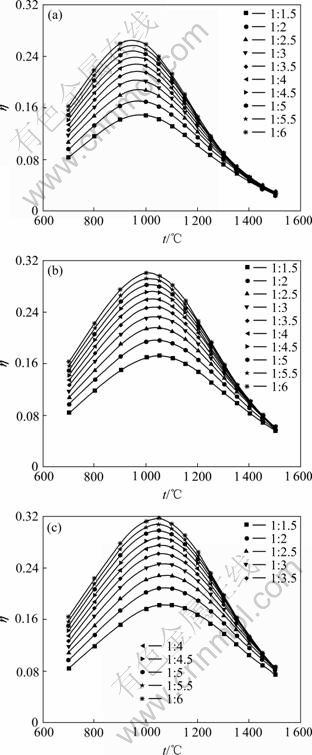
图3 进料配比时SiCl4氢化率(η)随温度的变化
Fig.3 Variation of transformation ratio of SiCl4 to SiHCl3 with temperature at different feeding mole ratios: (a) 0.1 MPa; (b) 0.2 MPa; (c) 0.3 MPa
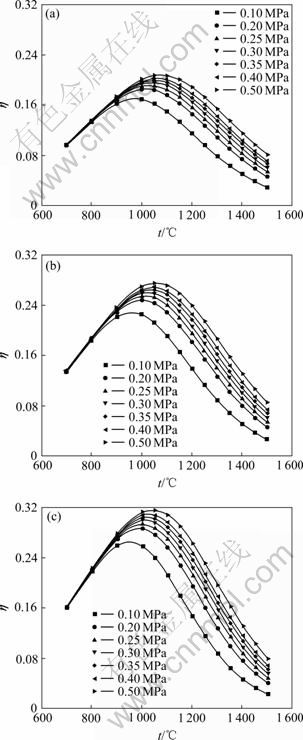
图4 不同压力时SiCl4氢化率随温度的变化
Fig.4 Variation of transformation ratio of SiCl4 to SiHCl3 with temperature at different presses: (a) ![]() =2; (b)
=2; (b) ![]() =3; (c)
=3; (c) ![]() =4
=4
2.2 压强对氢化率的影响
在温度和进料配比不变的条件下,分析压强对SiCl4氢化率的影响。在温度分别为800、1 050和1 250 ℃和进料配比(![]() 为1:2、1:3和1:4)条件下,压强在0.1~0.5 MPa范围内SiCl4氢化率的变化情况,分别如图5和6所示。
为1:2、1:3和1:4)条件下,压强在0.1~0.5 MPa范围内SiCl4氢化率的变化情况,分别如图5和6所示。
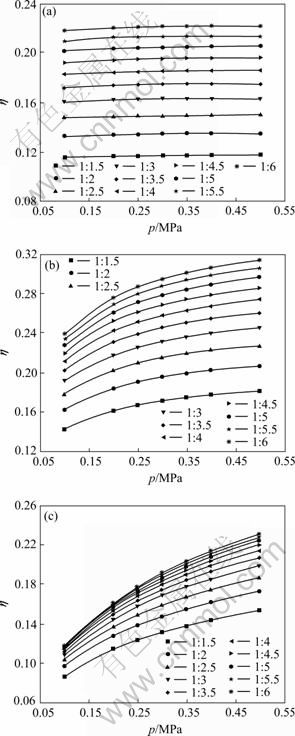
图5 不同温度时SiCl4氢化率随压强的变化
Fig.5 Variation of transformation ratio of SiCl4 to SiHCl3 with pressure at different feeding mole ratios: (a) 800 ℃; (b) 1 050 ℃; (c) 1 250 ℃
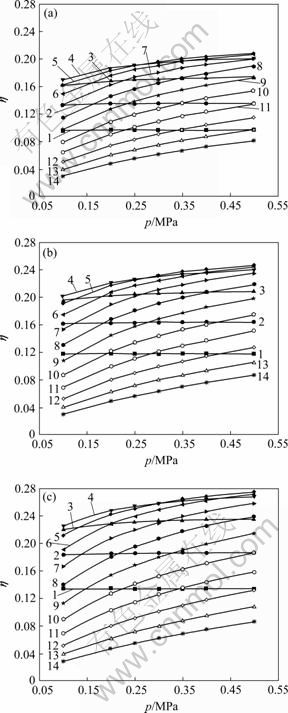
图6 不同温度时SiCl4氢化率随压强的变化
Fig.6 Variation of transformation of SiCl4 to SiHCl3 with pressure at different temperatures (1—700 ℃; 2—800 ℃; 3—900 ℃; 4—1 000 ℃; 5—1 050 ℃; 6—1 100 ℃; 7—1 150 ℃; 8—1 200 ℃; 9—1 250 ℃; 10—1 300 ℃; 11—1 350 ℃; 12—1 400 ℃; 13—1 450 ℃; 14—1 500 ℃): (a) ![]() =2; (b)
=2; (b) ![]() =3; (c)
=3; (c) ![]() =4
=4
由图5(a)可知,温度为800 ℃时,在当进料配比一定的条件下,SiCl4的氢化率为一条水平的直线,即随着压强的变化,SiCl4的氢化率保持为一个定值。也就是说温度较低时,压强对SiCl4的氢化率没有任何的影响,与2.1节讨论的结果一致。且由图6可看出,增大压强对SiCl4氢化率没有意义的温度范围为700~900 ℃,因此,在实际生产中,操作温度一定要保证高于900 ℃。
当温度达到一定数值时,随着压强的增大,SiCl4的氢化率逐渐增大,结果如图5(b)和(c)所示。在0.1~0.3 MPa之间,SiCl4的氢化率增加较快,当压强大于0.3 MPa时,SiCl4的氢化率增加较慢。通过分析可得到:实际生产中,当压强达到一定数值时,增大压强对SiCl4氢化率的影响不大。且操作压强越大,对设备的要求越高,设备的损坏率也越高,从而导致生产成本升高。因此,在实际生产过程中,压强应该选择在0.3 MPa左右。
2.3 进料配比对氢化率的影响
当温度和压强保持不变时,SiCl4氢化率随进料配比的变化情况分别如图7和8所示。
当温度和压强一定的条件下,随着进料配比![]() 的增大,SiCl4的氢化率增大。因此,在SiCl4氢化系统中,过量H2对SiCl4的氢化反应非常重要。由图7可知:当
的增大,SiCl4的氢化率增大。因此,在SiCl4氢化系统中,过量H2对SiCl4的氢化反应非常重要。由图7可知:当![]() 在2:1~4:1范围内,SiCl4氢化率增大的比较快;当
在2:1~4:1范围内,SiCl4氢化率增大的比较快;当![]() 大于4:1时,SiCl4的氢化率增加的比较缓慢。在压强为0.3 MPa、温度为 1 000 ℃,进料配比
大于4:1时,SiCl4的氢化率增加的比较缓慢。在压强为0.3 MPa、温度为 1 000 ℃,进料配比![]() 由2:1增加到到4:1时,SiCl4的氢化率增加到32.02%;而当进料配比
由2:1增加到到4:1时,SiCl4的氢化率增加到32.02%;而当进料配比![]() 由4:1增加到6:1时,SiCl4的氢化率增加14.40%。由此可以得到:当进料配比
由4:1增加到6:1时,SiCl4的氢化率增加14.40%。由此可以得到:当进料配比![]() 增大到一定程度时,再增大
增大到一定程度时,再增大![]() 的配比对SiCl4的氢化率影响很小,并且按照现有的技术,H2和HCl分离比较困难,H2过量势必会增大H2和HCl的分离难度,从而造成成本的增大。因此可以得到:虽然过量H2对SiCl4氢化转化为SiHCl3非常重要,但是
的配比对SiCl4的氢化率影响很小,并且按照现有的技术,H2和HCl分离比较困难,H2过量势必会增大H2和HCl的分离难度,从而造成成本的增大。因此可以得到:虽然过量H2对SiCl4氢化转化为SiHCl3非常重要,但是![]() 也不能太高,否则会产生以下3个方面的问题:1) 增加H2进料量对SiCl4氢化率的影响不大;2) 增加H2的进料量,产物中HCl的含量也随之增加,如在0.1 MPa、1 150 ℃条件下,当
也不能太高,否则会产生以下3个方面的问题:1) 增加H2进料量对SiCl4氢化率的影响不大;2) 增加H2的进料量,产物中HCl的含量也随之增加,如在0.1 MPa、1 150 ℃条件下,当![]() =1.5时,HCl的产量为0.399 7,当
=1.5时,HCl的产量为0.399 7,当![]() =5时,HCl的产量为0.736 2;3) 在现有的技术条件下,H2和HCl分离比较困难,且成本较高。增大H2的进料量势必会增大H2和HCl的分离难度,从而增大成本。通过以上分析可以得到:在实际生产中,进料配比
=5时,HCl的产量为0.736 2;3) 在现有的技术条件下,H2和HCl分离比较困难,且成本较高。增大H2的进料量势必会增大H2和HCl的分离难度,从而增大成本。通过以上分析可以得到:在实际生产中,进料配比![]() 应控制在4:1。
应控制在4:1。
然而在高温时,随着进料配比![]() 的增加,SiCl4的氢化率基本保持不变,甚至会略降低,结果如图8所示。产生这种现象的原因如下:在低压、高温条件下,更容易发生副反应(2)和(5),而主反应的反应进度增大较少,从而导致产物中主要产物由SiHCl3转化为SiCl2。且由图8可以看出:压强越低,产生这种现象的温度范围越广。这是因为在高温时,随着温度的升高,副反应反应(2)和(5)的平衡常数增大,然而增大压强使得这两个反应的平衡向逆向移动,从而在一定程度上抑制了这两个副反应的进行。因此,当压强较大时,产生该现象的温度范围明显缩小。
的增加,SiCl4的氢化率基本保持不变,甚至会略降低,结果如图8所示。产生这种现象的原因如下:在低压、高温条件下,更容易发生副反应(2)和(5),而主反应的反应进度增大较少,从而导致产物中主要产物由SiHCl3转化为SiCl2。且由图8可以看出:压强越低,产生这种现象的温度范围越广。这是因为在高温时,随着温度的升高,副反应反应(2)和(5)的平衡常数增大,然而增大压强使得这两个反应的平衡向逆向移动,从而在一定程度上抑制了这两个副反应的进行。因此,当压强较大时,产生该现象的温度范围明显缩小。
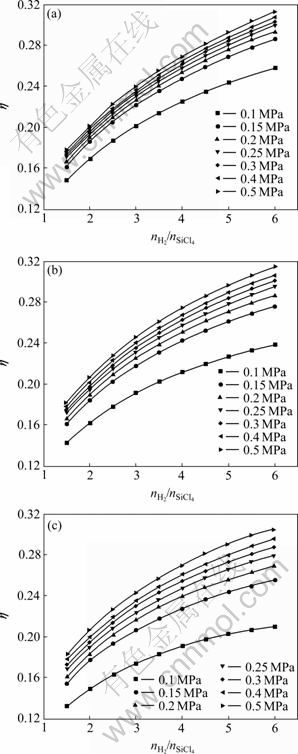
图7 不同温度和压强时SiCl4氢化率随进料配比的变化
Fig.7 Variation of transformation ratio of SiCl4 to SiHCl3 with feeding mole ratio of H2 and SiCl4 (![]() ) at 1 050 ℃(a), 1 250 ℃(b) and 1 450 ℃(c)
) at 1 050 ℃(a), 1 250 ℃(b) and 1 450 ℃(c)
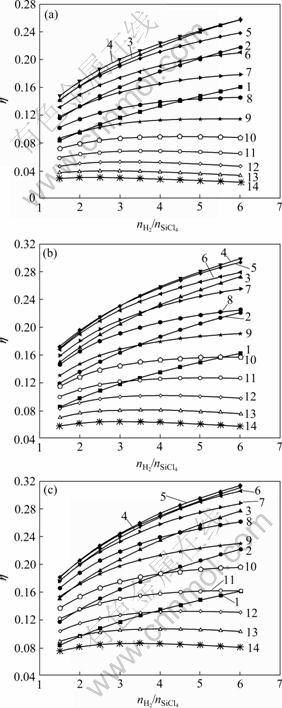
图8 不同压力和温度时SiCl4氢化率随进料配比的变化
Fig.8 Variation of transformation ratio of SiCl4 to SiHCl3 with feeding mole ratio of H2 to SiCl4 (![]() ) at 0.1(a), 0.3(b) and 0.5 MPa (c): 1—700 ℃; 2—800 ℃; 3—900 ℃; 4—1 000 ℃; 5—1 050 ℃; 6—1 100 ℃; 7—1 150 ℃; 8—1 200 ℃; 9—1 250 ℃; 10—1 300 ℃; 11—1 350 ℃; 12—1 400 ℃; 13—1 450 ℃; 14—1 500 ℃
) at 0.1(a), 0.3(b) and 0.5 MPa (c): 1—700 ℃; 2—800 ℃; 3—900 ℃; 4—1 000 ℃; 5—1 050 ℃; 6—1 100 ℃; 7—1 150 ℃; 8—1 200 ℃; 9—1 250 ℃; 10—1 300 ℃; 11—1 350 ℃; 12—1 400 ℃; 13—1 450 ℃; 14—1 500 ℃
通过以上分析,首先确定在不同压强条件下的最佳操作温度:当压强为0.1 MPa时,最佳温度为980 ℃;当压强为0.3 MPa,最佳温度为1 000 ℃;当压强为0.5 MPa时,最佳温度为1 050 ℃;然后通过分析确定了最佳操作压强为0.3 MPa;最后确定最佳进料配比![]() 为4。从而可以确定SiCl4氢化转化为SiHCl3过程的最佳操作条件如下:温度为1 000 ℃,压强为0.3 MPa,进料配比
为4。从而可以确定SiCl4氢化转化为SiHCl3过程的最佳操作条件如下:温度为1 000 ℃,压强为0.3 MPa,进料配比![]() 为4。在此条件下,SiCl4的氢化率为25.78%。与实际生产过程中所选用的操作条件[30](温度为1 000~1 250 ℃;压强为0.2~0.4 MPa;进料配比
为4。在此条件下,SiCl4的氢化率为25.78%。与实际生产过程中所选用的操作条件[30](温度为1 000~1 250 ℃;压强为0.2~0.4 MPa;进料配比![]() 为2~4)一致。而在实际生产中,SiCl4的氢化率不到20%,因此,通过改善操作条件、操作制度以及控制设备等可以进一步提高SiCl4的氢化率,这需要进行进一步的探讨和研究,同时也是一个机遇和挑战。
为2~4)一致。而在实际生产中,SiCl4的氢化率不到20%,因此,通过改善操作条件、操作制度以及控制设备等可以进一步提高SiCl4的氢化率,这需要进行进一步的探讨和研究,同时也是一个机遇和挑战。
3 结论
1) 应用有关热力学数据研究与生产多晶硅的主要工艺即西门子法相关的“Si-Cl-H”三元系的复杂化学反应,研究SiCl4氢化转化为SiHCl3过程中可能发生的15个反应,给出15个反应的![]() —T曲线。由于温度在973~1 773 K范围内,大多数反应的
—T曲线。由于温度在973~1 773 K范围内,大多数反应的![]() 数值都大于0,说明这些反应的平衡常数很小,很难进行。
数值都大于0,说明这些反应的平衡常数很小,很难进行。
2) 确定在SiCl4氢化转化为SiHCl3过程中5个独立反应,并绘出这5个独立反应的![]() —T曲线。高温时,由于副反应的
—T曲线。高温时,由于副反应的![]() 增长很快,SiCl4的氢化率很低;而低温时,主反应的平衡常数又很低,在1 373 K时仅为0.157 1,因此,SiCl4的氢化率低是无法改变的客观事实。
增长很快,SiCl4的氢化率很低;而低温时,主反应的平衡常数又很低,在1 373 K时仅为0.157 1,因此,SiCl4的氢化率低是无法改变的客观事实。
3) 随着温度的升高,SiCl4氢化率先增加后又逐渐减少。温度较高时,SiCl4的氢化率很低,且进料配比(![]() )对SiCl4氢化率几乎没有影响;温度较低时,SiCl4的氢化率也很低,且压强对SiCl4氢化率也几乎没有影响。因此,温度对SiCl4氢化转化为SiHCl3过程非常重要,通过分析确定在0.3 MPa时,最佳操作温度应该控制在1 000 ℃左右。
)对SiCl4氢化率几乎没有影响;温度较低时,SiCl4的氢化率也很低,且压强对SiCl4氢化率也几乎没有影响。因此,温度对SiCl4氢化转化为SiHCl3过程非常重要,通过分析确定在0.3 MPa时,最佳操作温度应该控制在1 000 ℃左右。
4) SiCl4的氢化率随着压强的增大而增大,在0.1~0.3 MPa之间,氢化率增加较快,当压强大于0.3 MPa时,氢化率增加较慢。在实际生产过程中,最佳压强应该控制在0.3 MPa左右。
5) 在SiCl4氢化系统中,过量H2对SiCl4的氢化反应非常重要,随着进料配比![]() 的增大,SiCl4的氢化率增大。当
的增大,SiCl4的氢化率增大。当![]() 在2:1~4:1范围内时,SiCl4的氢化率增大较快;当
在2:1~4:1范围内时,SiCl4的氢化率增大较快;当![]() 大于4:1时,增加较慢。且过分增大进料
大于4:1时,增加较慢。且过分增大进料![]() 的配比,会造成尾气分离困难、生产成本升高等问题,因此,在实际生产中,进料配比
的配比,会造成尾气分离困难、生产成本升高等问题,因此,在实际生产中,进料配比![]() 应该控制在4:1。
应该控制在4:1。
6) 确定SiCl4氢化转化为SiHCl3过程的最佳操作条件如下:温度为1 000 ℃,压强为0.3 MPa,进料配比![]() 为4。在此条件下,SiCl4的氢化率为25.78%,与实际生产过程一致。
为4。在此条件下,SiCl4的氢化率为25.78%,与实际生产过程一致。
REFERENCES
[1] NARAYANAN S, WOHLGEMUTH J. Cost-benefit analysis of high-efficiency cast polycrystalline silicon solar cell sequences [J]. Progress in Photovoltaics, 1994, 2: 121-128.
[2] 马文会, 戴永年, 杨 斌, 刘大春, 王 华. 太阳能级硅制备新技术研究进展[J]. 新材料产业, 2006, 10: 12-16.
MA Wen-hui, DAI Yong-nian, YANG Bin, LIU Da-chun, WANG Hua. Research process on new techniques of solar-grade silicon[J]. New Material Industry, 2006, 10: 12-16.
[3] BALAJI S, DU J, WHIT C M, ERIK B. Multi-scale modeling and control of fluidized beds for the production of solar grade silicon[J]. Powder Technology, 2010, 199(1): 23-31.
[4] MUKASHEV B N, ABDULLIN K A, TAMENDAROV M F, TURMAGAMBETOV T S, BEKETOV B A, PAGE M R, KLINE D M. A metallurgical route to produce upgraded silicon and monosilane[J]. Solar Energy Materials & Solar Cells, 2009, 93(10): 1785-1791.
[5] 马晓东, 张 剑, 李廷举. 冶金法制备太阳能级多晶硅的研究进展[J]. 铸造技术, 2008, 29(9): 1288-1291.
MA Xiao-dong, ZHANG Jian, LI Ting-ju. Research process on metallurgical processing of solar grade multicrystalline silicon[J]. Foundry Tech, 2008, 29(9): 1288-1291.
[6] 罗大伟, 张国梁, 张 剑, 李 军, 李廷举. 冶金法制备太阳能级硅的原理及研究进展[J]. 铸造技术, 2008, 29(12): 1721-1726.
LUO Da-wei, ZHANG Guo-liang, ZHANG Jian, LI Jun, LI ting-ju. Principle and research process on preparation solar grade (SoG) silicon by metallurgical route[J]. Foundry Tech, 2008, 29(12): 1721-1726.
[7] 吕 东, 马文会, 伍继君, 杨 斌, 戴永年. 冶金法制备太阳能级多晶硅新工艺原理及研究进展[J]. 材料导报, 2009, 23(3): 30-33.
L? Dong, MA Wen-hui, WU Ji-jun, YANG Bin, DAI Yong-nian. New process principle and research advances of production of solar grade poly silicon by metallurgical method[J]. Materials Review, 2009, 23(3): 30-33.
[8] 于站良, 马文会, 戴永年, 杨 斌, 魏奎先. 太阳能级硅制备新工艺研究进展[J]. 轻金属, 2006, 3: 43-47.
YU Zhan-liang, MA Wen-hui, DAI Yong-nian, YANG Bin, WEI Kui-xian. Research process for novel techniques of solar grade silicon[J]. Light Metals, 2006, 3: 43-47.
[9] 侯彦青, 谢 刚, 陶东平, 俞小花, 田 林, 杨 妮. 太阳能级多晶硅生产工艺[J]. 材料导报, 2010, 24(7): 31-34.
HOU Yan-qing, XIE Gang, TAO Dong-ping, YU Xiao-hua, TIAN Lin, YANG Ni. Production technology of solar-grade polycrystalline silicon[J]. Materials Review, 2010, 24(7): 31-34.
[10] 张鸣剑, 李润源, 代红云. 太阳能多晶硅制备新技术研发进展[J]. 新材料产业, 2008, 6: 29-34.
ZHANG Ming-jian, LI Run-yuan, DAI Hong-yun. Research process on new techniques of solar grade silicon[J]. New Material Industry, 2008, 6: 29-34.
[11] 汪光裕, 丁国江, 艾 波. 四氯化硅在西门子多晶硅生产流程内部的循环利用[J]. 东方电气评论, 2008, 22(4): 70-72.
WANG Guang-yu, DING Guo-jiang, AI Bo. Circular utilization of silicon tetrachloride in production of polycrystalline silicon by siemens process[J]. Dongfang Electric Review, 2008, 22(4): 70-72.
[12] 龙桂花, 吴 彬, 韩 松, 丘克强. 太阳能级多晶硅生产技术发展现状及展望[J]. 中国有色金属学报, 2008, 18(s1): s387-s392.
LONG Gui-hua, WU Bin, HAN Song, QIU Ke-qiang. Development status and prospect of solar grade silicon production technology[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(s1): s387-s392.
[13] 王季陶, 刘明登. 半导体材料[M]. 北京: 高校出版社, 1990: 112-132.
WANG Ji-tao, LIU Ming-deng. Semiconducting material[M]. Beijing: University Press, 1990: 112-132.
[14] 沈 辉, 曾祖勤. 太阳能光伏发电技术[M]. 北京: 化学工业出版社, 2005: 76-112.
SHEN Hui, ZENG Zu-qin. Photovoltaic technology applied to utilize solar energy[M]. Beijing: Chemical Industry Press, 2005. 76-112.
[15] SIRTL E, HUNT L P, SAWYER D H. High temperature reactions in the silicon-hydrogen-chlorine system[J]. J Electrochem Soc, 1974, 121: 919-924.
[16] DIANA M, MARINO L D. MASTRANTUONO L. Thermodynamic analysis of the reduction of silicon chlorides with hydrogen in the 300-4 500 K temperature range[J]. Rev Int Hautes Temper Refact, 1981, 18: 203-213.
[17] 苗军舰, 陈少纯, 丘克强. 西门子法生产多晶硅的热力学[J]. 无机化学学报, 2007, 23(5): 795-801.
MIAO Jun-jian, CHEN Shao-chun, QIU Ke-qiang. Thermodynamic study on production of the multicrystalline silicon by siemens process[J]. Chinese Journal of Inorganic Chemistry, 2007, 23(5): 795-801.
[18] 苗军舰, 丘克强, 陈少纯. 西门子体系中SiHCl3和SiCl4的热力学行为[J]. 中国有色金属学报, 2008, 18(10): 1937-1944.
MIAO Jun-jian, QIU Ke-qiang, CHEN Shao-chun. Thermodynamic behavior of SiHCl3 and SiCl4 in Siemens system[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(10): 1937-1944.
[19] 印永祥, 任永平. 一种转化四氯化硅制取三氯氢硅和多晶硅的方法: 中国, CN 101254921A[P]. 2008-09-03.
YIN Yong-xiang, REN Yong-ping. Method for preparation of trichlorosilane and polysilicon from silicon tetrachloride by plasma-induced reduction reaction: China, CN 101254921A[P]. 2008-09-03.
[20] 沈祖祥, 毋克力, 严大洲, 刘建军, 汤传斌. 四氯化硅氢化生产三氯氢硅的方法: 中国, CN 1436725 A[P]. 2003-08-20.
SHEN Zu-xiang, WU Ke-li, YAN Da-zhou, LIU Jian-jun, TANG Chuan-bin. Process for preparation of trichlorosilane by hydrogenation of silicon chloride: China, CN 1436725 A[P]. 2003-08-20.
[21] 陈其国, 陈文龙. 三氯氢硅的制造方法: 中国, CN 101759189 A[P]. 2010-06-30.
CHEN Qi-guo, CHEN Wen-long. Manufacture of trichlorosilane from silicon tetrachloride, hydrogen and/or hydrogen chloride, and silicon powder: China, CN 101759189 A[P]. 2010-06-30.
[22] 李祖勇. SiCl4氢化生产SiHCl3的节能降耗循环工艺及系统: 中国专利, CN 101817528 A[P]. 2010-09-01.
LI Zu-yong. Energy-saving circulating process and system for production of SiHCl3 by hydrogenation of SiCl4: China, CN 101817528 A[P]. 2010-09-01.
[23] KIMURA E, OGI K, KURASHIGE T. Manufacture of trichlorosilane from silicon tetrachloride using platinum-group metal catalyst: Japan, JP 62256713 A[P]. 1987-11-09.
[24] BAN V S, GILVERT SL. Chemical process in vapor deposition of siliconⅠ[J]. J Electrochem Soc, 1975, 122: 1382-1389.
[25] HUNT L P, SIRTL E. Thermodynamic analysis of the silicon-hydrogen-chlorine vapor deposition system[J]. J Electrochem Soc, 1972, 119: 1741-1747.
[26] CHARIG J M, JOYCE B A. Epitaxial growth of silicon by hydrogen reduction of SiHCl3 onto silicon substrates[J]. J Electrochem Soc, 1962, 109: 957-962.
[27] KEE R J, RUPLEY F M, MILLER J A. The thermodynamic data for silanes and chlorosilanes[R]. Sandia National Laboratories Report. Sandia: SAND 87-8215B. 1990.
[28] 叶大伦, 胡建华. 使用无机物热力学数据手册[M]. 二版. 北京: 冶金工业出版社, 2002: 187-210.
YE Da-lun, HU Jian-hua. Practical handbook of thermodynamic data for inorganic compounds[M]. 2nd ed. Beijing: Metallurgical Industry Press, 2002: 187-210.
[29] 徐宝琨, 赵慕愚. 复杂化学平衡计算[M]. 长春: 吉林大学出版社, 1990: 8-53.
XU Bao-kun, ZHAO Mu-yu. Computation of the complicated chemical equilibrium[M]. Changchun: Jinlin University Press, 1990: 8-53.
[30] 汪光裕, 丁国江, 艾 波. 四氯化硅在西门子法多晶硅生产流程内部的循环利用[J]. 东方电气评论, 2008, 22: 70-72.
WANG Guang-yu, DING Guo-jiang, AI Bo. Circular utilization of silicon tetrachloride in production of polycrystalline silicon by siemens process[J]. Dongfang Electric Review, 2008, 22: 70-72.
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(50574045)
收稿日期:2010-10-26;修订日期:2011-07-25
通信作者:谢 刚,教授;电话:13987135411;传真:0871-5181011;E-mail: gangxie@sina.com
摘 要:应用有关热力学数据研究了与多晶硅主要生产工艺即西门子法相关的“Si-Cl-H”三元系的复杂化学反应,研究SiCl4氢化转化为SiHCl3过程中可能发生的15个反应,给出15个反应的![]() —T图;并确定5个独立的反应,给出这5个独立反应的
—T图;并确定5个独立的反应,给出这5个独立反应的![]() —T图;高温时主反应(1)的
—T图;高温时主反应(1)的![]() 增长较慢,而反应(2)和(5)的
增长较慢,而反应(2)和(5)的![]() 快速增大,1 373 K时,主反应(1)的
快速增大,1 373 K时,主反应(1)的![]() 较小,为0.157 1。进一步研究温度、压强和进料配比
较小,为0.157 1。进一步研究温度、压强和进料配比![]() 对SiCl4氢化率的影响,并绘制出SiCl4氢化率随这些因素的变化曲线。结果表明:当压强和进料配比一定时,SiCl4的氢化率随温度的升高先增加后降低;增大压强或增加进料配比
对SiCl4氢化率的影响,并绘制出SiCl4氢化率随这些因素的变化曲线。结果表明:当压强和进料配比一定时,SiCl4的氢化率随温度的升高先增加后降低;增大压强或增加进料配比![]() 都会提高SiCl4的氢化率;SiCl4氢化转化为SiHCl3过程的最佳操作条件为温度为1 000 ℃,压强为0.3 MPa,进料配比
都会提高SiCl4的氢化率;SiCl4氢化转化为SiHCl3过程的最佳操作条件为温度为1 000 ℃,压强为0.3 MPa,进料配比![]() 为4,在此条件下,SiCl4的氢化率为25.78%。
为4,在此条件下,SiCl4的氢化率为25.78%。


