
DOI: 10.11817/j.issn.1672-7207.2019.10.001
S0生物还原介导的铁矿物厌氧还原过程研究
夏旭1,周雨行1,夏金兰1, 2,聂珍媛1, 2,王娜1,杨洪英3
(1. 中南大学 资源加工与生物工程学院,湖南 长沙,410083;
2. 中南大学 生物冶金教育部重点实验室,湖南 长沙,410083;
3. 东北大学 冶金学院,辽宁 沈阳,110819)
摘 要:
铁矿和黄钾铁矾,综合利用同步辐射X线吸收近边结构光谱(XANES)、X线衍射(XRD)等方法,结合微生物的生长行为和高铁矿物的还原行为测定,研究碱性厌氧条件下元素硫(S0)生物还原介导的3种不同铁矿物还原过程。研究结果表明:元素硫(S0)可以有效促进奥奈达希瓦氏菌(Shewanella oneidensis MR-1)还原黄钾铁矾和水铁矿,但对赤铁矿作用不明显;硫的K边和铁的L边XANES说明3种铁矿物还原过程中均形成FeS类似物,FeS类似物的形成速率由高到低依次为黄钾铁矾、水铁矿和赤铁矿;高铁矿物还原程度由高到低依次为水铁矿、黄钾铁矾和赤铁矿。
关键词:高铁矿物;元素硫;奥奈达希瓦氏菌;X线吸收近边结构光谱
中图分类号:X52,Q939.97 文献标志码:A 开放科学(资源服务)标识码(OSID)
文章编号:1672-7207(2019)10-2335-07
Study on S0 bio-reduction mediated reduction of iron minerals
XIA Xu1, ZHOU Yuhang1, XIA Jinlan1, 2, NIE Zhenyuan1, 2, WANG Na1, YANG Hongying3
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;
2. Key Lab of Biometallurgy of the Ministry of Education, Central South University, Changsha 410083, China;
3. School of Metallurgy, Northeastern University, Shenyang 110819, China)
Abstract: The dissimilatory reduction of ferric iron minerals (ferrihydrite, hematite and jarosite) under alkaline anaerobic conditions by Shewanella oneidensis was studied by X-ray absorption near edge structure spectroscopy (XANES) and X-ray diffraction (XRD), as well as determination of cell growth and ferric minerals reduction behavior. The results show that, with the addition of elemental sulfur, Shewanella oneidensis MR-1 can effectively promote reduction of jarosite and ferrihydrite, but not obviously for hematite. The S K- and Fe L- edge XANES prove that FeS analogues form during the reduction of the three iron minerals. The formation rates of FeS analogues of jarosite, ferrihydrite and hematite are in descending order from high to low, and the reduction degrees of the ferric minerals of ferrihydrite, jarosite and hematite are also in descending order.
Key words: ferric iron minerals; elemental sulfur; Shewanella oneidensis; X-ray absorption near edge structure (XANES)
微生物厌氧铁还原是重要的生物地球化学过程,在铁的地球化学循环中起着重要的作用,与C,N和S的生物地球化学循环紧密相关,对矿物的形成与转化、重金属的迁移与固定及有机质(如有毒含氯化合物等)的分解与转化等有重要意义[1-3]。在异化铁还原过程中,异化铁还原菌利用有机质做电子供体,将环境中的高铁矿物(水铁矿、针铁矿、赤铁矿、磁铁矿、施氏矿物和黄钾铁矾等)还原,这类反应通常在酸性或中性条件下进行,但在碱性条件下由于缺少质子、耗能较高,导致反应难以发生[4]。FLYNN等[5]发现在碱性条件下通过耦联微生物元素硫(S0)和硫酸盐的还原实现针铁矿的还原。目前针对厌氧酸性和中性条件下,微生物硫酸盐还原耦合的铁还原过程研究较多,但针对厌氧碱性条件下相关研究比较缺乏,有关微生物元素硫或硫酸盐的还原对铁矿物还原过程的介导机制并不明晰[6]。在还原过程中生成形态多样的铁硫中间体,涉及复杂的铁硫形态转化,且易受环境条件如氧气等的影响,用传统的离位分析技术难以进行准确测定。X线吸收近边结构光谱(XANES)是原位检测复杂样品中元素形态的有效手段,广泛应用于地质、环境和生物样品的相关检测。为此,本文以水铁矿、赤铁矿以及黄钾铁矾为对象,利用XANES技术对铁矿物还原过程中Fe/S的形态转化进行表征,研究元素硫介导下典型异化铁还原菌奥奈达希瓦氏菌(Shewanella oneidensis MR-1)对3种高铁矿物的还原过程差异,进而阐明微生物元素硫还原对铁还原过程的介导机制。
1 实验
1.1 材料和方法
1.1.1 细菌、培养基和矿物的准备
本文所用菌株为奥奈达希瓦氏菌(Shewanella oneidensis MR-1),购自中国海洋微生物菌种保藏管理中心(MCCC,菌株编号1A01706)。微生物生长培养基质量浓度如下:NaHCO3为2.5 g/L,NH4Cl为0.25 g/L,KCl为0.1 g/L,NaCl为0.1 g/L,MgSO4·7H2O为0.05 g/L,MgCl2·6H2O为0.2 g/L,KH2PO4为0.04 g/L,酵母膏为1 g/L。在培养基中加入乙酸钠(0.01 mol/L)作为电子供体,用1 mol/L NaOH调节培养基溶液pH至9.0,最后于115 ℃下高温灭菌30 min待用。微生物起始接种浓度约为2×108 个/mL,接种体积为100 mL,于厌氧培养箱中30 ℃静置培养。化学试剂均为分析纯或更高。
实验中使用的水铁矿、赤铁矿和元素硫来自Sinopharm化学试剂公司,黄钾铁矾通过生物合成方法制备[7]:将浓度为3×106 个/mL的Sulfolobus metallicus(由中南大学生物冶金教育部重点实验室提供)接入装有200 mL基本培养基的锥形瓶中(容量为250 mL),并加入30 g/L的FeSO4·7H2O,然后在65 ℃,180 r/min的条件下培养48 h。收集生成的黄钾铁矾,并用蒸馏水清洗7次。采用X线衍射(XRD)技术表征3种铁矿物样品。
1.1.2 细菌培养和铁还原实验
在含有100 mL培养基的厌氧瓶中(容量为250 mL),分别加入水铁矿、赤铁矿和黄钾铁矾至铁的最终浓度为0.1 mol/L;加0.1 g硫,加入S.oneidensis至细菌终浓度为2×108 个/mL,在30 ℃下厌氧培养。在培养过程中,每隔24 h取样,通过显微镜检直接记数法测定细胞浓度,通过邻菲罗啉法的显色原理,利用紫外可见分光光度计测定Fe2+浓度[8-9],并通过拍照记录溶液颜色变化。在采用无菌对照的同时,使用加矿加菌不加硫实验组作为辅助对照。所有实验均设置3次重复。
1.1.3 铁硫形态XANES分析
在上述铁还原实验过程中每隔24 h取出0.5 mL悬浮液,以12 000 r/min的速度离心8 min,沉淀用去离子水清洗3次,真空冷冻干燥,将冻干样品保存在氮气中直至硫的K边和铁的L边XANES分析。硫的K边和铁的L边XANES分析分别在中国高能物理所的北京同步辐射装置4B7A线站(能量范围是2 100 ~6 000 eV)和4B7B线站(能量范围50 ~1 700 eV)完成。4B7A线站的束线来自电流为100 mA,能量为2.5 GeV的存储环。4B7A线站光源经过Si(111)双晶体单色仪过滤,在荧光模式下通过Si (Li)检测器(PGT LS30135)获得数据。硫的K边XANES能量扫描范围为2 460 ~ 2 490 eV,扫描步长0.3 eV。每个样品检测时间约为10 min,并根据ZnSO4光谱中最高共振能量峰(2 480.4 eV)来校准该X线能量。采用全电子产额模式分析铁的L边XANES,能量扫描范围为690 ~ 928 eV,在690 ~ 703 eV范围内,扫描步长为0.5 eV,在703~928 eV范围内,扫描步长为0.1 eV。根据FeSO4最高共振能量峰(702 eV)和Fe2(SO4)3最高共振能量峰(704 eV)来校准该X线能量。所有扫描次数为5次,选取边后已无结构吸收的直线区的2点对XANES谱图进行归一化处理,并且以最大吸收处的能量进行归一校准,所用软件为Origin Pro 8.5和IFEFFIT[10]。
2 结果
2.1 3种矿物样品XRD结果
水铁矿、黄钾铁矾和赤铁矿的XRD结果如图1所示。由图1(a)可见:水铁矿的结晶度很小,XRD图中没有明显的尖峰,2个宽峰分别对应2-线水铁矿的(300)和(110)晶面,说明该水铁矿为典型的2-线水铁矿[11-12]。由图1(b)可见:生物合成的黄钾铁矾XRD结果中衍射特征峰的位置与黄钾铁矾标准衍射图谱(22-0827)所示位置相一致[13],表明生物合成法获得的黄钾铁矾具有较高的结晶度,且纯度很高。由图1(c)可见:赤铁矿的结晶度很好,通过与α-Fe2O3标准衍射图谱(79-1741)相比较,各衍射特征峰吻合度高,且没有出现其他物相的衍射峰,表明赤铁矿的纯度也很高[14]。
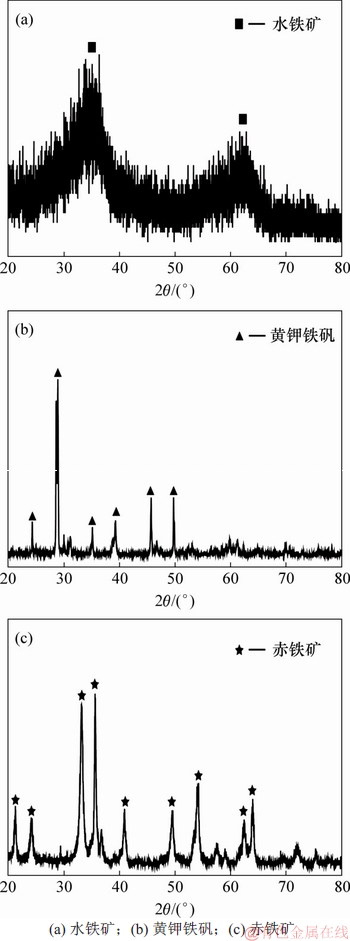
图1 3种高铁矿XRD谱
Fig. 1 XRD patterns of three ferric minerals
2.2 生长曲线、Fe2+质量浓度和溶液颜色变化
在微生物硫还原介导下,铁矿物还原过程中的细菌浓度、Fe2+质量浓度和颜色变化分别如图2~4所示。由图2可见:细菌浓度在第7天达到最大浓度,之后开始下降。由图3可见:在未加元素硫时,3种矿物的生物还原过程中Fe2+质量浓度增长缓慢,其中,黄钾铁矾和水铁矿中Fe2+质量浓度比赤铁矿中的高;在加有元素硫时,溶液中Fe2+质量浓度明显增加,其中黄钾铁矾中Fe2+质量浓度的增长速度明显高于水铁矿和赤铁矿质量浓度的增长速度,在第7天时黄钾铁矾中Fe2+质量浓度提高近6.8倍, 在水铁矿中提高近3.0倍,而在赤铁矿中提高近1.7倍。由图4可见:24 h时,无菌对照组溶液颜色(A7,B7,C7)基本不发生变化,有菌体系(A8,B8,C8和A9,B9,C9)中颜色均发生变化;进一步比较2组有菌体系的颜色变化,发现添加元素硫的实验组(A6,B6,C6和A9,B9,C9)有黑色沉淀生成,且溶液颜色变化比未添加元素硫的对照组(A5,B5,C5和A8,B8,C8)明显加快。
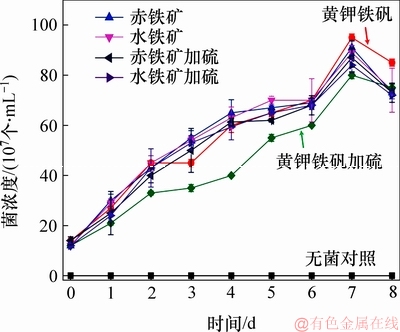
图2 不同实验体系中S. oneidensis的生长曲线
Fig. 2 Growth curves of S. oneidensis in different experiments
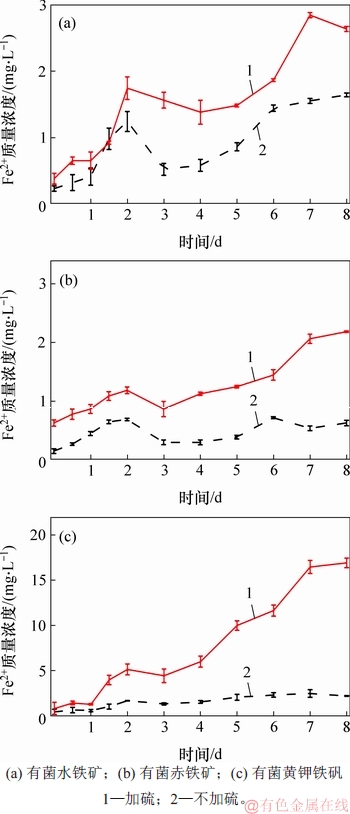
图3 不同实验体系中Fe2+浓度的变化
Fig. 3 Concentration of Fe2+ in different experiments

图4 不同实验体系中溶液颜色变化
Fig. 4 Color variation in different experiments
2.3 铁还原过程中沉淀物的硫的K-边和铁的L-边XANES光谱分析
为进一步研究微生物硫还原介导下铁矿物还原过程中Fe/S形态转化和黑色沉淀物形态,利用硫的K-边和铁的L-边XANES光表征不同铁矿物还原过程中Fe和S形态。图5所示为不同实验体系中沉积物的硫的K-边XANES图。由图5可见:在加硫的3种矿物实验体系中,均在2 472 eV处出现了较强的元素硫特征吸收峰[15],而2 469 eV处对应的硫化物特征吸收峰[5,16]则表现出较大差异;水铁矿加硫实验组在96 h后出现不断增强的硫化物特征吸收峰;赤铁矿加硫实验组直到192 h时才出现非常微弱的硫化物特征吸收峰,而黄钾铁矾加硫实验组在24 h后开始出现不断增强的硫化物特征吸收峰,并且在2 482.8 eV处一直存在较强的硫酸盐特征吸收峰[15]。这说明黄钾铁矾的铁还原速率最快,但其结构并没有被破坏,而赤铁矿基本没有被还原。为进一步检测硫化物的组成,对沉淀物进行了铁的L-边XANES光谱分析。图6所示为不同实验体系中沉积物的铁的L-边XANES结果。由图6可见:在704 eV和706 eV分别出现Fe2+和Fe3+的L3-边特征吸收峰,但不同实验体系中Fe2+和Fe3+的L3-边吸收峰的强度差别比较大。赤铁矿加硫实验组中Fe2+和Fe3+特征吸收峰的强度基本不变,黄钾铁矾加硫实验组和水铁矿加硫实验组分别在12 h和48 h后Fe2+ L3-边吸收峰越来越高,表明Fe3+逐渐还原为Fe2+,96 h后水铁矿加硫实验组的Fe2+ L3-边吸收峰明显高于黄钾铁矾加硫实验组。进一步说明赤铁矿基本没有发生Fe3+还原,黄钾铁矾的铁还原速度较快,水铁矿的铁还原程度较大,产物均为FeS类似物[17]。
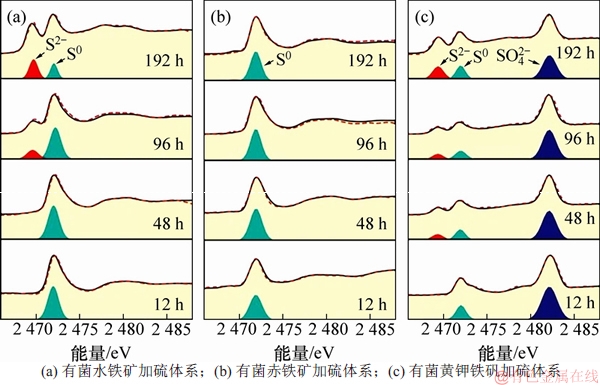
图5 不同实验体系中沉淀物的硫K-边XANES图
Fig. 5 S K-edge XANES spectra of precipitates in different experiments
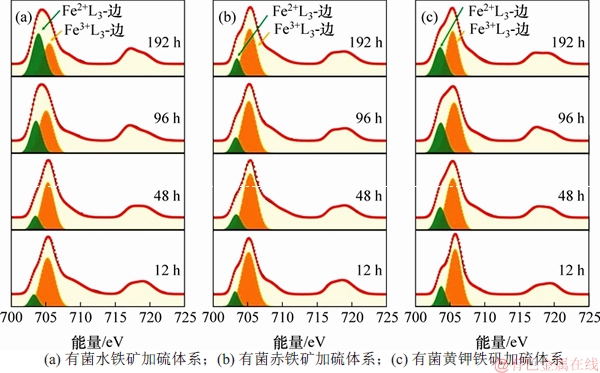
图6 不同实验体系中沉淀物的铁L-边XANES图
Fig. 6 Fe L-edge XANES spectra of precipitates in different experiments
3 讨论
微生物硫还原介导的铁还原过程在自然界中C,N和S等元素循环及有害的重金属迁移与转化中有重要作用[18-19]。水铁矿、赤铁矿和黄钾铁矾是自然界中重要的高铁矿物,图1表明3种铁矿物在结构上有显著差异,赤铁矿和黄钾铁矾具有较高的结晶度,而水铁矿结晶程度较差。以乙酸钠为能源底物,S. oneidensis在含3种铁矿物的培养基生长时,其铁还原过程如式(1)所示。进一步跟踪溶液中Fe2+的质量浓度和颜色变化发现,元素硫的加入可明显提高溶液中Fe2+质量浓度,同时溶液颜色变得更深,结合硫的K-边XANES和铁L-边 XANES结果表明溶液颜色加深的原因是在还原过程中生成了FeS类似物的黑色沉淀。这些过程如式(2)~(4)所示[5]。
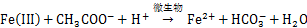
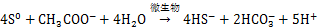
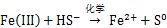
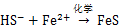
在高铁矿物还原形成黑色沉淀过程中,加硫的黄钾铁矾和水铁矿实验组的变化尤为明显,赤铁矿加硫实验组变化有限,未加硫矿物实验组没有明显变化。这些结果表明:在碱性条件下,S.oneidensis对高铁矿物的还原作用较弱,但这种作用受到元素硫生物还原的促进,其促进机理可用式(3)和(4)解释,即微生物硫还原形成的HS-通过化学作用将高铁矿物还原,形成Fe2+和元素硫(式(3)),Fe2+与HS-形成沉淀(式(4))并与元素硫的生物还原(式(2))相耦合进一步促进矿物的溶解。3种矿物结构的差异导致了元素硫生物还原过程形成的HS-对其促进作用的差异,其中生物合成的黄钾铁矾由于结构较疏松最容易被HS-还原,水铁矿结晶度较低,结构容易被破坏,HS-还原程度最大,赤铁矿结晶度高,结构致密,最难被HS-还原,说明在碱性条件下,元素硫生物还原介导的高铁矿物还原过程与矿物的结构密切相关。值得注意的是,新生成的FeS类矿物具有较强的表面活性,能有效吸附环境中重金属及加速降解芳香类有机污染物[6]。在元素硫生物还原介导下,黄钾铁矾和水铁矿容易被还原,FeS形成速率较快,意味着其在重金属吸附和芳香类有机污染物降解有较高的应用潜力。
4 结论
1) 在碱性条件下,元素硫的加入可以明显提高S. oneidensis对水铁矿、赤铁矿和黄钾铁矾的铁还原效率,并形成FeS类似物黑色沉淀。
2) 硫生物还原介导下的3种高铁矿物还原有明显的差异,黄钾铁矾结构疏松,最容易被还原;水铁矿结晶度较低,结构容易被破坏,还原程度最大;赤铁矿结晶度高,结构致密,最难被还原。
参考文献:
[1] MELTON E D, SWANNER E D, BEHRENS S, et al. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle[J]. Nature Reviews Microbiology, 2014, 12(12): 797-808.
[2] OSORIO H, MANGOLD S, DENIS Y, et al. Anaerobic sulfur metabolism coupled to dissimilatory iron reduction in the extremophile acidithiobacillus ferrooxidans[J]. Applied and Environmental Microbiology, 2013, 79(7): 2172-2181.
[3] SMEATON C M, WALSHE G E, FRYER B J, et al. Reductive dissolution of Tl(I)-jarosite by shewanella putrefaciens: providing new insights into Tl biogeochemistry[J]. Environmental Science & Technology, 2012, 46(20): 11086-11094.
[4] BETHKE C M, SANFORD R A, KIRK M F, et al. The thermodynamic ladder in geomicrobiology[J]. American Journal of Science, 2011, 311(3): 183-210.
[5] FLYNN T M, O'LOUGHLIN E J, MISHRA B, et al. Sulfur-mediated electron shuttling during bacterial iron reduction[J]. Science, 2014, 344(6187): 1039-1042.
[6] 李欣凤. 厌氧条件下铁/硫还原耦合影响五氯酚脱氯消减的作用研究[D]. 杭州: 浙江大学环境与资源学院, 2016: 14-15.
LI Xinfeng. The effect of coupling between Fe(III) and sulfate reduction on pentachlorophenol dechlorinated dissipation under anaerobic condition[D]. Hangzhou: Zhejiang University. College of Environment and Resources, 2016: 14-15.
[7] 杨益. 极端嗜热菌Sulfolobus metallicus介导下硫元素形态与转化研究[D]. 长沙: 中南大学资源加工与生物工程学院,2010: 26-27.
YANG Yi. Study on sulfur speciation and transformation mediated by extreme themophile Sulfolobus metallicus[D]. Changsha: Central South University. School of Minerals Processing and Bioengineering, 2010: 26-27.
[8] 聂珍媛, 刘红昌, 夏金兰, 等. 邻菲啰啉计算光度法同时测定生物浸出样品中Fe(Ⅱ)和Fe(Ⅲ)[J]. 分析测试技术与仪器, 2014, 20(2): 65-72.
NIE Zhenyuan, LIU Hongchang, XIA Jinlan, et al. Simultaneous determination of Fe(II) and Fe(III) in bioleaching samples by computational phenanthroline photospectrometry[J]. Analysis and Testing Technology and Instruments, 2014, 20(2): 65-72.
[9] STOOKEY U L L. Ferrozine-A new spectrophotometric reagent for iron[J]. Analytical Chemistry, 1970, 42(7): 779-781.
[10] RAVEL B, NEWVILLE M. Athena, artemis, hephaestus: data analysis for X-ray absorption spectroscopy using IFEFFIT[J]. Journal of Synchrotron Radiation, 2005, 12(4): 537-541.
[11] GAUTIER J, GROSBOIS C, COURTIN-NOMADE, et al. Transformation of natural As-associated ferrihydrite downstream of a remediated mining site[J]. European Journal of Mineralogy, 2006, 18(2): 187-195.
[12] KUKKADAPU R K, ZACHARA J M, FREDRICKSON J K, et al. Transformation of 2-line ferrihydrite to 6-line ferrihydrite under oxic and anoxic conditions[J]. American Mineralogist, 2003, 88(11/12): 1903-1914.
[13] 谈波. 针铁矿、赤铁矿对铅的吸附及其CD-MUSIC模型拟合[D]. 武汉: 华中农业大学资源与环境学院, 2012: 26-27.
TAN Bo. Lead adsorption on goethite, hematite and its CD-MUSIC model fit[D]. Wuhan: Huazhong Agricultural University. College of Resources and Environment, 2012:26-27.
[14] WANG Hongmei, BIGHAM J M, TUOVINEN O H. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms[J]. Materials Science and Engineering: C, 2006, 26(4): 588-592.
[15] MANCEAU A, NAGY K L. Quantitative analysis of sulfur functional groups in natural organic matter by XANES spectroscopy[J]. Geochimica et Cosmochimica Acta, 2012, 99: 206-223.
[16] EVANS K A, O’NEILL H S C, MAVROGENES J A, et al. XANES evidence for sulphur speciation in Mn-, Ni- and W-bearing silicate melts[J]. Geochimica et Cosmochimica Acta, 2009, 73(22): 6847-6867.
[17] LIU Hongchang, XIA Jinlan, NIE Zhenyuan, et al. Iron L-edge and sulfur K-edge XANES spectroscopy analysis of pyrite leached by Acidianus manzaensis[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(7): 2407-2414.
[18] LUEF B, FAKRA S C, CSENCSITS R, et al. Iron-reducing Bacteria accumulate ferric oxyhydroxide nanoparticle aggregates that May support planktonic growth[J]. The ISME Journal, 2013, 7(2): 338-350.
[19] KAMPMAN N, BURNSIDE N M, SHIPTON Z K, et al. Pulses of carbon dioxide emissions from intracrustal faults following climatic warming[J]. Nature Geoscience, 2012, 5(5): 352-358.
(编辑 秦明阳)
收稿日期: 2018 -10-28; 修回日期: 2018 -12-20
基金项目(Foundation item):国家自然科学基金资助项目(51774342);国家自然科学基金-辽宁联合基金资助项目(U1608254)(Project(51774342) supported by the National Natural Science Foundation of China; Project(U1608254) supported by the Joint Fund of National Natural Science Foundationof China and Liaoning Province)
通信作者:夏金兰,教授,博士生导师,从事资源、能源和环境(耦合)微生物学与生物工程技术研究;E-mail:jlxia@csu.edu.cn
摘要:针对水铁矿、赤铁矿和黄钾铁矾,综合利用同步辐射X线吸收近边结构光谱(XANES)、X线衍射(XRD)等方法,结合微生物的生长行为和高铁矿物的还原行为测定,研究碱性厌氧条件下元素硫(S0)生物还原介导的3种不同铁矿物还原过程。研究结果表明:元素硫(S0)可以有效促进奥奈达希瓦氏菌(Shewanella oneidensis MR-1)还原黄钾铁矾和水铁矿,但对赤铁矿作用不明显;硫的K边和铁的L边XANES说明3种铁矿物还原过程中均形成FeS类似物,FeS类似物的形成速率由高到低依次为黄钾铁矾、水铁矿和赤铁矿;高铁矿物还原程度由高到低依次为水铁矿、黄钾铁矾和赤铁矿。
[6] 李欣凤. 厌氧条件下铁/硫还原耦合影响五氯酚脱氯消减的作用研究[D]. 杭州: 浙江大学环境与资源学院, 2016: 14-15.
[7] 杨益. 极端嗜热菌Sulfolobus metallicus介导下硫元素形态与转化研究[D]. 长沙: 中南大学资源加工与生物工程学院,2010: 26-27.
[8] 聂珍媛, 刘红昌, 夏金兰, 等. 邻菲啰啉计算光度法同时测定生物浸出样品中Fe(Ⅱ)和Fe(Ⅲ)[J]. 分析测试技术与仪器, 2014, 20(2): 65-72.
[13] 谈波. 针铁矿、赤铁矿对铅的吸附及其CD-MUSIC模型拟合[D]. 武汉: 华中农业大学资源与环境学院, 2012: 26-27.


