隐藏嗜酸菌DX1-1和氧化亚铁硫杆菌CMS的
紫外诱变育种及浸矿研究
杨宇,张帅, 徐爱玲, 邹俐宏, 历丽, 邱冠周
(中南大学 资源加工与生物工程学院,生物冶金教育部重点实验室,湖南 长沙,410083)
摘 要:
摘 要:对从江西大兴黄铜矿的酸性矿坑水中分离得到的氧化亚铁硫杆菌 CMS 和隐藏嗜酸菌 DX1-1进行紫外诱变育种及浸矿研究。结果表明:细菌CMS和DX1-1的最适生长温度为30 ℃,最适pH值分别为2.0和3.5;通过紫外诱变获得突变型隐藏嗜酸菌 DX1-1和氧化亚铁硫杆菌 CMS,最佳处理时间为60 s,正突变率分别可达到16.7%和20.0%;诱变后的隐藏嗜酸菌 DX1-1达到稳定期的时间比诱变前缩短20 h,并且具有更大的菌体浓度;诱变后的氧化亚铁硫杆菌 CMS氧化全部亚铁所需时间为48 h,比诱变前菌株缩短11 h;诱变后混合菌浸矿中,用原子吸收光谱法测定浸出30 d后铜离子质量浓度达到2.78 g/L,而紫外诱变前菌株浸出铜离子质量浓度为2.48 g/L;生物浸出30 d后,隐藏嗜酸菌 DX1-1与氧化亚铁硫杆菌 CMS的菌落个数比由1?1变为1?20左右。
关键词:
中图分类号:Q939.97 文献标志码:A 文章编号:1672-7207(2010)02-0393-07
UV-induced mutagenesis and bioleaching of Acidiphilium cryptum and Acidithiobacillus ferrooxidans
YANG Yu, ZHANG Shuai, XU Ai-ling, ZOU Li-hong, LI Li, QIU Guan-zhou
(Key Laboratory of Biometallurgy of Ministry of Education of China, School of Minerals Processing and Bioengineering,
Central South University, Changsha 410083, China)
Abstract: The original strains Acidithiobacillus ferrooxidans CMS and Acidiphilium cryptum DX1-1 isolated from the drainage of some caves rich in chalcopyrite in Dexing in Jiangxi Province of China were studied by UV-induced mutagenesis and bioleaching. The results show that the optimum temperature and pH value are 30 ℃ and 3.5 for Ac. cryptum DX1-1, and 30 ℃ and 2.0 for At. ferrooxidans CMS, respectively. After being treated by UV radiating, the optimum UV radiating time of DX1-1 and CMS is 60 s and their positive mutation rates are 16.7% and 20.0%. Ac. cryptum after mutagenesis reaches stationary phase 20 h ahead of the original strain. The most active UV-mutated strain At. ferrooxidans CMS oxidizes all the ferrous ion in 48 h, which is 11 h less than its original strain. After bioleaching with the mixture of UV-mutated strains of At. ferrooxidans CMS and Ac. cryptum DX1-1, 2.78 g/L of copper can be extracted, which can be measured by atomic absorption spectrometry after 30 d, while 2.48 g/L copper can be extracted with the mixture of the original strains before UV-mutation. After bioleaching for 30 d, the proportion of cell density in the cultures of Ac. cryptum DX1-1 and At. ferrooxidans CMS is changed from 1?1 to approximately 1?20.
Key words: Acidiphilium cryptum; Acidithiobacillus ferrooxidans; UV-induced mutagenesis; bioleaching
近年来,在极端环境下生长的微生物,由于其特殊的生理学和生态学的特征,受到了广泛关注[1],特别是能氧化矿物的微生物,它们能通过生理生化反应利用矿物产生铁离子和硫酸,后者是浸矿反应中的关键因素[2]。这些微生物能够利用铁和硫的氧化产生能量,属于化能自养的细菌或古菌[3]。迄今为止,在硫化矿坑废水中仅得到了几个种属的具有铁和硫氧化能力的细菌[4-5],包括Leptospirillum ferrooxidans, Acidithiobacillus ferrooxidans在内的嗜酸[6]和耐酸自养菌属以及嗜酸异养菌,其中,又以氧化亚铁硫杆菌Acidithiobacillus ferrooxidans(At. ferrooxidans)的氧化能力最为突出,在自然界浸出硫化矿中扮演重要角色,被广泛地应用于生物湿法冶金[7-8]。相对而言,铁的还原能力被认为可以加快含铁矿物如黄钾铁矾和针铁矿的溶解。具有这种能力的细菌有中等嗜温异养菌,如隐藏嗜酸菌Acidiphilium spp.,该菌不能氧化二价铁[9]。又如Sulfobacillus spp.,该菌既不能氧化二价铁又不能还原三价铁[10]。所有的Acidiphilium spp.( Ac. cryptum.)都能通过异化作用使三价铁还原成二价铁,区别在于这种能力在一些菌株中是由结构决定的,另一些则是诱导产生的[11]。浸出反应常由上述氧化菌属催化,但是产量较低。原因包括如下3个方面:(1) 生长速率缓慢;(2) 细胞浓度低;(3) 三价铁在氧化过程中被抑制[12]。这些不足亟需在生物浸出过程中得到解决。
诱变育种作为一种有效地提高微生物代谢产物产量的手段得到了广泛应用,紫外线是一种非电离辐射,能使被照射物质的分子或原子中的内层电子提高能级跃迁到能量高的外层轨道(称为激发),导致分子的理化变化。DNA分子上的碱基对强烈吸收紫外线,而且嘧啶比嘌呤敏感100倍。紫外线辐射能引起DNA链的断裂、DNA分子内和分子间的交联、核酸与蛋白质的交联,以及胞嘧啶和尿嘧啶的水合作用等,但最主要的则是形成嘧啶二聚体,它会阻碍双链的解链和复制,阻碍碱基的正常配对,从而导致基因突变。它的遗传效应主要是引起GC→AT 的转换或移码突 变[12]。在At. ferrooxidans的DNA中,AT碱基的含量为46%~47%[13],而Ac. cryptum中AT碱基的含量为37%~40%,可能形成胸腺嘧啶二聚体,从而容易诱导产生突变。
1 材料和方法
1.1 培养基和菌种
本试验所用原始菌株At. ferrooxidans CMS (DQO062118)和 Ac.cryptum DX1-1(DQ529311)由江西德兴铜矿的酸性矿坑废水(AMD)中分离得到[14]。在自然环境中,生长pH=2.0,温度为21 ℃,细菌密度为6×109个/L,二价铜离子的质量浓度为 0.1 g/L。表明这2株菌具有氧化含铜硫化矿的能力,并具有铜离子耐受能力。
9K基础培养基成分(质量浓度)如下:(NH4)2SO4 3 g/L, KCl 0.1 g/L, K2HPO4 0.5 g/L,MgSO4·7H2O 0.5 g/L,Ca(NO3)2 0.01 g/L。
CMS所用9K发酵培养基初始pH值为2.0 并加入4.5% FeSO4作为能源。
DX1-1所用9K发酵培养基初始pH值为3.0,并加入1.5%葡萄糖作为能源。
9K固体培养基为9K发酵培养基+1%琼脂粉,pH=3.5~4.5。
1.2 活菌计数
连续稀释培养基,在适宜菌体浓度下通过血细胞计数板进行镜检计数。
1.3 隐藏嗜酸菌DX1-1和氧化亚铁硫杆菌CMS的紫外诱变
菌株在发酵培养基里扩大培养,收集对数生长期的菌体,洗涤,用无菌水制备成菌悬液,菌体密度N为107~108个/mL。取10 mL菌悬液放入9 cm平皿中,经磁力搅拌后置于15 W 紫外灯下30 cm处进行照射,照射时间分别为30, 60, 120, 180和240 s,设立平行对照组。各取1 mL溶液稀释,涂9K平板计算致死率。另取1 mL溶液接种到添加了0.3% LiCl的9K发酵培养基。LiCl的作用是为了增强诱变效果。在4 ℃避光保藏12 h后,在30 ℃避光培养36 h。Ac. cryptum DX1-1的正突变率由传代时间决定,At. ferrooxidans CMS的正突变率由亚铁离子氧化率决定。At. ferrooxidans CMS的亚铁离子氧化率通过在250 mL锥形瓶里加入100 mL 9K基础培养基+30 g/L FeSO4·7H2O (6.08 g/L Fe2+),在30 ℃,pH=2.0条件下培养测定。在初始阶段,每10 h取样检测Fe2+质量浓度;在中后期,每3 h取样检测Fe2+质量浓度。
1.4 矿样
试验所采用的矿样使用前经过粉碎并用丙酮和乙醇洗涤[15]。矿样成分(质量分数)为:CuFeS2 60.8%,FeS2 20.7 %,CaCO3 8.4%,SiO2 4.6%。
1.5 生物浸出试验
在250 mL锥形瓶里加入100 mL含硫化矿的 9K基础培养基(在硫化矿浸出试验中不加入亚铁),矿含量为5%[16]。通过离心收集细菌,用硫酸调至pH=2.0的蒸馏水洗涤2次,再用9K基础培养基悬浮,不加入能量物质,试验温度为30 ℃,初始pH=2.5。设计6个试验组,每组做3个平行试验:(1) 培养基中接种诱变后Ac. cryptum DX1-1;(2) 培养基中接种诱变前At. ferrooxidans CMS;(3) 培养基中接种诱变后At. ferrooxidans CMS;(4) 将诱变前2株菌按数量比1?1混合接种;(5) 将诱变后2株菌按数量比1?1混合接种;(6) 对照组(不接菌)。每种菌的接种量为1 mL,菌体密度为1×107个/mL左右, 同时调节摇瓶内浸出环境。
1.6 分析方法
水样的物化性质分析由中南大学分析检验中心测定,金属离子用原子吸收光谱法测定,pH值由pH计(pHs-25)测定,铜离子在30 d内的浸出量通过原子吸收光谱法测定,亚铁离子的氧化率通过重铬酸钾化学滴定法测定,致死率通过平板计数法测定,Ac. cryptum DX1-1 和At. ferrooxidans CMS的正突变率分别由传代时间和亚铁离子的氧化率决定。
1.7 生物浸矿后期浸出液的微生物群落组成分析
1.7.1 DNA的提取和纯化
将试验样品浸出液通过孔径为0.2 ?m的尼龙过滤器过滤收集细菌。DNA 提取使用EZ-10 Spin Column Genomic DNA Isolation Kit (Bio Basic Inc) 试剂盒,纯化使用 Wizard DNA Clean-Up Kit (Promega)试剂盒。
1.7.2 扩增16S rRNA
采用2个引物扩增16S rRNA基因片断,上游引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′);下游引物为1492R(5′-GGTTACCTTGTTACGACTT-3′)。通过低熔点琼脂糖凝胶电泳观察PCR结果,使用Wizard DNA Clean-Up Kit (Promega)试剂盒回收目的片断。将16S rRNA基因片断连接到PCR2.1 TOPO载体上,转化到E. coli TOP10F感受态细胞内(Invitrogen)。转化后重组菌涂LB琼脂平板37 ℃过夜培养,LB琼脂平板加入氨苄青霉素、X-gal和IPTG,通过蓝白筛选,随机挑取60个白色菌落,使用载体引物M13F(5′-GTAAAACGACGGCCAGTG-3′)和M13R(5′- GGAAACAGCTATGACCATG-3′),将携带重组质粒的细菌破壁,进行菌落PCR扩增。
1.7.3 限制性片断长度多态性分析(ARDRA)
16S rRNA PCR扩增产物经HindI和MspI (Fermentas) 37 ℃酶切过夜,3.0%琼脂糖凝胶电泳分离后,在紫外光下观察ARDRA结果,与文献[17]中进行比较分析。
2 结果与讨论
2.1 酸性矿坑废水的理化分析
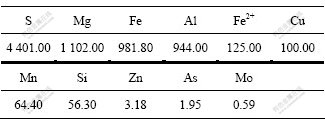
酸性矿坑废水成分如表1所示。从表1可见:硫的质量浓度为4 401.00 mg/L,已经被证实可以作为Ac. cryptum DX1-1的能源物质[15];Fe3+具有同样功效,这也是Ac. cryptum DX1-1可以促进生物浸出的主要原因。采集AMD样品时,pH=2.0,温度为21 ℃。
表1 酸性矿坑水成分分析
Table 1 Composition of AMD ρ/(mg?L-1)
2.2 细菌的生理生化特征
pH值和温度对Ac. cryptum DX1-1生长的影响如图1所示,可见:最适pH=3.5,最适生长温度为30 ℃。pH和温度对At. ferrooxidans CMS生长的影响如图2所示,可见:最适pH=2.0,最适生长温度为30 ℃。由于2种菌有不同的最适pH值以及At. ferrooxidans CMS在浸矿中起主要作用,所以,在浸矿试验中取pH=2.5。
2.3 紫外诱变结果
2.3.1 Ac. cryptum DX1-1的紫外诱变结果
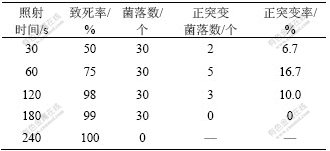
Ac. cryptum DX1-1的致死率和正突变率如表2所示。从表2可见:致死率与照射时间成正比,以细菌在稳定期具有比原始菌株更大的菌体密度为正突变指标。60 s时的致死率为75%,正突变率为16.7%,为最佳诱变时间。从正突变菌株中选取传代时间最短的菌体用于浸出试验。
Ac. cryptum DX1-1诱变前和诱变后的生长曲线如图3所示。可见:诱变后正突变菌株达到稳定期的时间为80 h,比原始菌株提前了20 h,菌体密度也由原来的109个/mL上升到1010个/mL。

图1 pH值和温度对Ac. cryptum DX1-1生长的影响
Fig.1 Effects of pH and temperature on growth of strain Ac. cryptum DX1-1
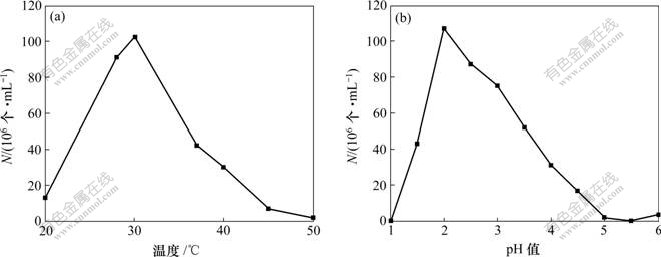
图2 pH值和温度对At. ferrooxidans CMS生长的影响
Fig.2 Effects of pH and temperature on growth of strain At. ferrooxidans CMS
表2 紫外诱变对Ac. cryptum DX1-1的影响
Table 2 Effect of UV-induced mutagenesis on Ac. cryptum DX1-1
2.3.2 At. ferrooxidans CMS的紫外诱变效果
At. ferrooxidans CMS的致死率和正突变率如表3所示。从表3可见:At. ferrooxidans CMS的致死率与照射时间成正比,以细菌具有比原始出发菌更高的亚铁氧化率为正突变指标,60 s时的致死率为73%,正突变率为20.0%,因此,60 s为最佳诱变时间。
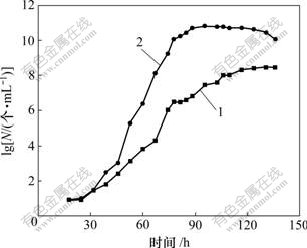
1—诱变前;2—诱变后
图3 Ac. cryptum DX1-1诱变前和诱变后的生长曲线
Fig.3 Growth curves of Ac. cryptum DX1-1 before and after UV-induced mutagenesis
表3 紫外诱变对At. ferrooxidans CMS的影响
Table 3 Effect of UV-induced mutagenesis on
At. ferrooxidans CMS

从正突变菌株中选取氧化亚铁能力最强的菌株用于浸出试验。At. ferrooxidans CMS诱变前后的亚铁氧化率曲线如图4所示。可见:诱变后的正突变菌株氧化全部亚铁所需时间为48 h,较诱变前菌株缩短了 11 h。
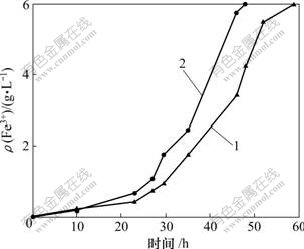
1—诱变前;2—诱变后
图4 At. ferrooxidans CMS诱变前后的亚铁氧化率
Fig.4 Fe2+ oxidation rates of strain At. ferrooxidans CMS before and after UV-induced mutagenesis
最佳的紫外照射时间取决于细菌自身的特性及基因的特异性,试验表明:对于At. ferrooxidans CMS 和 Ac. cryptum DX1-1,采用低剂量的紫外诱变更为适合。因为中高剂量紫外诱变会造成大量基因严重损伤,这些基因的功能得不到及时修复就会导致负突变产 生。尤其在低温避光条件下,修复酶的活性受到限制,细菌的繁殖速度同样受到了抑制,使得突变菌被分离和纯化。
2.4 生物浸出试验
黄铜矿作为酸溶性金属硫化矿,易与三价铁发生亲核反应而被溶解[18-21]。三价铁氧化黄铜矿在溶液中生成铜离子、二价铁离子和元素硫,反应方程式如下:
![]()
(1)
At. ferrooxidans能够氧化在浸矿过程中产生的亚铁离子,反应式如下
![]() (2)
(2)
At. ferrooxidans能够将上述过程中产生的硫氧化,反应式如下:
![]() (3)
(3)
另外,在生物浸出过程中,也对电势敏感,黄铜矿在硫酸溶液中的动力学原理如下:
![]() (4)
(4)
硫在化学浸出过程中(式(1))形成,又在生物浸出过程(式(3))中被氧化。
从以上反应中不难看出:At. ferrooxidans有利于反应的持续进行。在生物浸出的初始阶段,需要向摇瓶内加入硫酸使pH值维持在 2.5左右,提供所需的酸性环境;6 d以后,由于硫的氧化以及三价铁水解成Fe(OH)2+和 ![]() [22],pH值会不断下降。
[22],pH值会不断下降。
在生物浸出过程中,会形成黄钾铁矾和硫的混合物,作为副产物在矿物表面形成一个层状结构,阻碍黄铜矿的溶解[23]。Acidiphilium能在很大程度上降低Fe3+-(氢)氧化物包括黄钾铁矾、铁矾、无定型氢氧化铁和混合Fe2+/Fe3+磁铁矿的形成[11]。Acidiphilium的加入溶解了矿物表面致密的层状结构,有利于铜离子的持续浸出。
选用Ac. cryptum DX1-1和 At. ferrooxidans CMS浸出黄铜矿,结果如图5所示。可见:在整个浸出过程中,铜离子的浸出质量浓度持续上升,在前15 d,铜离子的浸出质量浓度快速增大,在16~30 d,质量浓度增大速度减慢;前15 d是生物浸出铜的主要阶段,铜离子质量浓度大幅度上升,同时也产生了大量的黄钾铁矾和硫的混合物,阻碍了黄铜矿的溶解,因此,15 d后,铜离子的浸出趋于缓慢。接种了诱变后的Ac. cryptum DX1-1的浸出体系中,30 d后铜离子的质量浓度为0.52 g/L。接种了诱变前的At. ferrooxidans CMS的浸出体系中,30 d后铜离子的质量浓度为1.82 g/L,诱变后的体系中为1.89 g/L。接种了诱变前的At. ferrooxidans CMS和Ac. cryptum DX1-1(数量比为1?1)的浸出体系中,浸出30 d后铜离子的质量浓度为2.48 g/L,诱变后的混合体系中,30 d后铜离子的质量浓度达到2.78 g/L。紫外诱变育种有助于提高At. ferrooxidans的亚铁氧化活性,有利于生物浸出。
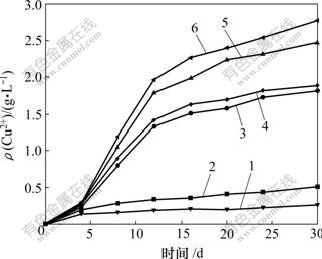
1—对照组;2—诱变后Ac. cryptum DX1-1浸出体系;
3—诱变前At. ferrooxidans CMS浸出体系;
4—诱变后At. ferrooxidans CMS浸出体系;
5—诱变前At. ferrooxidans CMS和Ac. cryptum DX1-1(1?1)浸出体系;6—诱变后At. ferrooxidans CMS和Ac. cryptum DX1-1(1?1)浸出体系
图5 不同浸出体系Cu2+质量浓度
Fig.5 Cu2+ concentrations extracted in different systems
从试验结果可以看出,使用2种菌混合浸矿的效果大于2种菌单独浸矿效果,说明混合浸出是一个相互促进的过程。Ac.cryptum 加快了还原溶解黄钾铁矾和针铁矿,并且消耗了抑制At. ferrooxidans生长的有机化合物,促进了At. ferrooxidans的浸矿过程。由于Ac. cryptum不能氧化亚铁[24],所以,它单独浸矿的效果最差。
2.5 生物浸出后浸出液内生物群落结构分析
在生物浸出反应的初始阶段,Ac. cryptum DX1-1和At. ferrooxidans CMS具有相同的细胞浓度。浸出30 d后,在接种了诱变前混合菌的浸矿体系中,经过限制性片断长度多态性(ARDRA)分析,浸出液中Ac. cryptum DX1-1和At. ferrooxidans CMS的数量比约为1?20,在相同条件下,接种了诱变后混合菌的浸出矿体系中,它们的数量比为1?18。这证明了Ac. cryptum不是浸矿过程的优势菌,只占菌落结构的小部分,协助At. Ferrooxidans起浸矿作用。因此,可以在以后的试验设计中更多考虑有利于At. Ferrooxidans浸矿的因素,并在浸出体系中接种少量的Ac. cryptum。
3 结论
(1) 试验中所选用的Ac. cryptum DX1-1 和 At. ferrooxidans CMS的最适生长温度均为30 ℃,最适pH值分别为3.5和2.0。
(2) 紫外诱变Ac. cryptum DX1-1和At. ferrooxidans CMS最佳时间为60 s,正突变率分别达到16.7%和20.0%。诱变后的Ac. cryptum DX1-1达到稳定期的时间比诱变前缩短了20 h,并且具有更大的菌体浓度。诱变后的At. ferrooxidans CMS较诱变前具有更强的氧化亚铁能力,将氧化全部亚铁所需时间缩短了11 h。
(3) 诱变后的At. ferrooxidans CMS 和Ac. cryptum DX1-1(数量比为1?1)混合浸矿,30 d后铜离子质量浓度达到2.78g/L,优于At. ferrooxidans CMS单独浸矿或诱变前混合菌的浸矿效果。Ac. cryptum单独浸矿的效果最差。
(4) 浸出30 d后,Ac. cryptum DX1-1和At. ferrooxidans CMS的数量比由1?1变为1?20左右,为以后的生物浸矿试验设计提供了科学依据。
参考文献:
[1] 张成桂, 夏金兰, 邱冠周, 等. 嗜酸氧化亚铁硫杆菌亚铁氧化系统研究进展[J]. 中国有色金属学报, 2007, 16(7): 1239-1249.
ZHANG Cheng-gui, XIA Jin-lan, QIU Guan-zhou, et al. Progress in research on Fe2+ oxidation system of Acidithiobacillus ferrooxidans[J]. Transactions of Nonferrous Metals Society of China, 2007, 16(7): 1239-1249.
[2] YIN Hua-qun, QIU Guan-zhou, WANG Dian-zuo, et al. Comparison of microbial communities in three different mine drainages and their efficiency of bioleaching to the low grade of chalcopyrite[J]. Journal of Central South University of Technology, 2007, 14(4): 460-466.
[3] Rawling D E. Heavy metalmining using microbes[J]. Annual Review Microbiology, 2002, 56: 65-91.
[4] Watling H R. The bioleaching of sulphide minerals with emphasis on copper sulphides: A review[J]. Hydrometallurgy, 2006, 84(1/2): 81-108.
[5] Johnson D B, Halberg K B. The microbiology of acidic mine waters[J]. Research in Microbiology, 2003, 154(7): 466-473.
[6] Kelly D P, Wood A P. Reclassi?cation of some species of Thiobacillus to the newly described genera Acidithiobacillus gen..nov., Hallothiobacillus gen.nov. and Thermithiobacillus gen.nov[J]. Evolution Microbiology, 2000, 50: 511-516.
[7] Rawling D E, Silver S. Mining with microbes[J]. Nature Biotechnology, 1995, 13: 773-778.
[8] Rawling D E. The molecular genetics of Thiobacillus ferrooxidans and other mesophilic, acidophilic, chemolithotrophic iron- or sulfur-oxidizing bacteria[J]. Hydrometallurgy, 2001, 59(2/3): 187-201.
[9] Bridge T A M, Johnson D B. Reductive dissolution of ferric ironminerals by Acidiphilium SJH[J]. Geomicrobiology, 2000, 17(3): 193-206.
[10] Bridge T A M, Johnson D B. Reduction of soluble iron and reductive dissolution of ferric iron-containing minerals by moderately thermophilic iron-oxidizing bacteria[J]. Applied Environmental Microbiology, 1998, 64(6): 2181-2190.
[11] Johnson D B, Bridge T A M. Reduction of ferric iron by acidophilic heterotrophic bacteria: Evidence for constitutive and inducible enzyme systems in Acidiphilium spp[J]. Applied Microbiology, 2002, 92(2): 315-321.
[12] 施巧琴, 吴松钢. 工业微生物育种[M]. 福州: 福建科学技术出版社, 1991: 45-48.
SHI Qiao-qin, WU Song-gang. Breeding of industrial microbes[M]. Fuzhou: Fujian Science and Technology Publishing House, 1991: 45-48.
[13] Kulpa C F, Roskey M, Mjoli N. Construction of genomic libraries and induction of iron oxidation in Thiobacillus ferrooxidans[J]. Biotechnology Applied Biochemistry, 1986, 8(4): 330-341.
[14] 杨宇, 徐爱玲. 酸性矿坑水中一株兼性菌及其胞内聚合物的分离及表征[J]. 武汉大学学报, 2007, 53(6): 753-758.
YANG Yu, XU Ai-ling. Isolation and characteriation of a facultative autotrophic bacterial strain and its cellular polymer granules from acid mine drainage[J]. Transaction of Wuhan University, 2007, 53(6): 753-758.
[15] Mcguire M M, Edwards K J, Banfield J F. Kinetics, surface chemistry, and structural evolution of microbially mediated sulfide mineral dissolution[J]. Geochimica et Cosmochimica Acta, 2001, 65(8): 1243-1258.
[16] 杨宇, 万民熙, 彭宏, 等. 一株黄铜矿专属浸出细菌的分离与鉴定[J]. 中南大学学报: 自然科学版, 2008, 38(4): 641-644.
YANG Yu, WAN Min-xi, PENG Hong, et al. Isolation and characterization of bacterium for chalcopyrite bioleaching[J]. Journal of Central South University: Science and Technology, 2008, 38(4): 641-644.
[17] YANG Yu, WAN Min-xi, SHI Wu-yang. Bacterial diversity and community structure in acid mine drainage from Dabaoshan mine, China[J]. Aquatic Microbioal Ecology, 2007, 47(2): 141-151.
[18] Rohwerder T, Gehrke T, Kinzler K, et al. Bioleaching review part A: Progress in bioleaching: fundamentals and mechanisms of bacterial metal sulfide oxidation[J]. Applied Microbiology Biotechnology, 2003, 63(3): 239-248.
[19] Suzuki I. Microbial leaching of metals from sulfide minerals[J]. Biotechnology Advances, 2001, 19(2): 119-132.
[20] Schippers A, Sand W. Bacterial leaching of metal sulfides proceeds by two indirect mechanisms via thiosulfate or via polysulfides and sulfur[J]. Applied Environmental Microbiology, 1999, 65(1): 319-321.
[21] Bevilaqua D, Leite A L L C, Garcia O Jr, et al. Oxidation of chalcopyrite by Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans in shake flasks[J]. Process Biochemistry, 2002, 38(4): 587-592.
[22] Sandstorm A, Petersson S. Bioleaching of a complex sulphide ore with moderate thermophilic and extreme thermophilic microorganism[J]. Hydrometallurgy, 1997, 46(1/2): 181-190.
[23] Stott M B, Watling H R, Franzmann P D. The role of iron-hydroxy precipitates in the passivation of chalcopyrite during bioleaching[J]. Minerals Engineering, 2000, 13(10/11): 1117-1127.
[24] Kirsten K. Microbial cycling of iron and sulfur in acidic coal mining lake sediments water[J]. Air and Soil Pollution, 2003, 3(1): 67-90.


