模板法电化学共沉积Ni-Mo合金纳米线的研究
中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,湖南科技大学化学化工学院 湖南长沙410083,湖南科技大学化学化工学院,湖南湘潭411201,湖南长沙410083,湖南长沙410083,湖南湘潭411201
摘 要:
使用多孔阳极氧化铝模板, 电沉积制备了Ni-Mo合金纳米线。用扫描电镜 (SEM) 和表面能谱 (XPS) 表征沉积物形貌和组成, 用伏安法研究了Ni-Mo合金纳米线的沉积条件及催化性能。结果表明, Ni-Mo合金纳米线的直径在2030 nm之间。Ni-Mo共沉积的伏安图上在-1.4 V (vs Ag/AgCl) 左右出现一个扩散电流平台。光电子能谱 (XPS) 表明, Ni-Mo合金纳米线的共沉积电位出现在-1.4 V以后, 大于这个电位钼以低价氧化物存在。Mo-Ni离子浓度比大于2时扩散电流平台消失。柠檬酸盐浓度达到23倍镍盐浓度时, 扩散电流平台趋于稳定。在较优条件下电沉积的Ni-Mo合金纳米线显示较高的析氢催化活性。
关键词:
多孔阳极氧化铝模板;Ni-Mo合金纳米线;诱导共沉积;析氢反应;
中图分类号: TB383.1
收稿日期:2006-08-01
基金:国家自然科学基金 (20475065) 资助项目;
Codeposition of Ni-Mo Alloy Nanowires in Porous Anodic Alumina Templates
Abstract:
Ni-Mo alloy nanowires were prepared using porous anodic alumina (PAA) as templates and were characterized by SEM and XPS.Voltammetry was performed in order to determine the optimum conditions for codeposition of Ni-Mo alloy nanowires.SEM micrographs revealed that the diameter of the Ni-Mo alloy nanowires was about 20~30 nm.Voltammogram of the Ni-Mo alloy codeposition presented an obvious plateau of a limiting current.XPS indicated that the complete reduction of Mo ion occurred at potentials more negative than-1.4 V, corresponding to the beginning of the plateau of the limiting current.When the concentration ratio of molybdate salt to nickel salt was higher than 2, the plateau of the limiting current disappeared.When the concentration of citrate salt was 2~3 times higher than that of nickel salt, the plateau of the limiting current tended to stability.The as-prepared Ni-Mo alloy nanowires exhibited a better catalytic activity for hydrogen evolution reaction.
Keyword:
porous anodic alumina;Ni-Mo alloy nanowire;induced codeposition;hydrogen evolution reaction;
Received: 2006-08-01
电化学析氢材料有两类:贵金属和镍系材料。 铂是性能优良的析氢材料, 但资源少而且价格昂贵, 限制了它的实际应用。 镍系材料属中等析氢活性材料, 它们析氢性能虽然没有贵金属好, 但价格便宜, 资源丰富, 在工业中广泛应用。 为了开发高析氢催化活性材料, 人们进行了大量的探索研究。 根据Engel Brewer价键理论, 过渡系右边的金属 (Fe, Co, Ni) 同过渡系左边的金属 (W, Mo, La, Ha, Zr) 熔成合金时, 对析氢反应产生协同作用
纳米材料由于具有量子尺寸效应、 小尺寸效应、 表面效应、 界面效应和宏观量子隧道效应, 在光、 电、 磁、 催化等领域展示了广泛的应用前景。 模板法是合成纳米材料的一项有效技术, 通常是用孔径为纳米级的多孔材料作模板, 结合电化学法、 沉淀法、 溶胶-凝胶法和气相沉淀法等技术使物质原子或离子沉淀在模板的孔壁上, 形成所需的纳米结构, 然后移去模板, 得到具有模板规范形貌与尺寸的纳米材料。 多孔阳极氧化铝 (Porous anodic alumina PAA) 具有合成简单, 孔径分布均匀、 有序, 孔深、 孔径大小可调, 广泛用于一维纳米材料的合成
1 实 验
1.1 PAA模板的制备
铝片 (纯度99.95 %) 经500 ℃退火4 h, 丙酮浸泡除油, 1 mol·L-1 NaOH溶液中超声5 min去氧化层后, 在1∶3 (V/V) 的高氯酸乙醇溶液中电化学抛光1 min, 抛光电压15 V。 用蒸馏水洗净后, 在0.3 mol·L-1的硫酸中铝片作阳极, 不锈钢板为阴极, 采用二步阳极氧化法
1.2 电沉积过程
电镀液成分:0.1 mol·L-1 NiSO4·7H2O, Na2MoO4·2H2O, NH4Cl, Na3Cit (柠檬酸钠) 。 溶液的pH值用H2SO4, NaOH调节。 采用恒电位沉积模式, PAA作阴极, 石墨作阳极, Ag/AgCl作参比电极。
1.3 性能测试与表征
沉积了Ni-Mo合金的PAA样品用0.1 mol·L-1 NaOH 溶解氧化铝模板, 露出Ni-Mo合金纳米线, 用Sirion 200场发射扫描电子显微镜观察Ni-Mo合金纳米线的形貌。 用VG ESCALAB MKⅡ表面能谱分析仪测定样品中钼元素的结合能。 测量时先用Ar离子溅射一定深度后再进行XPS测定。 电化学测量采用三电极系统, 工作电极为多孔阳极氧化铝 (PAA) 或nano Ni-Mo/PAA (用硫化硅橡胶将电极背面及侧面密封, 表观面积为0.25 cm2) , 辅助电极为铂片, 参比电极为Ag/AgCl, 在LK98BⅡ微机电化学分析系统上进行。
2 结果与讨论
2.1 Ni-Mo纳米线的形貌表征
图1为去掉部分氧化铝模板后的Ni-Mo合金纳米线形貌图, 纳米线直径为20~30 nm, 与模板孔径相符。 由于纳米线直径较小, 长度较长, 没有模板支撑的纳米线出现倒伏现象。
2.2 电沉积条件讨论
2.2.1 Ni-Mo电化学共沉积的伏安行为
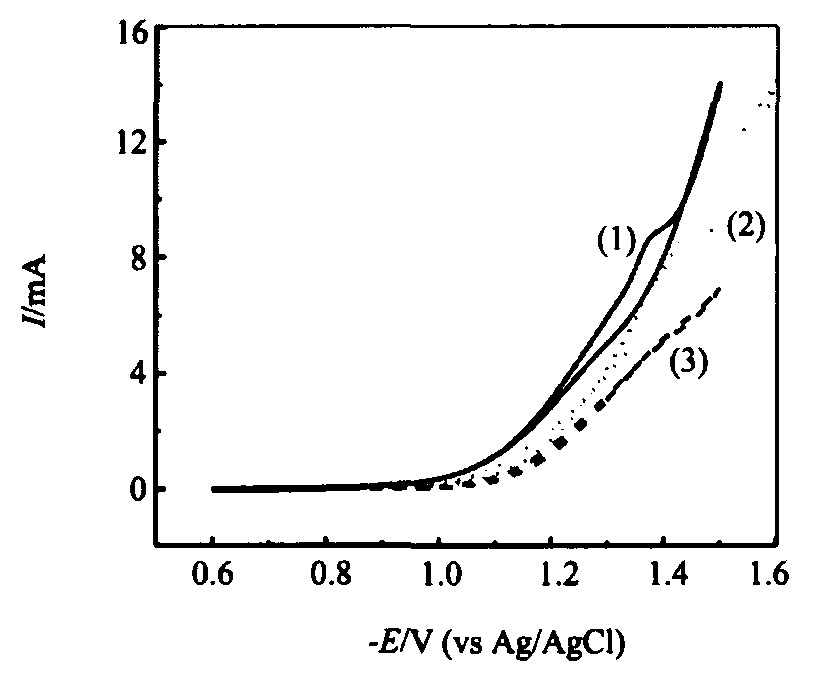
在水溶液中, 单纯的钼离子不可能发生完全电还原生成金属钼, 仅还原成低价氧化物。 然而含铵盐-柠檬酸盐络合剂的溶液中, 在铁族元素 (铁、 钴、 镍) 的诱导下, 钼离子可以与铁族元素离子以合金的形式发生电化学共沉积
2.2.2 沉积电位对合金组成的影响
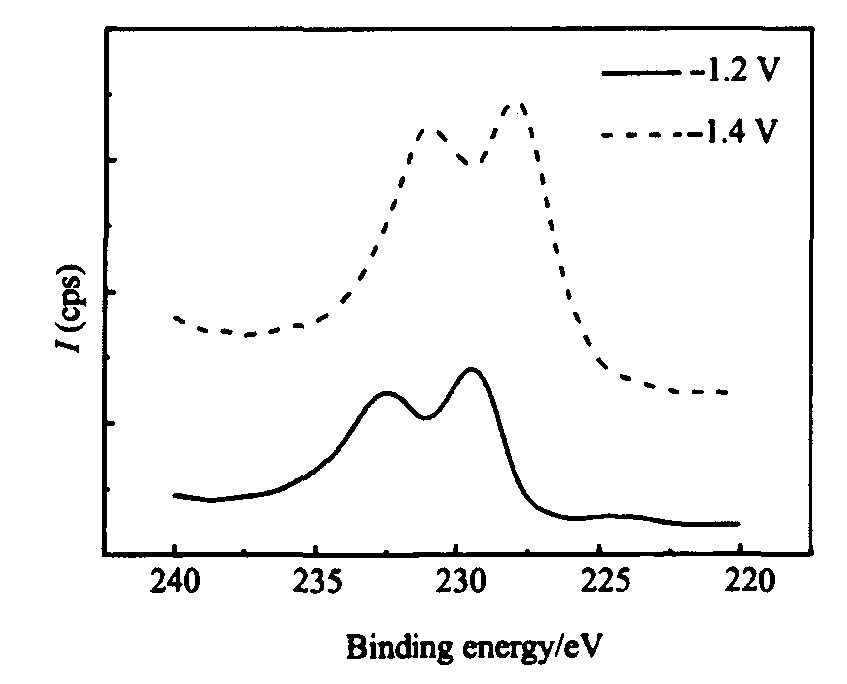
为了确定沉积电位对沉积物中钼的价态的影响, 对不同电位下沉积得到的沉积物进行X射线光电子能谱实验。 样品经氩离子刻蚀2 min, 其XPS 结果如图3。 从该图可知, 在-1.4 V电位下沉积的样品在结合能
图1 Ni-Mo合金纳米线不同倍率下 (a, b) 的表面形貌图 Fig.1 SEM imagines of Ni-Mo alloy nanowires under different magnifications
图2 铵盐-柠檬酸盐电解液镍钼沉积循环伏安图 (含0.1 mol·L-1 NiSO4和0.05 mol·L-1 Na2MoO4 (1) , 0.1 mol·L-1 NiSO4 (2) 和0.05 mol·L-1 Na2MoO4 (3) , 扫描速率: 25 mV·s-1) Fig.2 Cyclic voltammograms obtained in ammonia-citrate electrolyte (Containing 0.1 mol·L-1 NiSO4 and 0.05 mol·L-1 Na2MoO4 (1) , 0.1 mol·L-1 NiSO4 (2) and 0.05 mol·L-1 Na2MoO4 (3) respectively. Potential scan rate: 25 mV·s-1)
为227.96和231.06 eV 处有两个谱峰, 它们被指认为金属钼的3d5/2和3d3/2谱峰
2.2.3 镀液中钼盐浓度对电沉积合金的影响
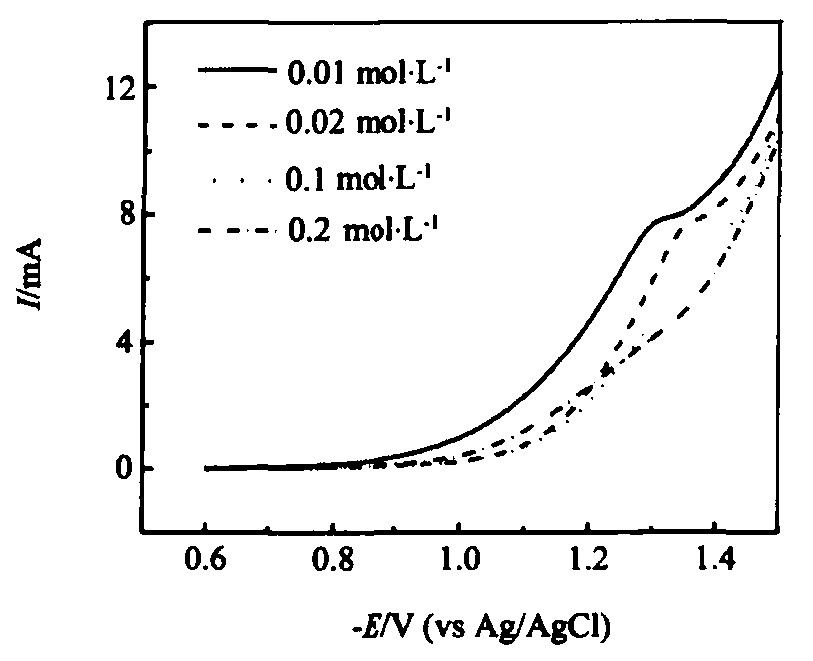
镀液中钼盐浓度会影响合金的组成。 一方面, 钼离子的完全还原受扩散控制, 因此镀液中钼盐浓度影响合金中钼含量; 另一方面, 钼离子还原生成的低价氧化物如果在电极表面累积, 则会直接进入合金, 影响合金的组成, 从而影响材料的析氢催化性能。 图4为在不同钼盐浓度的镀液中电化学共沉积Ni-Mo合金纳米线的线性伏安曲线。 从图中可以看出, 随着镀液中钼盐浓度的增加, 镍、 钼在阴极共沉积的还原电流不但没有增加, 反而有下降的趋势。 当钼盐浓度达到0.2 mol·L-1以后 (2倍于镍盐浓度) , 扩散电流平台消失, 表明钼的完全还原受到抑制。 这可能因为钼盐浓度越高, 钼的不完全还原产物生成速率快, 吸附在电极表面上, 占据了电极表面上的活性位点, 钼离子还原的活性位点减少, 阻碍了钼的完全还原
2.2.4 柠檬酸盐的影响
图5是不同浓度柠檬
图3 不同电位下沉积的Ni-Mo合金纳米线中Mo3d的XPS谱图 Fig.3 XPS spectra of Mo3d in Ni-Mo deposits at different potentials
图4 含0.1 mol·L-1 NiSO4, 0.2 mol·L-1 NH4Cl, , 0.3 mol·L-1 Na3Cit和不同浓度Na2MoO4电解液中 (pH 8.0) 极化曲线 (扫描速率: 25 mV·s-1) Fig.4 Polarization curves in electrolyte of pH 8.0 containing 0.1 mol·L-1 NiSO4, 0.2 mol·L-1 NH4Cl, 0.3 mol·L-1 Na3Cit and different concentrations Na2MoO4 (Potential scan rate: 25 mV·s-1)
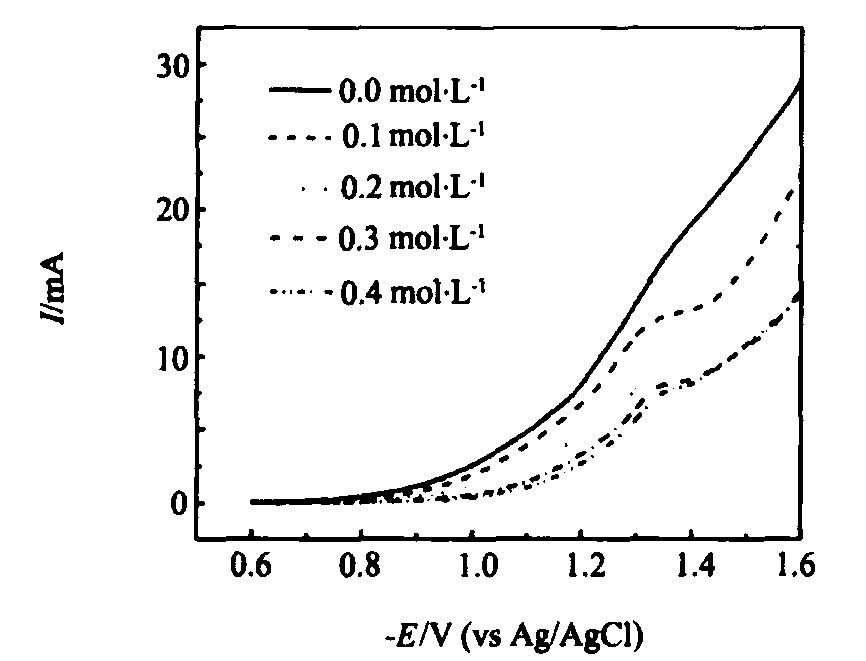
酸盐的镀液中沉积Ni-Mo合金纳米线的极化曲线。 在没有加入柠檬酸盐的溶液中, 伏安曲线上不出现扩散电流平台, 表明钼离子没有完全还原生成金属; 加入0.1 mol·L-1的柠檬酸钠后, 阴极还原电流降低, 并出现扩散电流平台, 说明柠檬酸钠催化了钼离子的完全还原; 还原电流降低的原因是柠檬酸钠络合镍离子后, 使镍离子的还原速率降低; 随着柠檬酸钠浓度的增加, 还原电流进一步下降, 当超过0.3 mol·L-1, 还原电流基本上稳定, 这时镍离子全部与柠檬酸盐络合。 因此Ni-Mo合金共沉积时, 柠檬酸盐是必要的, 浓度为2~3倍镍盐浓度。
图5 含0.1 mol·L-1 NiSO4, 0.04 mol·L-1 Na2MoO4, 0.2 mol·L-1 NH4Cl 和不同浓度Na3Cit电解液中 (pH 8.0) 极化曲线 (扫描速率: 25 mV·s-1) Fig.5 Polarization curves obtained in electrolyte (pH 8.0) containing 0.1 mol·L-1 NiSO4, 0.04 mol·L-1 Na2MoO4, 0.2 mol·L-1 NH4Cl, and different concentrations Na3Cit (Potential scan rate: 25 mV·s-1)
图6 Ni-Mo合金纳米线 (1) 与本体Ni-Mo合金 (2) 析氢极化曲线 Fig.6 Polarization curves of Ni-Mo bulk alloy (1) and Ni-Mo alloy nanowires (2) in 0.2 mol·L-1 K2SO4 solution
2.3 析氢活性比较
为了比较纳米Ni-Mo合金的析氢活性, 以在上述优化条件下 (0.1 mol·L-1 NiSO4, 0.02 mol·L-1 Na2MoO4, 0.3 mol·L-1 Na3Cit, 0.2 mol·L-1 NH4Cl, 酸度控制在pH=8, 沉积电势控制在-1.5 V) 制备的纳米Ni-Mo合金、 Ni-Mo合金 (在相同条件下以金作基体电极电沉积得到) 作电极, 测量极化曲线 (图6) 。 由图可以看出, 在电流为0.1 A时, 纳米Ni-Mo合金的析氢电位比本体Ni-Mo合金正移约210 mV, 表明纳米Ni-Mo合金能有效地降低析氢过电位。
3 结 论
PAA中电沉积Ni-Mo合金纳米线的电位应控制在低于扩散电流平台电位以后 (小于-1.4 V) 。 钼镍离子浓度比、 柠檬酸盐浓度的影响Ni-Mo合金纳米线的共沉积。 在较优条件下电沉积的Ni-Mo合金纳米线是一种析氢活性较高的电催化材料。
参考文献
[1] Brewer L.Bonding and structures of transition metals[J].Sci-ence, 1968, 161:115.
[2] 马洁, 刘顺诚, 江琳才, 蒋雄.纳米晶Ni-Mo复合镀层中钼含量对析氢性能的影响[J].化学学报, 1997, 55 (1) :363.
[7] 杨静, 吴仲达.Ni-Mo合金电极的析氢性能研究[J].稀有金属, 1998, 22 (4) :251.
[13] 黄令, 许书楷, 周绍明, 董浚修.纳米晶镍-钼合金电沉积层的结构与性能[J].应用化学, 1999, 16 (2) :38.