文章编号: 1004-0609(2005)12-2034-06
水热法合成LiFePO4的形貌和反应机理
庄大高, 赵新兵, 曹高劭, 米常焕, 涂 健, 涂江平
(浙江大学 硅材料国家重点实验室, 杭州 310027)
摘 要:
以分析纯的FeSO4、 H3PO4 和LiOH为原料, 用水热合成法得到纯度高、 结晶好的纳米LiFePO4。 X射线衍射和SEM分析结果表明, 当实验温度为120~150℃, 时间为5~15h时, 随反应温度的提高和反应时间的延长, LiFePO4从不规则的纳米颗粒团聚体逐渐生长为厚200nm、 长800nm左右的规则矩形薄片。 研究发现, 在合成过程中, 首先合成中间产物Li3PO4, 然后与Fe2+反应形成LiFePO4。 水热合成产物经550℃聚丙烯裂解碳包覆处理后, 以0.05C充放电, 可逆电容量达到163mA·h·g-1, 以0.5C充放电, 可逆电容量达到144mA·h·g-1。
关键词: 锂离子电池; 正极材料; 水热合成; 形貌 中图分类号: O646.54; TM911.1
文献标识码: A
Morphology and reaction mechanism of
LiFePO4 prepared by hydrothermal synthesis
ZHUANG Da-gao, ZHAO Xin-bing, CAO Gao-shao,
MI Chang-huan, TU Jian, TU Jiang-ping
(State Key Laboratory of Silicon Materials, Zhejiang University, Hangzhou 310027, China)
Abstract: High-pure and well-crystalline nano-LiFePO4 was prepared by hydrothermal method using analytically pure FeSO4, H3PO4 and LiOH as the precursors. The results through XRD and SEM analyses show that, with the increase of the reaction temperature from 120℃ to 150℃ and time from 5h to 15h, the synthesized LiFePO4 particles grow from the irregular congeries of nano-crystals to the rectangular slabs with thickness of about 200nm and side-length of about 800nm. The intermediate product Li3PO4 is first synthesized during the reaction, then it reacts with Fe2+ to form the high-pure LiFePO4. A reversible capacity of 163mA·h·g-1 at 0.05C or 144mA·h·g-1 at 0.5C has been obtained after the carbon coated with LiFePO4 is prepared by decomposing polypropylene with the LiFePO4 powders at 550℃.
Key words: lithium-ion battery; cathode material; hydrothermal synthesis; morphology
绿色环保锂离子二次电池作为新一代化学电源正越来越显示出发展前途, 应用领域也不断扩大。 目前, 商品化锂离子电池的正极材料主要为LiCoO2。 由于Co在自然界中含量极低, 价格昂贵, 其未来的发展受到制约。 因此, 寻找电性能优异。 价格低廉的正极材料是一项非常迫切的任务。 由于LiFePO4具有价格低廉、 安全性能和热稳定性能好、 无污染和质量比能量高等优点, 成为最有潜力的锂离子正极材料之一。 但由于LiFePO4的电导率很低, 因此一般采用包覆和合金化。 目前, 国内外对此已进行了广泛地研究, 但大多集中在高温固相合成上[1-12]。 化学合成方法具有易于合成纳米级材料[13]、 便于合金化和表面修饰等优点[14]。 Yang等[15]最早用水热法合成LiFePO4, 但合成的产物不纯, 需通过离心机分离才能得到纯度高的LiFePO4粉体, 且颗粒尺寸为3μm量级。 Tajimia等[13]在反应中加入聚乙二醇, 增加反应溶液的粘度, 作为晶体生长抑制剂, 得到的颗粒为500~1500nm的LiFePO4。 本文作者采用一种新的、 比较简洁的水热合成LiFePO4方法, 通过控制反应温度和时间得到不同尺寸、 不同形貌的LiFePO4晶体。
1 实验
将分析纯原料FeSO4、 H3PO4和LiOH按摩尔比1∶1∶3配料。 将LiOH溶解于去离子水中以后, 先加入H3PO4, 并搅拌使其充分反应。 然后, 再加入FeSO4, 搅拌1min后, 放入密封反应釜中。 在不同实验温度下保温一定时间后进行水热合成反应。 自然冷却后, 收集反应釜中的固体粉末, 经多次洗涤过滤后, 于120℃下真空干燥1h, 得到相应产物。 根据水热反应温度和时间的不同, 本文实验的试样编号如表1所示。 按水热合成LiFePO4的设计质量计算, 各试样的转化率都在95%以上。
表1 试样的水热合成温度和时间
Table 1 Synthesis temperature and time of samples

水热合成粉末的X射线衍射分析采用Riguku D/MAX-2550PC型多晶X射线衍射仪进行, 使用Cu靶Kα射线(λ=0.15406nm), Ni滤波片, 管流为20mA, 管压为40kV, 扫描范围为10°~80°。 采用FEI-Siron型场发射扫描电子显微镜(FESEM)观察粉末试样的微观形貌。
电化学测试采用锂阳极模型电池进行, 组成为LiFePO4、 乙炔黑与聚偏氟乙烯(PVDF)的质量比为75∶15∶10, 对电极为金属锂片; 隔膜为聚丙烯微孔膜(Celgard-2300); 电解液为1mol/L LiPF6/碳酸乙烯酯(EC)+二甲基碳酸酯(DMC), EC与DMC体积比为1∶1。 电池装配在充满氩气的干燥手套箱中进行。 采用PCBT-138-32D多通道电池程控测试仪进行恒流充放电测试, 电压为2.75~4.20V(vs Li+/Li), 充放电倍率分别为0.05、 0.1和0.5C(C为LiFePO4的理论比容量170mA·h·g-1与LiFePO4质量乘积)。 充放电制度为以上述电流充电至4.2V, 改恒压充电, 至电流下降至1%C, 休眠5min, 以上述电流放电, 至电压为2.75V。
2 结果与讨论
图1所示为反应温度为120、 140和150℃, 反应时间均为15h所得产物的X射线衍射谱。 对照JCPDF 83-2092标准, 图1中的曲线都可标定为正交晶系Pnma空间群的橄榄石结构LiFePO4。 根据150℃, 15h水热反应产物的X射线衍射数据, 计算得到的晶胞参数为a=1.0337nm, b=0.6nm, c=0.4696nm, 晶胞体积V=0.291nm3, 与文献[16]的相吻合。 衍射峰强度随温度的升高而略为增强。
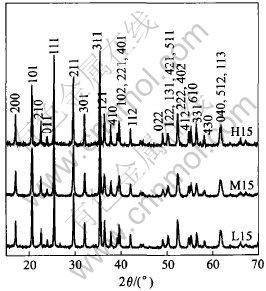
图1 经120℃(L15)、 140℃(M15)和150℃(H15)15h水热合成LiFePO4的X射线衍射谱
Fig.1 XRD patterns of LiFePO4 synthesized for 15h at 120℃ (L15), 140℃ (M15) and 150℃ (H15)
图2所示为相应各试样的FESEM照片。 120℃, 15h合成的试样L15(见图2(a))主要为几十纳米的不规则颗粒, 大部分颗粒进一步聚合成500nm左右的不规则团聚体。 140℃, 15h的水热合成产物M15主要为扁平状矩形颗粒(见图2(b)), 厚度为200nm左右, 矩形体的边长为500~800nm。 在矩形颗粒的表面附着一些非常细小的纳米颗粒。 150℃, 15h的水热合成产物H15, 矩形颗粒的形态进一步规则化, 尺寸略有增加, 表面同样存在一些纳米颗粒(见图2(c))。

图2 经120℃(a)、 140℃(b)和150℃(c),15h水热合成LiFePO4的FESEM像
Fig.2 FESEM images of LiFePO4 synthesized for 15h at 120℃ (a), 140℃ (b) and 150℃ (c)
图3和4所示分别为150℃保温5h(H05)、 10h(H10)和15h(H15)水热合成试样的X射线衍射谱和FESEM像。 其中图3中H15试样的X射线衍射谱与图1中的相同。 由图3可看出, 经5h和10h合成的产物为结晶良好的LiFePO4, 衍射峰的强度随合成时间的延长而增强。 由图4中可看出, 在150℃水热合成过程中, 随着时间的延长, 合成产物(LiFePO4相)的形态由不规则团聚体(H05, 见图4(a))逐步变化到片状多面体(H10, 见图4(b)), 并最终形成矩形片状颗粒(H15, 见图4(c))。 LiFePO4的这种晶体形态特征变化规律与LiFePO4的正交晶系晶体结构相关, 同时也说明LiFePO4在水热合成过程中存在着明显的晶体生长各向异性。
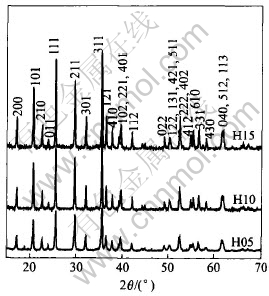
图3 经150℃, 5h(H05)、 10h(H10)和15h(H15)水热合成LiFePO4的X射线衍射谱
Fig.3 XRD patterns of LiFePO4 synthesized at 150℃ for 5h (H05), 10h (H10) and 15h (H15)

图4 经150℃, 5h(a)、 10h(b)和15h(c)水热合成LiFePO4的FESEM像
Fig.4 FESEM images of LiFePO4 synthesized at 150℃ for 5h (a), 10h (b) and 15h (c)
LiFePO4水热合成中所涉及的化学反应包括H3PO4和LiOH的中和反应:
3LiOH+H3PO4=
Li3PO4+3H2O(1)
以及Fe2+的置换反应:
FeSO4+Li3PO4=
LiFePO4+Li2SO4(2)
在上述反应中, 首先形成中间产物Li3PO4是获得高纯度LiFePO4的关键步骤。 为了验证这一点, 本文作者进行了2个150℃, 15h水热合成辅助实验: 辅助实验A按照目标产物中的正离子摩尔比配置原料, 即按n(H3PO4)∶n(LiOH)∶n(FeSO4)=1∶1∶1配料, 按照H15试样的合成路线进行水热合成。 辅助实验B按H15试样实验条件(n(H3PO4)∶n(LiOH)∶n(FeSO4)=1∶1∶3), 但加料次序更改为先将H3PO4和FeSO4混合, 再添加LiOH进行水热合成反应。
辅助实验A和B合成产物的X射线衍射谱如图5所示。 从图5中的谱线(a)可见, 辅助实验A的产物中基本不存在LiFePO4的衍射峰, 主要产物为一些复杂的磷酸盐和铁酸盐。 实验中测量溶液的pH值为4左右。 在这种较强的酸性条件下, 大部分Li以可溶性硫酸锂的形式存在, 而Fe也将以氧化态的三价离子形式存在, 因此不能形成稳定的LiFePO4。 这说明在原料中配置3倍LiOH是必要的。 从图5中的谱线(b)中可看出, 辅助实验B产物虽然合成了部分LiFePO4, 但还存在相当多的杂质化合物的衍射峰(主要为含羟基的磷酸铁)。 在辅助实验B的实验过程中发现, 在溶液中加入FeSO4和H3PO4后, 溶液没有沉淀产生。 再加入3倍物质的量的LiOH后, 溶液中产生沉淀, pH值上升到6左右。 经初步分析, 添加LiOH后, 溶液中的沉淀主要为Fe3(PO4)2和Li3PO4。 此后, 溶液中的Fe2+与Li3PO4反应生成LiFePO4。 但由于磷酸铁的形成消耗了一部分磷酸根, 使得多余的Li以可溶性硫酸盐的形式存在, 从而使合成的LiFePO4数量低于设计的量。 上述二个辅助实验表明: 在LiFePO4的水热合成反应中, 在每摩尔目标产物LiFePO4的原料配比中添加3mol的LiOH, 并先进行中和反应(1)是必要的。
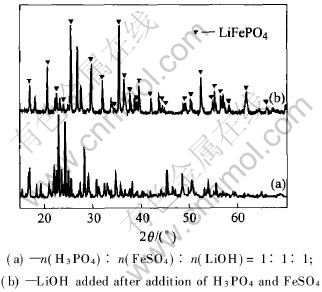
图5 辅助实验经150℃, 15h水热合成产物的X射线衍射谱
Fig.5 XRD patterns of products synthesized at 150℃, 15h
对各个试样的电性能进行测试结果表明, 试样H05(即在150℃下, 合成时间最短的试样)具有相对较高的比容量。 由图6(a)可见, 试样H05在0.05C充放电时, 可逆放电容量为118mA·h·g-1。 但当0.1C充放电时, 可逆容量明显下降到78mA·h·g-1。 实验中发现, 当电流增大到0.5C时, 充电电压随着充电容量的增大, 几乎垂直上升, 这时已不能进行正常的充放电循环。
将水热合成试样H05和聚丙烯按一定比例混合均匀, 在550℃和N2气保护下加热6h进行碳包覆。 氧气氛热失重分析[7]测得产物中的碳包覆量为2.6%。 碳包覆LiFePO4的充放电曲线如图6(b)所示。 在0.05C、 0.1C和0.5C充放电倍率下, 可逆放电容量分别达到163、 159和144mA·h·g-1。 其中, 以0.05C充放电时的可逆放电容量已接近LiFePO4的理论容量。 相对于图6(a)中的数据, 水热合成LiFePO4包覆后的大电流充放电性能明显改善, 说明碳包覆有效地改善材料的导电性能, 减小电池的极化, 提高了LiFePO4的电化学性能。
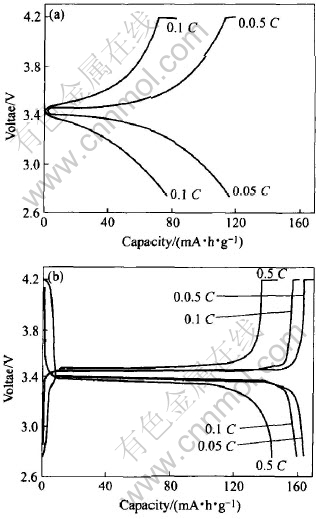
图6 LiFePO4正极材料在碳包覆前(a)和包覆后(b)的充放电曲线
Fig.6 Charge-discharge profiles of bare LiFePO4 (a) and carboncoated LiFePO4 (b)
3 结论
1) 以FeSO4、 H3PO4 和LiOH为原料, 用水热合成法可以制得纯度高、 结晶好、 颗粒分布均匀且细小的LiFePO4粉体。 X射线衍射结果显示, LiFeO4具有规整的橄榄石型结构, FESEM像表明所得产物具有非常好的微观形貌, 与固相合成法相比, 采用水热法得到的LiFePO4颗粒更细, 微观形貌更清晰。
2) 合成温度和反应时间对产物形貌和结晶度均有影响。 由X射线衍射谱和SEM像可看出, 当反应温度为150℃、 反应时间为15h时, 所得产物形貌最清晰、 颗粒大小均匀, 平均直径为800nm。 而在同一温度下, 反应时间为5h时, 得到的产物颗粒均匀细小, 直径为100~300nm。
3) 必须先合成中间产物Li3PO4, 再与Fe2+反应才能得到LiFePO4, 而不是由Li+与Fe3(PO4)2反应生成LiFePO4。
4) LiFePO4粉体经碳包覆之后, 电化学性能可大幅度改善, 以0.01C充放电, 可逆容量达到163mA·h·g-1; 大电流充放电, 性能明显提高, 以0.5C充放电, 可逆电容量达到144mA·h·g-1。
REFERENCES
[1]Padhi A K, Nanjundaswamy K S, Goodenough J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc, 1997, 144(4): 1188-1194.
[2]施志聪, 李晨, 杨勇. LiFePO4新型正极材料电化学性能的研究[J]. 电化学, 2003, 9(1): 9-14.
SHI Zhi-cong, LI Chen, YANG Yong. The electrochemical performance studies on novel LiFePO4 cathode material for Li-ion batteries[J]. Electrochemistry, 2003, 9(1): 9-14.
[3]Yamada A, Chung S C, Hinokuma K. Optimized LiFePO4 for Lithium battery cathodes[J]. J Electrochem Soc, 2001, 148(3): A224-A229.
[4]Chen Z H, Dahn J R. Reducing carbon in LiFePO4/C composite electrodes to maximized specific energy, volumetric energy, and top density[J]. J Electrochem Soc, 2002, 149(9): 505-508.
[5]Chung S Y , Bloking J T, Chiang Y M. Electronically conductive phosphor-olivines as lithium storage electrodes[J]. Nature Mater, 2002, 1(2): 123-128.
[6]Prosini P P, Zane D, Pasquali M. Improved electrochemical performance of a LiFePO4-based composite cathode[J]. Electrochimica Acta, 2001, 46(23): 3517-3523.
[7]Huang H, Yin S C, Nazar L F. Approaching theoretical capacity of LiFePO4 at room temperature at high rate[J]. J Electrochem Solid-Stat Lett, 2001, 4(10): A170-A172.
[8]Yang S, Song Y, Zavali P Y, et al. Reactivity, stability and electrochemical behavior of lithium iron phosphates[J]. Electrochem Comm, 2002, 4(3): 239-244.
[9]Li G H, Azuma H, Tohda M. Optimized LiMnyFe1-y-PO4 as the cathode for lithium batteries[J]. J Electrochem Soc, 2002, 149(6): A743-A747.
[10]Mi C H, Cao G S, Zhao X B. Low-cost, one-step process for synthesis of carbon-coated LiFePO4 cathode[J]. Mater Lett, 2005, 59(1): 127-130.
[11]Mi C H, Cao G S, Zhao X B, et al. In-situ synthesis and properties of carbon coated LiFePO4 as Li-ion battery cathodes[J]. J Electrochem Soc, 2005, 152(3): A483-A487.
[12]张宝, 罗文斌, 李新海, 等. LiFePO4/C锂离子电池正极材料的电化学性能[J]. 中国有色金属学报, 2005, 15(2): 300-304.
ZHANG Bao, LUO Wen-bin, LI Xin-hai, et al. Electrochemical properties of LiFePO4 /C for cathode material of lithium ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(2): 300-304.
[13]Tajimi S, Ikeda Y, Uematsu K, et al. Enhanced electrochemical performance of LiFePO4 prepared by hydrothermal reaction[J]. Solid State Ionics, 2004, 175(1-4): 287-290.
[14]Franger S, Frederic L C, Carole B, et al. Comparison between different LiFePO4 synthesis routes and their influence on its physico-chemical properties[J]. J Power Sources, 2003, 119-121: 252-257.
[15]Yang S F, Zavalij P Y, Whittingham M S. Hydrothermal synthesis of lithium iron phosphate cathodes[J]. Electrochem Comm, 2001, 3(9): 505-508.
[16]HU Guo-rong, ZHANG Xin-long, PENG Zhong-dong, et al. Synthesis and characterization of LiFePO4/C composite used as lithium storage electrodes[J]. Trans Nonferrous Met Soc China, 2004, 14(2): 237-240.
基金项目: 国家自然科学基金资助项目(50201014)
收稿日期: 2005-02-28; 修订日期: 2005-08-24
作者简介: 庄大高(1962-), 男, 博士研究生
通讯作者: 赵新兵, 教授, 博士; 电话: 0571-87951451; 传真:0571-87951403; E-mail: zhaoxb@zju.edu.cn


