苎麻叶中绿原酸的提取
施树云,钟世安,任秀莲,陈晓娟,周春山
(中南大学 化学化工学院,湖南 长沙,410083)
摘 要:
叶中提取绿原酸的最佳工艺。在单因素实验的基础上,通过正交实验设计考察了提取溶剂的选择以及提取温度、料液比、提取时间和pH值等对绿原酸提取率的影响。得到的最佳工艺条件为:以pH=4.0,体积分数为70%的乙醇溶液浸提苎麻叶3次,料液比为1∶10,提取温度为70 ℃,提取时间为2 h;采用该工艺,可使绿原酸呈分子形式被有效地浸出,绿原酸的提取率达83%。
关键词: 绿原酸; 苎麻叶; 提取
中图分类号:R284.2 文献标识码:A 文章编号: 1672-7207(2005)01-0073-05
Extraction of Chlorogenic Acid from Ramie Leaf
SHI Shu-yun, ZHONG Shi-an, REN Xiu-lian, CHEN Xiao-juan, ZHOU Chun-shan
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract: The methods for the extraction of chlorogenic acid from ramie leaf were investigated. The effects of extraction solvents, extraction temperature and the ratio of mass of raw material to the volume of solvent, extraction time and pH value were studied. A series of parameters optimized by orthogonal experiment are as follows: 70% (volume fraction) ethanol as solvent is used to extract chlorogenic acid from ramie leaf 3 times for a duration of 2 h, the ratio of mass of raw material to the volume of solvent is 1∶10, extraction temperature is 70 ℃ and pH value is 4.0. According to the conditions mentioned above, chlorogenic acid is extracted efficiently and the extraction rate of the chlorogenic acid can reach 83%.
Key words: chlorogenic acid; ramie leaf; extraction
苎麻是一种重要的纤维作物,现代药学研究结果表明,苎麻叶具有丰富的药用和保健价值成分[1,2]。特别是其中的绿原酸(chlorogenic acid),具有利胆、抗菌、降压、增高白血球及兴奋中枢神经系统等多种药用功能[2-4]。目前,苎麻主要用作纺织工业原料,而苎麻叶作为工业废弃品被丢弃,资源浪费严重。中国农科院麻类研究所进行了从苎麻中提取绿原酸的研究[5]。在此,作者对从苎麻叶中提取绿原酸的方法进行研究,采用高效液相色谱法(HPLC)测定了苎麻叶中绿原酸的含量[6-11],研究了从苎麻叶中提取绿原酸的影响因素,考察了不同提取溶剂、提取时间、料液比、提取温度以及pH值对绿原酸提取率的影响,并通过正交实验寻求了最佳的提取工艺条件[12-18]。
1 实 验
1.1 药品及仪器
a. 药品:苎麻叶,2002年采摘(产自湖南);甲醇,色谱纯(湖南师范大学试剂厂生产);绿原酸标准品,纯度为995%(中国生物制品研究所生产);其他试剂,为分析纯;实验用水,为二次蒸馏水。
b. 仪器:不锈钢电热恒温水浴锅(北京医疗设备厂制造);BT-8100高效液相色谱仪;C-R6A积分仪;BT8200uv/vis检测器;Dynamic混合器(德国Biotronic公司制造);R-210旋转蒸发器(上海申生科技有限公司制造);Explorer电子天平(瑞士OHAUS公司制造)。
1.2 绿原酸的提取
采集新鲜的苎麻叶,烘干,粉碎成粒径小于2 mm的粉末,用pH=4.0,体积分数为70%的乙醇溶液在70 ℃时浸提3次,合并提取液,减压浓缩至一定体积得粗提液,并计算绿原酸的提取率。
1.3 分析方法
采用高效液相色谱分析的色谱条件为:Kromasil ODS-C18色谱柱(填料粒径为5 μm,填料高×直径为200 mm×4.6 mm);流动相为甲醇-水和乙酸(体积比为18∶81∶1);流速为0.8 mL·min-1;室温;检测波长为326 nm;进样量为6 μL。
配制绿原酸的标准溶液系列,建立绿原酸的峰面积(A)与浓度(ρ)之间的回归方程为:
A=1.618ρ-0.023。
相关系数r=0.9997。当绿原酸标准液的浓度为20~160 mg/L时,A与ρ呈线性关系。将提取液经0.5 μm滤膜过滤,从所得液中取6 μL进行HPLC分析(结果见图1),得到峰面积,根据回归方程计算出它的浓度。固定浓缩液体积,根据提取液的浓度,确定最佳提取工艺条件。
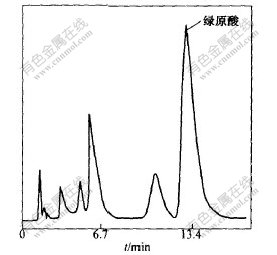
图 1 样品色谱图
Fig. 1 Chromatography of sample
2 结果与讨论
2.1 提取溶剂的选择
绿原酸是含有羟基和邻苯二酚的有机酸,易溶于水、甲醇、乙醇和丙酮等溶剂,甲醇和丙酮有毒性,用水提取时由于苎麻叶中含有大量的多糖,过滤困难且杂质含量较大,醇沉淀时会发生共沉淀现象,使绿原酸含量降低。用醇提取就可避免以上问题。实验中取苎麻叶2份,每份10 g,分别加水和70%的乙醇200 mL,浸提3次,每次2 h,分别合并水提液和醇提液,减压浓缩后,经真空干燥得粗提物,再取适量分析绿原酸含量,重复测定3次。通过比较绿原酸含量和粗提物含量可知:采用乙醇体系所得绿原酸含量高,杂质少。其实验结果如表1所示。
表 1 苎麻叶水提和醇提工艺比较
Table 1 Comparison between water and ethanol
extraction process in ramie leaf 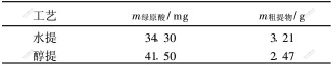
2.2 绿原酸提取的单因素实验
2.2.1 乙醇提取浓度的选择
取苎麻叶4 g,分别加入pH=4.0的不同体积分数的乙醇溶液40 mL,在70 ℃搅拌浸取2 h,采用三级浸提,然后,测定绿原酸浓度并计算各种条件下绿原酸的提取率,实验结果如图2所示。
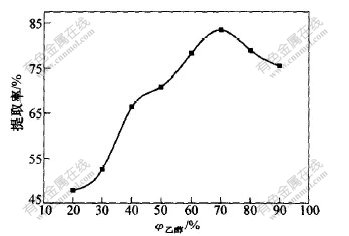
图 2 乙醇体积分数φ乙醇对绿原酸提取率的影响
Fig. 2 Influence of volume fraction of ethanol
on extraction rate of chlorogenic acid
由图2可知,苎麻叶在用20%~70%乙醇浸提时,随着乙醇含量的增加;绿原酸的提取率增加;当用70%以上的乙醇浸提时,绿原酸的提取率降低。由此可见,适宜的浸提液为70%乙醇溶液。
2.2.2 提取温度的选择
取苎麻叶4 g,加入pH=4.0的70%乙醇溶液40 mL,分别在不同温度条件下搅拌浸取2 h,采用三级浸提,然后测定绿原酸浓度,并计算各种条件下绿原酸的提取率,实验结果如图3所示。
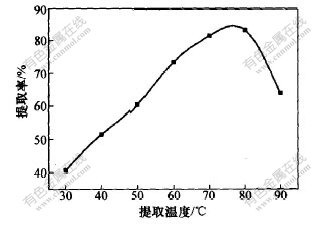
图 3 提取温度对绿原酸提取率的影响
Fig. 3 Influence of extraction temperature on
extraction rate of chlorogenic acid
由图3可以看出,绿原酸在30~80 ℃浸提时,随着温度的升高,绿原酸的提取率增加较快。在80 ℃以上浸提时,提取率降低。其原因是绿原酸的溶解度与温度有关,温度过低,不利于绿原酸浸出;提取液过热又会导致绿原酸分解。由此可见,苎麻叶的浸提温度不宜超过80 ℃,适宜的浸提温度在70~80 ℃之间。
2.2.3 提取时间的选择
控制温度为70 ℃,取苎麻叶4 g在pH=4.0的体积分数为70%、体积为40 mL的乙醇溶液中分别搅拌不同的提取时间,每样提取3次,然后测定绿原酸浓度,并计算各种条件下绿原酸的提取率,实验结果如图4所示。
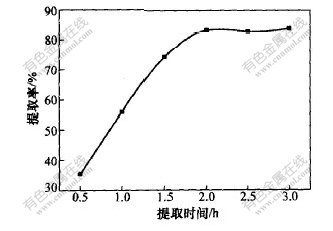
图 4 提取时间对绿原酸提取率的影响
Fig. 4 Influence of extraction time on
extraction rate of chlorogenic acid
由图4可以看出,提取时间对绿原酸的提取率有较大影响:当提取时间为0.5~2 h时,绿原酸的提取率随提取时间的增加而增大;浸提时间为2 h时,提取已基本完成。因此,适宜的提取时间为2 h。
2.2.4 提取液pH值的选择
取苎麻叶4 g,加入不同pH值的70%乙醇溶液40 mL,在70 ℃搅拌浸提2 h,采用三级浸提,然后测定各种条件下绿原酸的浓度,并计算绿原酸的提取率,实验结果如图5所示。
由图5可知,pH 值对提取过程有较大的影响。这与绿原酸本身是一种有机酸有关,酸性条件下有利于绿原酸的浸出,碱性条件下一部分绿原酸可能发生水解,导致绿原酸的浓度降低,在pH约为4.0时,绿原酸的提取率最高。
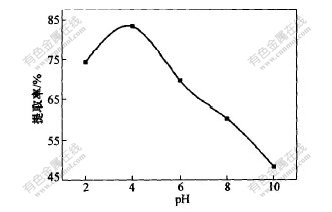
图 5 提取液pH值对绿原酸提取率的影响
Fig. 5 Influence of pH value of extractive
solution on extraction rate of chlorogenic acid
2.2.5 料液比的选择
在温度70 ℃时,对4 g苎麻叶分别加入pH=4.0的70%乙醇溶液24 mL(料液比为1∶6),32 mL(料液比为1∶8),40 mL(料液比为1∶10),48 mL(料液比为1∶12),60 mL(料液比为1∶15)和80 mL(料液比为1∶20),搅拌2 h,采用三级浸提,然后测定绿原酸浓度,并计算各种条件下绿原酸的提取率,实验结果如图6所示。
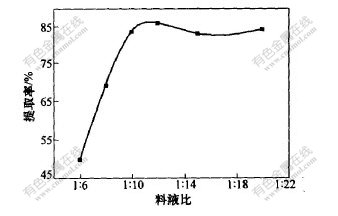
图 6 料液比对绿原酸提取率的影响
Fig. 6 Influence of ratio of mass of raw
material to volume of solvent on
extraction rate of chlorogenic acid
由图6可知,随着溶剂量的增加,绿原酸的提取率也随着提高,当料液比超过1∶10后绿原酸的提取率基本不变。但增加提取剂,既浪费了试剂,又给试剂回收带来困难,故选择料液比为1∶10时较适宜。
2.2.6 浸提级数的确定
由于单次浸提对绿原酸的提取不够完全,有必要对苎麻叶进行多级提取,以充分利用资源。称取4 g苎麻叶,以pH=4.0的70%乙醇溶液在70 ℃时多级浸提。由实验结果可知,三级提取已使大部分绿原酸浸提出,故以三级提取绿原酸比较合理。
2.3 正交实验
由以上实验可以看出,苎麻叶浸提液pH值、提取温度、提取时间以及料液比对提取效果均有显著影响。在单因素实验基础上进行L9(34)正交实验,结果见表2。其中:A为浸提液pH值;B为浸提液温度,℃;C为浸提时间,h;D为料液比,g/mL。
由表2可知各因素的极差R值,可以得出影响绿原酸提取率因素由大至小的顺序为:浸提时间,浸提液pH值,浸提温度,浸提料液比。由此可见,浸提时间和浸提液pH值分别为最显著因素和显著影响因素。由以上正交实验分析可知:最佳条件为A2B1C2D2,即浸提液pH值为4.0,浸提温度为70 ℃,浸提时间为2 h,浸提料液比为1∶10。
表 2 绿原酸提取条件的正交实验及结果分析
Table 2 Results analysis of orthogonal test for
optimizing extraction conditions of
chlorogenic acid 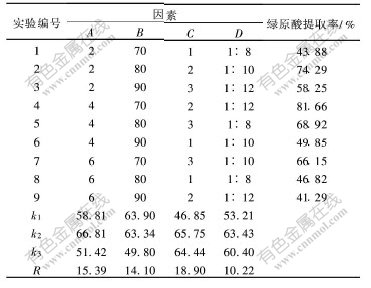
3 结 论
a. 各因素对苎麻叶中绿原酸提取率的影响由大至小顺序为:浸提时间,浸提液pH值,浸提温度,浸提料液比。通过正交实验得到优化后的工艺参数为:70%的乙醇溶液浸提苎麻叶3次,料液比为1∶10,提取温度为70 ℃,浸提时间为2 h,pH值为4.0。在此工艺条件下,此时绿原酸的提取率达83%。
b. 通过调节提取体系中pH值,使绿原酸呈分子状态而被有效地提取。此外,采用HPLC检测法建立了测定从苎麻叶中浸提绿原酸含量的方法。
参考文献:
[1]臧巩固,赵立宁,陈建华. 苎麻的药用价值及其开发前景[J]. 中国麻业,2002,24(1):27-29.
ZANG Gong-gu, ZHAO Li-ning, CHEN Jian-hua. Medical Value and Developed Foreground of Ramie Leaf[J]. Chinese Hemp Industry, 2002,24(1): 27-29.
[2]中国药科大学. 中药辞海(第2卷)[M]. 北京:中国医药科技出版社,1996.129-130.
China Pharmaceutical University. Chinese Medicine Encyclopedia (Vol.2)[M]. Beijing: China Medicine Technology Press, 1996. 129-130.
[3]国家中医药管理局. 中华本草[M]. 上海:上海科学科技出版社,1996.
State Administration of Traditional Chinese Medicine. Chinese Traditional and Herbal Drugs[M]. Shanghai: Shanghai Science and Technology Press, 1996.
[4]张鞍灵,马琼,高锦明,等.绿原酸及其类似物与生物活性[J].中草药,2001,32(2):173-176.
ZHANG An-ling, MA Qiong, Gao Jin-ming, et al. Studies on Bioactivities of Chlorogenic Acid and Its Analogues[J]. Chinese Traditional and Herbal Drugs, 2001, 32(2): 173-176.
[5]赵立宁,臧巩固,李育君,等.苎麻(Boehmeria)绿原酸和黄酮含量测定[J].中国麻业,2003,25(2):62-64.
ZHAO Li-ning, ZANG Gong-gu, LI Yu-jun, et al. The Content of Chlorogenic and Total Flavones in Boehmeria[J]. Chinese Hemp Industry, 2003, 25(2): 62-64.
[6]陈少洲,东慧茹. 向日葵仁中绿原酸和咖啡酸的反相高效液相色谱法测定[J]. 分析测试学报,2003,22(2):100-102.
CHEN Shao-zhou, Dong Hui-ru. Determination of Chlorogenic Acid and Caffeic Acid in Sunflower by Reversed Phase HPLC[J]. Journal of Instrumental Analysis,2003,22(2):100-102.
[7]NARDINI M, CIRILLO E. Detection of Bound Phenolic Acids: Prevention by Ascorbic Acid and Ethylenediaminetetraacetic Acid of Degradation of Phenolic Acids during Alkaline Hydrolysis [J]. Food Chemistry, 2002, 79: 119-124.
[8]孙莲,张丽静,孟磊. RP-HPLC法测定桑叶中绿原酸的含量[J]. 中草药,2003,34(1):78-79.
SUN Lian, ZHANG Li-jing, MENG Lei. Determination of Chlorogenic Acid in Mulberry Leaves by RP-HPLC [J]. Chinese Traditional and Herbal Drug, 2003, 34(1): 78-79.
[9]SIRANOUS S, IRMGARD B. Determination of Some Pharmacologically Active Phenolic Acids in Juices by High Performance Liquid Chromatography[J]. Journal of Chromatography, 1996, 741:223-231.
[10]李文莉,汪文涛. 高效液相色谱法测定脉络宁注射液中绿原酸的含量[J]. 中国药学杂志,2003,38(3):210-212.
LI Wen-li, WANG Wen-tao. Determination of Chlorogenic Acid in Mailuoning Injection by HPLC[J]. Chinese Journal of Pharmacology,2003,38(3):210-212.
[11]张丹,李章万,姜焱.HPLC测定金银花、茵陈及其10种中成药中绿原酸的含量[J].药物分析杂志,1996,16(2):83-85.
ZHANG Dan, LI Zhang-wan, JIANG Yan. Determination of Chlorogenic Acid in Flos Lonicerae, Herba Artemislas Scopariae and Ten Chinese Patent Medicines by HPLC[J]. Chin J Pharm Anal, 1996, 16(2): 83-85.
[12]李萍,刘云. 正交实验法优选金银花中绿原酸提取工艺的研究[J]. 时珍国医国药,2002,13(6):321-323.
LI Ping, LIU Yun. Study on Optimum Extraction Process for Chlorogenic Acid in Flos Lonicerae by Orthogonal Design[J]. Lishizhen Medicine and Materia Medica Research,2002,13(6):321-323.
[13]丁青龙,赵静安. 用正交试验探讨金银花煎煮条件对绿原酸含量的影响[J]. 中国新药杂志,1999,8(10):681-683.
DING Qing-long, ZHAO Jing-an. The Influence of Decocting Method on Chlorogenic Acid Content in Extract of Flos Lonicerae[J]. Chinese New Drugs Journal,1999,8(10):681-683.
[14]白海波,王剑飞. 金银花提取条件对绿原酸含量的影响[J]. 中国现代应用药学,2003,20(2):130-132.
BAI Hai-bo, WANG Jian-fei. Influence of Extraction Process on the Content of Chlorogenic Acid in Flos Lonicerae[J]. Chinese Journal of Modern Applied Pharmacology,2003,20(2):130-132.
[15]陈燕茹,李津明. 咳喘宁提取工艺的研究[J] . 黑龙江医药,2003,16(2):126-127.
CHEN Yan-ru, LI Jin-ming. Study on Extraction Process of Kechuanning[J]. Heilongjiang Medical Journal,2003,16(2):126-127.
[16]顾文彬,井山林. 连银汤提取工艺的正交实验研究[J].基层中药杂志,2003,16(5):13-14.
GU Wen-bin, JING Shan-lin. Orthogonal Experimental Research on Extracting Process of Chlorogenic Acid from Lian′yin Decoction[J]. Primary Journal of Chinese Materia Medica, 2003, 16(5): 13-14.
[17]张维农,刘大川. 葵花籽仁中提取绿原酸的研究[J]. 中国油脂,2002,27(2):76-77.
ZHANG Wei-nong, LIU Da-chuan. Study on Extraction Chlorogenic Acid from Sunflower Seed[J]. Chinese Grease, 2002,27(2):76-77.
[18]尉芹,景谦平,马希汉.杜仲叶中绿原酸自提取工艺条件研究[J].林产化学与工业,2001,21(4):27-32.
WEI Qin, JING Qian-ping, MA Xi-han. Study on Technique of Extraction and Isolation of Chlorogenic Acid from Leaves of Eucommia Ulmoides[J]. Chemistry and Industry of Forest Products, 2001, 21(4): 27-32.
收稿日期:2003-10-31
基金项目:湖南省科技厅重点攻关项目(00KNY1010)
作者简介:施树云(1979-),女,江苏如皋人,硕士,从事中草药有效成分的提取分离及测定研究
论文联系人: 钟世安,男,博士,副教授;电话:0731-8879672(H)
摘要: 研究了从苎麻叶中提取绿原酸的最佳工艺。在单因素实验的基础上,通过正交实验设计考察了提取溶剂的选择以及提取温度、料液比、提取时间和pH值等对绿原酸提取率的影响。得到的最佳工艺条件为:以pH=4.0,体积分数为70%的乙醇溶液浸提苎麻叶3次,料液比为1∶10,提取温度为70 ℃,提取时间为2 h;采用该工艺,可使绿原酸呈分子形式被有效地浸出,绿原酸的提取率达83%。
关键词: 绿原酸; 苎麻叶; 提取
中图分类号:R284.2 文献标识码:A 文章编号: 1672-7207(2005)01-0073-05


