网络首发时间: 2018-08-24 16:26
超小Ag纳米粒子的控制制备及其丙烯气相环氧化性能
华东理工大学工业催化研究所
摘 要:
负载型金属催化剂的性能与金属纳米粒子的粒径密切相关, 但目前传统合成方法还无法高效地合成颗粒尺寸为1~3 nm的超小金属纳米粒子。以Ag纳米粒子为研究模型, 在油胺体系中, 采用改进的“降温法”制备得到尺寸分布在1~3 nm范围内的超小Ag纳米粒子。在此基础上, 将所合成的超小Ag纳米粒子和尺寸在10 nm的Ag纳米粒子分别负载到经油酸改性的碳酸钡载体上, 并经“两步焙烧法”制备了负载不同尺寸Ag纳米粒子的Ag/BaCO3催化剂 (分别标记为Ag-BaCO3#-10 nm和Ag-BaCO3#-3 nm) 。同时, 研究了两种催化剂在丙烯气相环氧化反应中的性能。结果表明相比于Ag-BaCO3#-10 nm催化剂, Ag-BaCO3#-3 nm表现出更好的催化活性, 在较低温度下具有更高的丙烯转化率和环氧丙烷选择性。在150℃时其催化性能达到最佳, 具有88.2%的PO选择性和0.8%的丙烯转化率。
关键词:
中图分类号: TB383.1;TQ131.22;TQ223.26
作者简介:束远 (1993-) , 男, 安徽芜湖人, 硕士研究生, 研究方向:工业催化, E-mail:457290059@qq.com;*詹望成, 教授;电话:021-64252923;E-mail:zhanwc@ecust.edu.cn;
收稿日期:2018-04-16
基金:上海市浦江人才计划项目 (17PJD012) 资助;
Synthesis of Ultra-Small Ag Nanoparticles and Their Catalytic Performance for Epoxidation of Propylene
Shu Yuan Guo Xin Wang Li Guo Yanglong Guo Yun Zhan Wangcheng
Key Laboratory for Advanced Materials and Research Institute of Industrial Catalysis, East China University of Science and Technology
Abstract:
The catalytic performance of supported metal catalysts is closely related to the particle size of metal nanoparticles. However, the traditional synthesis methods could not efficiently synthesize ultra-small metal nanoparticles with particle size of 1~3 nm. In this paper, using Ag nanoparticles as the model, the ultra-small Ag nanoparticles (1~3 nm) were prepared by the “cooling method” under the oleylamine system. Meanwhile, Ag nanoparticles with particle size of 10 nm were also synthesized as reference sample. On this basis, the synthesized ultra-small and 10 nm Ag nanoparticles were supported on barium carbonate modified by oleic acid, respectively. After the samples were calcined by “two-step calcination” method, the obtained corresponding catalysts were labeled with Ag-BaCO3#-10 nm and Ag-BaCO3#-3 nm, respectively. The results showed that the catalytic activity of the Ag-BaCO3#-3 nm catalyst was higher than that of Ag-BaCO3#-10 nm catalyst. At 150 ℃, the Ag-BaCO3#-3 nm catalyst exhibited the best catalytic activity with 88.2% PO selectivity and 0.8% propylene conversion.
Keyword:
Ag nanoparticles; particle size; two-step calcination; propylene; selective oxidation;
Received: 2018-04-16
众所周知, 负载型金属催化剂的性能与金属纳米粒子的粒径密切相关。 当金属纳米粒子的粒径下降到10 nm以下时, 催化剂的性能通常可得到大幅的提升
目前, 合成纳米粒子的方法主要以湿化学法为主, 包括热注射法、 晶种生长法和两相还原法等
本文以1~3 nm大小的Ag纳米粒子合成为研究对象, 采用改进的“降温法”合成超小Ag纳米粒子, 然后将其负载到碳酸钡载体上制备得到Ag/BaCO3催化剂, 并研究了其在丙烯气相环氧化反应中的活性。 与此同时, 还制备了Ag颗粒尺寸为 10 nm左右的Ag/BaCO3催化剂, 研究Ag颗粒尺寸对催化剂活性的影响, 为进一步提高Ag基催化剂在丙烯气相环氧化反应中的活性提供指导意义。
1 实 验
1.1 催化剂的制备
1.1.1 超小Ag纳米粒子的合成
称取0.25 g的AgNO3置于10 ml油胺溶液中, 超声10 min使AgNO3完全溶解。 然后将混合溶液置于四口烧瓶中, 在氮气保护和搅拌条件下以3 ℃·min-1升温到80 ℃, 搅拌20 min后, 向混合溶液中注射溶有 200 mg 叔丁胺甲硼烷的油胺溶液。 随后迅速往混合溶液中注射10 ml四氢萘溶液, 然后立即关停加热装置, 将四口烧瓶置于冰水浴中老化, 继续搅拌1 h。 待反应结束后, 加入10 ml正己烷和50 ml乙醇, 将该混合溶液于10000 r·min-1转速下离心 6 min, 随后将该沉淀重新分散于10 ml的正己烷溶液中, 即得到所合成的超小Ag纳米粒子胶体。 另外, 采用同样的方法合成Ag纳米粒子参照样品, 区别在于关停加热装置后四口烧瓶不转移至冰水浴中, 而是自然降温冷却至室温进行老化, 继续搅拌1 h, 离心步骤与前者相同。
1.1.2 较大尺寸Ag纳米粒子的合成
为了研究Ag纳米粒子尺寸对最终制备得到的催化剂在丙烯环氧化反应中的活性影响, 在实验过程中还制备了10 nm左右的Ag纳米粒子, 该合成方法参见了Chen等
1.1.3 BaCO3载体有机改性
称取20 g的 BaCO3和50 ml的油酸溶液混合, 超声直至混合溶液呈白色米糊状, 待BaCO3完全分散于油酸溶液后, 将该混合物加热至150 ℃, 搅拌3 h后, 关停加热, 待混合液降至室温后, 加入50 mL乙醇稀释该混合溶液, 随后以6000 r·min-1的转速离心 6 min, 得到偏黄色的白色沉淀, 该沉淀物于40 ℃的烘箱中干燥12 h, 得到的样品标记为BaCO3#。
1.1.4 Ag/BaCO3的制备
称取1 g BaCO3#置于20 ml正己烷溶液中, 超声30 s后置于搅拌台上剧烈搅拌, 随后按4% (质量分数) 的理论负载量, 将一定量的超小Ag纳米粒子和环己烷的混合溶液逐滴加入到该混合物中。 持续搅拌3 h后, 通入氮气直至将正己烷完全挥发, 得到的固体样品于40 ℃真空烘箱中干燥。 最后, 将固体样品先在400 ℃和氮气气氛下焙烧1 h, 使Ag纳米粒子表面的有机物转变成炭, 然后在400 ℃和空气气氛中焙烧3 h去除Ag纳米粒子表面的积碳, 最终制备得到BaCO3负载的Ag催化剂, 标记为Ag/BaCO3#。
1.2 纳米材料及催化剂的表征
Ag纳米粒子胶体中Ag的粒径和形貌采用JEOL公司的JEM-2100型高分辨透射电镜 (HR-TEM) 进行分析, 而BaCO3负载的Ag催化剂中Ag纳米粒子的粒径和相关形貌在Hitachi HD 2700C (200 kV) 仪器上进行, 纳米粒子的粒径分布用Image J软件进行计算。 催化剂的检测在Bruker AXS D8 Focus型X射线衍射仪 (XRD) 上进行。 采用Cu靶Kα射线 (λ=0.15406 nm) , 电压40 kV, 电流40 mA, 扫描范围为2θ=10°~80°。 样品的热重分析采用TGA Setaram热重分析仪, 测试条件为空气气氛, 升温速率为10 ℃·min-1。 Ag/BaCO3的实际含量由等离子体发射光谱仪 (TJA IRIS ADVANTAG 1000) 进行定量检测。
1.3 催化剂性能的评价
催化剂对丙烯环氧化反应的活性评价在固定床石英反应管中进行, 反应压力为常压。 催化剂装填量为0.5 g, 催化剂颗粒尺寸为20~40目。 原料气组成为20%C3H6+10%O2+70%N2, 气体总流量为20 ml·min-1, 对应的质量空速为2400 ml·g-1·h-1。
2 结果与讨论
2.1 Ag纳米粒子制备过程中老化温度对其颗粒尺寸的影响
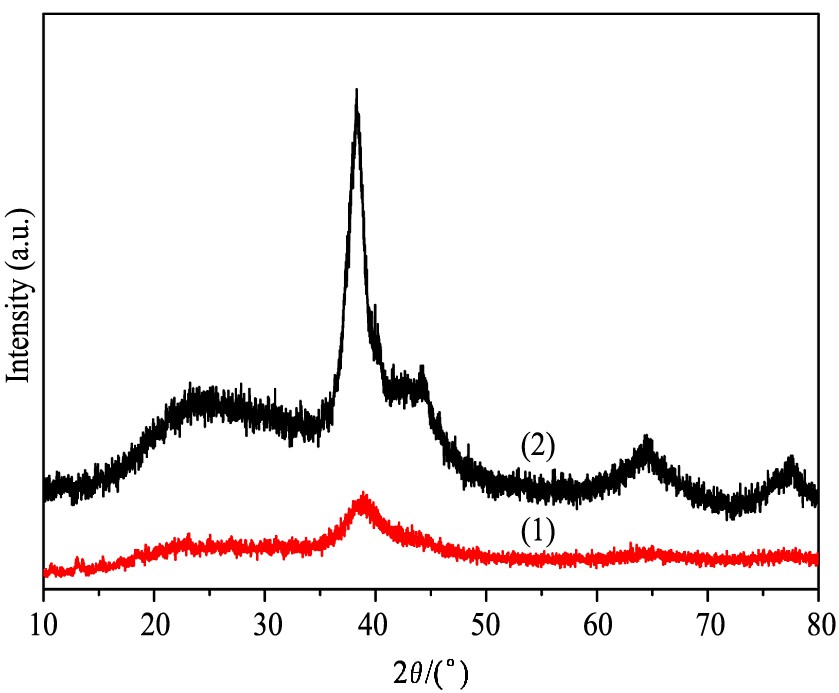
在实验过程中, 分别在冰水浴和室温等两种条件下进行老化, 合成Ag纳米粒子。 制备得到的Ag纳米粒子的TEM和XRD表征结果见图1和2。 图1 (a) 为在冰水浴条件下老化1 h制备得到的Ag纳米粒子的TEM图, 可以看出所制备的Ag纳米粒子尺寸分布非常均一, 而且非常小, 其颗粒大小为 (2.6±0.4) nm。 相反, 在室温下老化1 h制备得到的Ag纳米粒子, 尺寸分布很不均一, 而且Ag纳米粒子较大, 小颗粒Ag的尺寸约4 nm, 大颗粒Ag的尺寸约15 nm, 如图1 (b) 所示。 为了进一步分析老化温度对合成的Ag纳米粒子颗粒尺寸的影响, 对不同条件下老化制备的Ag纳米粒子进行了XRD表征。 如图2所示, 对于冰水浴中老化制备得到的Ag纳米粒子, XRD图谱只在2θ=38.8°出现一个较弱的衍射峰, 该峰归属为Ag (111) , 说明在冰水浴条件下老化制备得到的Ag纳米粒子的尺寸很小。 相反, 对于在室温下老化制备得到的Ag纳米粒子, XRD图谱在2θ=38.8°, 44.1°, 64.5°和77.6°出现明显的衍射峰, 分别归属为Ag (111) , (200) , (220) 和 (311) , 说明在室温条件下老化制备得到的Ag纳米粒子的尺寸较大。
不同的老化温度会影响Ag纳米粒子成核后的生长过程, 包括聚集成核和生长过程, 从而影响Ag纳米粒子的尺寸
图1 在冰水浴和室温条件下老化合成的Ag纳米粒子的TEM图
Fig. 1 TEM images of Ag nanoparticles prepared at ice bath temperature (a) and room temperature (b)
图2 在冰水浴 (1) 和室温 (2) 条件下老化合成的Ag纳米粒子的XRD图谱
Fig.2 XRD patterns of Ag nanoparticles prepared at ice bath temperature (1) and room temperature (2)
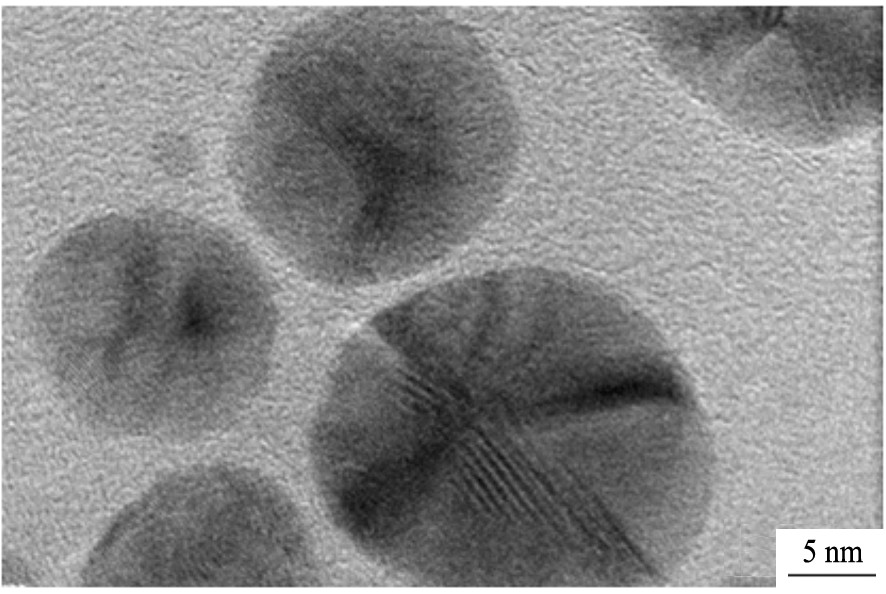
图3 在室温条件下老化合成的Ag纳米粒子的HRTEM图
Fig.3 HRTEM image of Ag nanoparticles prepared at room temperature
为了验证上述低温老化过程对制备得到的金属纳米粒子尺寸的影响, 采用同样的方法合成了Au和Pt纳米粒子。 如图4所示, 当纳米粒子的老化过程在冰水浴中进行时, 制备得到的Au和Pt纳米粒子的尺寸都非常小, 其中Au纳米粒子的粒径在 (2.6±0.4) nm, Pt纳米粒子的粒径在 (1.5±0.3) nm。 相反, 当纳米粒子的老化过程在室温下进行时, 制备得到的Au和Pt纳米粒子的尺寸都显著长大, 并且出现了多晶及蠕虫状的纳米晶 (图4 (b, d) ) , 表明Au和Pt纳米粒子在老化过程中存在聚集成核和生长的过程。
2.2 载体BaCO3的预处理
如实验部分描述, 在负载过程中, 首先需要将载体BaCO3分散在正己烷中, 然后将Ag进行负载。 但由于载体BaCO3表面为亲水性, 而正己烷为非极性溶剂, 因此如果不将载体BaCO3进行预处理, 无法将其均匀分散于正己烷溶液中, 不利于Ag纳米粒子在载体BaCO3上的分散。
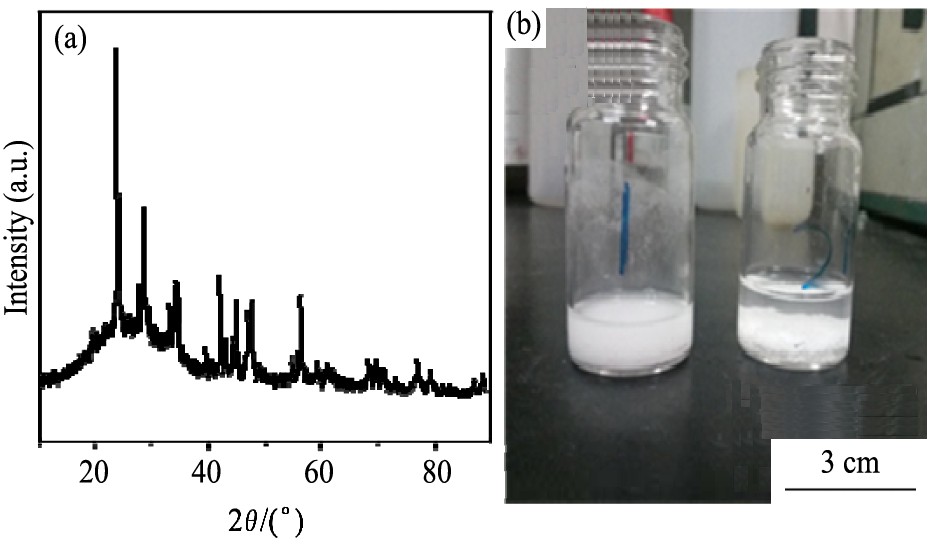
图5 (a) 为经过处理后的BaCO3载体 (BaCO3#) 的XRD图谱。 从图5中可以看出, 经油酸高温处理后, BaCO3#的结构并没有发生明显变化。 因为油酸的酸性低于碳酸, 所以油酸不会和BaCO3发生酸置换反应。 在此基础上, 将处理后的BaCO3#载体分散于一定量的正己烷中, 并对比了未经处理的BaCO3在正己烷中的分散情况。 从图5 (b) 可以看出, 经过处理的BaCO3#可以很好地分散在正己烷溶液中, 溶液呈乳白色, 并且静置1 h后不发生明显的沉降。 相反, 未经改性的BaCO3与正己烷混合时, 则完全沉淀在正己烷溶液的底部, 这不利于Ag纳米粒子在载体上的负载。 这主要是因为BaCO3具有一定的碱性, 在后处理过程中表面会吸附一定量的油酸, 从而赋予载体一定的疏水性, 使其均匀分散在正己烷溶液中。
图4 不同条件下老化所得到的Au, Pt纳米粒子的TEM图
Fig.4 TEM images of Au and Pt nanoparticles prepared at different conditions
(a) Au nanoparticles obtained under ice bath; (b) Au nanoparticles obtained at room temperature; (c) Pt nanoparticles obtained under ice bath; (d) Pt nanoparticles obtained at room temperature
图5 经油酸处理后BaCO3#的XRD图谱, 载体BaCO3#和未处理的BaCO3在正己烷溶液中的分散性
Fig.5 XRD pattern of BaCO3# after oleic acid treatment (a) , dispersion of BaCO3# and untreated BaCO3 in n-hexane solution (b)
随后, 对BaCO3#进行了红外吸收光谱 (FTIR) 表征, 结果如图6所示, 样品在3005, 2925, 2854, 1711和1428 cm-1等处出现了明显的吸收峰, 表明油酸分子已经成功地嫁接到了BaCO3的表面上。 图7为BaCO3#载体的热重测试结果, 差热 (DTA) 曲线中200 ℃之前未出现失重峰, 表明催化剂表面的水分占比很少, 而在220和340 ℃左右出现的失重峰可归属为有机物的脱附分解峰。 热重 (TG) 曲线表明载体吸附的油酸约占BaCO3#总重量的30.7%, 这些吸附的油酸有利于BaCO3#载体在正己烷溶液中分散, 以及Ag纳米粒子在其上的负载。
图6 经油酸处理后BaCO3#的FTIR图谱
Fig.6 FTIR pattern of BaCO3# after oleic acid treatment
图7 BaCO3#载体的TG和DTA图
Fig.7 TG and DTA curves of BaCO3# sample
2.3 催化剂上Ag的分散性和价态
采用经过处理的BaCO3#为载体, 分别负载预先合成的3和10 nm左右的Ag纳米粒子, 理论负载量为4%。 然后经过“两步焙烧法”制备负载不同粒径Ag纳米粒子的Ag/BaCO3#催化剂, 分别标记为Ag/BaCO3#-3 nm和Ag/BaCO3#-10 nm, 相应的实际负载量分别为2.8%和2.4%。
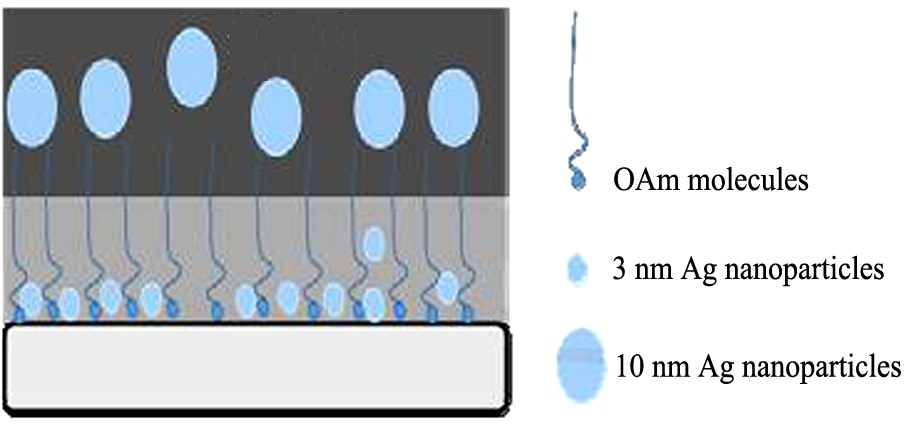
首先, 对预先合成的10 nm Ag纳米粒子进行了TEM表征。 如图8所示, Ag纳米粒子的尺寸较为均一, 平均粒径为10.1 nm。 将这两种尺寸的Ag纳米粒子负载到BaCO3#后制备得到的两个催化剂的TEM结果如图9所示。 Ag/BaCO3#-10 nm催化剂上Ag的分散性较差, 而且Ag颗粒尺寸发生一定的烧结, 导致颗粒尺寸分布并不是很均匀。 经统计Ag纳米粒子的平均尺寸为12.5 nm, 表明了Ag颗粒发生了一定程度的长大。 相反, Ag/BaCO3#-3 nm催化剂上Ag的分散性较好, 虽然有极少数的Ag烧结变成了大颗粒Ag, 但由于大颗粒Ag的数目较少, 催化剂表面Ag纳米粒子的平均尺寸依旧维持为3 nm左右。 两种尺寸Ag颗粒在BaCO3#载体上不同的分散性可能是由BaCO3载体经过预处理所造成的。 当载体表面嫁接有表面活性剂时, 其长碳链暴露在远离载体的一侧, 会排斥纳米颗粒和载体的接触, 此时尺寸越小的颗粒越有机会与载体接触, 而较大尺寸的颗粒会被排斥在外。 因此, 使得尺寸较小的Ag纳米颗粒在载体表面具有较高的分散性, 而尺寸较大的Ag纳米颗粒在载体表面的分散性较差, 示意图如图10所示。
图8 合成的10 nm Ag纳米粒子的TEM图
Fig.8 TEM image of 10 nm Ag nanoparticles
图9 Ag/BaCO3#-10 nm和Ag/BaCO3#-3 nm的TEM图
Fig.9 TEM images of Ag/BaCO3#-10 nm (a) and Ag/BaCO3#-3 nm (b) catalysts
图10 不同尺寸Ag纳米粒子在BaCO3#表面的分散情况
Fig.10 Dispersion of Ag nanoparticles with different sizes on surface of BaCO3#
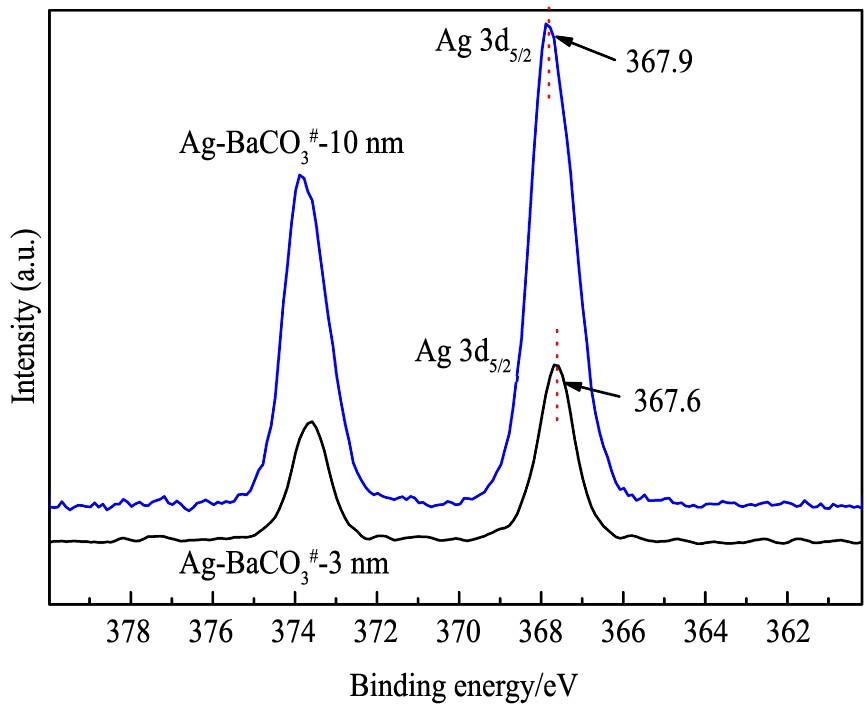
随后, 分别对Ag/BaCO3#-3 nm和Ag/BaCO3#-10 nm进行了XPS表征, 以判断两个样品中Ag的价态, 结果见图11。 两个样品的Ag 3d5/2峰位置非常接近, Ag/BaCO3#-3 nm中Ag 3d5/2的结合能位于367.6 eV, 而Ag/BaCO3#-10 nm中Ag 3d5/2的结合能位于367.9 eV。 根据相关文献报道
2.4 Ag/BaCO3催化剂的催化性能
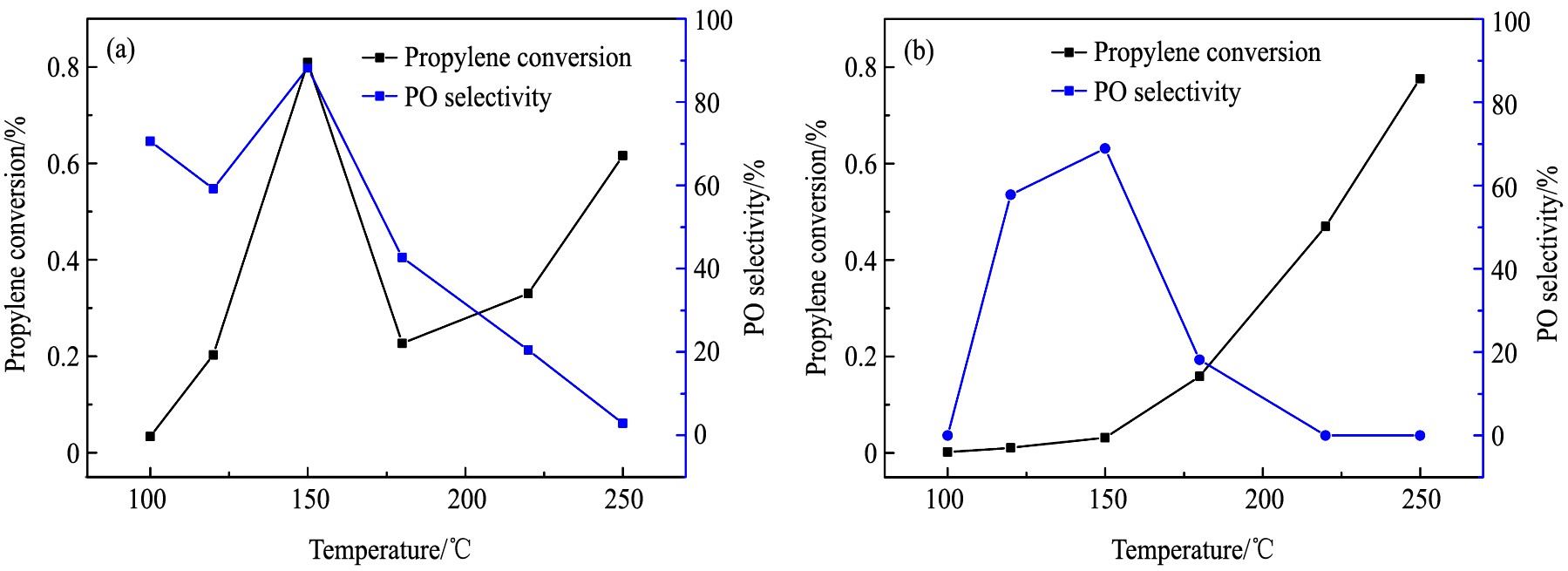
在上述表征的基础上, 进一步研究了Ag纳米粒子尺寸对催化剂在丙烯环氧化反应中的活性影响。 图12为Ag/BaCO3#-3 nm和Ag/BaCO3#-10 nm两个催化剂在丙烯环氧化反应中的活性。 从图12中可知, 在Ag/BaCO3#-10 nm催化剂上, 丙烯的转化率随温度升高而逐渐增大, 在260 ℃时丙烯转化率为0.8%。 而环氧丙烷 (PO) 的选择性随温度升高是先上升后下降, 在150 ℃时最高, 为70%。 当反应温度升高到220 ℃以上时, PO选择性降至0%。 相比于Ag/BaCO3#-10 nm催化剂, Ag/BaCO3#-3 nm催化剂则表现出较好的丙烯环氧化性能。 随着反应温度的升高, 丙烯转化率和PO选择性都是先升高后降低, 在150 ℃时两者达到最高值, 此时丙烯转化率可达0.8%, 而PO选择性为90%。
图11 Ag/BaCO3#-3 nm和Ag/BaCO3#-10 nm的Ag 3d XPS谱图
Fig.11 Ag 3d XPS spectra of Ag/BaCO3#-3 nm and Ag/BaCO3#-10 nm
图12 Ag/BaCO3#-3 nm和Ag/BaCO3#-10 nm催化剂的性能
Fig.12 Catalytic activity of Ag/BaCO3#-3 nm (a) and Ag/BaCO3#-10 nm (b) for propylene epoxidation
对于丙烯气相环氧化反应, Ag活性物种的颗粒大小和价态是影响负载型Ag催化剂的关键。 通常情况下, 较小尺寸的Ag纳米粒子有利于提高负载型Ag催化剂的活性。 例如Vajda等发现对于Al2O3薄膜负载Ag催化剂, Ag颗粒为8.7和12 nm的催化剂的活性是23.3 nm时的10倍
在前期研究中
3 结 论
通过对油胺合成体系进行改进, 成功地合成了3 nm左右的超小Ag纳米粒子。 同时, 通过对BaCO3进行油酸预处理, 可使BaCO3均匀分散于正己烷溶液中, 从而提高Ag纳米粒子在载体BaCO3上的分散性。 在此基础上, 通过“两步焙烧法”制备了负载不同尺寸Ag纳米粒子的Ag/BaCO3催化剂。 由于Ag/BaCO3#-3 nm催化剂中Ag颗粒尺寸较小, 并含有更多的+1价Ag物种, 从而使得其活性远高于Ag/BaCO3#-10 nm催化剂。 随着反应温度的升高, 丙烯转化率和PO选择性都先升高后降低。 在150 ℃时两者达到最高值, 丙烯转化率可达0.8%, 而PO选择性为88.2%。
参考文献