羧甲基壳聚糖磁性纳米复合物高效分离基因组DNA
廖鹏飞1, 2,夏金兰1,张成桂1,聂珍媛1
( 教育部生物冶金重点实验室,中南大学 资源加工与生物工程学院,湖南 长沙,410083;
2. 南昌大学 生命科学学院,江西 南昌,330031)
摘 要:
摘 要:分别以常量的大肠杆菌和微量的嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans) 为实验对象,研究羧甲基壳聚糖磁性纳米复合物载体对基因组DNA的分离纯化,对分离的大肠杆菌基因组DNA直接采用琼脂糖凝胶电泳和紫外分光光度计分析,分离的A. ferrooxidans基因组DNA则直接作为硫化物质体醌氧化还原酶基因片断的PCR扩增模板。研究结果表明:采用磁性纳米复合物法,其制备DNA的时间是传统方法的1/3,具有快速、简单的优点,在微量样品DNA提取中,由于其富集提取DNA,并提高了PCR的灵敏性功能,比传统方法优越,可用于食品卫生致病微生物的检测、法医鉴定以及极难培养的微生物的菌种鉴定。
关键词:
中图分类号:Q503;TB383 文献标识码:A 文章编号:1672-7207(2009)01-0007-05
Extraction of genomic DNA by carboxymethylated
chitosan-Fe3O4 nanocomposites
2LIAO Peng-fei1, 2, XIA Jin-lan1, ZHANG Cheng-gui1, NIE Zhen-yuan1
(1. Key Laboratory of Biometallurgy of Ministry of Education,
School of Resources Processing and Bioengineering, Central South University, Changsha 410083, China;
2. School of Life Science, Nanchang University, Nanchang 330031, China)
Abstract: The carboxymethylated chitosan-Fe3O4 nanocomposites were applied to extract genomic DNA from Escherichia coli and traces of Acidithiobacillus ferrooxidans strains, respectively. The quality of isolated DNA from E. coli was analyzed directly by agarose gel electrophoresis and UV spectrometry, and DNA isolated from A. ferrooxidans strains was directly used as DNA template for PCR amplification of gene fragment of sulfide quinone oxidoreductase, and the results obtained with magnetic nanocomposites were compared with those of conventional phenol-chloroform extraction. The results show that the magnetic nanocomposites are suitable for fast extraction of genomic DNA from samples without involving the use of hazardous agents, simplifying extremely the whole procedure for DNA preparation and enhancing sensitivity of PCR amplification. It can be used to detect pathogenic bacteria in food hygiene, judge forensic medicine and identify some microorganisms that are difficult to culture. ⊙
Key words: magnetic nanoparticles; magnetic nanocomposites; carboxylmethylated chitosan; Acidithiobacillus ferrooxidans
含表面功能基团的磁性微球或纳米复合物粒子由于粒径小,比表面积大,容易与目标物质结合,同时,由于其具有特有的磁响应性,能通过外加磁场进行定向分离,不需要离心操作,有利于分离过程的简化和自动化,在生物大分子的分离与纯化、细胞和细胞器的分离等领域中具有广阔的应用前景[1-5]。
传统的核酸分离方法存在使用有毒试剂(苯酚、氯仿)、耗时长等不足。近年来,采用通过无机或有机聚合物表面修饰或包覆的磁性微米、纳米级粒子作为核酸分离的载体可克服这些不足。这类分离载体材料主要包括无机和有机高分子物质包覆的2类磁性微球。无机修饰物主要为二氧化硅[6],有机高分子修饰物主要有聚乙烯醇[2]、甲基丙烯酸聚合物等合成高分子材料[7-8]以及褐藻酸[9]、壳聚糖[10]等天然来源生物高分子材料。这些微粒或者微球具有特殊的表面结构,能在存在一定浓度的聚乙二醇和盐的环境中选择吸附DNA分子,吸附的DNA分子在低盐或水溶液中会重新释放到溶液中,避免了采用传统方法时溶液多步转移和使用有毒试剂的不足,加快了DNA制备过程。在本研究中,采用自主制备的羧甲基壳聚糖磁性纳米复合物用于不同量的大肠杆菌(Escherichia coli)培养液和不同细胞数的嗜酸氧化亚铁硫杆菌 (Acidithiobacillus ferrooxidans,一种典型的嗜酸自养的浸矿微生物)进行基因组DNA的提取试验,并与传统的苯酚-氯仿提取DNA方法进行比较。
1 实 验
1.1 主要仪器与材料
a. 主要仪器:Universal 32R型控温高速离心机(德国Hettich zentrifugen 公司制造);UV-3000 紫外可见扫描分光光度仪(日本Shimadzu公司制造);T-Gradient thermo 型基因梯度扩增仪(德国Biometra制造,其中,PromegaTM磁力架由美国普洛麦格公司制造)。
b. 主要材料:蛋白酶K(购于德国Merk公司);琼脂糖(购于中国杭州微生物试剂厂);壳聚糖(脱乙酰度为90%,购于中国浙江玉环海洋生物化学有限公司);羧甲基壳聚糖磁性纳米复合物[11](自制);实验所用水,为双蒸水;E. coli和A. ferrooxidans ATCC 23270 菌株(由中南大学资源加工与生物工程学院提供);硫化物质体醌氧化还原酶(Sulfide quinone oxidoreductase, 简称SQR)基因(sqr)片段引物1(序列为5’ CCAGATGACCGATGTAGGG 3’)和引物2 (序列为5’ AATAACAGGCTTTGTTGCG 3’),其浓度均为5 μmol/L;Taq DNA 聚合酶和10 mmol/L dNTPs,25 mmol/L Mg2+ ;10×PCR Buffer;100-1500 bp DNA marker(均购于上海生工生物工程技术服务有限公司)。所用的化学试剂和溶剂都为分析纯。
1.2 方 法
1.2.1 常量大肠杆菌中基因组DNA的提取
a. 细菌培养与裂解。将E. coli接种于LB液体培养基中,在温度为37 ℃的摇床中过夜培养,取细菌培养液于1.5 mL离心管中,在12 000 r/min转速下离心1 min, 弃上清,收集菌体(注意吸干多余水分),重复上述步骤1次,总共分别收集0.5,1和3 mL培养液。向每支离心管中加入400 ?L STE缓冲溶液(0.1 mol/L NaCl,10 mmol/L Tris-HCl,1 mmol/L EDTA)洗涤菌体1次。在12 000 r/min转速下离心1 min,弃上清。然后,用400 ?L TE (10 mmol/L,pH=8.0的Tris-HCl,1 mmol/L EDTA )缓冲液悬浮菌体,加入40 ?L浓度为10% SDS溶液,加入6 ?L 蛋白酶K (20 g/L),于55 ℃水浴10 min,直到变成透明清澈溶液为止。
b. 从细菌裂解液中提取DNA。参照文献[12]采用苯酚-氯仿方法从E. coli细菌裂解液中提取基因组DNA,采用CMCTS-Fe3O4 磁性纳米复合物从细菌裂解液中提取基因组DNA,方法如下:在上述细胞裂解液中分别加入50 ?L磁性纳米复合物载体(20 g/L)溶液,混匀,然后,加入170 ?L杂合缓冲液(20 % PEG-6000, 4 mol/L NaCl)混匀。室温温育10 min。用磁力架固定磁性纳米复合物,弃上清,加入400 ?L浓度为70%乙醇洗涤结合DNA的磁性纳米复合物2次,自然风干磁性复合物载体2 min,去除乙醇,加入25 ?L TE (10 mmol/L EDTA,25 mmol/L Tris-HCl, pH值为6.5) 溶液, 在55 ℃ 水浴锅中温育2 min,进行磁性分离并迅速地将溶有基因组DNA转移到新的离心管中。重复洗脱1次,将2次所得DNA洗脱液合并,加入RNA酶,于4 ℃保存备用。
对用2种方法提取的基因组DNA分别采用紫外可见分光光度计和1%琼脂糖凝胶电泳分析检测。
1.2.2 A. ferrooxidans 基因组DNA的提取及PCR扩增
a. 细菌培养与裂解。嗜酸氧化亚铁硫杆菌ATCC 23270 在改良的9K培养基中培养,培养基成分包括:3.00 g/L (NH4)2SO4;0.10 g/L KCl;0.50 g/L K2HPO4;0.50 g/L MgSO4·7H2O;0.01 g/L Ca(NO3)2;10.0 g/L S。用1.0 mol/L H2SO4调节培养基的pH值为1.8。在转速为160 r/min,温度为30 ℃的恒温振荡培养箱中培养。当细菌在对数生长期时,收获菌液,用新华滤纸过滤,去除大颗粒元素硫等固体杂质。于转速为10 000 r/min时离心5 min,收集菌体,菌体用TE (10 mmol/L,pH=8.0的Tris-HCl,1 mmol/L EDTA)缓冲液多次洗涤,然后,悬浮在1 mL TE缓冲液中。
在4支1.5 mL离心管中调节各管菌液的浓度分别为 109,107,104和102 个/mL。并制作3组平行样。
以上数量级的所有菌液在转速为12 000 r/min时离心5 min,悬浮在200 ?L的TE缓冲液中,加入20 ?L浓度为10%的SDS溶液,加入3 ?L蛋白酶K(20 g/L)于55 ℃水浴消化30 min。
b. 从细菌裂解液中提取DNA。参照文献[12]采用苯酚-氯仿方法从A. ferrooxidans细菌裂解液中提取基因组DNA,采用CMCTS-Fe3O4 磁性纳米复合物从细菌裂解液中提取基因组DNA,方法如下:在上述细菌裂解液中分别加入20 ?L 磁性纳米复合物(20 g/L)溶液,与100 ?L杂交液(20 % PEG-6000, 4 mol/L NaCl) 混匀,于室温放置10 min, 用PromegaTM磁力架固定磁性纳米复合物,弃上清液,加入400 ?L浓度为70%乙醇洗涤磁性纳米复合物和结合的DNA,室温放置 2 min,自然风干磁性纳米复合物,加入10 ?L TE,在 55℃ 温育2 min,然后,用磁力架固定磁性纳米复合物,将上清液转移到新的灭菌离心管中。重复洗脱DNA 1次,将2次所得洗脱液合并,于4 ℃保存备用。
c. PCR 扩增和PCR产物检测。采用CMCTS-Fe3O4 磁性纳米复合物和苯酚-氯仿抽提方法从上述不同A. ferrooxidans 菌数中分离基因组DNA,分别作为sqr片段PCR扩增的模板。 扩增反应体系为:DNA模板2 ?L,dNTP (10 mmol/L) 0.4 ?L,引物1和引物2 (5 mmol/L)各1.0 ?L,10×PCR缓冲液2 ?L,Mg2+ (25 mmol/L) 1.6 ?L,Taq聚合酶(5 U/?L) 0.2 ?L,补水至20 ?L。反应条件如下:于94 ℃变性3 min;接着于94 ℃变性30 s,于57 ℃变性30 s,于72 ℃变性30 s,共进行34次循环,最后,于72 ℃延伸8 min。PCR产物用TBE电泳缓冲液配制的1 %的琼脂糖凝胶进行电泳,电泳完成后,用溴化乙锭(0.5 mg/L)染色,用凝胶成像系统拍照。
2 结果与讨论
2.1 常量大肠杆菌中基因组DNA的提取
为了克服传统核酸提取方法的某些缺点,减少溶剂用量,简化整个核酸分离的操作过程,相继开发出一些固相颗粒用于核酸的分离,如:DEAE-磁性琼脂糖颗粒用于基因组和质粒DNA的分离[13],二氧化硅或表面包覆二氧化硅的磁性微粒、表面含有羧基的磁性和非磁性的微球在聚乙二醇和氯化钠存在时用于PCR产物的纯化[14]和基因组DNA的分离[4, 6, 15]。本研究中,采用羧甲基壳聚糖磁性纳米复合物作为固相颗粒用于不同体积大肠杆菌细胞中基因组DNA的提取。纯化后,DNA直接用于琼脂糖凝胶电泳和紫外可见扫描分光光度分析。从大肠杆菌细胞中分离的基因组DNA的琼脂糖凝胶电泳结果如图1所示。图中条带M为标准相对分子质量的DNA (λDNA通过 EcoRI-HindIII 酶消化);条带1~4为CMCTS-Fe3O4 磁性纳米复合物法分离的DNA;条带5~6为采用苯酚-氯仿法分离的DNA。由图1可见,采用CMCTS-Fe3O4磁性纳米复合物和传统的苯酚-氯仿方法分离得到的DNA在电泳图上移动了相同的距离,说明这2种方法从大肠杆菌中分离得到的DNA的长度一致,并且保持完整。

图1 从大肠杆菌中分离的基因组DNA 的
琼脂糖凝胶电泳图
Fig.1 Agarose gel electrophoregram of genomic DNA isolated from E.coli
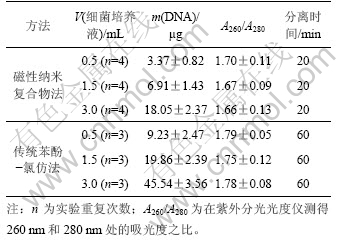
采用CMCTS-Fe3O4磁性纳米复合物法和传统苯酚-氯仿法从不同体积大肠杆菌培养液中分离DNA 的性能进行比较,结果如表1所示。从表1可以看出,相对于传统苯酚-氯仿法,磁性纳米复合物分离所用的时间大大缩短,大约只需传统苯酚-氯仿制备方法所需时间的1/3,虽然所得到的DNA纯度和产量较低,但能满足一般分子生物学实验(如聚合酶链式反应扩增)对DNA纯度的要求,这意味着CMCTS-Fe3O4磁性纳米复合物用于基因组DNA的分离是可行的,而且由于分离快速、简单、不使用有毒试剂,避免了样品的污染以及可望采用自动化操作,因此,其发展前景广阔。
表 1 磁性纳米复合物法与传统苯酚-氯仿法从大肠杆菌中分离DNA的性能比较
Table 1 Comparison of performances between magnetic nanocomposites method and traditional chloroform-phenol method for isolating DNA from E.coli
2.2 微量A. ferrooxidans 基因组DNA的提取及PCR扩增
采用磁性分离载体用于生物样品核酸提取,不但可以简化实验过程,避免接触有毒试剂,而且由于其特殊的表面结构,对目标生物大分子具有富集吸附作用,操作条件温和以及能彻底地去除PCR抑制剂等特点,在处理微量生物样品和环境样品中显示出极大的优势。XIE等[16]研发了一种羧基修饰的磁性纳米粒子,可以直接从样品中完成靶细胞富集和细胞裂解液中DNA吸附过程,吸附在磁性纳米粒子表面的DNA不用洗脱,直接可作为目标基因PCR扩增的模板,利用该法实现了微量唾液样品中HLA基因的快速制备与扩增。Amagliani等[5]采用顺磁性的纳米粒子从含单核细胞增多性李斯特菌(Listeria monocytogenes)的牛奶样品中分离出DNA,结合PCR扩增技术,检测下限为10 个细菌/mL,比商业化的DNA纯化柱的灵敏度高10倍。
以CMCTS-Fe3O4磁性纳米复合物法和苯酚-氯仿抽提方法从微量的A. ferrooxidans菌中分离基因组DNA 分别作为sqr基因片段PCR扩增的模板,扩增产物电泳图如图2所示。其中:泳道1~4分别为采 用常规苯酚-氯仿法从109,107,104和102 个/mL A. ferrooxidans菌中分离的基因组DNA为模板的PCR扩增产物;泳道5~8分别为采用磁性纳米复合物法从109,107,104,102 个/mL A. ferrooxidans菌中分离的基因组DNA为模板的PCR扩增产物;泳道C 为阴性对照(不加模板DNA);泳道M是标准相对分子质量的DNA。从图2可知,采用这2种方法提取的基因组DNA作为模板都扩增出产物,为300 bp左右,与预期结果相同,但是,泳道3和4比泳道7和8的电泳条带微弱,说明在处理微量的样品时磁性纳米复合物法比常规苯酚-氯仿法优越。采用常规方法在分离提取核酸的过程中,通过有机溶剂的反复抽提、溶液转移和离心步骤,容易导致核酸一级结构破坏和部分核酸丢失,也容易导致试验交叉污染。而采用磁性纳米复合物时,整个操作条件温和,不需离心操作,通过外加磁场进行分离,不使用有毒试剂,并且整个操作在同一只离心管中进行,避免了核酸的交叉污染,因而,该方法用于极其微量样品基因组DNA分离中具有明显优势。
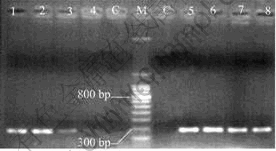
图2 A. ferrooxidans 菌基因组DNA的PCR扩增产物
sqr 基因片段的凝胶电泳图
Fig.2 Agarose gel electrophoregram of sqr gene fragment of A. ferrooxidans
3 结 论
a. CMCTS-Fe3O4磁性纳米复合物应用于常量的大肠杆菌基因组DNA的分离。采用该磁性纳米复合物法使整个DNA分离时间缩短至传统方法的1/3,同时,不使用有毒试剂,离心操作步骤简单。
b. CMCTS-Fe3O4磁性纳米复合物应用于微量的A. ferrooxidans菌中基因组DNA的分离,表明该磁性纳米复合物具有富集提取DNA的功能,在微量样品DNA提取中比传统方法优越,可望用于食品卫生致病微生物的检测、法医鉴定以及极难培养的微生物的菌种鉴定。
参考文献:
[1] Bach H J, Hartmann A, Trevors J T, et al. Magnetic capture–hybridization method for purification and probing of mRNA for neutral protease of Bacillus cereus[J]. Journal of Microbiological Methods, 1999, 37(2): 187-192.
[2] Jürgen O, Jeffrey P, Lothar à B. Polyvinyl-alcohol-based magnetic beads for rapid and efficient separation of specific or unspecific nucleic acid sequences [J]. Journal of magnetism and Magnetic Materials, 2001, 225(1/2): 145-150.
[3] Garlie N K, Lefever A V, Siebenlist R E, et al. T cells Coactivated with immobilized anti-CD3 and anti-CD28 as potential immunotherapy for cancer[J]. Journal of Immunotherapy, 1999, 22(4): 336-345.
[4] ?panová A, Rittich B, Horák D, et al. Immunomagnetic separation and detection of Salmonella cells using newly designed carriers[J]. Journal of Chromatography A, 2003, 1009(1/2): 215-221.
[5] Amagliani G., Brandi G, Omiccioli E, et al. Direct detection of Listeria monocytogenes from milk by magnetic based DNA isolation and PCR[J]. Food Microbiology, 2004, 21(5): 597-603.
[6] Nagy M, Otremba P, Krüger C, et al. Optimization and validation of a fully automated silica-coated magnetic beads purification technology in forensics[J]. Forensic Science International, 2005, 152(1): 13-22.
[7] K?ízová J, ?panová A, Rittich B, et al. Magnetic hydrophilic methacrylate-based polymer microspheres for genomic DNA isolation[J]. Journal of Chromatography A, 2005, 1064(2): 247-253.
[8] Horák D, Rittich B, ?panová A, et al. Magnetic microparticulate carriers with immobilized selective ligands in DNA diagnostics[J]. Polymer, 2005, 46(4): 1245-1255.
[9] Prodělalová J, Rittich B, ?panová A, et al. Isolation of genomic DNA using magnetic cobalt ferrite and silica particles[J]. Journal of Chromatography A, 2004, 1056(1/2): 43-48.
[10] 夏金兰, 廖鹏飞, 聂珍媛, 等. 羧甲基壳聚糖磁性纳米复合物的制备与表征[J]. 中南大学学报: 自然科学版, 2006, 37(6): 1075-1080.
XIA Jin-lan, LIAO Peng-fei, NIE Zhen-yuan, et al. Preparation and characterization of magnetic carboxymethylated chitosan-Fe3O4 nanocomposites for bioseparation[J]. Journal of Central South University: Science and Technology, 2006, 37(6): 1075-1080.
[11] 夏金兰, 王 春, 聂珍媛, 等. 羧甲基壳聚糖银噻苯咪唑的制备及其抑菌性能[J]. 中南大学学报: 自然科学版, 2005, 36(1): 34-37.
XIA Jin-lan, WANG Chun, NIE Zhen-yuan, et al. Preparation and antimicrobial activity of carboxymethyl chitosn-Ag- tiabendazole[J]. Journal of Central South University: Science and Technology, 2005, 36(1): 34-37.
[12] Sambrook J, Russell D W. 分子克隆实验指南[M]. 黄培堂, 王嘉玺, 朱厚础, 等译. 北京: 科学出版社, 2002.
Sambrook J, Russell D W. Molecular cloning: A laboratory manual[M]. HUANG Pei-tang, WANG Jia-xi, ZHU Hou-chu, et al transl. Beijing: Science Press, 2002.
[13] Levison P R, Badger S E, Hathi P, et al. New approaches to the isolation of DNA by ion-exchange chromatography[J]. Journal of Chromatography A, 1998, 827(2): 337-344.
[14] Bitner R, White D, Krueger S, et al .Use of MagneSilTM paramagnetic particles for plasmid purification, PCR cleanup, and purification of dideoxy and big dye DNA sequencing reactions[C]// Proceedings of SPIE-The International Society for Optical Engineering, 2000, 3926: 126-133.
[15] Taylor J I, Hurst C D, Davies M J, et al. Application of magnetite and silica-magnetite composites to the isolation of genomic DNA [J]. Journal of Chromatography A, 2000, 890(1): 159-166.
[16] XIE Xin, ZHANG Xu, YU Bing-bin, et al. Rapid extraction of genomic DNA from saliva for HLA typing on microarrey based on magnetic nanobeads[J]. Journal of Magnetism and Magnetic Materials, 2004, 280(2/3): 164-168.
收稿日期:2008-03-10;修回日期:2008-05-08
基金项目:国家自然科学基金资助项目(50674101; 50621063)
通信作者:夏金兰(1964-),男,湖南攸县人,教授,博士生导师,从事微生物学研究;电话:0731-8836944;E-mail: jlxia@mail.csu.edu.cn


